Потенциал использования метаболита бородатых корней Scutellaria baicalensis в качестве геропротектора
Автор: Чекушкина Д.Ю., Милентьева И.С., Ле В.М., Просеков А.Ю., Проскурякова Л.А.
Рубрика: Питание и здоровье
Статья в выпуске: 2 т.12, 2024 года.
Бесплатный доступ
Транс-коричная кислота (TKR-k) - природное органическое соединение, которое используется в синтезе различных химических и фармацевтических препаратов, биологически активных добавок (БАД). Она обладает высокой биологической активностью, включая в себя антиоксидантную, антибактериальную и прочие способности. Целью работы являлось изучение биопотенциала и биобезопасности TKR-k, выделенной из экстракта шлемника байкальского (Scutellaria baicalensis) с помощью модельных объектов - грызунов для дальнейшего ее применения в разработке биодобавок с геропротекторной активностью. Объектом исследования являлась TKR-k, выделенная в ранее проведенных исследованиях авторами из биомассы шлемника байкальского. Для исследований іn vivo в качестве модельных объектов использовали грызунов: самок крыс (Rattus sp.) Sprague Dawley, самцов крыс Rattus sp., крыс-самцов Wistar, самцов мышей Mus musculus, самок мышей (Mus musculus) стока CD-1. В результате установлено, что TKR-k не обладала мутагенными свойствами, а при введении дозы в 50,0 мг/кг проявляла антимутагенный потенциал; не проявляла цитотоксичность в диапазоне концентраций 2,1-33,3 мкг/мл. TKR-k не обладала гипохолестеринемической активностью и гепатотоксичностью. Однако TKR-k проявляла провоспалительный эффект при остром воспалении (вызванном λ-каррагенином) - статистически значимо уменьшала массу грануляционной ткани на 20 %, но не оказывала влияния на экссудативную реакцию при пролиферативном воспалении, вызванном имплантацией ватных тампонов под кожу крысам. Установлено, что TKR-k, выделенная из экстракта шлемника байкальского, in vivo на грызунах является биобезопасным веществом, проявляющим антимутагенный потенциал, не стимулирующим развитие гипохолестеринемической активности и гепатотоксичности, следовательно, данное соединение является перспективным компонентом БАД с геропротекторным потенциалом.
Биопотенциал, транс-коричная кислота, геропротектор, гепатоксичность, in vivo, грызуны
Короткий адрес: https://sciup.org/147243931
IDR: 147243931 | УДК: 57.084:57.086 | DOI: 10.14529/food240210
Текст научной статьи Потенциал использования метаболита бородатых корней Scutellaria baicalensis в качестве геропротектора
D.Y. Chekushkina^, ,
I.S. Milentyeva,
V.M. Le,
A.Yu. Prosekov,
L.A. Proskuryakova,
Естественным физиологическим процессом всех людей является старение. Несмотря на увеличивающуюся продолжительность жизни мирового населения, проблема здорового долголетия остается важной [1]. На экономику стран влияет не прецедентный рост числа людей пожилого возраста, страдающих от хронических заболеваний, мешающих нормальной и активной жизнедеятельности [1].
Важным промышленным регионом страны является Кузбасс. Население Кузбасса постоянно сталкивается с серьезными факторами риска развития хронических заболеваний – экологическими проблемами из-за добычи угля и промышленной деятельности. Статистические данные о количестве пожилых людей Кузбасса и характерные для них хронические заболевания представлены на рисунке [2, 3].
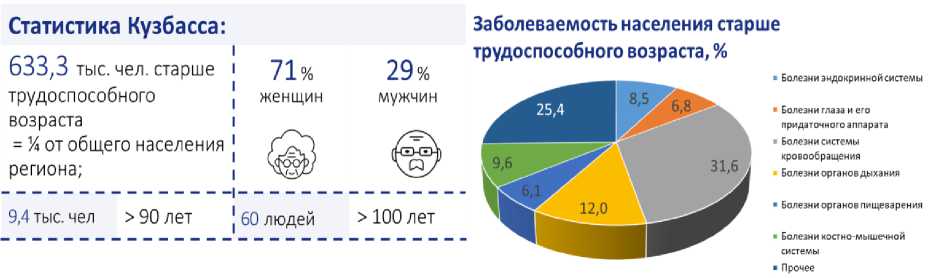
Статистические данные о количестве пожилых людей Кузбасса и характерные для них хронические заболевания [2, 3]
Ученые исследуют природные источники биологически активных веществ (БАВ) потенциальных геропротекторов, таких как растения. На предмет таких полезных свойств исследуются лекарственные растения из Сибирского федерального округа [3].
В ранее проведенных исследованиях [4, 5] авторами с помощью модельного объекта -нематод Caenorhabditis elegans было установлено, что транс-коричная кислота (TKR-k), выделенная из экстракта Scutellaria baicalensis (шлемника байкальского), может являться перспективным геропротектором. TKR-k проявляет способность положительно влиять на выживаемость C. elegans в условиях окислительного стресса. Раствор TKR-k в концентрации 100 мкМ (в сравнении с особями, культивируемыми без внесения БАВ) увеличивал выживаемость при 24 ч культивирования на 8,4 % и на 11,1 % при культивировании в течение 48 ч эксперимента [5]. TKR-k стимулирует увеличение продолжительности жизни C. elegans [4] - в сравнении с контрольными объектами исследования (нематодами, культивируемыми без добавления БАВ) продолжительность жизни на 8 сутки эксперимента была выше на 36,6 % при добавлении 2000 мкмоль/л раствора TKR-k.
Целью работы являлось изучение биопотенциала и биобезопасности TKR-k, выделенной из экстракта шлемника байкальского ( Scutellaria baicalensis) . А именно оценить цитотоксичность in vitro , мутагенные и анти-мутагенные свойства, гипохолестеринемиче-скую активность, гепатотоксичность и противовоспалительную активность при остром экссудативном воспалении и хроническом пролиферативном воспалении на грызунах.
Для использования TKR-k в дальнейших исследованиях необходимо исключить наличие мутагенной активности и цитотоксичности. Данные показатели выбраны, так как исследование цитотоксичности, мутагенной активности является важным при формировании биологически активных добавок (БАД), употребляемых людьми. Оценка способности уменьшать уровень холестерина в крови, риски повреждения печени, проявлять противовоспалительный эффект важна для БАД с геропротекторным потенциалом, способным предотвращать / уменьшать факторы риска развития хронических заболеваний.
Избыточное количество холестерина в крови приводит к образованию бляшек на стенках артерий, что увеличивает риск развития сердечно-сосудистых заболеваний (ССЗ). Продукты и вещества с гипохолестеринеми-ческой активностью способствуют снижению риска развития ССЗ, таких как атеросклероз [6]. На фоне гепатоксичности развиваются такие заболевания, как гепатит, жировое заболевание печени, цирроз печени, печеночная недостаточность. Здоровье печени имеет решающее значение для общего благополучия, поскольку печень выполняет важные функции, такие как детоксикация, обмен веществ и хранение питательных веществ. Здоровая печень помогает поддерживать правильное пищеварение, уровень энергии и иммунную функцию [6]. Противовоспалительная активность при остром экссудативном воспалении включает снижение высвобождения медиаторов воспаления и ограничение инфильтрации иммунных клеток. При хроническом пролиферативном воспалении основное внимание уделяется ингибированию аномальной пролиферации клеток и повреждению тканей, вызванному постоянным воспалением [7].
Противовоспалительная активность при остром экссудативном воспалении может помочь уменьшить отек, боль и покраснение. Это может предотвратить повреждение тканей и способствовать более быстрому заживлению. При хроническом пролиферативном воспалении контроль воспаления может предотвратить разрушение тканей и ограничить осложнения, связанные с длительным воспалением, улучшая общее состояние здоровья в долгосрочной перспективе.
Грызуны выбраны из-за физиологического и генетического сходства с человеком, коротких репродуктивных циклов, простоты обращения и эффективности исследований.
Материалы и методы
Объект исследования – TKR-k, выделенная из экстракта Scutellaria baicalensis . Параметры экстракции и выделения БАВ описаны в работах A. Dmitrieva и E.R. Faskhutdinova [4, 8].
В качестве модельных объектов выбраны грызуны. Все исследования проводились и были одобрены этическим комитетом испытательского центра ООО «ИФАР» (г. Томск).
Для оценки мутагенных и антимутагеных свойств использовались самки мышей ( Mus musculus ) стока CD-1; для оценки цитотоксичности – линейных мышей; для оценки гепатотоксичности – самцы крыс стока SD ( Sprague Dawley); для оценки гипогликемической активности и гипохолестеринемической активности – самцы крыс стока SD ( Sprague Dawley ) и мыши стока CD-1; оценивание противовоспалительной активности при остром экссудативном воспалении и хроническом пролиферативном воспалении проводилось на самках крыс стока SD ( Sprague Dawley ). Все грызуны были свободные от патогенной микрофлоры.
Для изучения мутагенной активности TKR-k и вещество негативного контроля (вода очищенная свежеприготовленная) вводили 5-кратно. Вещество позитивного контроля (циклофосфамид) вводили однократно внутрибрюшинно в дозе 40,0 мг/кг. Через 24 ч после последнего введения животных взвесили и эвтаназировали, приготовили и проанализировали при помощи светового микроскопа с иммерсией препараты костного мозга. Эксперименты проведены с использованием самок мышей ( Mus musculus ) стока CD-1 (коллекция линий животных) [9].
Для исследования антимутагенной активности животным вводили TKR-k в желудок в течение 5 дней; на 6-й день вводили TKR-k в желудок и алкилирующий агент циклофосфамид (Белмедпрепараты, Беларусь) – внутрибрюшинно в дозе 40,0 мг/кг. Через 24 ч животных взвесили и эвтаназировали, приготовили и проанализировали при помощи светового микроскопа с иммерсией препараты костного мозга [10].
Исследуя способность TKR-k оказывать токсическое воздействие на спленоциты in vitro в МТТ-тесте, у мышей после эвтаназии в асептических условиях извлекали селезенки и путем ее щадящей гомогенизации получали спленоциты. Суспензию спленоцитов инкубировали в среде RPMI-1640 (Пущинские лаборатории, Россия) с глутамином с добавлением 10 % инактивированной фетальной телячьей сыворотки, гентамицина в концентрации 40 мг/мл и 2М Hepes (Sigma, США) в 96-луночном планшете в конечной концентрации 8 × 105 клеток/мл с добавлением и TKR-k в концентрациях 2,1–33,3 мкг/мл [11].
Планшеты помещали на инкубацию на 72 ч при 37 °С, 100 % влажности воздуха и 5 % содержанием СО 2 . За 4 ч до окончания инкубации в лунки вносили по 20 мкл водного раствора МТТ в концентрации 2 мг/мл. По окончании инкубации содержимое лунок удаляли и к осадку в лунках вносили по 100 мкл диметилсульфоксида, затем измеряли оптическую плотность лунок при 450 нм [12].
Для изучения гипогликемической активности у крыс моделировали сахарный диабет однократным внутрибрюшинным введением раствора аллоксана в дозе 150,0 мг/кг. Массу тела грызунов и концентрацию глюкозы в крови замеряли до и через 48 ч после введения раствора аллоксана для подтверждения развития сахарного диабета [13]. На протяжении 21 дня эксперимента следили за общим состоянием животных, еженедельно оценивали массу тела животных натощак, концентрацию глюкозы и общего холестерина в сыворотке крови. TKR-k в дозах 50,0 и 100,0 мг/кг вводили ежедневно в течение 7 дней последней недели эксперимента.
В исследовании гиперхолестеринемии для моделирования гиперхолестеринемии в течение 2 недель животным групп № 11–17 три раза в неделю (понедельник, среда и пятница) внутрибрюшинно вводили водный раствор ингибитора липопротеинлипазы, нарушающий клиренс липопротеидов – полокса-мера Р 407 в дозе 400,0 мг/кг в объеме 1,0 мл.
Интактные животные группы № 10 не получали веществ на протяжении всего исследования. TKR-k и вещество негативного контроля вводили животным в желудок ежедневно в течение 2 недель в объеме 1,0 мл. После последнего введения животных наркотизировали для забора крови и затем эвтаназировали, в сыворотке крови определяли концентрацию общего холестерина [13].
Для изучения гепатотоксичности TKR-k вводили 14-кратно. Ежедневно наблюдали за общим состоянием животных, раз в неделю оценивали массу тела, консистенцию фекалий. Через 24 ч после последнего введения лишенных накануне корма животных эвтана-зировали. С целью оценки возможного токсического повреждения печени провели ее гистологический анализ, определили весовой коэффициент печени, в сыворотке крови определили маркеры повреждения гепатоцитов и желчевыводящих путей: активность аланинаминотрансферазы, аспартатаминотрансферазы, гамма-глутамилтрансферазы, щелочной фосфатазы, содержание общего белка, альбумина и глобулинов (разность концентраций общего белка и альбумина) [14].
В рамках исследования противовоспалительной активности TKR-k острое экссудативное воспаление вызывали однократной инъекцией раствора k-каррагенина под плантарный апоневроз. Исследуемые вещества вводили в дозах 50,0 и 100,0 мг/кг за 1 ч до введения ^-каррагенина. Через 3 и 4 ч после введения ^-каррагенина оценивали выраженность отека с помощью плетизмометра [15].
Хроническое пролиферативное воспаление моделировали подкожной имплантацией ватных тампонов, которые извлекали и взвешивали спустя 7 сут после имплантации [16]. Исследуемое вещество вводили семикратно один раз в день в дозах 50,0 и 100,0 мг/кг.
Результаты исследования и их обсуждение
При изучении мутагенной активности выявлено, что TKR-k при 5-кратном внутриже-лудочном введении в дозах до 100,0 мг/кг не обладает мутагенными свойствами в микро-ядерном тесте у мышей. Введение позитивного контроля циклофосфамида значительно увеличивало количество полихроматофильных эритроцитов с микроядрами в костном мозге мышей [17]. Применение TKR-k уменьшало количество полихроматофильных эритроцитов с микроядрами в костном мозге мышей, получивших циклофосфамид.
Для исследования антимутагенной активности животным вводили исследуемые вещества в желудок в течение 5 дней; на 6-й день вводили исследуемые вещества в желудок и алкилирующий агент циклофосфамид - внутрибрюшинно в дозе 40,0 мг/кг [18].
Введение исследуемых веществ не приводило к увеличению количества полихроматофильных эритроцитов с микроядрами в костном мозге мышей.
Введение позитивного контроля циклофосфамида значительно увеличивало количество полихроматофильных эритроцитов с микроядрами в костном мозге мышей. Применение TKR-k уменьшало количество полихроматофильных эритроцитов с микроядрами в костном мозге мышей, получивших циклофосфамид.
При 6-кратном внутрижелудочном введении TKR-k мышам в дозе 50,0 мг/кг обладает антимутагенными действием, которое выражается снижением числа полихроматофильных эритроцитов с микроядрами на 25 % [18].
Также TKR-k в диапазоне концентраций 2,1-33,3 мкг/мл в экспериментальных условиях не обладает цитотоксичностью.
Следовательно, исходя из полученных данных, образцы пригодны для дальнейших исследований.
TKR-k при введении в желудок крысам с аллоксан-индуцированным сахарным диабетом в дозах 50,0 и 100,0 мг/кг в течение 7 дней не влияют на массу тела и не обладают гипогликемическим и гипохолестеринемическим действием. Введение TKR-k в дозах 50,0 и 100,0 мг/кг в течение 14 дней мышам с гиперхолестеринемией, вызванной полоксамером (кол-лифором) P 407, не приводило к уменьшению концентрации холестерина в сыворотке крови [19]. Результаты представлены в таблице.
До введения аллоксана концентрация глюкозы в сыворотке крови у интактных животных (5,264 ± 0,374 ммоль/л, n = 10) и пула животных для формирования групп (5,254 ± 0,163 ммоль/л, n = 80) соответствовала норме. Значения данных показателей не отличались друг от друга (р > 0,05).
Сахарный диабет у крыс сформировался через 48 ч после однократного внутрибрюшинного введения раствора аллоксана в дозе 150,0 мг/кг (p < 0,05), что подтверждается увеличением концентрации глюкозы и холе-
Усредненные показатели биохимии крови крыс после введения внутрь TKR-k в дозах 50 и 100 мг/кг
|
Временная точка |
Интактные животные |
Вода очищенная (контроль) |
TKR-k 50,0 мг/кг |
TKR-k 100,0 мг/кг |
|
Глюкоза, ммоль/л |
||||
|
48 ч после введения аллоксана |
4,883 ± 0,301 (n = 10) |
22,618 ± 0,792* (n = 10) |
22,872 ± 0,733* (n = 10) |
22,625 ± 1,280* (n = 10) |
|
1 неделя после введения аллоксана |
4,335 ± 0,227 (n = 10) |
24,457 ± 0,700* (n = 9) |
24,565 ± 0,671* (n = 9) |
24,189 ± 1,106* (n = 8) |
|
2 недели после введения аллоксана |
4,533 ± 0,285 (n = 10) |
23,372 ± 0,721* (n = 7) |
24,433 ± 0,806* (n = 7) |
22,896 ± 0,436* (n = 6) |
|
3 недели после введения аллоксана |
4,370 ± 0,378 (n = 10) |
20,094 ± 0,398* (n = 6) |
20,372 ± 0,387* (n = 6) |
20,337 ± 0,350* (n = 6) |
|
Холестерин, ммоль/л |
||||
|
1 неделя после введения аллоксана |
1,612 ± 0,063 (n = 10) |
2,592 ± 0,090* (n = 9) |
2,514 ± 0,132* (n = 9) |
2,581 ± 0,099* (n = 8) |
|
2 недели после введения аллоксана |
1,544 ± 0,088 (n = 10) |
2,584 ± 0,074* (n = 7) |
2,411 ± 0,108* (n = 7) |
2,544 ± 0,089* (n = 6) |
|
3 недели после введения аллоксана |
1,580 ± 0,074 (n = 10) |
2,437 ± 0,073* (n = 6) |
2,499 ± 0,090* (n = 6) |
2,532 ± 0,063* (n = 6) |
* – статистически значимые различия с интактом (p < 0,05).
стерина в сыворотке крови крыс относительно показателей интактных животных. Эффект сохранялся у экспериментальных животных на протяжении всего эксперимента (p < 0,05).
Введение в желудок в течение 7 дней экспериментальным крысам TKR-k в дозах 50,0 и 100,0 мг/кг не приводило к снижению концентрации глюкозы и холестерина в сыворотке крови (p > 0,05).
Таким образом, в данных экспериментальных условиях TKR-k в дозах 50,0 и 100,0 мг/кг не обладают гипохолестеринемической активностью.
Исследуемые вещества во всех исследованных дозах не вызывали гибели и тяжелых нарушений здоровья животных, не влияли на массу тела и печени, не вызывали морфологических повреждений этого органа. Выявленные изменения в параметрах биохимии крови не указывают на наличие гепатотоксичности исследуемых веществ [18].
TKR-k при 14-кратном внутрижелудоч-ном введении в дозах до 100,0 мг/кг не обладает гепатотоксичностью.
При остром экссудативном воспалении, вызванном λ-каррагенином у крыс, TKR-k в дозах 50,0 и 100,0 мг/кг при однократном введении в желудок при данных экспериментальных условиях повышает величину отека, т. е. оказывает провоспалительный эффект при остром воспалении.
При хроническом пролиферативном воспалении, вызванном имплантацией ватных тампонов под кожу крысам, TKR-k в дозе 100,0 мг/кг при многократном введении в желудок при данных экспериментальных условиях ослабляет пролиферативную реакцию. Исследуемое вещество не оказывает влияния на экссудативную реакцию при данном модельном воспалении.
Таким образом, исходя из полученных результатов исследований, подтвердили, что TKR-k является безопасной для использования в качестве геропротектора для дальнейшего создания БАД [19].
Также TRK-k проявляет биоактивность, что ранее подтверждалось в научной литературе. Так рядом авторов выявлено, TKR-k, выделенная из шлемника байкальского (Scutellaria baicalensis), положительно влияла на выживаемость нематод (С. elegans), подвергнутых окислительному стрессу, что свидетельствует о ее геропротекторных свойствах [20]. Авторы выделили TKR-k из водно-спиртового экстракта культуры корней Scutellaria baicalensis in vitro методом ВЭЖХ [5]. Для изучения геропротек-торной активности транс-коричной кислоты исследователи оценили ее влияние в различных концентрациях на продолжительность жизни, устойчивость к окислительному и термическому стрессу, а также репродуктивность C. elegans, используемого в качестве модельного организма. Все изученные концентрации транскоричной кислоты увеличивали продолжительность жизни червей C. elegans, наибольшее увеличение было достигнуто на 50 мкмоль/л.
В работе N. Solanki и R. Patel исследовали биопотенциал TKR-k, было установлено значительное снижение массы тела, жировой массы и уровня липидов у животных с ожирением, значительное снижение печеночных маркеров наряду со снижением TNF-α как провоспали-тельного цитокина по сравнению с больными контрольными крысами. Эти результаты показали, что лечение TKR-k может помочь предотвратить неалкогольную жировую болезнь печени, вызванную диетой с высоким содержанием жиров и фруктозы, связанной с ожирением. Способность TKR-k уменьшать воспаление за счет снижения уровня TNF-α и улучшения гистопатологических изменений в ткани печени была полезна при лечении неалкогольной жировой болезни печени [21].
Выводы
В рамках исследования изучили биопотенциал TKR-k, выделенной из экстракта шлемника байкальского ( Scutellaria baicalensis) . Установили безопасность выделенного БАВ путем оценки цитотоксичности in vitro , мутагенных и антимутагенных свойств, изучили гипохоле-стеринемическую активность, гепатотоксичность и противовоспалительную активность при остром экссудативном воспалении и хроническом пролиферативном воспалении.
Все результаты, полученные в ходе исследования, позволяют сделать вывод о том, что TKR-k не проявляет цитотоксичность и мутагенность, что позволяет использовать ее в создании различных БАД. Учитывая результаты, полученные при изучении гиполхоле-стеринемической и противовосполительной активностей, гепатотоксичности, данную кислоту можно использовать как источник геро-протекторных свойств для создания БАД.
Список литературы Потенциал использования метаболита бородатых корней Scutellaria baicalensis в качестве геропротектора
- Kuluyev B.R., Vershinina Z.R., Knyazev A.V. «Shaggy» plant roots are an important tool for researchers and a powerful phytochemistry factory for production workers // Biomika. 2015. Vol. 7, no. 2. P. 70-120.
- Об утверждении прилагаемой программы социально-экономического развития Кемеровской области - Кузбасса до 2024 года (с изменениями на 27 декабря 2023 года (2023). URL: https://docs.cntd.ru/document/573864374?section=status.
- Росстат опубликовал демографический прогноз до 2046 года. URL: https://ros-stat.gov.ru/folder/313/document/220709.
- Faskhutdinova E.R., Sukhikh A.S., Le V.M. Effects of bioactive substances isolated from Siberian medicinal plants on the lifespan of Caenorhabditis elegans // Foods and Raw Materials. 2022. Vol. 10, no. 2. P. 340-352.
- Fedorova A.M., Dyshlyuk L.S., Milentyeva I.S. Geroprotective activity of trans-cinnamic acid isolated from the Baikal skullcap (Scutellaria baicalensis) // Food Processing: Techniques and Technology. 2022. Vol. 52(3). P. 582-591.
- Liu Y., Wang F., Li Z. Neuroprotective Effects of Chlorogenic Acid in a Mouse Model of Intracerebral Hemorrhage Associated with Reduced Extracellular Matrix Metalloproteinase Inducer // Biomolecules. 2022. Vol. 12(8). P. 1020.
- Metwally D.M., Alajmi R.A., El-Khadragy M.F. Chlorogenic acid confers robust neuroprotection against arsenite toxicity in mice by reversing oxidative stress, inflammation, and apop-tosis // Journal of functional foods. 2020. Vol. 75. P. 104202.
- Dmitrieva A., Kozlova O., Atuchin V. Study of the Effect of Baicalin from Scutellaria baicalensis on the Gas-trointestinal Tract Normoflora and Helicobacter pylori // International Journal of Molecular Sciences, 2023. Vol. 24, no. 15. P. 11906.
- Zuniga L.Y., Aceves-de la Mora M.C.A.D., Gonzalez-Ortiz M. Effect of chlorogenic acid administration on glycemic control, insulin secretion, and insulin sensitivity in patients with impaired glucose tolerance // Journal of Medicinal Food. 2018. Vol. 21(5). P. 469-473.
- Biologically active compounds in Scutellaria baicalensis L. Callus extract: phytochemical analysis and isolation / I.S. Milentyeva, A.M. Fedorova, T.A. Larichev, O.G. Altshuler // Foods and Raw Materials. 2023. Vol. 11, no. 1. P. 172-186.
- Milentyeva I.S., Le V.M., Kozlova O.V. Secondary metabolites in in vitro cultures of Siberian medicinal plants: Content, antioxidant properties, and antimicrobial characteristics // Foods and Raw Materials. 2021. Vol. 9, no. 1. P. 153-163.
- Wang Z., Ge S., Li S. Anti-obesity effect of trans-cinnamic acid on HepG2 cells and HFD-fed mice // Food and chemical toxicology: an international journal published for the British Industrial Biological Research Association. 2020. Vol. 137. P. 111148.
- Damnjanovic I., Najman S., Stojanovic S. Quercetin induces apoptosis and necroptosis in mcf-7 breast cancer cells // Bratislavske Lekarske Listy. 2017. Vol. 116. P. 227-232.
- Elmann, A., Wang C.K., Vauzour D. Polyphenols targeting brain cells longevity, brain's redox status, and neurodegenerative diseases // Oxidative Medicine and Cellular Longevity. 2018. Vol. 2018.
- Vesnina A., Prosekov A., Atuchin V. Tackling Atherosclerosis via Selected Nutrition // International Journal of Molecular Sciences. 2022. Vol. 23(15). P. 8233.
- Vanhooren V., Libert C. The mouse as a model organism in aging research: usefulness, pitfalls and possibilities // Ageing research reviews. 2013. Vol. 12(1). P. 8-21.
- Ackert-Bicknell C.L., Anderson L.C., Sheehan S. Aging Research Using Mouse Models // Current protocols in mouse biology. 2015. Vol. 5(2). P. 95-133.
- Zhang B.T., Xu J.Y., Wang W. Obesity and cancer: Mouse models used in studies // Frontiers in Oncology. 2023. Vol. 13. P. 1125178.
- Janus C., Welzl H. Mouse Models of Neurodegenerative Diseases: Criteria and General Methodology // Methods in Molecular Biology. 2010. Vol. 602.
- Фасхутдинова Е.Р., Дмитриева А.И., Милентьева И.С. Изучение влияния транскоричной кислоты на устойчивость Caenorhabditis elegans к окислительному стрессу. Инновационное развитие агропромышленного, химического, лесного комплексов и рациональное природопользование. Великий Новгород, 2022. С. 147-150.
- Solanki N., Patel R. Unraveling the mechanisms of trans-cinnamic acid in ameliorating nonalcoholic fatty liver disease // American Journal of Translation Research. 2023. No. 15(9). P. 5747-5756.


