Повышение эффективности экстракции биологически активных веществ из растительного сырья методом ультразвукового воздействия
Автор: Попова Наталия Викторовна, Потороко Ирина Юрьевна
Рубрика: Технологические процессы и оборудование
Статья в выпуске: 1 т.6, 2018 года.
Бесплатный доступ
Постоянно возрастающие потребности общества в биологически активных веществах, в том числе антиоксидантного характера, обуславливают поиск не только перспективных источников их получения, но и методов экстракции. Высокая вариабельность биологически активных соединений требует развития подходящих стандартных подходов для их извлечения. Подбор метода и параметров ведения процесса экстракции БАВ определяет в дальнейшем свойства экстрагированного вещества и его эффективность воздействия. Нами в качестве механизма активизации процесса экстрагирования предложено ультразвуковое воздействие, характеризующееся наличием упругих колебаний и волн частотой выше 15-20 кГц. В качестве источников природных адаптогенов были выбраны: крапива двудомная (Urtica folia L.) и овес районированный, сорт «Белозерный». В основу эксперимента заложены следующие факторы экстракции: экстрагенты БАВ (вода и водно-спиртовой раствор, концентрация спирта 70 %); обработка УЗ разной мощности (120 Вт и 240 Вт) экстрагента в течение 5 минут; метод экстрагирования (настаивание и дистилляция). Результаты исследований показали, что наибольшей антиоксидантной активностью по отношению к контролю обладают образец экстракта Urtica folia L., полученный при использовании ультразвукового воздействия мощностью 120 Вт. УЗ воздействие мощностью 120 Вт в течение 5 минут весьма эффективно для сохранения антиоксидантов (АОА 2,4043 ± 0, 084 мг/мл при контроле 2,0773 ± 0,06 мг/мл). Ультразвуковой воздействие на зерно в воде мощностью 120 Вт в течение 5 минут активизирует выделение из овса экстрактивных веществ и повышает антиоксидантную активность экстракта. Таким образом, установлено, что ультразвуковая обработка улучшает кинетику экстрагирования и выход биологически активных веществ из субстрата.
Биологически активные вещества, экстракция, крапива двудомная, овес, антиоксидантная активность, экстрактивные вещества
Короткий адрес: https://sciup.org/147160872
IDR: 147160872 | УДК: 57.033+664 | DOI: 10.14529/food180102
Текст научной статьи Повышение эффективности экстракции биологически активных веществ из растительного сырья методом ультразвукового воздействия
Постоянно возрастающие потребности общества в биологически активных веществах, в том числе антиоксидантного характера, обуславливают поиск не только перспективных источников их получения, но и методов экстракции.
Чрезвычайная ситуация с диетическими соединениями с преимуществами для здоровья – это прекрасная возможность улучшить общественное здравоохранение [11]. Несмотря на динамичное развитие нутрицевтики, физиологические функции биологически активных веществ еще не полностью раскрыты. Однако их добавление в пищевые матрицы признано в качестве фактора сохранения высокого потенциала для снижения риска заболеваний.
Все большее число современных медиков признает необходимость изменения стратегии лечения болезней, причем основной выход видит в развитии профилактического направления в медицине, о котором в последние го- ды почти полностью забыли. При этом под профилактикой следует понимать не только предупреждение возникновения заболеваний, но и их осложнений, а также защиту организма при современном агрессивном специфическом и хирургическом лечении, реабилитацию больных.
Эффективность продуктов нутрицевтики в профилактике заболеваний зависит от сохранения стабильности, биоактивности и биодоступности активных ингредиентов [14].
Всемирная организация здравоохранения Организация (ВОЗ) прогнозирует, что 80 % населения мира зависит от традиционной медицины как первичной медико-санитарной помощи, в основном с использованием растительных экстрактов и их биологически активных соединений (Azmir и др., 2013).
Адаптогенами называют целую группу препаратов в фармакологии, действие которых направлено на повышение сопротивляемости организма воздействию вредных фак- торов физического, химического или биологического характера. Действующие вещества данных средств не предполагают непосредственное укрепление иммунитета в ходе приема лекарства, однако положительно воздействуют на жизнь клетки, улучшая работоспособность систем и повышая износостойкость организма в целом. Данное действие основывается на возможности тканей и органов дольше и положительнее переносить стрессовые реакции для адаптации организма [16-18].
Вид адаптогена определяется в зависимости от положения в его структуре основного действующего вещества, ее особенности, в свою очередь, определяют влияние на организм:
-
• адаптогены растительного происхождения (природные источники - женьшень, радиола розовая, лимонник, аралия, элеутерококк, имбирь и облепиха);
-
• адаптогены животного происхождения (экстракты, вытяжки, порошки, бальзамы и мази с костными тканями рогов марала, пятнистого оленя или кровью и секретами желез данных животных. В фармакологические формы также входят продукты пчеловодства, порошки из раковин морских обита-
- телей, вытяжки из свежих улиток, червей, пиявок и тому подобные компоненты);
-
• адаптогены из гуминовых веществ (данные адаптогены входят в органический состав почвенных, водных экосистем и твердых горючих ископаемых);
-
• минеральные адаптогены (мумие);
-
• адаптогены синтетического происхождения (вещество оксиэтиламмония метилфеноксиацетат или препарат «Трекрезан», структура молекул которого схожа с некоторыми молекулами человеческого организма и некоторых растений).
Высокая вариабельность биологически активных соединений требует развития подходящих стандартных подходов для их извлечения. Фактически, качество дальнейших этапов разделения, идентификации и характеристики биоактивных соединений сильно зависит от пригодности выбранного процесса экстракции. Все имеющиеся методы направлены на извлечение наиболее ценных соединений, преобразование биоактивных соединений в более подходящие формы [1, 4, 9, 12].
Все существующие способы экстрагирования классифицируют на: статические и динамические (рис. 1). В процессе их производ-
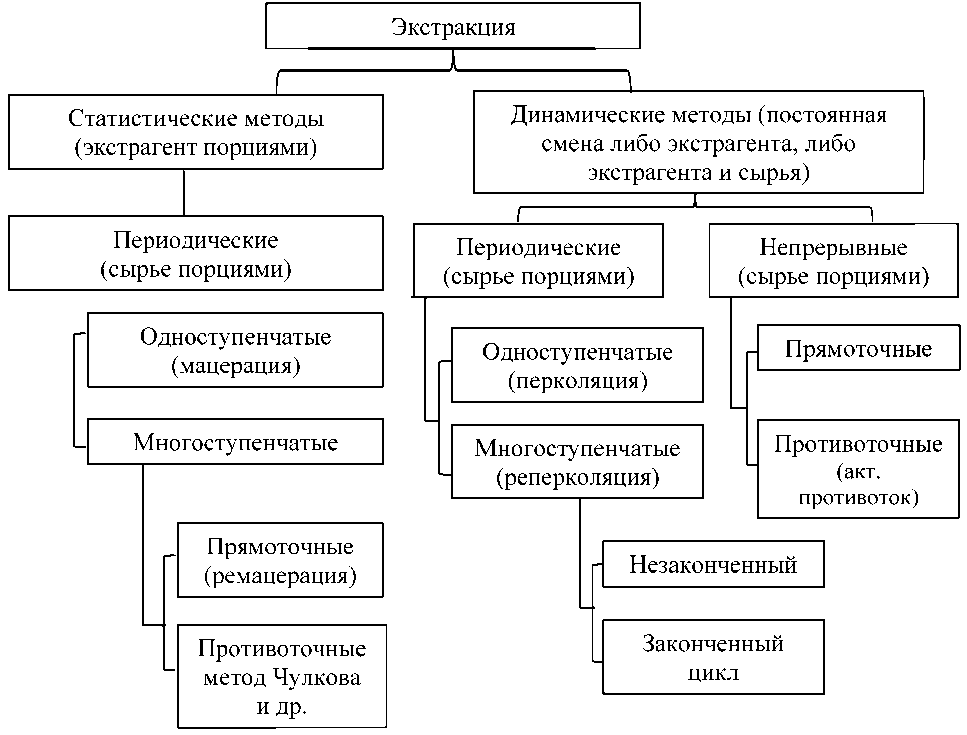
Рис. 1. Методы экстракции
ства используются специальные растворители (глицерин, эфир, вода или спирт).
Полученные таким образом растительные экстракты делят на:
-
• подвижные (жидкие);
-
• густые (содержание влаги в составе экстракта не превышает 25 %);
-
• сухие/сыпучие (содержание влаги не превышает 5 %).
Экстрагент подбирают в зависимости от того, к какому компоненту (спирту, воде и т. д.) чувствительно исходное сырье. Экстракты, получаемые промышленным способом, подлежат обязательной стандартизации, которая определяет минимально необходимое содержание тех или иных компонентов в составе конечного вещества.
Некоторые из наиболее применяемых методов включают:
-
1. Извлечение методом Сокслета, обычно с гексаном, петролейным эфиром, этилацетатом или метанолом; эта методика позволяет выполнять несколько циклов экстракции с «обновленным» растворителем, но процесс слишком длинный, и растворители являются дорогостоящими. Этот метод обычно используется для извлечения липофильных компонентов, используя гексан или петролейный эфир в качестве растворителей. Однако он также может быть использован для полярных соединений, как в случае конкретных фенольных соединений, которые эффективно экстрагируются метанолом [10].
-
2. Ультразвуковая экстракция (УЗЭ), основанная на использовании ультразвуковых вибраций к извлеченному образцу. Несмотря на то, что сильно зависит от типа растворителя, размера образца, рН экстракции, температуры и давления, это быстрый и простой метод, позволяет одновременно извлекать несколько партий; часто совмещается с метанолом, ацетоном, водой и этилацетатом. Эта технология успешно применяется для извлечения различных биологически активных соединений, такие как каротиноиды, полисахариды, белки, фенольные соединения, ароматические соединения или стеролы [20].
-
3. Флюидная экстракция, обычно выполняемая с двуокисью углерода под высоким давлением. Осуществляется при низких температурах, требует небольших объемов растворителей, времени осуществления экстракции, обладает высокой селективностью. На эффективность этого метода влияют такие
-
4. Ускоренная экстракция растворителем - производится с помощью одинаковых растворителей, но с использованием более высокого давления и повышенных температур. Имеет дополнительные преимущества по увеличению объема получаемых экстрактов, ускорению процесса экстракции, автоматизации процесса и повышению его кинетики. Используется для извлечения фенольных соединений и каротиноидов [10, 14, 19].
-
5. Извлечение встряхиванием. В этом типе экстракции используются вибрационные устройства, что повышает эффективность экстракции и сокращает ее время. Основным преимуществом этого метода является увеличение поверхности взаимодействия растворителя с растительным материалом. Высокое разнообразие встряхивающих устройств или доступные растворители делают его пригодным для экстракции большого количества компонентов [10].
параметры, как давление, температура, время осуществления и растворимость [10].
Таким образом, подбор метода и параметров ведения процесса экстракции БАВ определяет в дальнейшем свойства экстрагированного вещества и его эффективность воздействия.
Нами в качестве механизма активизации процесса экстрагирования предложено ультразвуковое воздействие, характеризующееся наличием упругих колебаний и волн частотой выше 15-20 кГц. В результате действия ультразвука в жидкой среде возникает кавитация -массы пульсирующих пузырьков, заполненных паром, газом или их смесью.
Движение пузырьков в различных направлениях, их схлопывание, слияние друг с другом и т. д. порождают в жидкости импульсы сжатия (микроударные волны) и микропотоки, что способствует локальному нагреванию среды, возникновению ионизации. В результате указанных эффектов происходит разрушение находящихся в жидкости твердых тел (кавитационная эрозия), жидкость перемешивается, инициируются или ускоряются различные физические и химические процессы.
Степень и глубина кавитационных процессов определяются условиями ультразвукового воздействия, которое способствует образованию в жидкости участков с высоким и низким давлением, которые, в свою очередь, обусловливают формирование в среде зон высоких сжатий и зон разрежений.
Материалы и методы
В качестве источников природных адап-тогенов было выбрано следующее растительное сырье:
– крапива двудомная ( Urtica folia L. ), содержит некоторые одно- и двухосновные карбоновые кислоты (муравьиную, масляную, щавелевую, янтарную, фумаровую), некоторые оксикислоты (молочную, лимонную, хинную, галловую). В траве присутствует аминокислоты, азотсодержащие соединения, эфирное масло в том числе метилгептенон, ацетофенон; стероиды – ситостерин; витамины: В1, В2, С, Е, К, РР, каротин; дубильные вещества, флавоноиды; кумарины, а также порфирины – протопорфирин, копропорфи-рин I; тритерпеновые вещества и лигнаны, макро- и микроэлементы, находящиеся в связанном состоянии, белки, клетчатку и пектиновые вещества. Существуют данные, что из надземной части крапивы двудомной выделили кофейную кислоту, рутин, кверцетин, гиперин, изокверцетин [10]. В листьях содержится большое количество различных водо- и жирорастворимых витаминов (В1, В2, пантотеновая кислота, аскорбиновая кислота – 200 мг %), биологически активных соединений (β-каротин – 50 мг %, хлорофилл, кумарины, флавонолы, алкалоиды – 0,19–0,29 % и др.), камедей, органических кислот, макро- и микроэлементов. В порошке сахаров – 5,3 %, жиров 3,3 %, крахмала – до 10 %, белков – 17–20 %. В состав белков входят незаменимые аминокислоты лизин, треонин, валин, лейцин, триптофан [2, 3, 5–7].
– овес районированный, сорт «Белозерный». Выведен Сибирским НИИ растениеводства и селекции и Уральским НИИ сельского хозяйства. Разновидность var. mutica. Белозерный, безостый, в отдельные годы наблюдается слабая остистость. Зерно промежуточного типа между толстоплодным и среднеплодным, средней крупности, масса 1000 зерен 32– 35 г, пленчатость от низкой до средней – 23– 28 %. Содержание белка в крупе 14–16 %
Наиболее примечательной является уникальная группа антиоксидантов под названием авентрамиды, которые почти исключительно встречаются у овса. Авентрамиды могут помочь снизить уровень артериального давления за счет увеличения производства оксида азота. Молекулы газа оксида азота помогают расширять кровеносные сосуды, что приводит к лучшему кровообращению. Кроме того, авентрамиды обладают противовоспалительным и противозудным действием [13].
В основу эксперимента были заложены следующие факторы экстракции: экстрагенты БАВ (вода и водно-спиртовой раствор, концентрация спирта 70 %); обработка УЗ разной мощности (120 Вт – 30 % от паспортного значения; 240 Вт – 60 % от паспортного значения) экстрагента в течение 5 минут; метод экстрагирования (настаивание и дистилляция).
Условия экстрагирования овса:
-
а) водное;
-
б) с добавлением спирта (20, 50 и 70 %);
-
в) обработка ультразвуком мощностью 120 и 240 Вт в течение 1, 3 и 5 минут на разных этапах (предварительно воды либо совместно смеси зерна и воды).
Для обработки исследуемых объектов ультразвуковым воздействием применялся ультразвуковой технологический аппарат серии «Волна-М» (модель УЗТА-04/22-ОМ), обладающий следующими характеристиками:
-
• частота механических колебаний – (22 ± 1,65) кГц;
-
• мощность – 400 ВА;
-
• интенсивность ультразвукового воздействия – не менее 10 Вт/см2;
-
• диаметр излучающей поверхности – 25 мм.
Ультразвуковая колебательная система построена на пьезоэлектрических кольцевых элементах и изготовлена из титанового сплава ВТ5. Используемые инженерные решения защищены патентом РФ № 2141386.
Результаты и их обсуждение
Нами в первую очередь устанавливалось влияние метода экстракции на содержание экстрактивных веществ и антиоксидантную активность получаемых экстрактов. Данные по указанным параметрам по крапиве приведены в табл. 1.
Результаты оценки показали, что наибольшей АОА по отношению к контролю обладают образец экстракта Urtica folia L. (2,4043 мг/мл), полученный при использовании ультразвукового воздействия мощностью 120 Вт, и образец на основе водно-спиртового экстрагента без УЗВ (2,5209 мг/мл).
УЗВ воздействие мощностью 120 Вт в течение 5 минут весьма эффективно для сохранения антиоксидантов (АОА (2,4043 ± 0, 084) мг/мл при контроле (2,0773 ± 0,06) мг/мл).
Повышение мощности до 240 Вт дает значительное повышение по показателю накопление экстрактивных веществ ‒ (67,29 ± 1,2) % при значении этого показателя в контроле (66,66 ± 0,9) %.
Результаты оценки доли экстрактивных веществ и ОАО в экстрактах из овса приведены в табл. 2.
Визуально результаты можно отразить в виде диаграммы (рис. 2).
Различные условия экстрагирования овса определяют разницу в экстрактивности и антиоксидантной активности экстрактов. Ультразвуковое воздействие на зерно в воде мощностью 120 Вт в течение 5 минут наиболее сильно активизирует выделение из овса экстрактивных веществ, по сравнению с контролем их массовая доля увеличилась в экстракте на 43,7 %, предварительная обработка только воды до внесения в нее зерна также активизирует процесс экстрагирования, но в меньшем объеме – на 15,5 %.
Также применяемые методы экстрагирования способствуют повышению антиоксидантной активности экстрактов, и спиртовых, и с ультразвуковым воздействием.
Согласно исследованиям А. Яшина, Я. Яшина с коллегами основными антиоксидантами цельных зерен являются оксиарома-тические кислоты – производные бензойной и коричной кислот. В зернах овса и других зерновых обнаружены гидроксибензойные кислоты (галловая, салициловая, ванилиновая, сиреневая, протокатехиновая и n-гидро-ксибензойная), гидроксикоричные кислоты (феруловая, кофейная, о-, м-, и n – кумаро-вые, коричная, синаповая) [8, 21]. Оксиаро-матические кислоты в зернах находятся как в
Таблица 1
Результаты оценки экстрактов крапивы
|
Показатель |
Наименование образца |
||||
|
контроль |
образец 1 (УЗ 5 мин/ 120 Вт) |
образец 2 (УЗ 5 мин/ 240 Вт) |
образец 3 (дистилляция) |
образец 4 (спиртовой экстракт) |
|
|
АОА, мг/мл |
2,0773 |
2,4043 |
1,9748 |
1,9629 |
2,5209 |
|
Содержание экстрактивных веществ (ЭВ), % |
66,66 |
60,90 |
67,29 |
69,09 |
32,38 |
Таблица 2
Результаты оценки экстрактов овса
|
Способ получения экстракта |
Содержание экстрактивных веществ, % |
АОА, мг/мл |
|
Водный (контроль) |
31,4480 |
0,69799 |
|
Водно-спиртовой 20 % |
30,0546 |
0,685405 |
|
Водно-спиртовой 50 % |
33,9890 |
1,478465 |
|
Водно-спиртовой 70 % |
26,9672 |
1,643948 |
|
Обработка УЗ смеси (5 мин, 120 Вт) |
75,1092 |
0,80018 |
|
Предварительная обработка воды (5 мин, 120 Вт) |
46,9945 |
0,938377 |
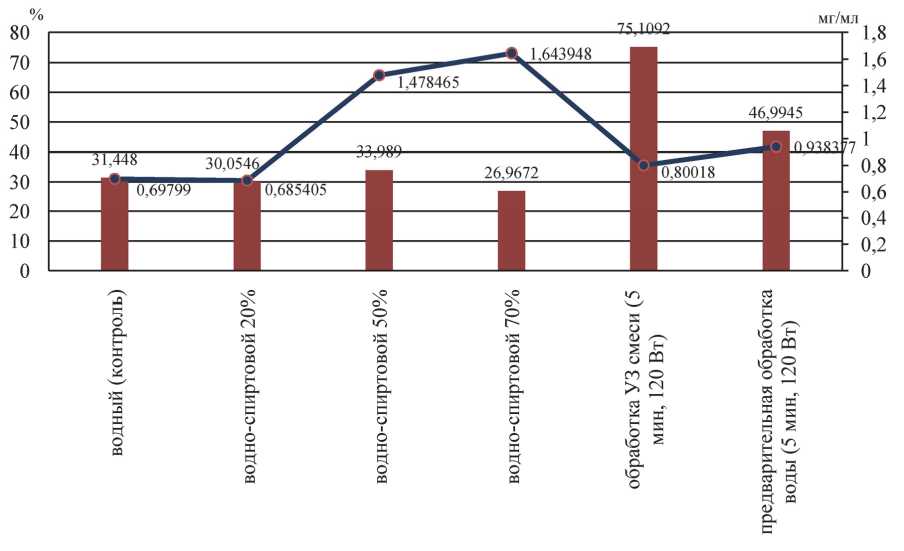
^™ Содержание экстрактивных веществ, % ■• ■ АОА,
Рис. 2. Результаты определения экстрактивности и АОА экстрактов из овса
свободном, так и связанном состоянии. Свободные оксиароматические кислоты в основном находятся во внешней оболочке и легко экстрагируются органическими растворителями [8].
Наши исследования подтверждают повышение антиоксидантной активности спиртовых экстрактов в среднем на 111,8–135,5 %, ультразвук действует менее активно, повышение АОА экстрактов составило 14,6– 34,4 %.
Таким образом, установлено, что ультразвуковая обработка улучшает кинетику экстрагирования и выход биологически активных веществ из субстрата. В технологии экстрагирования исключается этап настаивания, что обеспечивает снижение энергоемкости процесса. Эти эффекты обусловлены имплозией пузырьков, генерируемых эффектами кавитации. Температура и давление, создаваемое при имплозии, разрушают оболочку клетки растительного сырья, и ее содержимое выбрасывается в среду экстрагента.
Применяемые нами методы экстрагирования дают положительные результаты и требуют дальнейших исследований в указанном направлении.
Список литературы Повышение эффективности экстракции биологически активных веществ из растительного сырья методом ультразвукового воздействия
- Марина Н.В., Новоселова Г.Н., Шавнин С.А. Продукты повышенной биологической ценности из нетрадиционного растительного сырья//Известия Самарского научного центра Российской академии наук. -2010. -Т. 12, № 1(8). -С. 2079-2082.
- Попов А.И., Шпанько Д.Н., Черкасова Е.А. Некоторые товароведческие показатели сырья крапивы двудомной и крапивы коноплевидной//Техника и технология пищевых производств. -2009. -№ 3. -С. 54-58.
- Савенко А.В., Сорокопуд А.Ф., Гриценко В.В. Получение экстрактов листьев крапивы двудомной и березы повислой в вибрационном аппарате//Техника и технология пищевых производств. -2015. -Т. 38, № 3. -С. 102-109.
- Синютина С.Е., Романцова С.В., Савельева В.Ю. Экстракция флавоноидов из растительного сырья и изучение их антиоксидантных свойств//Вестник ТГУ. -2011. -Т. 2, № 1. -С. 345-347.
- Тринеева О.В., Сливкин А.И. Исследование микроэлементного состава листьев крапивы двудомной//Научные ведомости Белгородского государственного университета. Серия Медицина. Фармация. -2015. -№ 22. -С. 169-174.
- Тринеева О.В., Сливкин А.И, Воропаева С.С. Определение органических кислот в листьях крапивы двудомной//Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация. -2013. -№ 2. -С. 215-219.
- Яцюк В.Я., Чалый Г.А, Сошникова О.В. Биологически активные вещества травы крапивы двудомной//Российский медико-биологический вестник имени академика И.П. Павлова. -2006. -№ 1. -С. 25-29.
- Яшин А., Яшин Я., Федина П., Черноусова Н. Определение природных антиоксидантов в пищевых злаках и бобовых культурах//Аналитика. -2012. Т. 2, № 1. -С. 32-36.
- Adom K.K., Liu R.H. Antioxidant activity of grains//Journal of Agricultural and Food Chemistry. -2002. -V. 50. -P. 6182-6187 DOI: 10.1021/jf0205099
- Arceusz Agnieszka, Wesolowski Marek and Konieczynski Pawel. Methods for Extraction and Determination of Phenolic Acids in Medicinal Plants//Natural Product Communications. -2013. -V. 8 (12). -Р. 1821-1830.
- Chen Lingyun, Remondetto Gabriel E., Subirade Muriel. Food protein-based materials as nutraceutical delivery systems//Trends in Food Science & Technology. -2006. -V. 17, Issue 5. -Р. 272-283 DOI: 10.1016/j.tifs.2005.12.011
- Chester T.L., Pinkston J.D., Raynie D.E. Supercritical fluid chromatography and extraction//Analytical Chemistry. -1996. -V. 68 (12). -P. 487-514 DOI: 10.1021/a1960017i
- Dykes L., Rooney L.W. Phenolic Compounds in Cereal Grains and Their Health Benefits//Cereal Foods World. -2007. -V. 32 (3). -P. 105-111.
- Fang Z., Bhandari B. Encapsulation of polyphenols//Trends in Food Science & Technology. -2010. -V. 21 (10). -P. 510-523 DOI: 10.1016/j.tifs.2010.08.003
- Jones J.M. Grain-based foods and health//Cereals Food World. -2006. -V. 51. -P. 108.
- Oliveira B. Vieira da Silva et al. Natural phytochemicals and probiotics as bioactive ingredients for functional foods: Extraction, biochemistry and protected-delivery technologies//Trends in Food Science & Technology. -2016. -V. 50. -P. 144-158. 2015.12.007 DOI: 10.1016/j.tifs
- Palacios I., Lozano M., Moro C., D’Arrigo M., Rostagno M. A., Martínez J.A., García-La fuente A., Guillamón E., & Villares A. Antioxidant properties of phenolic compounds occurring in edible mushrooms//Food Chemistry. -2011. -V. 128(3). -P. 674-678 DOI: 10.1016/j.foodchem.2011.03.085
- Peterson D.M. Oat antioxidants//Journal of Cereal Science. -2001. -V. 33, Issue 2. -P. 115-129 DOI: 10.1006/jcrs.2000.0349
- Saha S., Walia S., Kundu A., Sharma K., & Paul R.K. Optimal extraction and fingerprinting of carotenoids by accelerated solvent extraction and liquid chromatography with tandem mass spectrometry//Food Chemistry. -2015. -V. 177. -P. 369-375 DOI: 10.1016/j.foodchem.2015.01.039
- Vilkhu K., Mawson R., Simons L., & Bates D. Applications and opportunities for ultrasound assisted extraction in the food industry//Innovative Food Science & Emerging Technologies. -2008. -V. 9(2). -P. 161-169 DOI: 10.1016/j.ifset.2007.04.014
- Yashin Ya.I., Nemzer B.V., Ryzhnev V.Yu., Yashin A.Ya., Chernousova N.I. and Fedina P.A. Creation of a Databank for Content of antioxidants in food products by an amperometric method//Molecules. -2010. -V. 15. -P. 7450-7466 DOI: 10.3390/molecules15107450


