Практические аспекты послеоперационной аналгезии
Автор: Молчанов Игорь Владимирович, Буров Николай Евгеньевич, Пулина Наталья Николаевна, Черкавский Олег Николаевич
Журнал: Клиническая практика @clinpractice
Рубрика: Мнение эксперта
Статья в выпуске: 1 (9), 2012 года.
Бесплатный доступ
В статье обобщен опыт применения наркотических, ненаркотических и адъювантных препаратов в целях послеоперационной анальгезии, указаны основные наиболее простые и доступные в условиях стационара схемы послеоперационного обезболивания в комплексной послеоперационной интенсивной терапии в хирургической клинике. Применение рекомендуемой схемы способствует профилактике внутрибольничной наркомании у пациентов с длительным болевым синдромом.
Анальгезия, наркотические и ненаркотические средства, шкала оценки боли, схемы послеоперационного обезболивания
Короткий адрес: https://sciup.org/14338420
IDR: 14338420
Текст научной статьи Практические аспекты послеоперационной аналгезии
Послеоперационная анальгезия является одним из важнейших компонентов в системе общей интенсивной терапии хирургического больного, создающих условия комфортности пациентам. При этом обезболивание является проявлением не только гуманного отношения к больному, но и следствием более глубокого понимания механизмов боли, как интегрального фактора отрицательного воздействия на основные функциональные показатели организма и возможного отягощения течения послеоперационного периода [1-6].
Разработка наиболее оптимальных вариантов послеоперационной анальгезии является одной из актуальных социально-экономических задач здравоохранения, сдерживающих рост наркомании [7, 8].
Патофизиологические аспекты
После оперативного вмешательства, а также при открытых или закрытых механических повреждениях в тканях образуется много различных «гуморальных продуктов боли», местных биохимических трансмиттеров болевого восприятия (алгогенов), включая такие как: ионы К, Н, серотонин, гистамин, ацетилхолин, простагландин, кинин, брадикинин, аденозин, возбуждающие аминокислоты, субстанция Р (пептиды), лейкотриены, а также продукты жизнедеятельности клеток белой крови (лим-фокины, монокины, интерлейкины) и др. Вместе они выступают не только как алгогены, но и как маркеры первичного воспалительного ответа, действуя на один и тот же биологический объект [8, 9, 10].
Ноцицептивные раздражения, поступаю- щие из различных областей тела, модулируются в задних рогах спинного мозга, передаются по восходящей системе боли по спиноталамическому или спиноретикулоталамическому пути в ядра таламуса, гипоталамуса, лимбической системе и к чувствительной коре головного мозга, где осуществляется перцепция и развивается не менее сложная системная реакция ответного реагирования.
Система ответного реагирования в живом организме представлена нисходящей антино-цицептивной системой. Эту систему формирует кора, подкорковые структуры и нейтро-трансмитеры нисходящей системы. К медиаторной группе нисходящей проводящей системы относятся моноамины, включающие аминокислоты (глицин), катехоламины, серотонин, а также эндорфины, соматостатин, кальцитонин. Таким образом, в живом организме постоянно взаимодействуют две системы: болевая и антиболевая. Головной мозг играет ключевую роль в формировании боли и ответной реакции на боль включением антиноци-цептивной системы [11-13].
Однако проявление естественной антиноци-цептивной защиты в реальной жизни отстает по скорости, темпу и силе от развития острой болевой реакции при травме, которая возникает в результате каскада ноцицептивных раздражений. Клинически это выражается в развитии острого болевого синдрома. И в этой фазе ощущение острой боли может быть опасным, несмотря на то, что в этот период болевого стресса организм мобилизует все функциональные, нейро-гуморальные и метаболические механизмы на борьбу с болью. Таким образом задача современной анестезиологии состоит в том, чтобы оказать первую «помощь» в периоде острой боли и периоде функционального дисбаланса двух проводящих систем путем применения обезболивающих средств и устранения так называемых вторичных признаков боли, которые проявляются дисфункцией со стороны различных органов и систем и, в первую очередь, изменением функции дыхания и кровообращения, нейрогумо-ральной системы и метаболизма.
Краткий экскурс в область нейрофизиологии боли в этой статье сделан для того, чтобы подчеркнуть, что лечение болевых синдромов – задача сложная. Современная анестезиология располагает весьма скромными возможностями целенаправленного воздействия на механизмы болевого восприятия, на различные звенья про- водящих путей, чтобы защитить пациента от острого болевого синдрома, связанного с травмой или оперативным вмешательством.
Исходя из механизма возникновения боли и ее распространения становится очевидным, что что сегодня в анестезиологии и медицине нет универсального метода для устранения боли и каждый фармакологический препарат или метод обезболивания способен оказывать влияние лишь на те или иные звенья проводящей системы.
Поэтому самым перспективным сегодня является выбор комбинированной анестезии с множественными точками воздействия на проводящую систему боли и современные методы анестезии при хирургических операциях обеспечивают достаточно эффективную защиту. Они способны оказывать существенное тормозящее влияние не только на ноцицептивную симуляцию, но и сдерживать каскад системной воспалительной реакции организма [1, 7, 8, 14].
Основы послеоперационного обезболивания
Что касается анальгезии непосредственно в послеоперационном периоде, то принцип комплексного подхода и медикаментозной коррекции болевого синдрома должен оставаться неизменным. Какие же практические рекомендации можно дать в плане выбора метода лечения острой послеоперационной соматической боли у пациентов, например, онкологического, неврологического, терапевтического или хирургического профиля?
Прежде всего врачи должны придерживаться ряда общих принципов:
-
1. Лечение должно быть по возможности патогенетическим, поскольку при спастической природе боли достаточно назначить спазмолитик, а не анальгетик.
-
2. Назначенное средство должно быть адекватно интенсивности боли и быть безопасным для пациента, не вызывать выраженных побочных явлений (депрессии дыхания, снижения АД, расстройства ритма).
-
3. Продолжительность назначения наркотических средств и их дозы должны определяться индивидуально, в зависимости от типа, причин и характера болевого синдрома.
-
4. Монотерапия наркотиками не должна применяться. Наркотик в целях увеличения эффективности должен сочетаться с ненаркотическими средствами и адъювантными симп-
- томатическими средствами различного ассортимента.
-
5. Назначать обезболивание следует лишь тогда, когда распознана природа и причина боли и установлен диагноз. Снятие симптома боли при неустановленной причине боли недопустимо [1, 3, 5, 7, 8, 14, 15].
При выполнении этих общих принципов обезболивания, принятых в практике здравоохранения, каждый врач должен:
Во-первых, знать фармакодинамику обезболивающих средств. Арсенал этих средств невелик и перечень наркотических и ненаркотических средств приводится в табл.1.
Таблица 1
|
Препараты |
Лекарств. форма |
Разовая доза |
Суточная доза |
|
Ненаркотические анальгетики |
|||
|
Анальгин |
Табл. |
500-1000 мг |
1-3 гр. |
|
Диклофенак |
Табл.,амп. |
50-100 мг |
200-400 мг |
|
Парацетамол- диклофенак |
Табл.,амп. |
200-400 мг 1000 мг |
1,5-2 гр. 3-4 гр. |
|
Индометацин |
Табл., свечи |
25 мг |
150 мг |
|
Аспирин |
Табл., |
250-500 мг |
2-3 гр. |
|
Баралгин, пенталгин, седалгин |
Табл., амп. |
500-1000 мг |
2-3 гр. |
|
Кетеролак |
Табл. |
10-30 мг |
60-120 мг |
|
Опиаты |
|||
|
Просидол |
Табл. |
25-100 мг |
400 мг |
|
Промедол |
Табл.,амп. |
10-20 мг |
300 мг |
|
Омнопон |
Амп. |
10-20 мг |
100 мг |
|
Морфин |
Табл., амп. |
10-20 мг |
100 мг |
|
Синтетические опиоиды |
|||
|
Трамадол (Трамал, традол) |
Капс.,амп.,свечи |
50-100 мг |
400-500 мг |
|
Буторфанол (Морадол,стадол) |
Амп. |
2-4 мг |
24 мг |
|
Бупренорфин (Сангезик,темгезик) |
Табл., амп. |
0.2-0.4 мг |
3.0 мг |
|
Налбуфин |
Амп. |
10 мг/мл, 20мг/мл |
40-60 мг |
Перечень ненаркотических и наркотических анальгетиков
Во вторых, знать фармакодинамику основных адьювантных средств. Как видно из табл. 2, они представлены: кортикостероидами, которые укрепляют клеточные мембраны, антидепрессантами, которые показаны при тревожно-мнительных состояниях, противо- судорожными средствами (при эклампсии, эпилепсии, гипертонусе), нейролептиками, транквилизаторами, антигистаминными, седативными средствами, что в комплексе с анальгетическими средствами обеспечивает лучший лечебный эффект.
Рекомендуемый перечень адъювантных средств
Таблица 2
|
Препараты |
Лекарств. форма |
Разовая доза |
Суточная доза |
|
Кортикостероиды |
|||
|
Преднизолон |
Табл., амп. |
5-30 мг |
120 мг |
|
Антидепрессанты |
|||
|
Амитриптилин |
Табл., амп. |
12,5-25 мг |
125 мг |
|
Азафен |
Табл. |
25-50 мг |
150-200 мг |
|
Противосудорожные |
|||
|
Финлепсин |
Табл. |
200 мг |
1200 мг |
|
Нейролептики |
|||
|
Аминазин |
Драже, ампулы |
25-50 мг |
200 мг |
|
Галоперидол |
Табл., амп. |
1,5-3 мг |
10 мг |
|
Транквилизаторы |
|||
|
Элениум |
драже |
5-10 мг |
50 мг |
|
Реланиум |
Табл.,амп. |
5 мг |
30 мг |
|
Антигистаминные |
|||
|
Димедрол |
Табл., амп. |
30-50 мг |
200 мг |
|
Супрастин |
Табл., амп. |
25-50 мг |
150 мг |
|
Седативные |
|||
|
Настойка валерианы |
флакон |
30-60 кап. |
По показаниям |
|
Корвалол |
флакон |
30 кап. |
По показаниям |
|
Пустырник |
флакон |
30-60 кап. |
По показаниям |
В третьих, при лечении болевого синдрома врач должен оценить интенсивность боли и в зависимости от этого применять единую тактику.
Для оценки интенсивности боли в литературе существует множество предложений, но в обычной практике пользуются следующей простой шкалой:
|
Баллы: |
Шкала оценки интенсивности боли 0123 4 |
|
Оценка: |
боли нет слабая умеренная сильная очень сильная |
Таким образом, учитывая интенсивность боли у пациента и особенности фармакодинамики ненаркотических, наркотических и адъювантных средств, можно рекомендовать к практическому применению в каждом хирургическом или реанимационном отделении трехступенчатую схему обезболивания [1, 3, 7, 8].
Слабая боль
При слабой боли принято назначать ненаркотические аналгетики в сочетании с адъювантными препаратами. В таблице 1 дается перечень ненаркотических анальгетиков, который был реакомендован ВОЗ в 1986 г. и дополненный в настоящее время, как альтернативный вариант с учетом появления новых средств [7, 8]. При этом широко применяются нестероидные противовоспалительные препараты (аспирин, индометацин, диклофенак, кетопрофен, ибупрофен, напроксен, кетопрофен, пироксикам и др.). Указанные ненаркотические аналгетики периферического действия давно используются в медицине благодаря их способности подавлять воспаление, снижать температуру тела и интенсивность болей [1, 3, 7, 8, 14, 15, 16]. Механизм действия их состоит в том, что они блокируют синтез простагландинов, ингибируя фермент циклооксигеназу (ЦОГ), который катализирует конверсию арахидоновой кислоты с образованием ряда предшественников простагландинов.
Простагландины являются медиаторами воспалительной реакции в тканях и вызывают лихорадку, отек, покраснение тканей, боль, нарушение функций. Назначение указанных средств способствует торможению или полному устранению воспалительной реакции. В последние годы в этой группе синтезирован препарат кетеролак-трометамин, который кроме ан-тивоспалительного действия обладает значительным обезболивающим эффектом [1, 15, 16].
Кетеролак-кеторол, кетолак (номер регистрации 000430; 01.07.05, ППР) – один из препаратов пиролуксусной кислоты, который по своей аналгетической силе практически не уступает опиоидам. Это аналгетик короткого действия. В дозе 2 мг в/м кетеролак эквивалентен 1 мг морфина и 3-5 мг меперидина. Аналгезия наступает через 10 мин и длится примерно 6 час. Время полувыведения кетеро-лака составляет 5 - 6 часов. Нагрузочная доза его составляет 60 мг в/м. Через каждые 6 часов вводится 30 мг препарата. Лицам старше 65 лет дозы уменьшаются наполовину. Препарат не имеет побочных реакций, свойственных опиоидам, он не угнетает дыхание, не снижает моторику ЖКТ и к нему не возникает привыкания и зависимости (2, 3, 15) Нестероидные противоспалительные препараты успешно применяются для послеоперационной аналгезии. Ректальные свечи с индометацином, пара- цетамолом могут быть хорошим дополнительным подспорьем для аналгезии после операции в абдоминальной хирургии.
Перфалган (номер регистрации 016008/01 от 30.06.09). Это жидкий парацетамол для внутривенного введения, прозрачный, слегка желтоватый раствор без видимых включений. Внедрение в хирургическую клинику внутривенной формы парацетамола открывает заманчивые перспективы его применения в интраоперационном и послеоперационном периодах. Парацетамол – эффективный аналгетик, потенциал которого незначительно уступает опиатам. Механизм его аналгетического действия пока не изучен. В отличие от опиатов и НПВП, он не имеет эндогенных рецепторов и не подавляет циклооксигеназу. Имеется много доказательств в пользу его центрального антиноци-цептивного действия. Возможно, он подавляет активность ЦОГ-2 в ЦНС и предупреждает развитие гипералгезии путем повышения активности антиноцицептивной системы и тормозных серотонинергических путей. Основное показание к парацетамолу – быстрое устранение боли и лихорадочной реакции.
В хирургической клинике парацетамол может применяется в двух вариантах. Во-первых, как компонент общей ингаляционной или неингаляционной анестезии. При этом парацетамол в дозе 1000 мг может входить в премедикацию, а также вводиться в/в во время или в конце анестезии для пролонгирования после-наркозной аналгезии, особенно у лихорадящего пациента. Во-вторых, парацетамол может быть применен как аналгетик и антипиретик в комбинации с другими наркотическими или ненаркотическими аналгетиками в послеоперационном периоде. При этом парацетамол вводят внутривенно (медленно) в дозе 1000 мг без разведения препарата и повторные дозы назначают через 4 часа. Через 1 - 3 сут. он может быть заменен на таблетированные формы.
У реанимационных больных, находящихся в критическом состоянии, при наличии цирро- за печени, портальной гипертензии, панкрео-некроза, нефропатии, декомпенсированного сахарного диабета, сепсиса с признаками ПОН и ДВС применение парацетамола нецелесообразно в связи с его гепато-и нефротоксичностью [17].
Умеренная боль
При умеренной боли препаратом выбора остается трамадол (трамал) , который может сочетаться с ненаркотическими анальгетиками (кетеролаком или с перфалганом) и адъювантной симптоматической добавкой.
Трамал, трамадол (номер регистрации 002951, от 31.10.2008) – синтетический опиоид средней силы действия, уступающий морфину по анальгетическому потенциалу (1:51:10), но лишенный побочных эффектов, свойственных опиатам.
Механизм действия трамала связан с опиоидной, адренергической и серотонинергической системами ЦНС. Кроме непосредственного действия на μ -опиатный рецептор, трамал нарушает обратный захват норадреналина и серотонина. Применяется в дозе 50-100 мг в/м. Он не вызывает угнетения дыхания и кровообращения, нарушения моторики желудочно-кишечного тракта (ЖКТ) и мочевых путей. Из побочных эффектов в ближайшем п/о периоде может отмечаться тошнота, головокружение, сухость во рту (2, 15). Для усиления анальгетического действия трамал может сочетаться с индометацином, диклофенаком (в свечах), ке-теролаком и седативными препаратами.
В настоящее время особое внимание уделяется комбинации трамала с другими анальгетиками. Высокую эффективность показал комбинированный препарат Залдиар, состоящий из трамадола (37,5 мг) и парацетамола (325 мг), регистрационный номер 015588/01 от 25.03.2009. Синергизм этих двух анальгетиков повышает анальгетический эффект при снижении риска возникновения побочных эффектов, что позволяет применять Залдиар при болях, которые раньше купировались лишь приемом опиатных аналгетиков. Это расширяет сферу клинического применения Залдиара при обезболивании после малотравматичных оперативных вмешательствах (грыжесечение, секторальная резекция молочной железы, операции на щитовидной железе), а в комбинации с НПВП – при более травматичных полостных операциях, а также для снижения или устранения болевого синдрома у пациентов онкологического профиля (3).
Сильная боль
При сильной боли назначается анальгетик центрального действия (морфин, промедол, бупренорфин, морадол и др.) в сочетании с ненаркотическими и адъювантными средствами (18, 19). Промежуточное положение между трамадолом, бупренорфином и промедолом занимает новый отечественный опиоид – про-сидол (регистрационный номер 001172/01 от 20.07.2009) . Его можно применять в дозе 20 мг защечным способом, и после рассасывания таблетки (порошка) через 15 - 30 мин наступает выраженное обезболивание и наркотический сон продолжительностью 3 - 4 часа.
Суточная доза может достигать 100 - 160 мг. Побочные эффекты, свойственные опиатам, у просидола выражены слабее.
Одним из хорошо известных аналгетиков, применяемых в анестезиологии, является буторфанол (морадол).
Буторфанол, морадол (номер регистрации-001327/01, от 29.12.06) является смешанным опиоидным агонистом и слабым антагонистом μ -опиатных рецепторов. В результате взаимодействия с каппа-рецепторами у морадола сильно выражены анальгетические свойства и седация, а в результате антагонизма с μ -рецеп-торами морадол ослабляет основные побочные эффекты морфиноподобных анальгетиков и более благотворно действует на дыхание и кровообращение. По своему анальгетическому потенциалу он уступает морфину, но превосходит действие промедола. Морадол в дозе 0,07 мг/кг в/м не оказывает отрицательного действия на тонус и моторику ЖКТ, является препаратом выбора после операции в абдоминальной хирургии. Он может применяться также в порошке и таблетках через рот. Длительность действия морадола при в/м введении составляет до 6 час. Морадол не вызывает физической и психической зависимости и не внесен в реестр наркотических веществ, находящихся под международным контролем [3]. При более сильных болях назначается бупренорфин.
Бупренорфин, (регистрационный номер 015004/01, 04.04.2008) – полусинтетический аналгетик, является частичным агонистом мю-и антагонистом каппа-опиатных рецепторов. По аналгетической активности он в 20-40 раз превосходит морфин, выпускается в ампулах по 0,3 и 0,6 мг. Он не оказывает заметного влияния на гемодинамику, депрессия дыхания ме- нее выражена, чем у морфина. Побочные эффекты проявляются в седации, сонливости и тошноте. Возможен сублингвальный путь введения препарата в дозе 0,2-0,4 мг. Бупренорфин предложен в лечебной практике и в трансдермальной форме, созданной по специальной технологии, под названием транстек, и представляет собой накожный пластырь. Срок аналгетического действия достигает 4-х суток и может с успехом применяться при лечении радикулитов, миозитов, растяжении связок, спондилоартрозе и других заболеваниях опорно-двигательного аппарата. Бупренорфин не оказывает влияния на моторику ЖКТ и может быть препаратом выбора после абдоминальных операций [3].
Применительно к хирургическим операциям различного объема можно рекомендовать следующие методы послеоперационного обезболивания, которые представлены в табл. 3.
После внеполостных операций преимуще- ственно назначается трамал с диклофенаком, кетеролаком или с перфалганом [3, 20].
После операций среднего объема назначается трамал с перфалганом или аспизолом (антивоспалительным и антиагрегационным средством). Дополнительно назначается ингибитор кининогенеза – контрикал – для снижения болей, отека тканей, улучшения органного кровотока, профилактики фибринолиза [3].
После больших абдоминальных и торакальных операций назначается трамал, буторфанол, морадол, промедол, просидол в качестве обезболивания в сочетании с парацетамолом, аспизолом, контрикалом и клофелином (0,050,1 мг п/к 2-3 раза в сутки), как специальным компонентом послеоперационного и интраоперационного обезболивания, значительно повышающим антистрессовую защиту больного, потенцирующего действие аналгетиков, вызывающего вазоплегию и снижающего гипердинамию.
Таблица 3
|
После внеполостных операций |
||
|
Препарат |
Суточная доза |
Разовая доза и число введений |
|
Трамал |
200-400 мг |
50-100 мг в/м, 4 раза |
|
Кеторолак или перфалган |
60-90 мг 3000 мг |
30 мг в/м, 2-3 раза По 1000 мг в/м, 3 раза |
|
После абдоминальных операций |
||
|
Препарат |
Суточная доза |
Разовая доза и число введений |
|
Трамал Перфалган или кетеролак Контрикал |
200-400 мг-(4 мг) 3 г 60-90 мг 30-50 тыс ЕД |
100 мг в/м, 4 раза (2 мг х 2раза) По 1 г в /м, 3 раза 30 мг в/м, 2-3 раза 10 тыс ЕД в/в, 4-6 раз |
Рекомендуемые средства для послеоперационного обезболивания
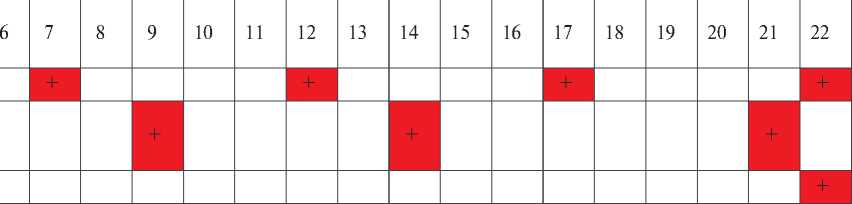
Примерный график фармакотерапии для внесения в протокол медицинской или реанимационной карты приводится в таблице 4. Обезболивающее средство назначается 4 раза в сутки – в 7, 12, 17 и 22 часа, нестероидные противовоспалительные препараты –3 раза – в 9, 14, 21 час, транквилизатор – 1 раз на ночь в 22 часа [1-3].
Такова принципиальная схема послеоперационного обезболивания и лечения болевых синдромов, принятая в нашей стране и зафиксированная в нормативных документах Фарм- комитета (приказ МЗиСР РФ №110 от 12.02.2007 г.)
В современной хирургической клинике кроме фармакологических методов обезболивания в послеоперационном периоде нашли широкое применение проводниковые виды местной анестезии [2, 21].
В связи с новой технологией наибольшее признание получила пролонгированная эпидуральная и сакральная аналгезия с использованием нового поколения анестетиков (марка-ин, бупивакаин, наропин), которые успешно
Таблица 4
Рекомендуемый график послеоперационной фармакотерапии
Препарат
Часы
Трамал Перфалган или кетеролак Диазепам
применяются для создания послеопарционной аналгезии в урологии, эндоурологии, гинекологии, травматологии, хирургии органов брюшной полости. Вместе с назначением седативных препаратов проводниковая аналгезия (при болюсном или непрерывном введении препарата с использованием инфузоматов) создает физический и психологический комфорт пациенту, позволяет ему эффективно дышать, откашливать мокроту, активизировать свое положение в кровати [1, 2, 7, 8, 14, 21].
При этом эпидуральный блок оказывает лечебный эффект в борьбе с парезом и атонией кишечника в связи с его симпатолитическим действием. Через 1-2 сут после ослабления острой боли катетер удаляется из эпидурального пространства. При необходимости он может быть оставлен на срок до 2 - 3 мес. [2, 10].
Начиная с 70-х годов ХХ века в нашей стране и за рубежом нашли широкое применение методы эпидурального введения морфина, в минимальных дозах (2-5 мг), который при однократном введении обеспечивал аналгезию в течение 16 - 24 часов [1, 2, 9].
Практические наблюдения показали, что при правильном выборе дозы и частоты введения наркотических препаратов техника пролонгированной аналгезии является безопасной и легко переносится пациентами даже пожилого и старческого возраста при наличии выраженной сопутствующей патологии со стороны органов дыхания и кровообращения [1, 7, 8, 14].
Побочные эффекты микродоз морфина при эпидуральном введении менее выражены, но могут также проявляться в виде тошноты, кожного зуда, задержки мочеиспускания, седации. При завышении указанной дозы опиатов может возникнуть умеренная депрессия дыхания обычно через 6-8 часов с момента эпидурального введения препарата. Однако, величи- на ДО увеличивается и МОД не изменяется и пациенты в послеоперационном периоде самостоятельно переходят в стойко компенсированное состояние газообмена.
В последние годы стала шире применяться методика интраплевральной регионарной аналгезии после операций в торакальной и абдоминальной хирургии [15]. В основе механизма аналгезии лежит односторонняя или двусторонняя блокада соматических межреберных нервов и симпатических ветвей. Техника ее проста и состоит в плевральной пункции по средне-подмышечной линии в 4-5 межреберье и введении местного анестетика маркаина (2030 мл 0,5% раствора). Аналгезия наступает быстро и достигает максимальной выраженности через 30 мин. Продолжительность анальгезии – 3-5 час. Для пролонгации анальгезии допустимо применение продолжительных капельных внутриплевральных инфузий препарата в течение 8 часов. Артериальной гипотензии при правильно выбранной дозе не бывает. Возможно появление симптома Горнера (миоз, птоз, энофтальм) на стороне блокады [15, 21].
Показанием к интраплевральной регионарной блокаде являются операции в верхнем этаже брюшной полости, множественные переломы ребер, болевой тормоз дыхания и кашля. Недостатком является односторонность блокады, возможная блокада диафрагмального нерва, низкая эффективность блокады при наличии плевральных сращений, возможны осложнения в виде пневмоторакса [15].
Таким образом, аналгезия послеоперационного периода является важным компонентом интенсивной терапии хирургического больного. Устранение боли является непременным условием нормализации витальных функций, сохранения нейрогуморального статуса и метаболизма. В обычных стационарах послеопе- рационная анальгезия может быть проведена в виде рекомендуемых выше схем, за счет рационального использования фармакологических препаратов.
Список литературы Практические аспекты послеоперационной аналгезии
- Буров Н.Е. Анальгезия послеоперационного периода//РМЖ. 2003, т.11, №21,С.1172-77.
- Овечкин А.М., Карпов И.А., Лосев С.В. Послеоперационное обезболивание в абдоминальной хирургии: новый взгляд на старую проблему//Анестезиол. и реаниматол. 2003, №5, с.45-50.
- Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы клинического применения наркотических и ненаркотических анальгетических средств при острой и хронической боли. Метод. указания МЗ и СР РФ. М., 2005, 79 с.
- Young T. Assessment of wound pain: overview and a new initiative. Br J Community Nurs. 2007; 12 (12 Suppl):5-8.
- Матвеев С.А., Жданов И.Г., Щуковский В.В. и др. Послеоперационное обезболивание у урологических пациентов//Саратовский мед. журнал. 2009. Т.5, №2. С.177-179.
- Viscusi ER. Patient-controlled drug delivery for acute postoperative pain management: a review of current and emerging technologies//Reg Anaesth Pain Med. 2008 Mar-Apr;33(2):146-58.
- Буров Н.Е.Применение нестероидных противовоспалительных препаратов в анестезиологии и реаниматологии//РМЖ. 2007, т.15, №29, С.2206-10.
- Буров Н.Е. Применение анальгетиков в анестезиологии и реаниматологии//РМЖ. 2005, т.13, №20. С.1340-45.
- Fredericks C.A., Drabant E.M., Edge F.M. et al. Healthy young women with serotonin transporter SS polymorphism show a pro-inflammatory bias under resting and stress conditions//Brain Behav Immun. 2010 Mar;24(3):350-7.
- Davis M.C., Zautra A.J., Younger J. et al. Chronic stress and regulation of cellular markers of inflammation in rheumatoid arthritis: Implications for fatigue//Brain Behav Immun. 2008 Jan;22(1):24-32.
- Lawrence JM, Hoeft F, Sheau KE, Mackey SC. Strategy-dependent dissociation of the neural correlates involved in pain modulation. Anaestesiology. 2011;115 (4):844-851.
- Younger J.W., Chu L.F., D`Arcy N.T., Trott K.E. et al. Prescription opioid analgetics rapidly change the human brain//Pain. 2011. 152 (8); 1803-10.
- Neugebauer V., Galhardo V., Maione S., Mackey S. Forebrain pain mechanisms.//Brain Res Rev. 2009. №60. P. 226-242.
- Буров Н.Е. Перспективы и негативы парацетамола в хирургической клинике//РМЖ. 2006, т.14, №12, С.879-85.
- Молчанов И.В., Филичкин А.С. Интраплевральная блокада. Возможность использования в хирургии желчевыводящих протоков//Клин анестезиол. и реаниматол. 2005, т.2, №3, С.2-9.
- Mackey S., Feinberg S.Pharmacologic therapies for complex regional pain syndrome//Curr Pain Headache Rep. 2007;11(1): 38-43.
- Girish C., Koner B.C., Jayanthi S. et al. Hepatoprotective activity of six polyherbal formulations in paracetamol induced liver toxicity in mice//Indian J Med Res. 2009;129 (5): 569-578.
- Hudcova I., McNicol E., Quah C., Lan J. et al. Patient controlled opioid analgesia versus conventional opioid analgesia for postoperative pain//Cochrame Database Syst Rev. 2006. №4: CD 003348.
- Sam W.J., Mackey S., Lotch J. et al. Morphine and its metabolites in patient controlled analgesia, considerations for respiratory depression. J Clin Anesth. 2011; 23 (2):102-6.
- Chou L.B., Wagner D., Witten D.M. et al. Postoperative pain following foot and ankle surgery: a prospective study//Foot Ankle Int. 2008; 29(1):1063-8.
- Rasmussen LS, Johnson T, Kuipers HM, et al. Does anaesthesia cause postoperative cognitive dysfunction? A randomised study of regional versus general anaesthesia in 438 elderly patients. Acta Anaesthesiol Scand. 2003 Mar;47(3):260-6.


