Преимущества использования биоматериала аллоплант при замедленно консолидирующихся переломах и псевдоартрозах трубчатых костей
Автор: Бейдик О.В., Анников В.В., Киреев С.И., Левченко К.К., Ван Кай , Марков Д.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2007 года.
Бесплатный доступ
Проведено экспериментальное иммунологическое обоснование возможности применения биоматериала аллоплант при замедленно консолидирующихся переломах и псевдоартрозах длинных костей. Показана возможность оптимизации репаративного остеогенеза и ускорения сращения переломов путем введения смеси измельченного материала аллоплант для склеропластики и аутокрови в костномозговой канал зоны повреждения или в область псевдоартроза.
Замедленно консолидирующиеся переломы, псевдоартрозы, репаративные процессы, аллоплант
Короткий адрес: https://sciup.org/142121038
IDR: 142121038
Текст научной статьи Преимущества использования биоматериала аллоплант при замедленно консолидирующихся переломах и псевдоартрозах трубчатых костей
Замедленная консолидация и ложные суставы как осложнения лечения перелома костей конечностей встречаются в 0,5-2,7 % случаев. После огнестрельных повреждений псевдоартрозы возникают у 3,1 % раненых, а с применением высокоскоростных снарядов их частота возрастает в 8 раз. Данная патология приводит к длительной нетрудоспособности пострадавших, необходимости многократных госпитализаций. Успешное решение задачи сокращения сроков лечения, уменьшения неблагоприятных последствий повреждения конечностей может быть достигнуто внедрением новых способов, направленных на оптимизацию репаративного остеогенеза в зоне остеоклазии.
Цель исследования: экспериментальное иммунологическое обоснование возможности применения биоматериала аллоплант при замедленно консолидирующихся переломах и псевдоартрозах длинных трубчатых костей.
МАТЕРИАЛЫ И МЕТОДЫ
Так, например, широко известен метод стимуляции остеогенеза оссеин-гидроксиапатитовым комплексом в виде препарата «Остеогенон», который включает неколлагеновые пептиды, коллагены, кальций и фосфор [1]. Однако длительный приём его внутрь (по 6 таблеток в день в течение не менее 1 месяца), необходимость наличия стабильного остеосинтеза, невозможность приёма препарата больными с гиперкальциемией и ги-перкальциурией, мочекаменной болезнью или предрасположенностью к ней сужает рамки его применения в практической травматологии.
В современных рекомендациях по стимуляции остеогенеза присутствует методика с использованием естественных иммуномодуляторов костного мозга – миелопептидов [2]. На их основе разработан иммунокорригирующий препарат «Миелопид», который является смесью высокоочищенных низкомолекулярных пептидов, выделенных из супернатанта культуры костномозговых клеток. Недостатком данного способа является снижение его эффективности при условии применения позднее 24 часов с момента возникновения перелома.
В настоящее время применяется и большое количество хирургических методик коррекции вяло консолидирующихся переломов, примером которых может служить стимуляция репаративного процесса свободным губчатым аутотрансплантатом при использовании малотравматичных методик [3]. В проведённых автором исследованиях на животных было показано, что кост- ный губчатый аутотрансплантат (гребень подвздошной кости), пересаженный малотравматичным способом, оптимизирует репаративные процессы в области нарушенной консолидации переломов костей. Однако предложенная автором методика обладает целым рядом недостатков. Вот лишь главные: необходимость проведения двух оперативных вмешательств (забор аутотрансплантата и внедрение его в место перелома), возможность миграции аутотрансплантата из места имплантации.
С недавнего времени для лечения вяло консолидирующих переломов и ложных суставов применятся новый биокомпозиционный материал «Остеоматрикс», который разработан в ЦИТО им. Н.Н. Пирогова совместно с фирмой ООО «Конек-тбиофарм» на основе костного аллоколлагена, костных аллосульфатированных гликозаминогликанов и гидроксиапатита. Необходимо обратить внимание на тот факт, что при применении этой методики также необходимо проводить оперативное вмешательство для заполнения костного дефекта под контролем зрения хирурга.
Нами впервые разработан способ оптимизации репаративного остеогенеза, оказывающий эффект при однократном применении, который возможно использовать для сокращения сроков сращения вяло консолидирующих переломов, лечения ложных суставов. Предложенный способ включает введение в костномозговой канал места перелома или зону ложного сустава предварительно измельчённого биоматериала аллоплант для склеро-пластики с аутокровью в виде взвеси 5 измельчённых пластин биоматериала аллоплант для склеропластики в 5 мл аутокрови. Взвесь вводят однократно путём инъекции иглой Гордеева с диаметром отверстия 2 мм.
Способ осуществляется следующим образом. В асептичных условиях стерильным скальпелем или ножницами в стерильном почкообразном лотке измельчают 5 пластин биоматериала ал-лоплант для склеропластики до мелкой крошки. В условиях операционной у больного осуществляют забор крови из кубитальной вены. Затем аутокровь в объёме 5 мл в асептичных условиях переливают в предварительно стерилизованный флакон, куда добавляют измельчённый биоматериал аллоплант для склеропластики. Место будущей инъекции обезболивают раствором местного анестетика. Вышеназванные субстанции перемешивают и набирают в шприц для инъекций, снабжённый иглой Гордеева с диаметром отверстия 2 мм, после чего производят однократную инъекцию лекарственной взвеси в полном объёме в костномозговой канал места перелома или в зону ложного сустава.
Биоматериал аллоплант обладает следующими свойствами: не вызывает реакции иммунного отторжения, является жестким и пластичным, способен стимулировать ангиогенез и процессы клеточной пролиферации, запускает механизм регенерации поврежденного органа. Аутокровь в данном случае обеспечивает равномерное проникновение крошки биоматериала аллоплант для склеропластики в костномозговой канал, является источником необходимых веществ для стимуляции активации остеобластов.
Нами было решено изучить возможность оптимизации репаративной регенерации костной ткани при экспериментальных переломах длинных трубчатых костей в условиях нестабильности отломков и наличия между ними диастаза более 0,5 мм путем сочетанного применения аутокрови и биоматериала аллоплант для скле-ропластики.
Были сформированы 4 группы животных – кроликов породы чёрный великан.
1-я группа – контрольная. Животным этой группы производился только остеосинтез повреждённой конечности аппаратом внешней фиксации.
2-я группа - каждому животному этой группы помимо наложения аппарата внешней фиксации в костномозговой канал зоны перелома вводили аутокровь в количестве 2 мл.
3-я группа – каждому животному этой группы осуществляли остеосинтез аппаратом внешней фиксации и интраоперационно место остео-клазии обворачивали цельной пластинкой биоматериала аллоплант для склеропластики.
4-я группа – каждому животному этой группы помимо наложения аппарата внешней фиксации в костномозговой канал зоны перелома вводили взвесь предварительно измельчённой до размеров мелкой крошки ½ пластины биоматериала аллоплант для склеропластики в 2 мл аутокрови.
Результаты эксперимента оценивали макро-и микроскопически через 10, 20 и 30 суток после перелома. Кроме того, нами проводился мониторинг основных иммунологических показателей исследуемых животных.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Через 30 суток после экспериментальной ос-теоклазии лишь в 4-й группе отмечено формирование полноценного костного регенерата, имевшего компактную структуру и состоявшего из сети утолщенных костных трабекул. Во всех остальных группах образовался регенерат, о недостаточной полноценности которого свиде- тельствовали как его губчатая структура, так и наличие участков фиброзной и хрящевой ткани той или иной степени выраженности.
Необходимо отметить тот факт, что всегда имеется комплексная ответная реакция организма на перелом, наблюдаются изменения в органах кроветворения, а также гематологических, биохи- мических, иммунологических показателей.
Цитокины являются регуляторами иммунных реакций организма, отвечая за балансировку всех этапов и звеньев иммунологического процесса. В большинстве случаев при различных заболеваниях сдвиги в иммунной системе можно выявить только путем оценки функциональной активности иммунокомпетентных клеток по уровню продукции цитокинов в крови.
Определение уровней цитокинов позволяет уточнить патогенез заболеваний, контролировать эффективность терапии и таким образом прогнозировать течение заболевания и эффективность иммуномодулирующей терапии.
Следует отметить, что концентрация цитокинов у клинически здоровых пациентов очень низкая или не определяется вообще. При проведении экспериментальных исследований по изучению цитокинового статуса у экспериментальных животных установили, что через сутки после операции концентрация противовоспалительных интерлейкинов существенно возросла во всех группах, достигнув своего максимума в опытной (4-й) группе, где она составила 50,02 пг/мл и сохранялась таковой до 10 суток. Через 20 суток наметилась тенденция к снижению уровня указанных цитокинов в крови животных, однако в опытной 4й группе их концентрация по-прежнему оставалась достаточно высокой, обеспечивая тем самым надёжную защиту от воспаления. Через 30 суток в 1-й группе (контрольной) уровень противовоспалительных интерлейкинов в 3 раза выше (30 пг/мл), чем в 4-й (опытной), где их концентрация снизилась даже по сравнению с дооперацион-ным уровнем и составляла 10 пг/мл. Таким образом, на примере 4-й группы исследуемых животных можно констатировать достаточно быстрое восстановление уровня указанных биологически активных веществ после проведённого оперативного вмешательства. Динамика показателей отражена в таблице 1 и на рисунке 1.
При мониторинге динамики концентрации гамма-интерферона наблюдалась следующая картина. Через сутки после операции во всех группах наметилась тенденция к увеличению его концентрации. Через 10 суток произошёл резкий скачок концентрации гамма-интерферона в крови животных 4 групп, достигнув max у животных контрольной группы (130 пг/мл), в опытной же группе она была незначительно ниже. Через 20 суток в обеих группах наметилась тенденция к снижению концентрации гамма-интерферона. Однако через 30 суток отмечено значительное снижение гамма-интерферона в контрольной группе по сравнению с опытной. Динамика уровня гамма-интерферона отражена в таблице 2 и на рисунке 2. Данный эффект мы склонны объяснять отсроченным иммуностимулирующим влиянием биоматериала алло-плант.
Таблица 1 Количественная характеристика уровня противовоспалительных интерлейкинов в крови у исследуемых животных
|
Концентрация провоспалительных ИЛ в крови, пг/мл |
1-я группа |
2-я группа |
3-я группа |
4-я группа |
|
До операции |
17,02 |
18,20 |
18,20 |
22,50 |
|
Через 1 день |
42,72 |
43,50 |
44,68 |
50,02 |
|
Через 10 суток |
42,72 |
45,85 |
46,21 |
48,56 |
|
Через 20 суток |
31,72 |
29,24 |
27,34 |
38,01 |
|
Через 30 суток |
31,72 |
31,26 |
23,40 |
10,03 |
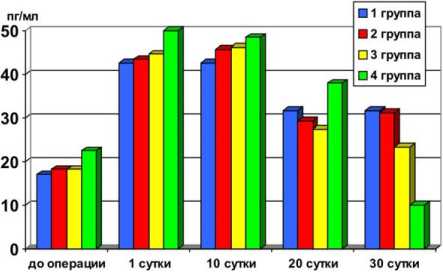
Рис. 1. Динамика уровня противовоспалительных интерлейкинов в крови у исследуемых животных
Таблица 2
Количественная характеристика уровня γ-интерферона в крови исследуемых животных
|
Концентрация γ-интерферона в крови, пг/мл |
1-я группа |
2-я группа |
3-я группа |
4-я группа |
|
До операции |
19,84 |
19,12 |
18,84 |
19,06 |
|
Через 1 день |
39,72 |
37,59 |
32,45 |
27,86 |
|
Через 10 суток |
129,68 |
119,36 |
123,32 |
116,04 |
|
Через 20 суток |
123,28 |
124,15 |
110,90 |
107,18 |
|
Через 30 суток |
53,72 |
59,13 |
55,64 |
83,84 |
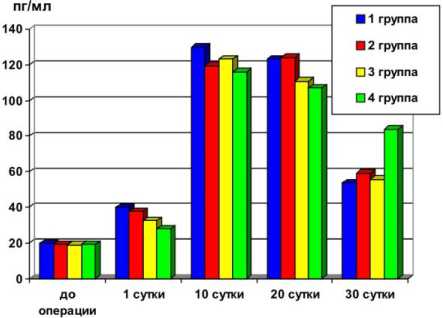
Рис. 2. Динамика уровня γ-интнрферона в крови у исследуемых животных
Таким образом:
быстрое формирование высоких показателей гуморального иммунитета и уровня противовоспалительных интерлейкинов приводит на ранней стадии травматической болезни к нормализации общих и локальных показателей гомеостаза;
биоматериал аллоплант обладает ярко вы- раженным репаративным эффектом;
наличие в зоне экспериментальной остео-клазии через месяц мощной костной мозоли еще раз подтверждает высокие регенерирующие способности биоматериала аллоплант.
Кроме того, приведёнными ранее данными доказано, что сочетанное использование аутокрови и измельчённого биоматериала аллоплант для склеропластики стимулирует метаболические процессы в остеобластических клеточных элементах формирующегося регенерата.
Всё вышеуказанное позволило внедрить предложенную методику в клиническую практику. При лечении больных с ложными суставами и замедленно консолидирующими переломами получены хорошие анатомо-функциональные результаты.
Приведём пример. Больной Ф., 50 лет, поступил через 311 дней с момента травмы с диагнозом: посттравматический псевдоартроз средней трети правой ключицы. Через 3 дня с момента травмы была выполнена операция – открытая репозиция отломков правой ключицы, остеосинтез интрамедуллярным стержнем. Через 122 дня после операции сращения не наступило. Стержень удалён оперативным путём. После операции была наложена шина Горюнова. При клинико-рентгенологическом исследовании выявлен тугой гиперпластический псевдоартроз средней трети правой ключицы (рис. 3).
Через 2 дня с момента поступления произведена операция остеосинтез правой ключицы аппаратом внешней фиксации стержневого типа, закрытая остеоперфорация зоны псевдоартроза по Беку. Затем больному в зону псевдоартроза осуществили введение смеси, состоящей из предварительно измельчённого биоматериала аллоплант и аутокрови по предложенному нами способу. Функция правой верхней конечности не была ог- раничена в течение всего срока фиксации в аппарате, при этом больной получал физиотерапевтическое лечение, занимался лечебной гимнастикой, посещал сеансы массажа. Период фиксации в аппарате внешней фиксации составил 40 дней (нормальные сроки сращения ключицы составляют 3045 дней; в условиях отягощённого анамнеза – например, при ложном суставе затягиваются на неопределённый срок). При рентгенологическом исследовании на этом этапе констатировано сращение в зоне псевдоартроза (рис. 4).
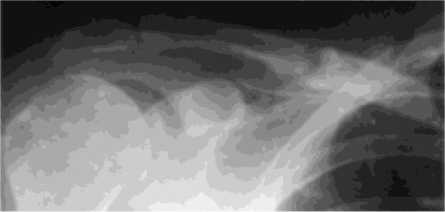
Рис. 3. Рентгенограмма больного Ф. до лечения
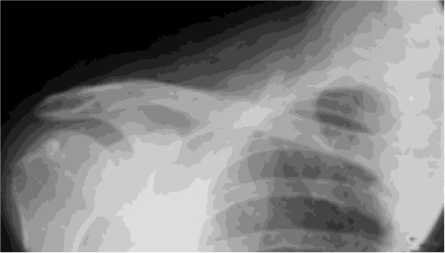
Рис. 4. Рентгенограмма больного Ф. после проведённого лечения по предложенной методике
Осложнений в процессе лечения не было. Получен хороший анатомо-функциональный результат лечения.
ЗАКЛЮЧЕНИЕ
-
1. При имплантации биоматериала аллоплант в зону патологии происходит активация гуморального иммунитета и снижается возможность воспалительных осложнений (ввиду увеличения концентрации противовоспалительных интерлейкинов).
-
2. Результатами проведенного исследования обоснована возможность оптимизации репаративного остеогенеза и ускорения сращения переломов
-
3. Предложенный способ ввиду своей простоты и малой инвазивности возможно применять при различных методиках лечения больных.
длинных трубчатых костей путём введения (имплантации) смеси предварительно измельчённого биоматериала аллоплант для склеропластики и аутокрови в костномозговой канал зоны повреждения или в область псевдоартроза.


