Преодоление тяжелого ладонно-подошвенного синдрома: представление клинического наблюдения
Автор: Быканова А.М., Петроченко Д.В., Станоевич И.В., Хвостовой В.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клиническое наблюдение
Статья в выпуске: 1 т.23, 2023 года.
Бесплатный доступ
Ладонно-подошвенный синдром (ЛПС, ладонно-подошвенная эритродизестезия) - токсическая реакция с изолированным поражением кожи ладоней и подошв, возникающая в результате применения цитостатиков. В силу отсутствия единого универсального подхода к профилактике и лечению, данное проявление токсичности химиотерапии остается одним из вариантов побочных реакций и осложнений, представляющих большую проблему для клинической онкологии,В представленном клиническом наблюдении на фоне применения препарата капецитабин, при первой линии лечения колоректального рака по схеме XELOX, у пациентки наблюдалось развитие тяжелой токсичности в виде ладонно-подошвенного синдрома 4-ой степени. Согласно инструкции к применению капецитабина, при развитии данной степени токсичности, требуется временное прекращение применения препарата, что ведет к несоблюдению сроков и интервалов лечения, что, в свою очередь, отражается на снижении эффективности вплоть до прогрессирования онкозаболевания. Данный случай продемонстрировал, что замена препарата группы фторпиримидиов одного на другой, таблетированной формы капецитабина на инфузионную форму 5-фторурацила, не снизила эффективности лечения, но способствовала купированию проявлений ладонно- подошвенного синдрома.
Клиническое наблюдение, колоректальный рак, капецитабин, 5- фторурацил, ладонно-подошвенный синдром
Короткий адрес: https://sciup.org/149143092
IDR: 149143092
Текст научной статьи Преодоление тяжелого ладонно-подошвенного синдрома: представление клинического наблюдения
Колоректальный рак (КРР) входит в число наиболее распространённых онкологических заболеваний. На протяжении нескольких лет имеется тенденция постоянного роста заболеваемости КРР, соответственно этому увеличивается смертность. Темпы роста заболеваемости и смертности КРР опережают аналогичные показатели среди других онкологических заболеваний [1].
Согласно клиническим рекомендациям МЗ РФ, при лечении КРР используются хирургический, лекарственный и лучевой методы. В зависимости от стадии онкологического процесса, в лекарственном лечении могут применяться как цитостатики, так и комбинации с таргетной терапией. При II стадии онкологического процесса у пациентов с КРР химиотерапия может рассматриваться как адъювантный метод лечения при наличии факторов неблагоприятного прогноза. В зависимости от стадии и морфологических нюансов заключительного клинического диагноза, в качестве 1-й линии терапии применяются схемы XELOX или FOLFOX, продолжительность лечения соответственно составляет 3 месяца, когда комбинируют оксалиплатин+капецитабин, и 6 месяцев по схеме оксалиплатин+кальция фолинат+5-фторурацил. У пациентов с раком прямой кишки адъювантное лечение составляет 6 месяцев при обоих из вышеперечисленных режимов. Лекарственное лечение пациентов с IV стадией или генерализацией процесса после ранее пролеченных локальных форм онкологического процесса проводится до прогрессирования заболевания или до развития непереносимой токсичности [2].
Именно развитие токсичности является основной проблемой для врачей химиотерапевтов, которые проводят лекарственное лечение. Развитие токсичности может привести к редукции дозы или даже временному прекращению лечения, что значительно ухудшает отдаленные результаты у пациентов. Для схем, применяемых в лечении КРР, наиболее часто характерно развитие гематологической, гастроинтестинальной токсичности в виде тошноты и рвоты, расстройства стула, нейротоксичности, а также особой формы кожной токсичности - ладонно-подошвенного синдрома (ЛПС, ладонно-подошвенной эритродизестезии).
Любая токсичность оценивается по специальной шкале (критерии NCI CTC) с выделением 4-х степеней токсичности. В зависимости от тяжести токсических явлений, токсичность устраняют симптоматической терапией и/или коррекцией дозы препарата (прервав лечение или уменьшив дозу препарата). Коррекция дозы препарата или временное прекращение приёма проводят при 2 и 3 степени токсичности, а при 4 степени лечение временно приостанавливают, так как это может привести к тяжелым необратимым последствиям вплоть до летального исхода. Следует отметить, что в нескольких рандомизированных исследованиях III фазы показана сходная эффективность оксалиплатин-содержащих режимов с капецитабином по сравнению с 5-ФУ и лейковорином в 1-й линии терапии КРР. Что касается развития токсичности, метаанализ выявил статистически достоверную разницу в пользу группы капецитабина и оксалиплатина. Тромбоцитопения III– IV степени и ЛПС III–IV степени достоверно чаще отмечались в группе капецитабина /оксалиплатина, нейтропения III–IV степени – в группе фторурацила/оксалиплатина. В частоте других побочных эффектов (анемия, астения, диарея, тошнота, рвота, нейропатия, стоматит) достоверных различий между группами не обнаружено [3].
В вышеописанных схемах частыми непосредственными причинами развития ЛПС являются препараты 5-фторурацила (35%) и капецитабина (60%). Патогенетический механизм ЛПС до конца неизвестен. Обсуждают механизмы прямой токсичности препарата в результате накопления его в эпидермисе и дерме [4], повышенной концентрации лекарственных препаратов в дистальных отделах конечностей, что обусловлено богатой капиллярной сетью в утолщенном сосочковом слое дермы этих вен [5]. Механизм развития ладонно-подошвенного синдрома на фоне приема капецитабина обусловлен тем, что его активация до 5-фторурацила происходит под воздействием фермента тимидинфосфолипазы, которая активна в кератиноцитах, особенно, в эпидермальной ткани ладоней и подошв. В результате происходит массивное накопление продуктов метаболизма капецитабина на поверхности ладоней и подошв, а впоследствии развиваются токсические эффекты, проявляющееся ладонно-подошвенным синдромом [6,7]. Существует также теория, которая предполагает, что под воздействием вторичного давления происходит разрыв капилляров в ладонях и подошвах, вследствие этого развиваются воспалительные реакции [8,9]. В соответствии с этой гипотезой, капецитабин высвобождается в разорванные капилляры, причиняя тем самым боль и вызывая образование пузырей и десквамаций.
К факторам риска, способствующим развитию ладонно-подошвенного синдрома, относят пожилой возраст, женский пол, тяжесть общего состояния и воздействие общего облучения, тип, дозирование и продолжительность применяемой химиотерапии и длительность пауз между приемами.
Классификация российского Общества онкологов-химиотерапевтов [9] подразделяет ЛПС на четыре степени по степени тяжести.
1-я степень – папулы и/или пустулы, поражение тела менее 10%, сопровождается/не сопровождается зудом или болезненностью;
2-я степень – папулы и/или пустулы, поражение тела 10–30%, сопровождается/не сопровождается кожным зудом или болезненностью, отрицательное психологическое воздействие, ограничение активности;
3-я степень – папулы и/или пустулы, поражение тела более 30% сопровождается/не сопровождается кожным зудом или болезненностью, ограничение самообслуживания, возможна локальная суперинфекция;
4-я степень – папулы и/или пустулы, площадь поражения тела любая, ассоциируется с распространенной суперинфекцией, требующей назначения внутривенной антибиотикотерапии, жизнеугрожающие последствия.
Изложение основного материала
Больная М., 70 лет
Впервые жалобы на боли в левом подреберье, ноющего характера, которые не требовали приема нестероидных противовоспалительных препаратов, появились в 2019 г. Сразу за медицинской помощью не обращалась. Ухудшение общего состояния началось в сентябре 2020 г., когда помимо болей в левых отделах живота, присоединились жалобы на выраженную общую слабость. Обратилась по месту жительства к терапевту, в лабораторных анализах крови была зарегистрирована анемия средней степени тяжести, проходила консервативную гемостимулирующую терапию с целью коррекции уровня гемоглобина в ОАК (конкретно название препаратов, которые принимала, назвать не может). Со слов, после проведенной терапии в общем состоянии наблюдалась положительная динамика.
Повторно пациентка обратилась к врачу по месту жительства в мае 2021 г., когда отметила усиление болей в левом подреберье. По результатам колоноскопии был выявлен рак левого изгиба ободочной кишки с тенденцией к развитию стеноза. Результаты биопсии показали высокодифференцированную аденокарциному.
Пациентка была направлена в Курский онкологический научно-клинический центр имени Г.Е. Островерхова для дообследования и определения дальнейшей тактики лечения. Пациентке было проведено комплексное обследование, выполнена компьютерная томография органов брюшной полости (рис. 1) с внутривенным контрастным усилением от мая 2021 г. Заключение: полученные данные могут соответствовать инфильтративным изменениям стенки поперечно-ободочной кишки (больше данных за c-r) с инфильтрацией параколярной клетчатки и региональной лимфоаденопатией, очаговыми изменениями печени (больше данных за метастазы, в С7 и в С5 печени определяются два гиподенсивных образования с нечеткими контурами, оба около 8 мм в диаметре, наиболее отчетливо визуализирующиеся в портальную фазу), очаговым образованием левого надпочечника (14×13 мм, накапливающее контраст, для уточнения природы очага рекомендовано динамическое наблюдение), кистой правой почки, состоянием после холецистэктомии.
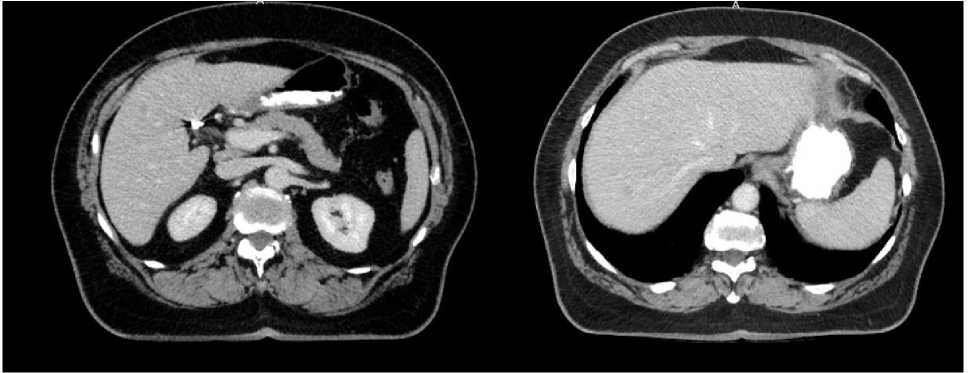
Рис. 1. Компьютерная томография брюшной полости от мая 2021 г.
В мае 2021 г. выполнена также КТ органов грудной клетки. Заключение: полученные данные могут соответствовать очаговым изменениям обоих легких (для уточнения природы очагов рекомендован КТ-контроль в динамике), фиброзным изменениям обоих легких, медиастинальной лимфаденопатии.
При пересмотре гистологических блоков была диагностирована аденокарцинома толстой кишки низкой степени злокачественности (low grade). Был выставлен заключительный клинический диагноз: С18.5 Рак селезеночного изгиба ободочной кишки, mts в печень. St IV, сT3cN2M1. КГ II. 25.05.2021 г. пациентка была обсуждена на консилиуме в ОБУЗ «КО НКЦ» им. Г.Е. Островерхова поликлиники в профильном кабинете у колопроктолога. На консилиуме было принято решение: с учетом стадии, распространенности опухолевого процесса, гистологического заключения, наличия отдаленного метастазирования по данным КТ-ОБП проведение оперативного лечения в настоящее время не показано, рекомендовано проведение химиотерапии I линии по схеме XELOX + таргетная терапия бевацизумабом (3 курса) с последующим контрольным обследованием, определение KRAS , NRAS , BRAF мутаций. С учетом наличия хронической анемии (гемоглобин - 86 г/л, эритроциты - 4,16×1012/л) пациентке рекомендуется лечение препаратами железа по месту жительства для коррекции анемии (приём тотемы по 1 ампуле 1 раз в день per os в течение 10 дней + феррум-лек по 2 ампулы внутримышечно в течение 7 дней, далее переход на таблетированную форму феррум-лек в течение месяца). После проведенного лечения и лабораторных анализов крови был выполнен повторный осмотр в профильном кабинете онкопроктологом. На консилиуме от 21.06.2022 г., с учётом коррекции лабораторных анализов крови, было решено начать специальное лечение по запланированной схеме, согласно решению консилиума от 09.06.2021 г.
Проведен расчет дозы препаратов по схеме XELOX + таргетная терапия бевацизумабом (табл. 1). Первый курс был проведен с 30.06.2021 г. по 02.07.2021 г. в химиотерапевтическом отделении №1 (ХТО №1).
Табл. 1. Сводная таблица лекарственных препаратов с расчетом доз, способов и кратности введения
|
Название препаратов |
Исходная доза препаратов |
Итоговая расчетная доза |
Способ введения |
Продолжительность введения препаратов |
|
Бевацизумаб |
7,5 мг/кг |
разовая доза 633 мг |
в/в капельно |
в 1-й день |
|
Оксалиплатин |
130мг/м2 |
разовая доза 260 мг |
в/в капельно |
в 1-й день |
|
Капецитабин |
2000 мг/м2 |
суммарная доза 4 г |
внутрь |
с 1 по 14-й день |
В связи с тем, что препарат капецитабин был назначен амбулаторно, а стандарт лечения, который необходимо было провести в круглосуточном стационаре ХТО №1, был выполнен в полном объеме, пациентка была выписана в удовлетворительном состоянии. При выписке были даны рекомендации по приёму препарата капецитабина в амбулаторных условиях (в выписке рекомендовалось начать приём препарат капецитабин по 4 таблетки утром и 4 таблетки вечером, за 30 минут после завтра и ужина, промежуток между приёмом должен составлять 12 часов с 1-14-й день per os). Рекомендован контроль лабораторных анализов крови (общий анализ крови) 1 раз в 5 дней, биохимический анализ крови, общий анализ мочи 1 раз в 7 дней, при ухудшении показателей крови прием препарата отменяется. Также пациентке были даны пояснения, какие токсические проявления могут быть при приёме препарата, в том числе и развитие ЛПС. Состояние пациентки ухудшилось 09.07.2021 г., появились жалобы на покраснение, отек, появление волдырей на ладонной поверхности рук и подошвах стоп, резкая болезненность, высыпание в полости рта, повышение температуры тела выше 38 оС, зуд кожных покровов, чувство жжения и жара. Пациентка вызвала бригаду скорой медицинской помощи, и ее госпитализировали в отделении аллергологии и иммунологии Курской областной клинической больницы. Предположительный диагноз: аллергический контактный дерматит. Проведена дезинтоксикационная терапия, состояние купировано введением глюкокортикостероидов, блокаторов Н1-гистаминовых рецепторов. В выписке не были указаны конкретные названия, дозы, а также способы введения препаратов с целью купирования вышеописанных жалоб. Приём капецитабина был отменен.
Для дальнейшего проведения специального лечения состоялась очередная госпитализация в ХТО №1 28.07.2021 г. На момент осмотра сохранялись жалобы на высыпания в ротовой полости, покраснение и шелушение ладоней и подошв стоп (рис. 2). Констатирован ладонно-подошвенный синдром 2 степени.
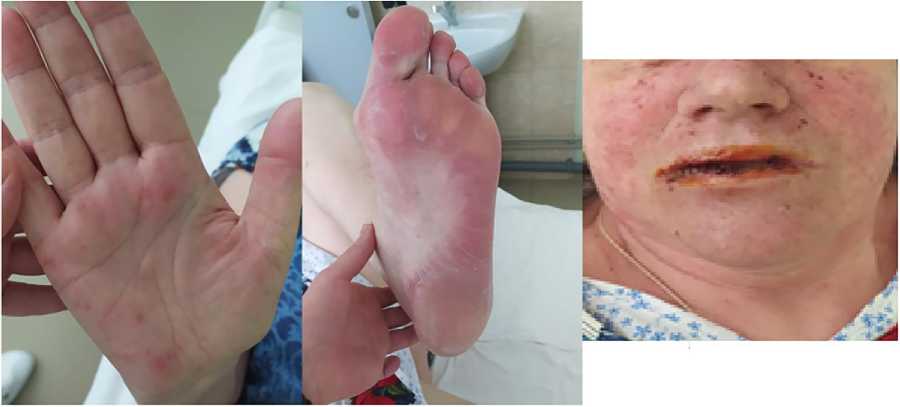
Рис. 2. Изменение кожных покровов ладоней, стоп, высыпания в ротовой полости.
С учётом стабильных лабораторных анализов крови, пациентка получила второй курс монохимиотерапии, таргетную терапию по схеме оксалиплатин+бевацизумаб, без включения препарата капецитабин в связи с проявлением выраженной токсичности 3-4 степени. При выписке пациентка была направлена на контрольное обследование. Заключение КТ органов брюшной полости от 05.08.2021 г.: полученные данные могут соответствовать инфильтративным изменениям стенки поперечно-ободочной кишки (больше данных за c-r) с инфильтрацией параколярной клетчатки и региональной лимфоаденопатией с положительной динамикой, по сравнению с КТ-данными от 21.05.2021 г., очаговым изменениям печени с положительной динамикой, очаговому образованию левого надпочечника без динамики (для уточнения природы очага рекомендовано динамическое наблюдение), кисте правой почки, состоянию после холецистэктомии. Заключение КТ органов грудной клетки от 05.08.2021 г.: полученные данные могут соответствовать очаговым изменениям обоих легких с неоднозначной динамикой в виде уменьшения размеров одних очагов и появления новых (для уточнения природы очагов и исключения mts рекомендован КТ-контроль в динамике), фиброзным изменениям обоих легких, медиастинальной лимфоаденопатии, без динамики по сравнению с КТ-данными от 21.05.2021 г. (рис. 3).
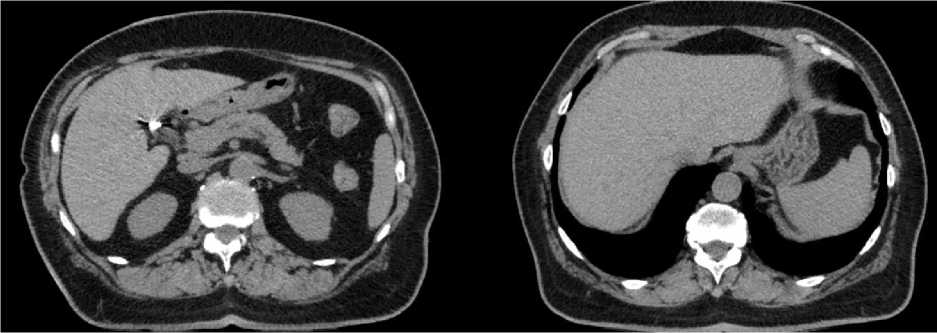
Рис. 3. Компьютерная томография брюшной полости от августа 2021 г.
Согласно решению консилиума от 13.08.2021 г., ввиду развития тяжелой токсичности при первом же курсе схемы, содержащей препарат капецитабин, была рекомендована смена схемы химиотерапии: провести 3 курса по схеме FOLFOX + бевацизумаб.
Пациентка получила 3 курса полихимиотерапии по запланированной схеме. Выраженной токсичности при комбинации данных препаратов не было выявлено, приём фторпиримидинов в виде инфузионной формы, не привел к развитию тяжелой «дерматологической токсичности», при проведении данного типа лечения наблюдалась токсичность в виде тошноты 1 степени и анемии легкой степени тяжести. Далее пациентка была направлена на контрольное обследование, где по результатам КТ органов брюшной полости от 30.09.2021 г. было получено заключение: полученные данные могут соответствовать инфильтративным изменениям стенки поперечно-ободочной кишки (c-r) с инфильтрацией параколярной клетчатки и региональной лимфоаденопатией с нарастанием стеноза просвета кишки по сравнению с КТ-данными от 05.08.2021 г., очаговым изменениям печени (mts) без динамики, очаговому образованию левого надпочечника без динамики (для уточнения природы очага рекомендовано динамическое наблюдение), кисте правой почки, состоянию после холецистэктомии. По результатам КТ органов грудной полости от 30.09.2021г. было получено заключение: полученные данные могут соответствовать очаговым изменениям легких без динамики по сравнению с КТ-данными от 05.08.2021 г., фиброзным изменениям обоих легких, положительной динамике медиастинальной лимфоаденопатии по сравнению с КТ-данными от 05.08.2021 г.
В связи с нарастанием стеноза просвета кишечника и появления симптомов частичной кишечной непроходимости, пациентка отправлена по скорой помощи в дежурный хирургический стационар по экстренным показаниям для разрешения явлений кишечной непроходимости, где 06.10.2021 г. была выполнена резекция поперечно-ободочной кишки с анастомозом конец в конец.
В ноябре 2021 г. был выполнен повторный осмотр в профильном кабинете ОБУЗ «КО НКЦ» им. Г.Е. Островерхова, проведен пересмотр гистологических блоков (8 фрагментов стенки толстой кишки с наличием аденокарциномы низкой степени злокачественности (Grade 2), с неравномерно выраженной полиморфноклеточной инфильтрацией с формированием внутристеночных микроабсцессов, прорастанием всей толщи кишечной стенки кишки с врастанием в прилежащую клетчатку, с наличием интрамуральной лимфоваскулярной инвазии, Тumor budding low grade; фрагменты стенки кишки, маркированные как края резекции - без опухолевого роста; в препаратах ткань 2-х лимфоузлов с неспецифическими реактивными изменениями, без метастазов). По результатам ПЭТ/КТ данных за продолженный рост первичной опухоли не получено, наблюдается регресс mts в печени. Обсуждена на консилиуме от 12.11.2021 г., по результатам которого запланировано 3 курса полихимиотерапии FOLFOX с оценкой динамики.
Далее пациентка получила 2 курса полихимиотерапии FOLFOX, отмечались тошнота и анемия легкой степени тяжести. Пациентка самостоятельно от дальнейшего лечения отказалась, при контрольном обследовании признаков прогрессирования не выявлено, в настоящий момент пациентка оставлена под динамическим наблюдением.
Заключение
Представленное клиническое наблюдение продемонстрировало, что замена препарата группы фторпиримидиов одного на другой, то есть, таблетированной формы капецитабина на инфузионную форму 5-фторурацила, не снизила эффективности лечения, но способствовала купированию проявлений ЛПС.
Вклад авторов. А.М. Быканова: разработка дизайна исследования, сбор данных, анализ полученных данных, написание текста рукописи; Д.В. Петроченко: разработка дизайна исследования, анализ полученных данных, консультативная помощь, написание текста рукописи; И.В. Станоевич: разработка дизайна исследования, анализ полученных данных, консультативная помощь; В.В. Хвостовой: анализ полученных данных, консультативная помощь.
Финансирование. Источник финансирования отсутствует.
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме.
Список литературы Преодоление тяжелого ладонно-подошвенного синдрома: представление клинического наблюдения
- Станоевич У.С., Горелик С.Г., Звягин И.Н., Полянский М.Б., Рукавишников А.С. Распространенность колоректального рака у пациентов старших возрастных групп. Cовременные проблемы здравоохранения и медицинской статистики. 2021;(4):235-250.
- Рубрикатор клинических рекомендаций. Доступно по: https://cr.minzdrav.gov.ru/recomend/554_2. Дата обращения: 25.02.2023.
- Практические рекомендации по лечению злокачественных опухолей Российского общества клинической онкологии. Доступно по: https://www.rosoncoweb.ru/standarts/suptherapy/. Дата обращения: 25.02.2023.
- Goldberg RM. Advances in the treatment of metastatic colorectal cancer. Oncologist. 2005;10 Suppl 3:40-8.
- Поддубная И.В., Орел Н.Ф. Побочные реакции и осложнения противоопухолевой лекарственной терапии: Руководство по химиотерапии опухолевых заболеваний. Под ред. Н.И. Переводчиковой. М.: Практ. мед. 2015. С. 441-443.
- Amado RG, Wolf M, Peeters M, Van Cutsem E, Siena S, Freeman DJ, et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol. 2008 Apr 1;26(10):1626-1634.
- Болотина Л.В., Горбунова В.А., Кононенко И.Б. и др. Практические рекомендации по поддерживающей терапии в онкологии. В сб.: Практические рекомендации по лечению злокачественных опухолей. М.: RUSSCO; 2015. С. 371-374.
- Орел Н.Ф. Практическое пособие по профилактике и коррекции побочных эффектов. Капецитабин: руководство для врачей 2-е изд., перераб. и доп. М.: Литтерра; 2010. 67 с.
- Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2006 г. (заболеваемость и смертность). М.: ФГУ "МНИОИ им. П.А.Герцена Росмедтехнологий"; 2018. 248 с.
- Esentaeva E.E., Ilyanova Z.T., Albergenova G.O., Nasrytdinova N.J. Palmar - plantar syndrome in cancer patients: the possibilities of prevention and treatment (experience with the use of Elima ointment). Medicine Oncology. 2015;(7):47-54.


