Приемы рационального изучения некоторых тем аналитической химии
Автор: Новопольцева В.М., Ускова Е.Н., Полянсков Р.А.
Журнал: Интеграция образования @edumag-mrsu
Рубрика: Инновации в образовании
Статья в выпуске: 4 (37), 2004 года.
Бесплатный доступ
Выбор буферного раствора при комплексообразовании обычно осуществляют эмпирически, экспериментальным подбором, что нерационально. Авторы попытались теоретически обосновать качественный и количественный состав буферного раствора на примере фотометрического определения Pd (II) с антранилфенолротом. Замена громоздких длинных описаний по теме «Титриметрические методы анализа» в классических учебниках на краткие, четкие табличные указания позволит студенту эффективнее усвоить материал.
Короткий адрес: https://sciup.org/147135966
IDR: 147135966
Текст научной статьи Приемы рационального изучения некоторых тем аналитической химии
Выбор буферного раствора при комплексообразовании обычно осуществляют эмпирически, экспериментальным подбором, что нерационально. Авторы попытались теоретически обосновать качественный и количественный состав буферного раствора на примере фотометрического определения Pd (II) с антранилфенолротом. Замена громоздких длинных описаний по теме «Титриметрические методы анализа» в классических учебниках на краткие, четкие табличные указания позволит студенту эффективнее усвоить материал.
Choosing the buffer for complex compound formation usually is carried out by empiric and experimental methods which is not rational. We tried to base the quantitative and qualitative composition of the buffer through example of photometric determination of Pd (II) with antranylphenolrothe. The substitution of unwieldy and long descriptions in the theme «The Titrimetric Methods of Analysis» in classic manuals for brief and clear tabular instructions will allow to make the material more understandable for students.
Анализируются девять слабых кислот для составления буферного раствора при фотометрическом определении палладия (II) с антранилфенолротом. Рекомендуется использовать 2M раствор уксусной кислоты при ц = 0,6 и рН 2,2.
Окрашенные комплексные соединения ионов металлов с органическими реагентами, используемые в фотометрическом анализе, образуются в определенном интервале рН, создаваемом буферными системами или растворами, их заменяющими. Подбор этих растворов обычно осуществляют эмпирически, исходя из опытных данных, экспериментально.
Целью нашего исследования был выбор качественного и количественного состава раствора для создания рН 2,2. Эта величина рН является максимальной комплексообразования Pd (II) с 3,3'-бuс-(N-o-карбоксифениламиноме- тил)-фенолсульфофталеином (R) (антранилфенолротом)1. Фотометрическому определению Pd (II) с R мешают ионы железа. После устранения мешающего влияния железа в анализируемом растворе методом ионообменной хроматографии, с использованием различной устойчивости хлоридных комплексов железа и палладия, и удаления избытка хлороводорода разрушали комплексный ион [PdCl6]4-. Для этого подбирали лиганд (кислоту), образующий четырехчленный цикл с палладием сравнительно невысокой прочности с тем, чтобы при действии фотометрического реагента R комплекс Pd (II) с кислотой разрушался, а образовывался бы фо-тометрируемый комплекс Pd (II) с R.
В качестве кислот для образования промежуточного комплекса нами рассмотрены следующие (расположены в порядке уменьшения Кдис кислоты):
-
2) O---S---O
I + II
Pd—O
(сернистая; 1,2 • 10-2)
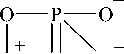
Pd—O O
(фосфорная; 1,1 • 10 -2 )
-
4) O--N
| +
Pd—O
(азотистая; 4,5 • 10 -4 )
-
5) O--C--H
| +
Pd—O
(муравьиная; 1,77 • 10 -4 )
-
6) O—C—CH3
Pd—O
(уксусная; 1,86 •Ю " 5 )
-
7) O--C—CH—CH
I +11 21
Pd-^O
(пропионовая; 1,35 • 10 -5 )
-
8) O--C—CH2CH2CH3
Pd^O
(масляная; 1,5 • 10 -6 )
9) O--C--O
+
Pd^O
(угольная; 4,3 • 10 -7 )
Установлено2, что комплексные анионы часто являются основаниями, в то время как комплексные катионы обнаруживают кислые свойства. Вероятно, структуры (1—3, 9) будут основаниями, (4—8) — кислотами, поэтому первые три кислоты кислотность среды, равную рНопт комплексообразования 1,9—2,8, не создадут. Для подтверждения этого была рассчитана концентрация фосфорной кислоты, необходимая для создания в растворе pH 2,2:
pH H 3 PO 4 = - 1lg K g - 2C M ;
1 , 1 ,
2,2 = - ^Igl^l • IO 2 - jlg c m ;
C M ( H 3 PO 4) = 3,6 • 10 - 3 моль/л .
Емкость буферной системы с этим компонентом будет мала, и величина pH не будет устойчивой. Следовательно, для поддержания слабокислой (pHmm 2,2) среды, в которой образуется комплекс Pd (II) с R, можно взять любую из кислот (4— 9). Однако с азотистой кислотой Pd (II) образует устойчивое комплексное соединение3 типа [Pd(NO2)6]n-, которое не разрушается при действии R с целью последующего фотометрирования.
Можно ли использовать муравьиную кислоту в качестве лиганда для образования промежуточного комплекса? Рассчитаем концентрацию муравьиной кислоты в растворе для создания pH 2,2. PH HCOOH = - ylg K g - 2 c m ;
2,2 = - 2lg1,77 • 10 - 4 - 2lg c m ;
2,2 = - 0,5(0,2480 - 4) - 0,51g c m ;
C M = 0,22 моль/л.
Емкость буферной системы при работе с этой кислотой также невелика, и даже небольшие колебания кислотности раствора не будут способствовать сохранению постоянного значения pH.
Если работать с муравьиной кислотой, то для поддержания постоянной величины ионной силы раствора равной 0,6 необходимо приготовить еще 2М раствор индифферентного электролита, например нитрата калия. Последний следует добавлять по 3 мл в фотометрируемый раствор для поддержания
^ = 2 ( CK + ^ Z K + + C NO-
1,2 • 3 2 •
= (---- +---- ) = 0,6,
2 10 10
^^^^^^^.
Z 2
NO 3
) =
если общий объем раствора — 10 мл.
Можно ли использовать для указанных целей уксусную кислоту?
PH CH 3 COOH
= - ylg Kg - 2 c m ;
2,2 = - 2ig1,86 • 10 -5 - 2ig c m ;
2,2 = -0,5(0,2695 - 5) - 0,5CM;
СМ = 2,14 моль/л = 2 моль/л.
Такой раствор СН3СООН, добавленный в количестве 3 мл на каждые 10 мл раствора, обеспечит pH 2,2. В этом случае наличие или отсутствие индифферентного электролита (KNO3), поддерживающего постоянной ц , не влияет на оптическую плотность фотометриру-емого комплекса Pd (II) с R (установлено практически). Создается возможность экономии реактива.
Аналогичные расчеты провели для пропионовой, масляной и угольной кислот:
pH C 3 H 6 O 2 =- 2 lg K g - 2 C M ;
2,2 =- 1 2 lg1,35 ⋅ 10 -5 - 1 2 lg C M ;
С м = 2,9 моль/л = 3 моль/л.
pH C 4 H 8 O 2 =- 2 lg K g - 2C M ;
2,2 =- 1 2 lg1,5 ⋅ 10 -6 - 1 2 lg C M ;
С м = 26,6 моль/л = 27 моль/л.
p HH 2 CO 3 = - 12lg Kg - 1 2 CM ; 2,2=- 12lg4,3⋅10 -7 - 12lgC M ;
С ^ = 92,4 моль/л = 92 моль/л.
При использовании этих кислот наблюдается нерациональный расход реактивов. Кроме того, последняя кислота катионный комплекс с Pd (II) не образует.
Итак, применение 2н раствора уксусной кислоты для поддержаниярНопт комплексообразования Pd (II) с R согласно расчетам является оптимальным вариантом. Это подтверждают эксперимен тальные исследования (оптическая плотность комплекса в данном случае наибольшая).
Разработанные условия образования комплекса позволяют использовать метод в анализе природных и промышленных вод на содержание Pd (II).
Как известно, титриметрический метод анализа, относящийся к группе химических методов, подразделяется в зависимости от типа используемых в анализе реакций. В каждом подразделе наблюдаются сходные показатели, например, обязательное наличие титрованного раствора, приготовление которого требует использования стандартного раствора, применение индикаторов для установления точки эквивалентности и др. В то же время между подразделами имеются и отличия по качественным характеристикам упомянутых показателей, формулам расчета результатов анализа и др. В учебниках4 и методических разработках все это описывается сплошным текстом словесно. Студенту трудно сосредоточиться на главном, уяснить для себя сходства и различия разделов.
Мы предлагаем раскрыть эту тему компактными таблицами, описывая показатели подразделов для каждого конкретного метода. Затем для сравнения можно свести эти таблицы рядом, например для метода кислотно-основного титрования — как показано в табл. 1, 2.
Т а б л и ц а 1
Характеристика ацидиметрии
Показатели
Рабочий раствор
Способы приготовления его титрованного раствора Стандартные растворы Способы приготовления их титрованных растворов Уравнения стандартизации
Индикатор
Способы титрования Анализируемые вещества
Ацидиметрия
Сильные минеральные кислоты: НС1, H 2 SO 4 , HNO 3
Установленные растворы; из фиксанала
Х.ч. Na2CO3, Na2B4O7-1GH2O
По точной навеске; из фиксанала
2НС1 + Na2CO3 = 2Na€1 + CO2 + H2O
2НС1 + Na2B4O7-1GH2O = 2Na€1 + 4H 3 BO 3 + 5H 2 O
Метиловый оранжевый
Прямой; обратный
Oснования (щелочи); соли, дающие при гидролизе щелочную реакцию среды (при этом слабая кислота, образующая соль, должна иметь К. < 10-6)
Характеристика алкалиметрии
Т а б л и ц а 2
|
Показатели |
Алкалиметрия |
|
Рабочий раствор Способы приготовления его титрованного раствора Стандартные растворы Способы приготовления их титрованных растворов Уравнения стандартизации Индикатор Способы титрования Анализируемые вещества |
Щелочи: NaOH, КОН Установленные растворы; из фиксанала Х.ч. Н2С2О4-2Н2О По точной навеске; из фиксанала 2NaOH + Н2С2О4-2Н2О = Na2С2O4 + 4Н 2 О Фенолфталеин Прямой; обратный Кислоты; соли, дающие при гидролизе кислую реакцию среды (при этом слабое основание, образующее соль, должно иметь А . < 10 6) |
Сущность других подразделов титриметрического метода анализа (окислительно-восстановительного, комплексонометрического, метода осадительного титрования) также можно изобразить в виде таблиц. Если они выполнены на листах ватмана, можно повесить их в аудитории. Это поможет студентам на лекциях, семинарах, экзаменах более детально разобраться в изучаемом разделе курса аналитической химии.


