Применение метода "быстрой" газовой хроматографии для регулярного анализа жирных кислот в молоке и молочных продуктах
Автор: Жижин Н.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (83), 2020 года.
Бесплатный доступ
В работе приведен один из подходов идентификации жирных кислот с помощью газовой хроматографии, который значительно сокращает время анализа, при этом является таким же эффективным при сравнении с традиционным методом исследования жирнокислотного состава. Определение состава жирных кислот на сегодняшний день является гарантом качества при выявлении различных конформаций и модификаций молочного жира, биоактивных свойств отдельных кислот семейства омега-3 и омега-6 и т.д. При этом этот метод является времязатратным, поэтому целью данной работы является оптимизация параметров этой методики для быстрого и регулярного анализа жирнокислотного состава, в лабораториях и на молочных предприятиях. Анализ жирнокислотного состава проводился с применением двух колонок с различными стационарными фазами. Сравнительная оценка аналитических характеристик была проведена на двух капиллярных хроматографических колонках: SP-2560 100?0,25 мм ID, 0,2 мкм с неподвижной фазой FFAP (традиционная) и газохроматографическая колонка BPX-70: стационарная фаза 70% цианопропилфенил диметилполисилоксан, 10м?0,1м?0,20 мкм...
Молоко, молочные продукты, газовая хроматография, жирнокислотный состав, омега-3, омега-6
Короткий адрес: https://sciup.org/140248295
IDR: 140248295 | УДК: 637.16 | DOI: 10.20914/2310-1202-2020-1-164-168
Текст научной статьи Применение метода "быстрой" газовой хроматографии для регулярного анализа жирных кислот в молоке и молочных продуктах
Состав жирных кислот молочного жира широко изучается из-за его важности в питании и здоровье человека [2, 4]. На сегодняшний день в молочных продуктах выявлено более 400 различных жирных кислот: от 4 до 26 атомов углерода, разветвленных и нет, насыщенных и ненасыщенных (до шести двойных связей), конъюгированных и с большим количеством позиционных и геометрических изомерных характеристик [3, 6]. Газовая хроматография, объединенная с длинными высокополярными капиллярными колонками, является наиболее Для цитирования
подходящей методикой для анализа этой сложной композиции. В частности, цианопропилсилоксановые стационарные фазы являются наиболее эффективными капиллярными колонками для разрешения критического разделения цис- и транс-, а также конъюгированных изомеров [7]. Этот хорошо разработанный аналитический подход имеет недостаток в трудоемкости, требующий более 60 минут времени анализа для каждого образца, и этот фактор становится особенно важным, когда требуется регулярный анализ, и необходим быстрый ответ.
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Жижин Н.А.Вестник ВГУИТ, 2020, Т. 82, №. 1, С. 164-168
Технологические инновации за последние годы, для ускорения времени анализа в ГХ, привели к эволюции аналитических приборов, которые поддерживают быстрые скорости потока, темпы программирования температуры, чувствительные системы обнаружения высокое давление на входе [5, 9]. Кроме того, введение капиллярных колонок нового поколения дало преимущество для сохранения эффективности разделения пиков, увеличивая интерес к исследованию разделения жирных кислот быстрой ГХ в сложных биологических матрицах [10], таких как молоко, и на их аналитические характеристики при оптимизации метода по сравнению с обычными колонками [4, 8]. Поскольку основной целью быстрой ГХ является достижение желаемого разрешения соединений в кратчайшие сроки, особое внимание следует обратить на оптимизацию условий хроматографирования. Поэтому целью настоящего исследования было установить конкретный, точный, экономящий время и надежный метод ГХ для определения метиловых эфиров жирных кислот в молоке и молочных продуктах, которые считаются наиболее сложными пищевыми жирами из-за широкого разнообразия в природе жирных кислот.
Материалы и методы
В качестве объекта исследования был использован образец масла 82,5% жирности. Разделение и идентификацию жировой фазы осуществляли с применением метода газовой хроматографии с использованием хроматографа «Кристаллюкс 4000М», снабженного пламенно-ионизационным детектором и кварцевой капиллярной колонкой SP – 2560 100 м×0,25 мм ID, 0,2 мкм с неподвижной фазой FFАР. Для проведения разделения методом «быстрой» ГХ использована колонка BPX-70 (10 м×0,1 мм×0,20 мкм). В качестве идентификационной смеси использовали
Для управления режимами анализа, записи хроматограмм и обработки полученной информации использовалось программное обеспечение «NetChrom» .
Расчет состава метиловых эфиров жирных кислот проводили методом внутренней нормализации [1]. За окончательный результат измерений принимали среднее арифметическое значение результатов двух последовательных измерений.
Результаты и обсуждение
Для проверки метода быстрой хроматографии жирных кислот молочного жира были проведены эксперименты по валидации аналитических параметров обеих колонок. При проведении эксперимента точность метода была подтверждена путем внутридневной и ежедневной повторяемости измерений образца молочного жира (таблицы 1, 2). Как видно из таблиц 1 и 2 внутридневная повторяемость времени удержания компонентов двух капиллярных колонок находится на низком уровне в пределах 0,2%. Изучена сопоставимость количественных данных измерения жирнокислотного состава обеих колонок с оценкой внутридневной и ежедневной повторяемости. Согласно приведенным в таблицах данным погрешность измерений между двумя колонками составила не более 2,5%.
Таблица 1
Внутридневные и ежедневные значения повторяемости (RSD%), полученные на 10 метровой колонке BPX 70
Table 1.
Intra-day and inter-day repeatability values obtained on the 10-meter BPX-70 column
|
Жирные кислоты Fatty acids |
Время удержания Retention time |
Внутридневная повторяемость Intra-day repeatability |
Ежедневная повторяемость Inter-day repeatability |
||||
|
Мин Min |
RSD% |
W% ЖК W% FA |
RSD% |
W% ЖК W% FA |
RSD% |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Масляная (с4:0) |
Butyric |
0,88 |
0,09 |
2,7843 |
1,66 |
2,7698 |
2,04 |
|
Капроновая (с6:0) |
Kapron |
1,15 |
0,11 |
2,0769 |
0,66 |
2,0661 |
0,93 |
|
Каприловая (с8:0) |
Caprylic |
1,65 |
0,07 |
1,3115 |
1,43 |
1,3047 |
1,7 |
|
Каприновая (с10:0) |
Capric |
2,34 |
0,10 |
3,0825 |
1,45 |
3,0665 |
2,07 |
|
Деценовая (с11:0) |
Detinova |
2,60 |
0,16 |
0,3246 |
1,43 |
0,3229 |
2,20 |
|
Лауриловая (с12:0) |
Lauric |
3,15 |
0,16 |
3,7102 |
6,41 |
3,6908 |
9,91 |
|
Миристиновая (с14:0) |
Myristic |
3,98 |
0,15 |
11,5970 |
1,66 |
11,5366 |
1,93 |
|
Пальмитиновая (с16:0) |
Palmitic |
4,78 |
0,15 |
32,0623 |
9,61 |
31,7642 |
14,74 |
|
Пальмитолеиновая (с16:1) |
Palmitoleic |
4,94 |
0,16 |
2,0592 |
2,27 |
1,9627 |
2,62 |
Продолжение таблицы 1 | Continuation of table 1
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Маргариновая (с17:0) |
Pentadecane |
5,14 |
0,15 |
0,6432 |
1,92 |
0,6398 |
2,65 |
|
Маргариновая цис-10 (с17:1) |
Pentadecane |
5,30 |
0,15 |
0,3937 |
9,36 |
0,3916 |
11,96 |
|
Стеариновая (с18:0 ) |
Stearic |
5,50 |
0,16 |
9,3660 |
1,36 |
9,3172 |
2,41 |
|
Элаидиновая ( С18:1 транс-) |
Elaidin |
5,61 |
0,15 |
2,0080 |
13,02 |
1,9976 |
17,73 |
|
Олеиновая ( с18:1 цис-) |
Oleic |
5,66 |
0,15 |
21,2766 |
3,19 |
21,9036 |
3,88 |
|
Линолэлаидиновая ( С18:2 транс) |
Linolenova |
5,81 |
0,15 |
0,1850 |
3,82 |
0,1840 |
4,51 |
|
Линолевая ( с18:2 цис-) |
Linoleic |
5,89 |
0,14 |
2,2103 |
12,25 |
2,1988 |
13,64 |
|
Гамма-линолевая (с18:3 n 6) |
Gamma-linoleic |
6,05 |
0,13 |
0,0450 |
6,63 |
0,0448 |
7,43 |
|
Арахиновая (с20:0) |
Arachin |
6,17 |
0,14 |
0,5820 |
13,50 |
0,5789 |
15,27 |
|
Эйкозеновая цис-11 (Гондоиновая) (с20:1) |
Eicosene |
6,24 |
0,14 |
0,5334 |
6,53 |
0,5307 |
8,71 |
|
Линоленовая (с18:3 n 3) |
Linolenic |
6,49 |
0,13 |
0,0416 |
7,32 |
0,0414 |
10,41 |
|
Генэйкозановая (с21:0) |
Hanakotoba |
6,56 |
0,13 |
0,0151 |
2,22 |
0,0150 |
3,15 |
|
Эйкозадиеновая (с20:2) |
Eykozadienovaya |
6,71 |
0,11 |
0,0663 |
2,93 |
0,0660 |
4,09 |
|
Бегеновая (с22;00) |
Begenova |
6,82 |
0,13 |
0,1649 |
3,15 |
0,1640 |
7,25 |
|
Эйкозатетраеновая цис – 8, 11, 14 (С20:3n6) |
Eicosatetraenoate |
6,96 |
0,14 |
0,0200 |
4,42 |
0,0199 |
4,86 |
|
Эруковая (с22:1) |
Erucic |
7,09 |
0,14 |
0,0651 |
9,09 |
0,0648 |
9,76 |
|
Эйкозатетраеновая цис – 11, 14, 17 (С20:3n3) |
Eicosatetraenoate |
7,21 |
0,10 |
0,0115 |
5,92 |
0,0114 |
6,69 |
|
Арахидоновая (с20:4 n 6) |
Arachidonic |
7,37 |
0,08 |
0,0057 |
11,16 |
0,0057 |
12,63 |
Таблица 2.
Внутридневные и ежедневные значения повторяемости (RSD%), полученные на 100 метровой колонке SP 2560
Table 2.
Intra-day and inter-day repeatability values (RSD%) obtained on the 100-meter SP-2560 column
|
Жирные кислоты Fatty acids |
Время удержания Retention time |
Внутридневная повторяемость Intra-day repeatability |
Ежедневная повторяемость Inter-day repeatability |
||||
|
Мин Min |
RSD% |
W% ЖК W% FA |
RSD% |
Мин Min |
RSD% |
||
|
Масляная (с4:0) |
Butyric |
9,54 |
0,08 |
2,7968 |
1,53 |
2,8328 |
1,97 |
|
Капроновая (с6:0) |
Kapron |
10,15 |
0,13 |
2,0862 |
0,65 |
2,1131 |
0,24 |
|
Каприловая (с8:0) |
Caprylic |
11,25 |
0,07 |
1,3174 |
1,39 |
1,3343 |
1,98 |
|
Каприновая (с10:0) |
Capric |
13,10 |
0,09 |
3,0963 |
1,58 |
3,1362 |
2,30 |
|
Деценовая (с11:0) |
Detinova |
14,19 |
0,15 |
0,3261 |
1,46 |
0,3303 |
2,51 |
|
Лауриловая (с12:0) |
Lauric |
15,88 |
0,15 |
3,7268 |
6,24 |
3,7747 |
8,48 |
|
Тридекановая (с13:0) |
Myristic |
18,55 |
0,16 |
0,1329 |
0,99 |
0,1347 |
1,05 |
|
Миристиновая (с14:0) |
Palmitic |
19,41 |
0,14 |
11,6489 |
1,73 |
11,7988 |
1,35 |
|
Миристолеиновая (с14:1) |
Palmitoleic |
20,93 |
0,13 |
1,3513 |
1,28 |
1,3687 |
1,78 |
|
Пентадекановая (с15:0) |
Pentadecane |
21,38 |
0,18 |
1,2802 |
6,18 |
1,2967 |
10,75 |
|
Пертадекановая-цис |
Pentadecane |
22,41 |
0,17 |
0,2893 |
0,99 |
0,2930 |
0,62 |
|
П альмитиновая (с16:0) |
Stearic |
23,40 |
0,15 |
32,0735 |
9,75 |
31,9065 |
12,79 |
|
П альмитолеиновая (с16:1) |
Elaidin |
24,51 |
0,13 |
1,9818 |
2,82 |
2,0073 |
2,44 |
|
М аргариновая (с17:0) |
Oleic |
25,35 |
0,15 |
0,6460 |
1,96 |
0,6543 |
2,14 |
|
Маргариновая цис-10 (С17:1) |
Linolenova |
26,36 |
0,17 |
0,3954 |
9,57 |
0,4005 |
11,77 |
|
С теариновая (с18:0) |
Linoleic |
27,39 |
0,15 |
9,4080 |
1,08 |
9,5290 |
1,93 |
|
Э лаидиновая (с18:1 транс) |
Gamma-linoleic |
28,02 |
0,15 |
2,0170 |
15,45 |
2,0430 |
17,83 |
|
О леиновая (с18:1 цис) |
Arachin |
28,21 |
0,16 |
21,3092 |
3,64 |
20,8764 |
3,04 |
|
Л инолэлаидиновая (с18:2 транс) |
Eicosene |
28,78 |
0,15 |
0,1858 |
3,89 |
0,1882 |
4,66 |
|
Л инолевая (с18:2 цис ) |
Linolenic |
29,66 |
0,12 |
2,0541 |
12,06 |
2,0805 |
13,13 |
|
Гамма-линолевая (С18:3n6) |
Hanakotoba |
29,95 |
0,13 |
0,0452 |
6,41 |
0,0458 |
7,74 |
|
А рахиновая (с20:0) |
Eykozadienovaya |
30,79 |
0,14 |
0,5846 |
13,96 |
0,5921 |
15,60 |
|
Эйкозеновая цис-11 (Г ондоиновая ) (с20:1) |
Begenova |
31,05 |
0,16 |
0,5358 |
6,51 |
0,5427 |
8,49 |
|
Л иноленовая (с18:3 n 3) |
Eicosatetraenoate |
31,49 |
0,12 |
0,0418 |
7,93 |
0,0423 |
9,29 |
|
Г енэйкозановая (с21:0) |
Erucic |
31,80 |
0,11 |
0,0152 |
2,91 |
0,0153 |
3,01 |
|
Э йкозадиеновая (с20:2) |
Eicosatetraenoate |
32,24 |
0,13 |
0,0666 |
2,39 |
0,0675 |
4,35 |
|
Бегеновая (с22;00) |
Arachidonic |
32,67 |
0,10 |
0,1656 |
5,66 |
0,1677 |
7,66 |
|
Эйкозатетраеновая цис – 8, 11, 14 (С20:3n6) |
Butyric acid |
32,90 |
0,12 |
0,0201 |
4,42 |
0,0203 |
4,14 |
|
Эруковая (с22:1) |
Kapron |
33,25 |
0,13 |
0,0654 |
9,26 |
0,0662 |
9,91 |
|
Эйкозатетраеновая цис – 11, 14, 17(С20:3n3) |
Caprylic |
33,53 |
0,10 |
0,0116 |
5,45 |
0,0117 |
6,94 |
|
Арахидоновая (с20:4 n 6) |
Capric |
33,69 |
0,06 |
0,0058 |
11,84 |
0,0058 |
12,27 |
Дополнительно, близость значений двух хроматографических подходов, оценивали путем внесения различных концентраций деценовой кислоты (С 11:0 ). Процент восстановления (Recovery, %), приведенный в таблице 3, показал,
Таблица 3.
Точность восстановления (Recovery, %) метилдеканоата (С 11: 0 ) в масла (n = 5) на колонках BPX 70 и SP 2560
что показатели точности колонок BPX-70 и SP-2560 практически совпадают. Фактический процент среднего восстановления на BPX-70 составил 100,05%, а на SP-2560 100,22%.
Table 3.
Recovery accuracy (Recovery, %) of citronellic acid (С 11: 0 ) in oil (n = 5) on the BPX-70 and SP-2560 columns
|
Внесенная концентрация, мг/мл Spiked Concentration, mg/ml |
BPX-70 |
SP-2560 |
||
|
Измеренная концентрация, мг/мл Measured Concentration, mg/ml |
Recovery, % |
Измеренная концентрация, мг/мл Measured Concentration, mg/ml |
Recovery, % |
|
|
0.50 |
0,51 |
102,21 |
0,49 |
96,08 |
|
0.75 |
0,73 |
97,09 |
0,74 |
101,34 |
|
1.00 |
1,01 |
100,93 |
1,03 |
103,00 |
|
1.25 |
1,25 |
100,00 |
1,25 |
100,00 |
|
1.50 |
1,50 |
100,00 |
1,51 |
100,67 |
|
Average recovery, % |
100,05 |
Average recovery, % |
100,22 |
|
Проведены исследования показателей линейности детектора, рассчитанного на 9 возрастающих концентрациях С 11:0 , показатель BPX-70
составил R 2 = 0,9998, тогда как на SP-2560 данный показатель был равен R 2 0,9874. приведенный в таблице 1.
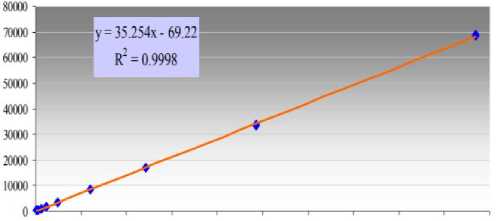
О 200 400 600 800 1600 1200 1400 1600 1800 2000
Рисунок 1. Показатели линейности детектора для колонок: а – BPX-70; b – SP-2560
Figure1. The linearity of the detector for the speakers: a – BPX 70; b – SP 2560
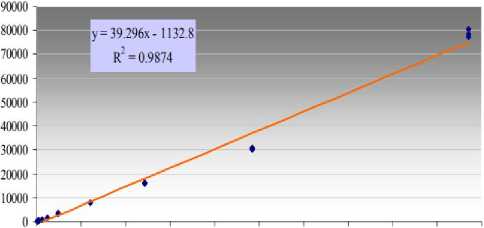
О 200 400 600 800 1000 1200 1400 1600 1800 2000
b
Значения нижних пределов обнаружения (LOD) и количественного определения (LOQ) также указывают на аналогичные характеристики. Полученные данные по колонке BPX-70 составили 0,19 и 0,63 мг/кг, а для SP-2560 0,18 и 0,60 мг/кг соответственно.
Заключение
В данном исследовании были испытаны две колонки для анализа жирнокислотного состава молока и молочной продукции. Традиционная колонка SP –2560 100 м×0,25 мм ID, 0,2 мкм с неподвижной фазой FFАР и колонка для проведения быстрого газохроматографического анализа стационарная фаза 70% цианопропилфенил диметилполисилоксан) BPX-70 (10 м× 0,1 мм×0,20 мкм). Для каждой капиллярной колонки было изучено влияние программирования температуры и подобран оптимальный режим хроматографирования, а также качественная и количественная оценка разработанного аналитического метода. Порядок элюирования жирных кислот характерен для данных видов колонок. Время анализа сложного состава ЖК составило 49,07 мин для колонки SP-2560, и 8,44 минуты для колонки BPX-70 соответственно. В целом капиллярная колонка BPX-70 показала отличные аналитические характеристики при оптимизации и валидации метода быстрой ГХ и может быть эффективно использована для регулярного анализа жирнокислотного состава жировой фазы молока и молочных продуктов, в том числе и в условиях лабораторий и предприятий по переработке молока.
Список литературы Применение метода "быстрой" газовой хроматографии для регулярного анализа жирных кислот в молоке и молочных продуктах
- ГОСТ 32915-2014. Молоко и молочная продукция. Определение жирнокислотного состава жировой фазы методом газовой хроматографии. М.: Стандартинформ, 2015. 9 с.
- Жижин Н.А. Разработка новых подходов к определению жирно-кислотного состава молока и молочных продуктов с применение метода газовой хроматографии // Международная научно-практическая конференция молодых ученых и специалистов отделения сельскохозяйственных наук российской академии наук. 2016. № 1. С. 94-98.
- Юрова Е.А. Фальсификация жировой фазы молочных продуктов // Методики выявления животных жиров. Молочная промышленность. 2017. № 3. С. 20-22.
- Bondia-Pons I., Castellote A.I., L?opez-Sabater M.C. Comparison of conventional and fast gas chromatography in human plasma fatty acid determination // Journal of Chromatography B. 2004. V. 809. P. 339-344.
- Delmonte P., Kia A.R.F., Kramer J.K., Mossoba M.M. et al. Separtion characteristics of fatty acid methyl ester using SLB-IL111, a new ionic liquid coated capillary gas chromatographic column // Journal of Chromatography A. 2011. V. 1218. № 3. P. 545-554.
- Jensen R G. The composition of bovine milk lipids: January 1995 to December 2000 // Journal of Dairy Science. 2002. V. 85. № 2. P. 295-350.
- Molkentin J. Bioactive lipids naturally occurring in bovine milk // Nahrung. 1999. V. 43. № 3. P. 185-189.
- Mondello L., Casilli A., Quinto Tranchida P., Costa R. et al. Evaluation of fast gas chromatography and gas chromatography-mass spectrometry in the analysis of lipids // Journal of Chromatography A. 2004. V. 1035. P. 237-247.
- Koryt?r P., Janssen H.G., Matisov? E., Udo A.T. Practical fast gas chromatography: methods, instrumentation and applications // Trends in Analytical Chemistry. 2002. V. 21. № 9-10. P. 558-572.
- Matisov? E., D?m?t?rov? M. Fast gas chromatography and its use in trace analysis // Journal of Chromatography A. 2003. V. 1000. P. 199-221.


