Применение МСК для терапии воспалительных заболеваний кишечника
Автор: Коноплянников Михаил Анатольевич, Князев Олег Владимирович, Баклаушев Владимир Павлович
Журнал: Клиническая практика @clinpractice
Рубрика: Обзоры
Статья в выпуске: 1 т.12, 2021 года.
Бесплатный доступ
Воспалительные заболевания кишечника (ВЗК), прежде всего язвенный колит и болезнь Крона, относятся к группе заболеваний, характеризующихся идиопатическим воспалением органов желудочно-кишечного тракта. Клинически ВЗК проявляются болью в животе, хронической диареей, кишечными кровотечениями, анемией, астенизацией и значимым снижением качества жизни больного. Кроме того, у пациентов с ВЗК существенно возрастает риск развития рака толстой кишки, тромбозов и первичного склерозирующего холангита. Более 4 млн человек в США и Европе страдают от ВЗК, каждый год в США диагностируется 70 000 новых случаев заболевания. Применение традиционных методов терапии ВЗК позволяет достичь стойкой ремиссии в 20-30%, при комбинированной терапии - в 50% случаев. Для терапии тяжелых форм ВЗК иногда требуется хирургическое удаление поврежденных участков желудочно-кишечного тракта. Одним из перспективных направлений в лечении ВЗК является регенеративная терапия биомедицинскими клеточными продуктами. В данном обзоре мы сфокусировали внимание на применении мезенхимальных стромальных клеток (МСК) при ВЗК. Проанализированы доступные в международных базах данных публикации по результатам доклинических и клинических исследований МСК, включая данные метаанализа, а также представленные в базе Clinicaltrials.gov 14 действующих клинических испытаний терапии ВЗК с помощью МСК. Проведенный анализ показал, что регенеративная терапия ВЗК с помощью МСК (как аутологичных, так и аллогенных) может быть эффективной альтернативой медикаментозным и хирургическим методам лечения.
Клинические испытания, воспалительные заболевания кишечника, язвенный колит, болезнь крона, клеточная терапия, мезенхимальные стромальные клетки, регенеративная медицина
Короткий адрес: https://sciup.org/143175839
IDR: 143175839 | DOI: 10.17816/clinpract64530
Текст обзорной статьи Применение МСК для терапии воспалительных заболеваний кишечника
Submitted 15.02.2021 Revised 25.02.2021 Published 01.04.2021
<линическая 2с21 п эакти keu Том 12 №1
прессантов, антибиотиков и ингибиторов фактора некроза опухолей.
Аминосалицилаты, такие как сульфасалазин, бальсалазид, месаламин и олсалазин, применяемые перорально или ректально, уменьшают воспаление стенки кишечника и используются в первую очередь для лечения неспецифического язвенного колита, но при этом не столь эффективны при лечении болезни Крона.
Кортикостероиды, такие как преднизолон и бу-десонид, уменьшают проявления иммунного воспаления, но эффективны лишь при краткосрочном применении во время обострений. Хроническое применение кортикостероидов чревато побочными эффектами, связанными с иммуносупрессией, развитием ожирения по стероидному типу, нарушением сна и другими осложнениями.
Иммунодепрессанты, такие как азатиоприн, 6-меркаптопурин (6-MP) и метотрексат, влияют на активность иммунной системы, токсичны и обычно используются для поддержания ремиссии пациентов, не отвечающих на другие препараты, или отвечающих только на стероиды.
Антибиотики, в частности ципрофлоксацин и метронидазол, приносят умеренную пользу при лечении пациентов с болезнью Крона, поражающей толстую кишку или область вокруг заднего прохода. Препараты используют при возникновении параректальных абсцессов и свищей.
Наиболее современной группой препаратов для терапии ВЗК являются ингибиторы фактора некроза опухолей альфа (tumor necrosis factor alpha,, TNF- α ), включающие адалимумаб, церто-лизумаб пегол, голимумаб и инфликсимаб и др. Эти препараты обладают выраженным противовоспалительным действием, используются для терапии пациентов, страдающих ВЗК в тяжелой форме, при отсутствии достаточного эффекта от стандартного лечения, но, к сожалению, их применение также не всегда эффективно. В частности, опыт длительного применения инфликсимаба показал, что до 1/3 больных не отвечают на ан-тицитокиновую терапию по причине первичной резистентности к нему или вследствие развития вторичной резистентности [6]. Кроме того, иногда могут возникать тяжелые осложнения, включая бактериальные, вирусные и грибковые инфекции, повышенный риск развития лимфомы, колоректального рака и других онкологических заболеваний.
Терапия воспалительных заболеваний кишечника с использованием мезенхимальных стромальных клеток
Ремиссия при применении традиционных методов терапии ВЗК составляет, по некоторым оценкам, 20–30%, максимум 50% при комбинированной терапии [7]. Весьма перспективным направлением в лечении ВЗК является использование клеточной терапии с помощью мезенхимальных стромальных клеток (МСК).
Свойства и механизмы действия МСК
МСК — мультипотентные стромальные клетки, которые могут быть выделены из костного мозга, жировой ткани, пульпы зуба, скелетных мышц и т.д. [8–11]. МСК экспрессируют молекулы комплекса гистосовместимости (major histocompatibility complex, МНС) класса I на низком уровне и не экспрессируют МНС класса II, следовательно, могут использоваться для аллогенной трансплантации [12]. МСК экспрессируют маркеры CD73, CD90, и CD105, но не экспрессируют гемопоэтические маркеры CD34 и CD45, а также эндотелиальный маркер CD31 [13], и могут дифференцироваться в адипоциты, остеобласты, хондроциты, миобласты и нейральные прогениторные клетки [14, 15].
Первый механизм действия МСК, описанный для аутологичных клеточных препаратов, заключается в их способности к миграции в патологический очаг и дифференцировке с образованием фибробластов, перицитов, остео- и миобластов и восполнению, таким образом, поврежденных клеток и тканей организма (кожа, хрящи, кости, мыщцы и т.д.) [14, 16]. Второй механизм действия МСК, характерный как для аутологичных, так и для аллогенных трансплантированных клеток, заключается в их паракринной активности. Мигрируя в места повреждения и воспаления, МСК секретируют большое количество цитокинов (в основном противовоспалительных) и ростовых факторов (VEGF, FGF, IGF, PDGF и др.) и таким образом способствуют уменьшению воспаления, активизации собственных механизмов регенерации и восстановлению поврежденных тканей (рис. 1) [17]. МСК обладают иммуномодулирующим и противовоспалительным действием, подавляя пролиферацию и дифференцировку Т-клеток (как CD4+, так и CD8+ лимфоцитов), снижая активность NK и активируя Т-регуляторные клетки. МСК снижают секрецию провоспалительных (IL-1 β , IL-6, TNF- α , IFN- γ ) и увеличивают секрецию
Рис. 1. Общие эффекты МСК, сгруппированные по двум основным механизмам: прямая клеточная дифференцировка рекрутированных МСК (в клетки жировой, костной, хрящевой и мышечной ткани) для замены поврежденных клеток и индукция цитокинов, секретируемых МСК в воспалительную среду, влияющих на иммунную систему организма реципиента (IL-6 — интерлейкин-6; PGE2 — простагландин E2; TGF- β — β -трансформирующий фактор роста; IDO — индоламин-2,3-диоксигеназа; CCL-2 — С-С-хе-мокиновый лиганд 2; IL-10 — интерлейкин-10; HGF — фактор роста гепатоцитов; MMP — матричные металлопротеиназы; HLA-G — человеческий лейкоцитарный антиген-G). Адаптировано из [7].
Fig. 1. General MSC’s effects grouped by the two fundamental mechanisms: 1) direct cell differentiation of recruited MSC (into cells of adipose, bone, cartilage and muscle tissues) to replace damaged cells and 2) induction of cytokines secreted by MSC into the inflammatory medium, affecting the recipient’s immune system (IL-6: interleukin-6; PGE2: prostaglandin E2; TGF- β : β -transforming growth factor; IDO: indoleamine-2,3-diox-ygenase; CCL-2: С-С-chemokine ligand 2; IL-10: interleukin -10; HGF: hepatocyte growth factor; MMP: matrix metalloproteinases; HLA-G: human leukocyte antigen-G). Adapted from [7].
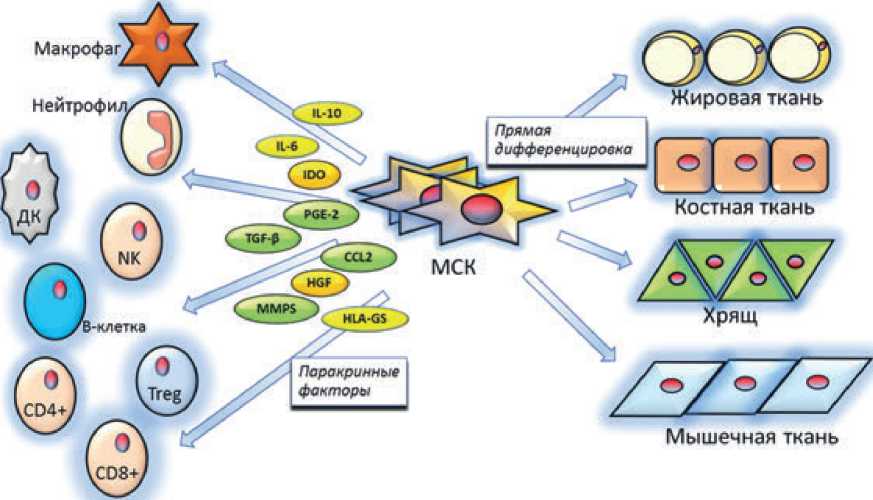
противовоспалительных цитокинов IL-4 и IL-10 [18], что приводит к уменьшению иммунного воспаления, активации ангиогенеза, ингибированию апоптоза и уменьшению степени окислительного стресса [19].
Доклинические исследования
T. Yabana и соавт. [20] продемонстрировали на крысах с моделированным колитом, вызванным декстраном сульфата натрия (dextran sodium sulfate, DSS), что МСК, введенные животным внутривенно, мигрировали в собственную пластинку (lamina propria) поврежденной толстой кишки, где они активировали экспрессию гладкомышечного актина (a-SMA), что способствовало восстановлению эпителия. Было также показано, что МСК участвовали в поддержании функции эпителиального барьера путем активации сборки клаудинов, апикальных белков плотных щелевых контактов.
В патогенезе ВЗК важнейшую роль играют, по-видимому, усиленная пролиферация и дефектный апоптоз иммунных клеток, что, предположительно, связано с дисбалансом Bcl-2 и Bax — ключевых белков, влияющих на апоптоз [21].
Среди патогенетических механизмов развития ВЗК выделяют дисбаланс в субпопуляциях Т-клеток. В итоге повышается уровень провос-палительных цитокинов: при болезни Крона из-за дифференцировки Th1- и Th17-клеток, при язвенном колите из-за дифференцировки Th2-клеток. Наоборот, уровень Т-регуляторных (Treg) клеток снижен в периферической крови пациентов с ВЗК [23]. Среди Treg-клеток ключевую роль в подавлении иммунной системы и поддержании толерантности играют CD4+CD25+FoxP3+ клетки [22]. K. Akiyama и соавт. [22] показали, что системная инфузия МСК из костного мозга (КМ-МСК) индуцирует апоптоз Т-клеток через Fas-лиганд- клиническая!?™
тактика
зависимый путь (FasL) и может улучшить течение заболевания при экспериментальном колите мышей, индуцированном DSS. Было показано, что Fas-регулируемая секреция КМ-МСК белка MCP-1 рекрутирует Т-клетки для FasL-опосредованного апоптоза. Апоптоз Т-клеток приводит в свою очередь к индукции макрофагов, продуцирующих высокий уровень β -трансформирующего фактора роста бета (transforming growth factor beta, TGF- β ), что сопровождается увеличением количества Т-регуляторных клеток и, в конечном итоге, способствует уменьшению степени иммунного воспаления. Q. Chen и соавт. [24] продемонстрировали, что внутривенное введение МСК сильно облегчает клиническую тяжесть язвенного колита мышей (потерю массы тела, диарею и воспаление), индуцированного тринитробензолсульфоновой кислотой (TNBS), и улучшает выживаемость животных. Показано также, что МСК достигали поврежденной толстой кишки и способствовали пролиферации эпителиальных клеток кишечника и дифференцировке стволовых клеток кишечника (определяемых путем обнаружения Lgr5+-клеток), что было опосредовано подавлением аутоиммунных и воспалительных реакций (IL-2, TNF- α , IFN- γ , T-bet; IL-6, IL-17, ROR γ t), обусловленных Th1-Th17-клетками, а также повышением активности Th2-клеток (IL-4, IL-10, GATA-3). Кроме того, было показано, что МСК индуцировали активированные CD4+CD25+Foxp3+ Т-регуляторные клетки (TGF- β , IL-10, Foxp3).
Макрофаги, дендритные клетки и другие антигенпрезентирующие клетки также вовлечены в патогенез ВЗК из-за их специализации в представлении антигена Т-клеткам и, в свою очередь, формировании генерируемого Т-клеточного ответа. Тканевые макрофаги играют ключевую роль в поддержании нормального гомеостаза кишечника, но могут участвовать и в патогенезе ВЗК. В здоровом кишечнике резидентные макрофаги проявляют фенотип M2, в то время как в воспаленной слизистой оболочке кишечника доминируют про-воспалительные макрофаги M1. В связи с этим изменение баланса популяций макрофагов до фенотипа M2 стало новым подходом при терапии ВЗК. Многочисленные доклинические исследования показали, что МСК могут индуцировать иммуномодулирующие макрофаги, и их терапевтическая эффективность при экспериментальном язвенном колите опосредуется макрофагами с M2-подобным фенотипом [25].
H. Jo и соавт. [26] культивировали незрелые дендритные клетки (imDC) и обработанные липополисахаридом (LPS) зрелые дендритные клетки (mDC) совместно с МСК в течение 48 ч, а затем анализировали профили поверхностных маркеров и цитокинов и регуляторную роль этих DC для первичных спленоцитов. Кроме того, терапевтические эффекты МСК и DC, совместно культивируемых с МСК, сравнивали у мышей с хроническим колитом. Авторы продемонстрировали, что после совместного культивирования МСК c незрелыми дендритными клетками (MSC-DC) или LPS-обработанными зрелыми дендритными клетками (LPS + MSC-DC) экспрессия CD11c, CD80, CD86, IL-6, TNF- α и IFN- γ была снижена, а экспрессия CD11b, IL-10 и TGF- β — повышена. Кроме того, MSC-DC и LPS + MSC-DC индуцировали экспрессию CD4, CD25 и Foxp3 в первичных спленоцитах, выделенных от мышей. У мышей с DSS-индуцированным колитом MSC и MSC-DC увеличивали длину толстой кишки, массу тела и выживаемость; вызывали восстановление нормальной морфологии, регистрируемое при гистологическом исследовании стенок кишечника. Более того, в MSC и MSC-DC группах, в тканях толстой кишки, экспрессия IL-6, TNF- α и IFN- γ также снижалась, а экспрессия IL-10, TGF- β и Foxp3 увеличивалась. Эти данные позволяют предположить, что МСК стимулируют дифференцировку дендритных клеток в регуляторные дендритные клетки, что улучшает эффективность терапии хронического колита.
Было показано также, что введение МСК может подавлять активацию и пролиферацию В-клеток, секретирующих IgG, и, наоборот, стимулировать образование CD5+ регуляторных В-клеток (Bregs), продуцирующих IL-10 Кроме того, было показано, что МСК могут подавлять пролиферацию NK-клеток, секретирующих провоспалительные цитокины [27].
Экзосомы из МСК для экспериментальной терапии ВЗК
Экзосомы — внеклеточные везикулы, секретируемые МСК, содержат большое количество биологически активных факторов. Экзосомы играют важную роль в межклеточных коммуникациях, передавая от клетки к клетке микроРНК, регуляторные и функциональные белки и пептиды, липиды, гликопротеины, мРНК, внутриклеточные мессенджеры и др. [28]. Таким образом, экзосомы из МСК, аналогично самим МСК, обладают мощны- ми физиологическими свойствами, влияющими на восстановление поврежденных тканей [29]. При этом экзосомы более стабильны, чем МСК, и более безопасны, т.к. принципиально не могут вызывать иммунного ответа организма-хозяина и провоцировать какие-либо еще реакции организма, которые потенциально возможны в ответ на введение клеточного препарата.
Ранее рядом исследователей было продемонстрировано, что экзосомы, секретируемые МСК, обладают выраженным восстанавливающим эффектом при терапии многих заболеваний, вызывающих повреждение тканей, включая ВЗК [30–32]. Так, F. Mao и соавт. показали, что экзосомы, высвобождаемые из МСК, полученных из пуповины человека (hucMSC), положительно влияют на лечение колита, индуцированного DSS, и изучили основной механизм их действия [32].
Экзосомы, меченные индоцианиновым зеленым (ICG), попадают в ткани толстой кишки мышей с ВЗК через 12 ч после инъекции. Экспрессия гена IL-10 увеличивалась, в то время как экспрессия генов TNF-α , IL-1β , IL-6 , iNOS и IL-7 снижалась в тканях толстой кишки и селезенке мышей, обработанных МСК-экзосомами. Кроме того, уменьшалась инфильтрация макрофагов в ткани толстой кишки. Было показано также, что совместное культивирование in vitro с экзосомами подавляло экспрессию iNOS и IL-7 в макрофагах энтероцелия мышей. При этом исследователи обнаружили, что экспрессия IL-7 выше в тканях толстой кишки пациентов с колитом, чем у здоровых людей из контрольной группы. В целом полученные результаты продемонстрировали, что экзосомы из hucMSCs оказывают сильное влияние на восстановление при DSS-индуцированном ВЗК, данный эффект может быть опосредован через модуляцию экспрессии IL-7 в макрофагах.
В исследовании R. Yang и соавт. [33] экзо-сомы, выделенные из МСК, прекондициони-рованных с IFN-γ, трансплантировали мышам с DSS-индуцированным колитом, что значительно улучшило индекс активности заболевания и гистологическую оценку колита, а также снизило соотношение Th17 и повысило соотношение Treg-клеток. Введение экзосом значительно снижало экспрессию Stat3 и p-Stat3, подавляя дифференцировку клеток Th17, при этом экзосомы из МСК, пре-кондиционированных с IFN-γ, показали наиболее высокую эффективность ингибирования. Предварительная обработка IFN-γ увеличивала уровень miR-125a и miR-125b в МСК-экзосомах, которые напрямую таргетировали Stat3, подавляющий дифференцировку клеток Th17. Более того, совместная инфузия miR-125a и miR-125b также продемонстрировала терапевтический эффект при колите, сопровождаемый снижением соотношения клеток Th17. В целом, это исследование демонстрирует, что обработка IFN-γ стимулировала эффективность экзосом из МСК для ослабления колита за счет увеличения уровня miR-125a и miR-125b, которые связываются с 3’-UTR Stat3 для подавления дифференцировки клеток Th17.
Клинические исследования
Завершенные клинические исследования
Благодаря своим терапевтическим свойствам, МСК, получаемые из костного мозга, плаценты или жировой ткани, активно применяются в клинических испытаниях по терапии пациентов с ВЗК как в виде локальных эндоскопических инъекций клеток, так и путем системной (внутривенной) инфузии.
Локальное введение МСК
Локальное введение МСК используется главным образом для терапии свищевой (экстралюми-нальной) формы болезни Крона [34]. Так, J. Panés и соавт. [35] провели двойное слепое рандомизированное плацебоконтролируемое исследование с целью определения долгосрочной эффективности и безопасности однократного местного введения аллогенных МСК, полученных из жировой ткани (препарат Сх601), при терапии пациентов с болезнью Крона и трудно поддающимися лечению дренирующими сложными перианальными свищами. Исследование было проведено в 49 клинических центрах Европы и Израиля, в него вошли 212 пациентов (ClinicalTrials.gov: NCT01541579). Пациенты были случайным образом распределены (1:1) в группы, которым в дополнение к стандартному уходу вводили однократную локальную инъекцию, или 120x106 клеток Cx601, или плацебо (контроль). Конечные точки эффективности, оцененные в модифицированной популяции намеренных лечиться (рандомизированно назначенных, получавших лечение и с одной или несколькими оценками эффективности после базового уровня) на 52-й нед, включали комбинированную ремиссию (закрытие всех обработанных наружных отверстий, дренирующих на исходном уровне при отсутствии скоплений >2 см, подтвержденных данными магнитно-резонансной томографии) и клиническую и ни не с кая ь™
пэактика 22
ремиссию (отсутствие дренирующих свищей). Ранее те же исследователи сообщали о первичной конечной точке исследования на 24-й нед. (комбинированная ремиссия у 51,5% пациентов, получавших Сх601, по сравнению с 35,6% в контрольной группе: разница в 15,8 процентных пункта; 97,5% доверительный интервал [ДИ] 0,5 – 31,2; p =0,021). На 52-й нед. значительно большая часть пациентов, получавших Сх601, достигла комбинированной ремиссии (56,3%), по сравнению с контрольной группой (38,6%) (разница в 17,7 процентных пункта; 95% ДИ 4,2–31,2; p =0,010), и клинической ремиссии (59,2% по сравнению с 41,6% контрольной группы с разницей в 17,6 процентных пункта; 95% ДИ 4,1–31,1; p =0,013). Безопасность поддерживалась в течение 52 нед.; побочные эффекты наблюдались у 76,7% пациентов в группе Сх601 и у 72,5% пациентов контрольной группы. По результатам фазы III исследования пациентов с болезнью Крона и резистентными к лечению перианальными свищами авторами сделан итоговый вывод, что препарат Cx601 безопасен и эффективен для закрытия наружных свищей по сравнению с плацебо через 1 год исследования.
M. Herreros и соавт. [36] опубликовали данные клинического исследования, оценивающего 45 пациентов с 52 хирургически резистентными анальными свищами различной этиологии (из них 18 пациентов с перианальными свищами, вызванными болезнью Крона), и их ответ на терапию МСК различных типов, включая аллогенные МСК из жира (adipose-derived mesenchymal stem cell, ASC), аутологичные ASC и стромальную сосудистую фракцию (stromal-vascular fraction, SVF), которая, как считается, содержит ASC с минимальным количество адипоцитов и эритроцитов. При рассмотрении 42 случаев перианальных свищей в 40 (95,2%) из них наблюдалось заживление или улучшение/ частичный ответ в среднем через 6,6 нед. (диапазон 2–36 нед). Излечение наступило в 22/42 (52,4%) случаях, при этом большинство пациентов вылечились в среднем за 5,8 мес (диапазон 0,5–24 мес). Излечение этих 42 пациентов было оценено в зависимости от типа использованных клеточных препаратов. Уровень излечения при использовании SVF составил 13/23 (56,5%) случаев, при аутологичных ASC — 3/9 (33,3%), при аллогенных ASC — 6/10 (60%). Введенная доза клеток также была проанализирована в перианальных свищах со средним значением 43,9 млн (диапазон 3–210 млн) в случаях излечения.
Если рассматривать только перианальный свищ вследствие болезни Крона [36, 37], 18/18 пациентов (100%) показали заживление или улучшение/ча-стичный ответ, начиная в среднем через 5,3 нед. (диапазон 2–12 нед.). Излечение наступило в 10/18 (55,5%) случаях, большинство пациентов вылечились за 6,5 мес (диапазон 0,5–24 мес). Излечение этих 18 пациентов также было оценено в зависимости от типа клеточных препаратов. Уровень излечения при применении SVF отмечался в 40% случаев, при аутологичных ASC — в 66,6%, при аллогенных ASC — в 55,5%. Введенная доза клеток составила в среднем 43,9 млн (диапазон 3–210 млн) в случаях излечения пациентов. Во всех случаях терапии перианального свища при болезни Крона применялась хирургическая техника — выскабливание, закрытие внутреннего отверстия свища и инъекция клеток [36, 37].
В случае перианального криптогландулярного свища [38] 18 пациентов прошли процедуры выскабливания, закрытия внутреннего отверстия и инъекции ASC, продемонстрировав заживление в 9/18 (50%) случаях; 6 подверглись выскабливанию, эн-доанальному продвижению лоскута и инъекции ASC, при этом закрытие свища отмечено в 3/6 (50%) случаях.
Клиническое испытание фазы II с использованием аутологичных МСК, полученных из жировой ткани (ASC-клетками) для лечения свищей при болезни Крона, характеризующихся разрушительным состоянием с высокой частотой рецидивов, продемонстрировало безопасность и терапевтический потенциал с устойчивым ответом в течение 2 лет [39]. В данном исследовании фазы II первоначально принимал участие 41 пациент. Через 24 мес полное заживление наблюдалось у 27 (75,0%) из 36 пациентов (данные для 5 из 41 пациента отсутствовали через 24 мес). Никаких побочных эффектов, связанных с введением ASC, не наблюдалось. Более того, полное закрытие свища после первоначального лечения было устойчивым. Результаты убедительно свидетельствуют об эффективности аутологичных ASC в лечении свищей Крона.
L. Scott и соавт. [40] опубликовали результаты применения препарата дарвадстроцел (Алофисел), представляющего собой суспензию размноженных аллогенных МСК человека (eASC), полученных из жировой ткани. Это первый препарат на основе МСК, одобренный Европейским союзом для лечения сложных перианальных свищей у взрослых пациентов с неактивной/умеренно активной люми- нальной болезнью Крона, когда свищи показали неадекватный ответ на одну или более стандартную терапию. В ключевой фазе III исследования ADMIRE-CD у этой трудно поддающейся лечению популяции пациентов после терапии фистулы, в соответствии со стандартным лечением, проводилась дополнительная терапия с локальным введением однократной дозы дарвадстроцела (120 млн eASC) в ткань, окружающую перианальный комплекс: заживление свищей было значительно более эффективным, чем в группе плацебо (пациентам вводили физиологический раствор), при этом пациенты в группе дарвадстроцела имели более высокую комбинированную частоту ремиссии (закрытие свищей по клинической оценке + отсутствие абсцессов по результатам магнитно-резонансной томографии) через 24 нед. после назначении лечения. Клиническая ремиссия сохранялась более чем у 50% пациентов через 52 нед. наблюдения. Учитывая очень ограниченные возможности лечения этого трудноизлечимого редкого состояния, терапия дарвадстроцелом является новаторским многообещающим малоинвазивным подходом.
Y. Cao и соавт. в 2021 г. опубликовали метаанализ и систематический обзор для оценки эффективности стволовых клеток (МСК из костного мозга и жировой ткани) для лечения свищей любой формы при болезни Крона [41]. Всего в данном обзоре было проанализировано 29 клинических исследований, включающих 1252 пациентов. В результате было показано, что в группе пациентов со свищами при болезни Крона, которым трансплантировали стволовые клетки, был более высокий уровень заживления свищей по сравнению с группой пациентов, получающей плацебо (61,75% против 40,46%, 95% ДИ 1,19-4,11; p <0,05). Группа пациентов, получающих стволовые клетки 3x107 кл./мл, имела преимущество в скорости заживления свищей на 71,0% по сравнению с группой стволовых клеток с другими дозами (относительный риск, ОР, 1,3; 95% ДИ 0,76–2,22), и показатели выздоровления пациентов с перианальными и транссфинктерными свищами были выше, чем с ректовагинальными (77,95 против 76,41%). Интересно, что показатели индекса активности болезни Крона по Бесту (Crohn disease activity index, CDAI) и свищевой формы (perianal disease activity index, PDAI) явно временно повышались при использовании стволовых клеток после 1 мес, в то время как возвращались к исходному уровню после введения стволовых клеток через 3 мес. Более того, частота побочных эффектов, связанных с лечением, в группе стволовых клеток была значительно ниже, чем в группе плацебо (ОР 0,58; 95% ДИ 0,30–1,14). Проведенное исследование показало, что использование стволовых клеток, особенно ASC из жировой ткани, являются многообещающим методом лечения свищей при болезни Крона вследствие более высокой эффективности и меньшей частоты нежелательных явлений.
Внутривенное введение МСК
Системное (внутривенное) введение МСК используется главным образом для терапии люминальных (воспалительных) форм ВЗК [34].
В рандомизированном плацебоконтролируемом клиническом исследовании J. Hu и соавт. (регистрационный номер NCT01221428) [42] изучали безопасность и эффективность МСК, полученных из пуповины человека, при умеренном и тяжелом неспецифическом язвенном колите, при этом 34 пациента с неспецифическим язвенным колитом были включены в группу I и получили инфузию МСК в дополнение к основному лечению, а 36 пациентов вошли в группу II и получали физиологический раствор в дополнение к основному лечению. Через 1 мес после терапии у 30 пациентов в группе I заметно снизилось образование диффузных и глубоких язв, течение тяжелых воспалительных процессов на слизистой оболочке. Во время последующего наблюдения средний балл по шкале Майо и гистологический балл в группе I снизились, в то время как баллы по международному опроснику качества жизни пациентов с ВЗК (inflammatory bowel disease questionnaire, IBDQ) были значительно улучшены в сравнении с таковыми до лечения, а также в сравнении с группой II ( p <0,05). Среди других положительных эффектов авторы отмечают отсутствие явных побочных реакций после инфузии МСК, а также хронических побочных или затяжных реакций в течение всего периода наблюдения. Таким образом, достоверно продемонстрировано, что инфузия МСК является безопасным и эффективным методом лечения неспецифического язвенного колита.
J. Zhang и соавт. [43] изучали эффективность и безопасность применения МСК из пуповины (UC-MSCs) для терапии болезни Крона. В исследование были включены 82 пациента с диагностированной болезнью Крона, получавшие поддерживающую терапию стероидами более 6 мес, из них 41 пациент случайным образом был отобран для клиническая!?™
тактика
получения четырех периферических внутривенных инфузий 106 UC-MSCs/кг, 1 инфузия/нед. Пациенты наблюдались в динамике до 12 мес с оценкой CDAI, индекса Харви-Брэдшоу (Harvey-Bradshaw index, HBI) и дозировки кортикостероидов. Через 12 мес после лечения CDAI, HBI и дозировка кортикостероидов снизились на 62,5±23,2; 3,4±1,2; 4,2±0,84 и 23,6±12,4; 1,2±0,58; 1,2±0,35 мг/сут соответственно в группах UC-MSC и контроле ( р <0,01, p <0,05 и p <0,05 для UC-MSC по сравнению с контролем соответственно). У 4 пациентов после инфузии клеток поднялась температура. Серьезных нежелательных явлений не наблюдалось. Исследователи делают вывод, что UC-MSCs эффективны при лечении болезни Крона, хотя и вызывают иногда незначительные побочные эффекты.
В исследовании нашей группы (О. Князев и соавт.) [44] проводили лечение 22 пациентов с обострением среднетяжелой и тяжелой форм неспецифического язвенного колита с применением аллогенных МСК из костного мозга. Пациентов с острой формой язвенного колита (менее 6 мес от дебюта заболевания) разделили на 2 группы. Больные неспецифическим язвенным колитом 1-й группы (n=12) помимо стандартной противовоспалительной терапии получали МСК по схеме: 0-я, 1-я и 26-я нед., затем в последующие годы наблюдения — каждые 6 мес. Пациенты 2-й группы (n=10) получали стандартную противовоспалительную терапию препаратами 5-аминосалициловой кислоты (5-АСК) и глюкокортикоидами. Пациентов с тяжелой формой обострения язвенного колита в 1-й группе было 58,3%, во 2-й группе — 60%, с обострением средней степени тяжести — 41,7 и 40% соответственно. В 1-й группе тотальный колит констатирован у 33,3% больных, во 2-й группе — у 40%, левосторонний колит — у 66,7 и 60% соответственно. Больным 1-й группы снижали дозу глюкокортикоидов до 0,5 мг на 1 кг массы тела и осуществляли системное введение МСК в дозе 1,5–2 млн клеток на 1 кг массы тела по схеме 0-я, 1-я и 26-я нед. Через 3–5 дней после введения дозу ранее назначенных глюкокортикоидов (не более 30 мг/сут) снижали в течение 6–8 нед. до полной отмены. В дальнейшем в отсутствии рецидива заболевания больные получали поддерживающую терапию препаратами 5-АСК и/или пробиотиками. Больные 2-й группы получали стандартную терапию в соответствии с международными рекомендациями. Дата введения культуры клеток являлась точкой включения в клиническое исследование. Критери- ем эффективности терапии служило безрецидив-ное течение заболевания в течение 12 мес. Клиническую активность неспецифического язвенного колита оценивали по шкале Рахмилевича, эндоскопическую — по шкале Майо. Контроль за динамикой клинических, лабораторных и эндоскопических показателей осуществляли через 2; 6 и 12 мес, затем ежегодно на протяжении 3 лет. Результаты исследования продемонстрировали, что включение МСК в комплексную терапию острой атаки язвенного колита не повлияло на частоту рецидивов, продолжительность ремиссии и средний уровень индексов клинической и эндоскопической активности в течение 1 года наблюдения: в 1-й группе рецидив язвенного колита произошел у 2 (16,7%) больных, во 2-й группе — у 3 (30%): ОР 0,3; 95% ДИ 0,08–1,36; p=0,2; χ2=1,47). Индекс Рахмилевича в 1-й группе больных составил 3,33±0,54 балла, во 2-й — 4,4±1,13 (р=0,81), индекс Майо — 3,1±0,85 и 3,9±1,06 балла соответственно (р=0,66). За 2 года наблюдения риск рецидива неспецифического язвенного колита в 1-й группе в 3 раза ниже, чем во 2-й группе (р=0,03). Средняя продолжительность ремиссии в 1-й группе составила 22 мес, во 2-й группе — 17 мес (p=0,049). Через 3 года наблюдения продолжительность ремиссии в 1-й и 2-й группах составила 22 и 20 мес соответственно (p=0,66). Индекс Рахмилевича в 1-й группе больных составил 4,75±1,13 балла, во 2-й — 8,1±1,1 (р=0,001). В итоге было достоверно показано, что введение МСК повышает эффективность противовоспалительной терапии у пациентов с острой формой язвенного колита.
В другом нашем исследовании (О. Князев и со-авт.) [45] мы оценили эффективность терапии МСК из костного мозга у пациентов с воспалительной (люминальной) формой болезни Крона ( n =34), получающих азатиоприн. В 1-й группе ( n =15) больные получали противовоспалительную терапию с применением культуры МСК в комбинации с азатиоприном, во 2-й ( n =19) — получала МСК без азатиоприна. Тяжесть атаки оценивали в баллах в соответствии с индексом CDAI. В сыворотке крови исследовали иммуноглобулины (IgA, IgG, IgM); интерлейкины (IL) 1 β , 4, 10; TNF- α , IFN- γ , TGF- β , С-ре-активный белок (СРБ), тромбоциты и скорость оседания эритроцитов (СОЭ) через 2; 6 и 12 мес от начала терапии МСК. В результате исходный средний CDAI в 1-й группе составил 337,6±17,1 балла, во 2-й — 332,7±11,0 ( p =0,3). В обеих группах больных отмечено достоверное снижение CDAI через

2 мес от начала терапии МСК: в 1-й группе — до 118,9±12,4 балла, во 2-й — до 120,3±14,1 (p=0,7), через 6 мес — 110,3±11,1 и 114,3±11,8 (p=0,8), через 12 мес — 99,9±10,8 и 100,6±12,1 (p=0,8), через 24 мес — 133,2±28,3 и 120,8±15,5 (p=0,2), через 36 мес — 139,9±23,4 и 141,7±20,8 балла (p=0,9) соответственно. Уровни IgA, IgG, IgM были достоверно ниже в группе больных с более продолжительным анамнезом заболевания и длительно принимающих азатиоприн. После введения МСК в обеих группах пациентов отмечалась тенденция к росту про- и противовоспалительных цитокинов с достоверно более низким уровнем провоспалительных цитокинов (IFN-γ, TNF-α, IL-1β) в 1-й группе, свидетельствующим о потенцировании иммуносупрессивного действия МСК и азатиоприна, которое обеспечивает более выраженный противовоспалительный эффект. В итоге было продемонстрировано, что трансплантация МСК способствует повышению в сыворотке крови пациентов с болезнью Крона изначально сниженной концентрации иммуноглобулинов, цитокинов и восстановлению их баланса по мере наступления клинической ремиссии, а в сочетании с азатиоприном оказывает более выраженный противовоспалительный эффект.
Интересные результаты были получены при сравнении влияния комбинированного (локального и системного) введения МСК из костного мозга, антицитокиновой терапии (инфликсимаб) и терапии антибиотиками и иммуносупрессорами на заживление простых перианальных свищей при болезни Крона [46]. Первая группа больных в возрасте от 19 до 58 (Ме 29) лет ( n =12) получала МСК системно по схеме и местно; вторая группа от 20 до 68 (Ме 36) лет ( n =10) получала инфликсимаб по схеме; третья группа от 20 до 62 (Ме 28) лет ( n =14) получала антибиотики и иммуносупрессоры. По результатам исследования через 12 нед. среди больных 1-й группы заживление простых свищей отмечено у 8 (66,6%), во 2-й — у 6 (60%), в 3-й — у 1 (7,14%); через 6 мес — у 8 (66,6%), 6 (60%) и 1 (7,14%); через 12 мес — у 7 (58,3%), 6 (60%) и 2 (14,3%); через 24 мес — у 5 (41,6%), 4 (40%) и 0 (0%) пациентов соответственно. В итоге было продемонстрировано, что комбинированная клеточная и антицитокино-вая терапия болезни Крона с перианальными поражениями достоверно способствует более частому и длительному закрытию простых свищей по сравнению с терапией антибиотиками и иммуносупрессорами, а также снижению частоты рецидивов заболевания.
J. Ko и соавт. [34] опубликовали в январе 2021 года детальный анализ безопасности и эффективности МСК-терапии ВЗК на основе 24 исследований (в 17 использовалось локальное введение МСК, в 7 — системное). В целом авторы приходят к выводу, что локальные инъекции МСК при свищевой (экстралюминальной) форме болезни Крона демонстрируют долгосрочную эффективность и благоприятный профиль безопасности. Доказательства же эффективности системной инфузии МСК для терапии воспалительной формы ВЗК остаются, по мнению авторов, неоднозначными, из-за выраженной методологической неоднородности исследований (прежде всего из-за разного источника МСК), усугубляемой отсутствием доказательств, показывающих, что МСК достигают кишечника после внутривенной инъекции, и не всегда ясно демонстрируемого профиля безопасности. Вместе с тем в уже упомянутых нами исследованиях нашей группы были получены довольно однозначные доказательства эффективности системной инфузии аллогенных МСК для терапии ВЗК [44–46].
Текущие клинические испытания
На сегодняшний день на сайте Clinicaltrials.gov зарегистрировано 14 действующих клинических испытаний (по состоянию на март 2021 г.) с использованием МСК-терапии для лечения ВЗК — в 2 случаях с аутологичными и в 12 — с аллогенными МСК (табл. 1). В 7 испытаниях используются МСК из костного мозга, в 5 — МСК из жировой ткани, в 1 — МСК из пуповинной крови, в 1 — МСК из Вартонова студня. В 10 случаях испытания проводятся для лечения болезни Крона, в 4 — для лечения язвенного колита. Локальное введение МСК используется в 12 испытаниях, системное — в 2.
ЗАКЛЮЧЕНИЕ
Многочисленные открытые и рандомизированные клинические исследования МСК в терапии ВЗК однозначно показали безопасность этого подхода и его потенциальную эффективность, в том числе и в случаях, резистентных к традиционным способам терапии. Терапевтическое действие МСК обусловлено мощным иммуномодулирующим эффектом, в результате которого снижается активность аутоиммунного воспаления и стимулируется процесс репарации в слизистой оболочке кишечника, что в свою очередь увеличивает продолжительность ремиссии, снижает риск клиническая
оактика
Том 12 №1
Таблица 1 / Table 1
KT FA
рецидива заболевания и частоту госпитализаций пациентов.
На основании проведенных клинических испытаний в Евросоюзе был одобрен первый препарат на основе аллогенных МСК из жировой ткани дарвад-строцел (Алофисел, Takeda, Япония) для лечения сложных перианальных свищей у пациентов с люминальной болезнью Крона. Вместе с тем в настоящее время не существует единого установленного оптимального протокола для трансплантации МСК для терапии ВЗК, что обусловливает актуальность дополнительных рандомизированных клинических исследований МСК, их источника, дозировки, способа и оптимальной частоты введения клеток. Помимо МСК из костного мозга и жировой ткани перспективно применение МСК из плаценты, что в сочетании с методами повышения эффективности производства МСК, такими как 3D-культивирова-ние и применение биореакторов большого объема, может существенно удешевить производство МСК и сделать этот уникальный метод терапии доступным для широкого круга пациентов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Участие авторов. М.А. Коноплянников — анализ литературных источников, написание статьи; О.В. Князев, В.П. Баклаушев — анализ литературных источников, редактирование. Все авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Author contribution. M.A. Konoplyannikov — literature analysis, manuscript writing; O.V. Knyazev, V.P. Baklaushev — literature analysis, manuscript editing. The authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Funding source. This study was not supported by any external sources of funding.
Список литературы Применение МСК для терапии воспалительных заболеваний кишечника
- Sairenji T, Collins KL, Evans DV. An update on inflammatory bowel disease. Prim Care. 2017;44(4):673-692. doi: 10.1016/j.pop.2017.07.010
- Guindi M, Riddell RH. Indeterminate colitis. J Clin Pathol. 2004;57(12): 1233-1244. doi: 10.1136/jcp.2003.015214
- Khor B, Gardet A, Xavier RJ. Genetics and pathogenesis of inflammatory bowel disease. Nature. 2011;474(7351):307-317. doi: 10.1038/natu re10209
- The facts about inflammatory bowel diseases. The Crohn's & Colitis Foundation of America (CCFA); 2014. Avalable from: https:// www.crohnscolitisfoundation.org/sites/default/files/2019-02/Up-dated%20IBD%20Factbook.pdf
- GBD 2017 Inflammatory Bowel Disease Collaborators. The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol. 2020;5(1):17-30. doi: 10.1016/S2468-1253(19)30333-4
- Magro F, Portela F. Management of inflammatory bowel disease with infliximab and other anti-tumor necrosis factor alpha therapies. BioDrugs. 2010;24(Suppl 1):3-14. doi: 10.2165/11586290-000000000-00000
- Ocansey DK, Qiu W, Wang J, et al. The Achievements and Challenges of Mesenchymal Stem Cell-Based Therapy in Inflammatory Bowel Disease and Its Associated Colorectal Cancer. Stem Cells Int. 2020;2020:7819824. doi: 10.1155/2020/7819824
- Tolar J, Le Blanc K, Keating A, et al. Concise review: hitting the right spot with mesenchymal stromal cells. Stem Cells. 2010;28(8):1446-1455. doi: 10.1002/stem.459
- Williams JT, Southerland SS, Souza J, et al. Cells isolated from adult human skeletal muscle capable of differentiating into multiple mesodermal phenotypes. Am Surg. 1999; 65:22-26.
- Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implication for cell-based therapies. Tissue Engl. 2001;7(2):211-228. doi: 10.1089/107632701300062859
- Gronthos S, Arthur A, Bartold PM, et al. A method to isolate and culture expand human dental pulp stem cells. J Methods Mol Biol. 2011;698:107-121. doi: 10.1007/978-1-60761-999-4_9
- Prockop D. Repair of tissues by adult stem/progenitor cells [MSCs]: controversies, myths, and changing paradigms. Mol Ther. 2009;17(6):939-946. doi: 10.1038/mt.2009.62
- Lv FJ, Tuan RS, Cheung KM, et al. Concise review: the surface markers and identity of human mesenchymal stem cells. Stem Cells. 2014;32(6):1408-1419. doi: 10.1002/stem.1681
- Caplan AI, Correa D. The MSC: an injury drugstore. Cell Stem Cell. 2011;9(1):11-15. doi: 10.1016/j.stem.2011.06.008
- Wang S, Miao Z, Yang Q, et al. The dynamic roles of mesenchymal stem cells in colon cancer. Can J Gastroenterol Hepatol. 2018;2018:7628763. doi: 10.1155/2018/7628763
- Caplan AI. MSCs: The sentinel and safe-guards of injury. J Cell Physiol. 2016;231(7):1413-1416. doi: 10.1002/jcp.25255
- Bernardo ME, Fibbe WE. Mesenchymal stromal cells: sensors and switchers of inflammation. Cell Stem Cell. 2013;13(4):392-402. doi: 10.1016/j.stem.2013.09.006
- Spaggiari GM, Capobianco A, Abdelrazik HF, et al. Mes-enchymal stem cells inhibit natural killer-cell proliferation, cyto-toxicity, and cytokine production: role of indoleamine 2, 3-dioxy-genase and prostaglandin E2. Blood. 2008;111(3): 1327-1333. doi: 10.1182/blood-2007-02-074997
- Terai S, Tsuchiya A. Status of and candidates for cell therapy in liver cirrhosis: overcoming the "point of no return" in advanced liver cirrhosis. J Gastroenterol. 2017;52(2):129-140. doi: 10.1007/s00535-016-1258-1
- Yabana T, Arimura Y, Tanaka H, et al. Enhancing epithelial engraftment of rat mesenchymal stem cells restores epithelial barrier integrity. J Pathol. 2009;218:350-359. doi: 10.1002/path.2535
- Dias CB, Milanski M, Portovedo M, et al. Defective apoptosis in intestinal and mesenteric adipose tissue of Crohn's disease patients. PLoS One. 2014;9(6):e98547. doi: 10.1371/joumal.pone.0098547
- Akiyama K, Chen C, Wang D, et al. Mesenchymal-stem cell-induced immunoregulation involves FAS-ligand-/FASmedi-ated T cell apoptosis. Cell Stem Cell. 2012;10(5):544-555. doi: 10.1016/j.stem.2012.03.007
- Sisakhtnezhad S, Alimoradi E, Akrami H. External factors influencing mesenchymal stem cell fate in vitro. Eur J Cell Biol. 2017;96(1):13-33. doi: 10.1016/j.ejcb.2016.11.003
- Chen Q, Yan L, Wang CZ, et al. Mesenchymal stem cells alleviate TNBS-induced colitis by modulating inflammatory and autoimmune responses. World J Gastroenterol. 2013;19(29):4702-4717. doi: 10.3748/wjg.v19.i29.4702
- Hidalgo-Garcia L, Galvez J, Rodriguez-Cabezas ME, Anderson PO. Can a conversation between mesenchymal stromal cells and macrophages solve the crisis in the inflamed intestine? Front Pharmacol. 20186;9:179. doi: 10.3389/fphar.2018.00179
- Jo H, Eom YW, Kim HS, et al. Regulatory dendritic cells induced by mesenchymal stem cells ameliorate dextran sodium sul-fate-induced chronic colitis in mice. Gut Liver. 2018;12(6):664-673. doi: 10.5009/gnl18072
- Liu J, Liu Q, Chen X. The immunomodulatory effects of mesenchymal stem cells on regulatory B cells. Front Immunol. 2020;11:1843. doi: 10.3389/fimmu.2020.01843
- Самойлова Е.М., Кальсин В.А., Беспалова В.А., и др. Эк-зосомы — от биологии к клинике // Гены и клетки. 2017. Т. 12, № 4. С. 7-19. [Samoilova EM, Kalsin VA, Bespalova VA, et al. Exo-somes — from biology to the clinic. Genes & Cells. 2017;12(4):7-19. (In Russ).] doi: 10.23868/201707024
- Zhao T, Sun F, Liu J, et al. Emerging role of mesenchymal stem cell-derived exosomes in regenerative medicine. Curr Stem Cell Res Ther. 2019;14(6):482-494. doi: 10.2174/1574888X14666190228103230
- Mianehsaz E, Mirzaei HR, Mahjoubin-Tehran M, et al. Mesenchymal stem cell-derived exosomes: a new therapeutic approach to osteoarthritis? Stem Cell Res Ther. 2019;10(1):340. doi: 10.1186/s13287-019-1445-0
- Mendt M, Rezvani K, Shpall E. Mesenchymal stem cell-derived exosomes for clinical use. Bone Marrow Transplant. 2019;54(Suppl 2):789-792. doi: 10.1038/s41409-019-0616-z
- Mao F, Yunbing Wu, Xudong Tang, et al. Exosomes derived from human umbilical cord mesenchymal stem cells relieve inflammatory bowel disease in mice. Biomed Res Int. 2017;2017:5356760. doi: 10.1155/2017/5356760
- Yang R, Huang H, Cui S, et al. IFN-y promoted exosomes from mesenchymal stem cells to attenuate colitis via miR-125a and miR-125b. Cell Death Dis. 2020;11(7):603. doi: 10.1038/s41419-020-02788-0
- Ko JZ, Johnson S, Dave M. Efficacy and safety of mesenchymal stem/stromal cell therapy for inflammatory bowel diseases: an up-to-date systematic review. Biomolecules. 2021;11(1):82. doi: 10.3390/biom11010082
- Panés J, García-Olmo D, Van Assche G, et al; ADMIRE CD Study Group Collaborators. Long-term efficacy and safety of stem cell therapy (Cx601) for complex perianal fistulas in patients with Crohn's disease. Gastroenterology. 2018;154(5):1334-1342.e4. doi: 10.1053/j.gastro.2017.12.020
- Herreros MD, Garcia-Olmo D, Guadalajara HT, et al. Stem cell therapy: a compassionate use program in perianal fistula. Stem Cells Int. 2019;2019:6132340. doi: 10.1155/2019/6132340
- Garcia-Olmo D, Garcia-Arranz M, Herreros D, et al. A phase I clinical trial of the treatment of Crohn's fistula by adipose mesenchymal stem cell transplantation. Dis Colon Rectum. 2005;48(7):1416-1423. doi: 10.1007/s10350-005-0052-6
- McNevin MS, Lee PY, Bax TW. Martius flap: an adjunct for repair of complex, low rectovaginal fistula. Am J Surg. 2007;193(5):597-599. doi: 10.1016/j.amjsurg.2007.01.009
- Cho YB, Park KJ, Yoon SN, et al. Long-Term results of adipose-derived stem cell therapy for the treatment of Crohn's fistula: ASCs for the treatment of Crohn's fistula. Stem Cells Transl Med. 2015;4(5):532-537. doi: 10.5966/sctm.2014-0199
- Scott LJ. Darvadstrocel: a review in treatment-refractory complex perianal fistulas in Crohn's disease. BioDrugs. 2018;32(6):627-634. doi: 10.1007/s40259-018-0311-4
- Cao Y, Su Q, Zhang B, et al. Efficacy of stem cells therapy for Crohn's fistula: a meta-analysis and systematic review. Stem Cell Res Ther. 2021;12(1):32. doi: 10.1186/s13287-020-02095-7
- Hu J, Zhao G, Zhang L, et al. Safety and therapeutic effect of mesenchymal stem cell infusion on moderate to severe ulcerative colitis. Exp Ther Med. 2016;12(5):2983-2989. doi: 10.3892/etm.2016.3724
- Zhang J, Lv S, Liu X, et al. Umbilical cord mesenchymal stem cell treatment for Crohn's disease: a randomized controlled clinical trial. Gut and Liver. 201812(1):73-78. doi: 10.5009/gnl17035
- Князев O.B., Парфенов A.M., Коноплянников A.r., Болдырева O.K Использование мезенхимальных стромальных клеток в комплексной терапии язвенного колита // Терапевтический архив. 2016. Т. 88, № 2. C. 44-48. [Knyazev OV, Parfenov AI, Konoplyannikov AG, Boldyreva ON. The use of mesenchymal stro-mal cells in the complex therapy of ulcerative colitis. Therapeutic archive. 2016;88(2):44-48. (In Russ).]
- Князев O.B., Каграманова A.B., Фадеева KA., и др. Мезенхимальные стромальные клетки костного мозга и аза-тиоприн в терапии болезни Крона // Терапевтический архив. 2018. Т. 90. № 2. C. 47-52. [Knyazev OV, Kagramanova AV, Fadeeva NA, et al. Bone marrow mesenchymal stromal cells and aza-thioprine in the treatment of Crohn's disease. Therapeutic archive. 2018;90(2):47-52. (In Russ).] doi: 10.26442/terarkh201890247-52
- Князев O.B., Фадеева KA., Каграманова A.B., и др. Клеточная терапия перианальных проявлений болезни Крона // Терапевтический архив. 2018. Т. 90, № 3. C. 60-66. [Knyazev OV, Fadeeva NA, Kagramanova AV, et al. Cell therapy of the perianal manifestations of Crohn's disease. Therapeutic archive. 2018;90(3):60-66. (In Russ).] doi: 10.26442/terarkh201890360-66


