Применение "red-ox" реакции и разности температур раствора для преобразования тепловой энергии в электрическую
Автор: Егеубаева С.С., Джакупова И.Б., Коныратбекова С.С., Шаихова Ж.Е.
Журнал: Вестник Алматинского технологического университета @vestnik-atu
Рубрика: Естественные науки
Статья в выпуске: 3 (120), 2018 года.
Бесплатный доступ
В зависимости от изменения разности температур в электродных пространствах оп-ределены величины электродвижущей силы (ЭДС) и тока короткого замыкания (ТКЗ). При-ведены величины формируемых электродвижущих сил и тока короткого замыкания в систе-мах: Fe2+↔Fe3+;I0↔I,С6Н4(ОН)2↔С6Н4О2;Sn+2↔Sn+4;K3[Fe(CN)6]↔K4[Fe(CN)6].3Н2О. Показа-но, что при разности температур между электродными пространствами, равной 700С меж-ду графитовыми электродами формируется ЭДС величиной 61,5 мВ и ТКЗ - 0,04 мА и изуче-но влияние конструкций электролиза.
Электродвижущая сила, ток короткого замыкания, электролиз, графитовые электроды, тепловая энергия
Короткий адрес: https://sciup.org/140237820
IDR: 140237820 | УДК: 31.17.15
Текст научной статьи Применение "red-ox" реакции и разности температур раствора для преобразования тепловой энергии в электрическую
Концепция вхождения Казахстана в число 30 самых развитых государств мира включает в себя приоритеты, учитывающие интересы страны в процессах регионального и глобального развития [1]. Энергетический комплекс представляется одним из определяющих факторов в развитии экономики страны. А в качестве одного из векторов развития энергетического комплекса рассматриваются возобновляемые источники энергии.
Ключевым фактором использования возобновляемых альтернативных источников энергии в Казахстане, также как и во всем мире, является необходимость снижения негативного воздействия применяемых традиционных источников энергии на окружающую среду. Преимуществом использования альтернативной энергетики является неисчерпаемость и экологическая чистота. Использование альтернативных источников энергии стало важным и необходимым направлением развития энергетики будущего. В этой связи перед учеными и технологами поставлены важнейшие задачи, в круг которых входит и разработка принципиально новых методов преобразования тепловой энергии в электрическую [2-5].
В результате исследований, проведенных нами, впервые предложен упрощенный электрохимический способ преобразования тепловой энергии в электрическую [6,7]. Как показали результаты предварительных исследований, в присутствии red-ox системыFe(ІІ)-Fe(ІІІ) и при разных температурах в электродных пространствах между электродами формируется электродвижущая сила (ЭДС).Ранее нами исследовано влияние различных параметров на формирование ЭДС и ТКЗ в гальванической пареграфит-графит в присутствии red-ox систем: Fe2+↔Fe3+; I0↔I-; С6Н4 (ОН)2↔С6Н4О2; Sn+2↔Sn+4; K3[Fe(CN)6]↔K4-[Fe(CN)6].3Н2О в разных электролитах [9-12]. Было показано, что в процессах формирования ЭДС и ТКЗ большое значение имеет обратимость в окислительно-восстановительных системах. Целью данной работы является изучение обратимости процессов окисления и восстановления в системе Fe2+↔Fe3+.
Объекты и методы исследований
С целью выяснения механизмов реакций окисления и восстановления в системе Fe2+↔Fe3+ снимались потенциодинамические поляризационные кривые на потенциостате-гальваностате «AutolabPGSTAT 302 N» в водных и сернокислых растворах на графитовом электроде.
Измерения проводились в трехэлектродной ячейке относительно хлорсеребряного электрода (Е0=+0,203 В). Вспомогательным электродом служила платиновая проволока. Перед измерениями поверхность электрода тщательно зачищали и полировали, затем обезжиривали спиртом, промывали водой и сушили, затем погружали в исследуемый раствор и выдерживали до установления стационарного потенциала. После этого включалась развертка потенциала с заданной скоростью и регистрировалась соответствующая по-тенциодинамическая поляризационная кривая.
Результаты и их обсуждение
При погружении графитового электрода в раствор серной кислоты, содержащий двух- и трехвалентные ионы железа, на поверхности электрода устанавливается следующее равновесие (1):
Fe3+ + е ↔ Fe2+ Е0 = + 0,77 В (1)
Как видно из полярограммы (рис. 1, кривая 1), в фоновом растворе серной кислоты, кроме токов выделения кислорода и водорода на графитовом электроде никаких волн не наблюдается.
На катодно-анодной поляризационной кривой, полученной в растворе, содержащем 20 г/л Fe+3 и 100 г/л H 2 SO 4 (рис. 1, кривая 2)
на графитовом электроде в области потенциалов «плюс» 300 мВ наблюдается максимум тока восстановления Fe (III) до Fe (II), при дальнейшем смещении потенциала в сторону отрицательных значений происходит выделение водорода. В анодном цикле в области потенциалов «плюс» 650 мВ протекает обратное окисление Fe(II) до Fe(III).
В сернокислом растворе, содержащем ион железа (ІІ), на катодно-анодной потен-циодинамической поляризационной кривой (рис. 2) при смещений потенциала в катодном направлении наблюдается катодный ток восстановления Fe(III) до Fe(II) с максимумом тока 375 мВ, а затем происходит выделение водорода, а при смещении потенциала в сторону положительных значений от потенциала «плюс» 275 мВ наблюдается анодный ток окисления двухвалентного железа с максимумом тока при «плюс» 650 мВ, затем происходит выделение кислорода.
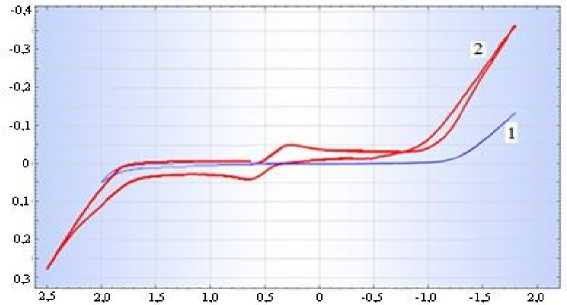
V=100мВ/с, t=250С; 1) 100 г/л-H 2 SO 4 ; 2) 100 г/л-H 2 SO 4 + 20 г/л-Fe 2 (SO 4 ) 3 ;
Рисунок 1 - Катодно-анодная поляризационная кривая графитового электрода в растворе серной кислоты в присутствии ионов железа (ІІІ)
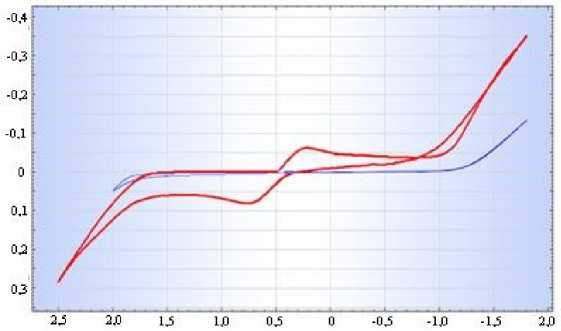
V=100мВ/с, t=250С; 1) 100 г/л-H 2 SO 4 ; 2) 100 г/л- H 2 SO 4 + 20 г/л-FeSO 4 ·7H 2 O
Рисунок 2 - Катодно-анодная поляризационная кривая графитового электрода в растворе серной кислоты в присутствии ионов железа (ІІ)
Таким образом, исследованы реакции окисления и восстановления в системеFe(II)-Fe(III) методом снятия потенциодинамичес-ких поляризационных кривых. На основе полученных экспериментальных данных показано, что на анодно-катодной поляризационной кривой на графитовом электроде, начиная от «плюс» 470 мВ, наблюдается волна окисления Fe(II) до Fe(III) с максимумом тока при «плюс» 620-630 мВ. А на катодно-анодной потенциодинамической поляризационной кривой в катодном цикле, начиная от потенциала 470 мВ, наблюдается ток восстановления Fe(III) до Fe(II) с максимумом тока при 375 мВ, т. е. система Fe(II) - Fe(III) является обратимой, и процессы red-ox протекают с низкими перенапряжениями.
Необходимо отметить, что формирование ЭДС и возникновение ТКЗ при наличии red-ox систем и разности температур в электродных пространствах и существенное возрастание указанных величин с увеличением разности температур свидетельствуют о возможности преобразования тепловой энергии в электрическую. В связи с этим нами ранее были изучены разные red-ox системы с точки зрения формирования ЭДС и преобразования тепловой энергии в электрическую и рассчитаны коэффициенты преобразования тепловой энергии в электрическую.
С использованием установок, приведенных на рисунке 3, исследованы процессы формирования электродвижущей силы (ЭДС) и возникновения тока короткого замыкания в системе Fe2+^Fe3+ в сернокислых растворах при создании разности температур в электродных пространствах.
Лабораторная установка для изучения процесса формирования ЭДС представляет собой стеклянный электролизер с разделенными электродными пространствами, соединенными между собой через нижнюю часть электролитическим мостиком в виде трубочки.
Принципиальные схемы горизонтальной и вертикальной установок для преобразования тепловой энергии в электрическую приведены на рисунке 3.
Электролизер заполняется раствором исследуемого электролита. Одно электродное пространство электролизера имеет термостатированную рубашку и по мере необходимости можно устанавливать в нем любую температуру в пределах 20-90 0 С.
Установлено, что при погружении двух графитовых электродов в водный раствор электролитов и при возникновении разности температур в электродных пространствах в системе формируется электродвижущая сила (ЭДС). С увеличением разности температур в электродных пространствах величина ЭДС между двумя электродами, находящимися в растворах с разными температурами, и величина тока короткого замыкания (ТКЗ) повышаются.
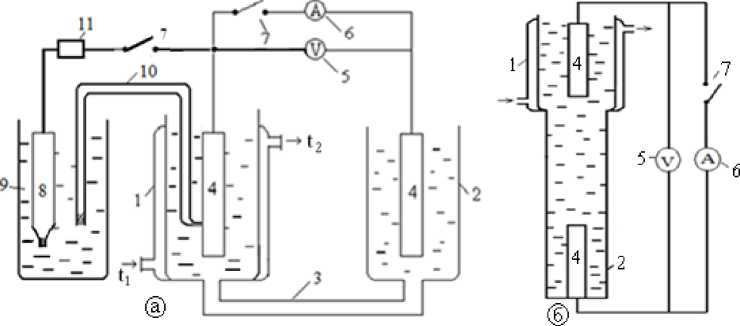
1-термостатируемое пространство электролизера; 2- нетермостатируемое пространство электролизера; 3 -мостик для соединения электродных пространств; 4 - графитовые электроды; 5 - вольтметр для измерения величины ЭДС; 6 - амперметр для измерения величины ТКЗ; 7 - ключ для измерения ЭДС между электродами (4 - 4); 8 - хлорсеребряный электрод сравнения; 9 - емкость с насыщенным раствором хлорида калия; 10 - стеклянный мостик, заполненный исследуемым раствором; 11- высокоомный вольтметр для
измерения величины потенциала электрода
Рисунок 3 - Принципиальная схема горизонтальной (а) и вертикальной (б) установок для проведения исследований по преобразованию тепловой энергии в электрическую.
Известно, что при погружении электрода в раствор, содержащий ионы в окисленной и восстановленной формах, на электроде устанавливается окислительно-восстановительный потенциал, величина которого определяется по уравнению Нернста [13], т.е. зависит от температуры раствора. Как следует из уравнения, величина окислительно-восстановительного потенциала, установившегося на инертном индикаторном графитовом электроде, при постоянной активности ионов в низшей и в высшей степени окисления будет зависеть от температуры раствора. С повышением температуры раствора, соответственно, потенциал графитового индикаторного электрода смещается в положительную сторону. При этом между графитовыми электродами, находящимися в растворах с разными темпе- ратурами, формируется ЭДС. Для того, чтобы данная система работала как источник электрического тока, на электродах, соответственно, должны протекать обратимые окислительно-восстановительные реакции.
На рисунке 4 приведены кривые, отражающие изменения ЭДС и величин тока короткого замыкания от температуры раствора в сернокислом растворе, содержащем трех- и двухвалентные ионы железа, полученные в горизонтальном электролизере. Установлено, что с повышением температуры существенно растет величина ЭДС и ТКЗ. Как видно из рисунка 4, при разнице температур между электродными пространствами, равной 700С, величины ЭДС и ТКЗ, соответственно, составляют 61,5 мВ и 0,04 мА.
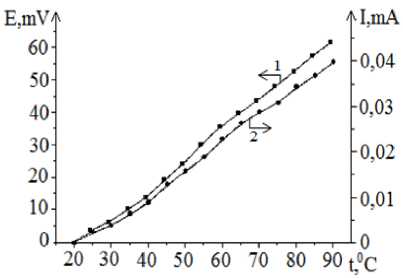
100 г/л Н 2 SO 4 ; 50 г/л Fe 2 (SO 4 ) 3 ; 1 г/л FeSO 4 ∙7H 2 O; t 0 =200С
Рисунок 4 - Зависимость изменения величин ЭДС(1) и ТКЗ(2) между графитовыми электродами от температуры в горизонтальном электролизере.
В таблице 1 приведены коэффициенты преобразования тепловой энергии в электрическую, полученные в горизонтальном и вертикальном электролизерах, в присутствии разных окислительно-восстановительных систем в растворе: Fe2+↔Fe3+; I0↔I; С6Н4 (ОН)2↔С6Н4О2; Sn+2↔Sn+4; K3[Fe(CN)6]↔K4 [Fe(CN)6].3Н2О в разных электролитах.
Таблица 1 - Коэффициенты преобразования тепловой энергии в электрическую, полученные в горизонтальном и вертикальном электролизерах
|
Окислительно-восстановительные системы |
Коэффициент преобразования тепловой энергии в электрическую, мВ/град |
|
|
На графитовом электроде |
в горизонтальном электролизере |
в вертикальном электролизере |
|
С6Н4О2-С6Н4(ОН)2 |
1,41 |
1,66 |
|
K3[Fe(CN)6] - K4[Fe(CN)6].3Н2О |
1,31 |
1,30 |
|
Fe2+- Fe3+ |
0,88 |
1,21 |
|
Sn2+–Sn4+ |
0,71 |
1,03 |
|
- I2 - 2I- |
0,42 |
0,60 |
|
Термопара «Pt-константан» |
0,034 |
|
Также проводились опыты с использованием вертикального электролизера. Следует отметить, что при использовании вертикального электролизера величина тока короткого замыкания (ТКЗ) всегда выше, чем в горизонтальном электролизере. Это связано с уменьшением сопротивления электролита между электродами.
Заключение
-
1. Таким образом, из приведенных выше результатов следует, что наибольшее значение ЭДС и ТКЗ получается в щелочном «хинон-гидрохинон» содержащем растворе, коэффициент преобразования тепловой энергии в электрическую составляет 1,41 мВ/град для горизонтального и 1,66 мВ/град для вертикального электролизера.
-
2. Следует отметить, что коэффициент преобразования тепловой энергии в электрическую электрохимическим методом превышает в 41,4 раз, чем значения коэффициента преобразования тепловой энергии в электрическую при использовании термопар (термопара «платина-константан» 0,034 мВ/град).
Список литературы Применение "red-ox" реакции и разности температур раствора для преобразования тепловой энергии в электрическую
- The Report will be formally launched at the Permanent Mission of Germany to the UN, New York, during the UN Sustainable Energy for All Forum. The report’s executive summary is available for media preview. . Режим доступа. URL: http://www.ren21.net/Portals/0/documents/Resources/GSR/2014/pdf. (дата обращения 26.03.2017 г.).
- Лосюк Ю.А., Кузьмич В.В. Нетрадицион-ные источники энергии: учебное пособие -Мн.: УП»Технопринт», 2005. -234с.
- Елистратов В.В. Использование возоб-новляемой энергии: учеб. пособие -СПб.: Изд-во Политехн. ун-та, 2008. -224с.
- Четошникова Л.М. Нетрадиционные во-зобновляемые источники энергии: учеб.пособие. Челябинск: Изд-во ЮУрГУ, 2010. -69 с.
- Пугач Л.И., Серант Ф. А., Серант Д.Ф. Нетрадиционная энергетика, возобновляемые ис-точники, использование биомассы, термохими-ческая подготовка, экологическая безопасность: учеб.пособие -Л.-Новосибирск: Изд-во НГТУ, 2006. -347 с.
- Баешов А., Баешова А.К. Электрохими-ческое преобразование тепловой энергии в элек-трическую//Энергетика и топливные ресурсы Казахстана.-2012. -№11. -С.17-19.
- Пат. 24466 РК. Преобразователь тепловой энергии в электрическую/Баешов А., Баешова А., Баешова А.К. и др.; опубл. 15.08.2011, Бюл. № 8. -4 с.
- Yegeubayeva S.S., Bayeshov A.B., Bayeshova A.K., Zhurinov M.Zh. Electrochemicaltrans formation of the rmalenergy of the sun and geothermal waters to the electric energy.//International Journal of Chemical Sciences. -2014. V. 12(2). -РР. 456-462.
- Баешов А.Б., Егеубаева С.С., Баешова А.К., Сарсенбаев Н. Формирование электродвижущих сил в окислительно-восстановительных системах в зави-симости от температуры./Материалы Междунар. научно-практич. конференции, посвященной 90 ле-тию Академика Е.А. Букетова «Научное и творчес-кое наследие Академика Е.А. Букетова», Караганда, 2015.-С. 121-124.
- Баешов А.Б., Егеубаева С.С., Баешова А.К., Журинов М.Ж. Влияние температуры и приро-ды растворителя на формирование электродви-жущих сил между графитовыми электродами в растворах содержащих I2-I-системы//Вестник НАН РК. -2014. №4.-С. 25-28.
- Bаyeshov А.B., Yegeubayeva S.S., Bayeshova А.K. The conversion of thermal energy into electrical energy using graphite and lead electrodes//Journal of Chemical and Pharmaceutical Research. -2015.Т. 7(2). -РР. 840-843.
- Баешов А.Б., Егеубаева С.С., Баешова А.К. Формирование ЭДС между свинцовыми электродами в присутствии «red-ox» системы Fe(II) -Fe(III)//Вестник КБТУ. -2015. № 1(32). -С. 39-44.
- Ротинян А.Л., Тихонов К.И., Шошина И.А. Теоретическая электрохимия. -Л.: Химия, 1981. -424 с.


