Применимость метода флуориметрического детектирования и классической жидкостной хроматографии при определении микотоксинов в различных матрицах
Автор: Артамонов Иван Владимирович
Журнал: АгроЗооТехника @azt-journal
Рубрика: Кормопроизводство, кормление сельскохозяйственных животных и технология кормов
Статья в выпуске: 4 т.3, 2020 года.
Бесплатный доступ
Микотоксины представляют важную в хозяйственно-экономическом плане группу химических соединений, в то же время являющуюся крайне разнообразной по строению и свойствам, что делает невозможным применение какого-либо одного метода для их поиска и количественного определения в различных матрицах. С учетом того, какое влияние оказывают эти соединения на живые организмы, часто приводя к массовым интоксикациям и гибели сельскохозяйственных животных, отравлениям среди потребителей продуктов питания, важность поиска средств деконтаминации сырья и субстратов очевидна. На первом этапе в этом процессе происходят поиск и количественное определение содержания микотоксинов в различных матрицах. Необходимо отметить многообразие существующих методов, позволяющих с разными точностью и эффективностью определять концентрацию микотоксинов. Метод высокоэффективной жидкостной хроматографии занял важное место среди прочих благодаря своей универсальности и высокой точности. Цель исследования - рассмотрение возможностей одной из методик, позволяющей с высокой точностью определять содержание в образцах наиболее хозяйственно важных ввиду высокой токсичности, многообразия вызываемых эффектов и широкой распространенности микотоксинов: группы афлатоксинов, охратоксинов, зеараленона, фумонизина - метода ВЭЖХ (HPLC) с флуориметрическим детектированием (FLD). Задачи: анализ существующих методик определения микотоксинов и вариаций этих методик, факторов, влияющих на качество определения и воспроизводимость результатов. Методика HPLC-FLD в различных вариантах достаточно показательна, обладает высокой точностью и повторяемостью результата, что позволяет использовать ее при проведении научных исследований. В этом заключается ее научная новизна.
Микотоксины, хроматография, флуориметрическое детектирование, вэжх
Короткий адрес: https://sciup.org/147225613
IDR: 147225613 | УДК: 543.544.5.068.7 | DOI: 10.15838/alt.2020.3.4.1
Текст научной статьи Применимость метода флуориметрического детектирования и классической жидкостной хроматографии при определении микотоксинов в различных матрицах
Объем продукции сельского хозяйства России в 2017–2019 гг. составил более 5,5 трлн руб., из которых на растениеводство приходится до 46% (2,6 трлн руб.). Формируя 4,7% ВВП страны и обеспечивая в последние годы лидерство Российской Федерации в мировом экспорте зерновых культур1, сельское хозяйство является весьма чувствительной отраслью экономики.
Качество производимой продукции напрямую определяет экономическую эффективность сельского хозяйства. Это касается не только продуктов питания (растительного и животного происхождения), но и кормов, от качества которых зависит здоровье сельскохозяйственных животных и, в конечном счете, их продуктивность и качество продукции животноводства.
Также нужно учитывать экономические потери, связанные с выбраковкой некачественной продукции, снижением конечной стоимости продукции ввиду ее низкого качества, падением продуктивности животных и их преждевременным выбыванием из стада.
Тщательный контроль как кормов, так и продукции сельского хозяйства на соответствие устанавливаемым нормам выступает необходимым условием повышения эффективности сельского хозяйства. Одним из критериев соответствия устанавливается содержание в продукции загрязнителей (контаминантов), обширной группой которых являются плесневые грибы и одни из их вторичных метаболитов – микотоксины.
Микотоксины – вторичные низкомолекулярные метаболиты плесеневых грибов родов Fusarium, Aspergillus, Myrothecium, Stachybotrys, Trichoderma, Trichothecium, Penicillium и др., а также контаминанты продукции сельского хозяйства, включая зерно злаковых, бобовые, масличные, овощные культуры и фрукты. Для жизнедеятельности грибов, однако, они не являются необходимыми и фактически никакой роли не играют. Исключением можно считать влияние микотоксинов на те грибы и растения, на которых они существуют. Поэтому в отношении их естественной функции можно сделать предположение о том, что микотоксины становятся средством повышения конкурентности.
Микотоксины выступают причиной множества заболеваний неинфекционной природы у человека и животных, объединяемых в группу «микотоксикозы», проявляющиеся как в острой форме (при попадании в организм больших доз микотоксинов однократно), так и хронической (следствие регулярного контакта с микотоксинами в малых дозах).
Микотоксины обладают миелотоксичным, нефротоксичным, канцерогенным, тератогенным, бактериостатическим, цитотоксическим, иммунодепрессивным, термогенным действием. Ввиду столь разнообразного влияния на животных и человека они стали объектом пристального изучения.
Микотоксины – чрезвычайно разнообразная группа веществ, воздействующая практически на все аспекты функционирования организма. В настоящее время неизвестными остаются многие эффекты микотоксинов. В частности, некоторые публикации показывают, что микотоксины оказывают существенное влияние на организмы животных даже в меньших концентрациях, чем допускается различными регуляторами [1]. Отчасти это объясняется и огромным количеством микотоксинов (в настоящее время известно не менее 400 видов) [2; 3].
Эфирные вытяжки грибов Fusarium sporotrichioides, Stachybotrys altennans при нанесении на кожу вызывают сильные некрозы и смерть животных. Claviceps purpurea приводит к эрготизму (к которому восприимчив и человек) и смерти животных и птицы в короткий период. Информация о поражениях людей спорыньей известна еще из средневековых летописей, а с 591 по 1789 год в Европе произошло 132 эпидемии эрготизма. В 1128 году эпидемия эрготизма стала причиной гибели 14 тыс. человек в Париже [5]. Даже в современной истории имеются случаи массового отравления людей микотоксинами, последний из них зафиксирован в 1951 году в Пон-Сент-Эспри во Франции.
Заражение грибами-продуцентами микотоксинов – частое явление в практике сельского хозяйства всех стран мира. Промышленная переработка не оказывает существенного влияния на содержание микотоксинов в пищевых продуктах и кормах, и они легко передаются по производственным цепочкам, попадая в конечные продукты и организм животных и человека.
Стоит отметить, что до недавнего времени основное внимание уделялось поиску микотоксинов в зерне, злаках, кукурузном силосе. Гораздо меньшее количество работ посвящено травяному силосу (разного состава), в котором обнаруживаются токсины грибов рода Fusarium [6].
Заражение может происходить как до сбора урожая, так и после него. Заражение грибами Penicillium spp. происходит, как правило, после сбора, в то время как грибы Alternaria spp. и Fusarium spp. поражают растения еще в посевах. Грибы Aspergillus spp. могут заражать материал в обоих случаях [8]. По этой причине избежать заражения в агрокультуре практически невозможно. Даже после уничтожения микрофлоры микотоксины остаются в сырье, попадая в организмы животных, продукты питания и организм человека.
Глобализация рынка сельскохозяйственной продукции, продуктов питания, кормов, снижение временных затрат на транспортировку продукции приводит к сложно предсказуемым последствиям в распространении плесневых грибов и продуцируемых ими контаминантов по всему миру [8]. Исследования показывают, что доля зараженных микотоксинами образцов различных культур (используемых как в качестве пищевого сырья, так и кормов) имеет стабильную положительную динамику [9].
Распространение микотоксинов носит глобальный характер и является значимой проблемой для сельского хозяйства в целом. По этой причине исследования различного масштаба (как крупные, интегрирующие данные из множества источников, так и локальные, оценивающие ситуацию в отдельно взятых регионах мира, государствах и их субъектах) – важный элемент решения задачи, связанной со снижением негативных эффектов, вызываемых этими контаминантами.
Цель исследования – выявление возможностей одной из методик, позволяющей с высокой точностью определять концен- трацию в исследуемых образцах наиболее хозяйственно важных ввиду высокой токсичности, многообразия вызываемых эффектов и широкой распространенности микотоксинов: группы афлатоксинов, охратоксинов, зеараленона, фумонизина – метода ВЭЖХ (HPLC) с флуориметрическим детектированием (FLD).
Задачи исследования:
-
1) анализ существующих методик определения микотоксинов;
-
2) анализ существующих вариаций методик, факторов, влияющих на качество определения и воспроизводимость результатов.
Методы определениямикотоксинов
Выявление заражения материала микотоксинами связано с определенными трудностями. Кроме случаев явного заражения, когда колонии плесневых грибов или признаки поражения хорошо заметны, большинство случаев скрытые. Концентрация микотоксинов, как правило, недостаточно высока, чтобы определять ее классическими методами аналитической химии.
Активную разработку методов для определения содержания микотоксинов стимулировали крупные эпидемии болезней сельскохозяйственных животных и птицы. После эпидемии «болезни Х», результатом которой стала гибель более 100 тыс. индеек в Великобритании в 1960 году, внимание исследователей привлекло наличие в арахисе, использующемся в качестве добавок к корму птицы, флуоресцирующего контаминанта – плесневого гриба Aspergillus flavus, продуцирующего группу афлатоксинов [10].
Результатом исследований стала целая группа методов, с различной степенью точности определяющих концентрацию микотоксинов в целом и афлатоксинов как одной из самых опасных групп в частно- сти, в исследуемых образцах. Наиболее распространенные методы представлены в табл. 1.
Стандартным методом выявления заражения в настоящее время служит иммуноферментный анализ (ИФА или ELISA, англ.). Его сущность заключается в высокоселективной реакции антиген-антитело, в результате которой образуются продукты, обладающие окраской или другими свойствами, позволяющими оценить ферментативную активность.
В приложение к микотоксинам, как правило, используется фотометрический метод определения концентрации в видимом диапазоне волн (классическая длина волны при определении содержания микотоксинов – 450 нм).
В настоящее время в абсолютном большинстве случаев применения ИФА микотоксинов используются готовые наборы, содержащие стандартные ИФА-планше-ты с закрепленными антителами, позволяющие проводить быстрый анализ, но имеющие высокую стоимость. Вторым ограничением ИФА является его высокая селективность, позволяющая определять только один микотоксин (или группу микотоксинов) в каждом испытании.
Тем не менее ИФА-методы недостаточно точны и показательны, чтобы использовать их в качестве методов точного количественного определения, когда такое определение выступает конечной целью анализа. В этих случаях, как правило, обращаются к высокоэффективной жидкостной хроматографии (ВЭЖХ или HPLC) и ее вариантам (в частности сверхвысокоэффективной жидкостной хроматографии – УВЭЖХ или UHPLC), а также различным методикам детектирования.
В соответствии с сущностью метода ВЭЖХ (либо УВЭЖХ) определение микотоксинов заключается в их разделении (в случае анализа нескольких микотоксинов) и обнаружении различными методами
Таблица 1. Наиболее распространенные методы анализа микотоксинов, используемые в настоящее время
|
Метод |
Предел обнаружения (нг/г) |
Преимущества |
Недостатки |
Анализируемые субстраты (примеры) |
|
Тонкослойная хроматография |
> 10 |
Универсальный, компактный, быстрый |
Трудоемкий, низкая чувствительность |
Арахис, какао, кукуруза и др. |
|
Газовая хроматография |
– |
Быстрый, автоматизирован |
Низкая чувствительность, высокая стоимость |
|
|
Жидкостная хроматография |
> 1 |
Высокие точность, чувствительность, извлекаемость, автоматизирован, анализ нескольких токсинов за один раз |
Сравнительно высокая стоимость |
Любые субстраты после экстракции токсинов |
|
Разделение на миниколонках |
> 5 |
Быстрый, простой |
Крайне низкая точность |
Кормовые смеси, арахис, семена хлопка, кукуруза |
|
Метод яркой желтозеленой флуоресценции |
– |
Быстрый метод |
Низкая точность |
Кукуруза, ячмень, сорго |
|
Изотопный иммунологический анализ |
> 5 |
Высокая чувствительность, высокая специфичность |
Дорогостоящий, радиоактивно опасный |
|
|
ELISA (ИФА) |
> 0,25 |
Высокоселективный, высокочувствительный, быстрый |
Дорогостоящий |
Любые субстраты после экстракции |
|
Примечание: группа биологических методов определения, индикатором содержания микотоксинов в которых служат живые организмы (эмбрионы, культуры тканей и клеток, микроорганизмы, чувствительные к микотоксинам животные, например форель), не получила широкого распространения ввиду невозможности количественного определения и высокой трудоемкости. В то же время с развитием технической базы снижаются трудоемкость и себестоимость химических и физических методов определения. Источник: Ellis W.O. [et al.]. Aflatoxins in food: Occurrence, biosynthesis, effects on organisms, detection, and methods of control. Critical Reviews in Food Science and Nutrition, 1991, vol. 30, no. 4, pp. 403–439. |
||||
детектирования после разделения на хроматографической колонке.
Будучи структурно сложными органическими соединениями2 (относительно простое строение имеет, например, патулин), микотоксины существенно различаются по времени удержания на хроматографических колонках, что позволяет проводить эффективное разделение их смесей.
Ввиду отсутствия у хроматографической колонки свойства селективности по отношению к микотоксинам (все введенные в нее микотоксины взаимодействуют с неподвижной и подвижной фазами), в процессе элюирования разделяются даже близкие по строению токсины, например, показано, что группа афлатоксинов хорошо поддается разделению на классических обращенно-фазовых хроматографических колонках с привитой неподвижной фазой С183. Элюирование производится смесями метанола, ацетонитрила и воды в различных соотношениях.
Многолетняя практика свидетельствует, что наиболее успешно хроматографическим способом разделяются и анализи- руются зеараленон, охратоксины и группа афлатоксинов. Оценивая применимость FL-детектирования, в основном сосредоточимся на последних как наиболее важных по степени влияния на живые организмы, чаще встречающихся и, в общем, являющихся причиной наибольшего числа случаев отравления.
Стоит отметить, что хроматографическое разделение микотоксинов требует предварительной очистки пробы с помощью метода твердофазной экстракции на им-муноаффинных колонках, позволяющих существенно повысить концентрацию анализируемых веществ и избавиться от примесей, которые могут влиять на выраженность флуоресценции и, соответственно, сигнала, получаемого детектором4.
Первые успешные попытки разделения афлатоксинов методом ВЭЖХ с детектированием их флуоресценции в ультрафиолете были предприняты в середине 1970-х годов. Разделение на нормально-фазовых колонках с детектированием в диапазоне 360–365 нм показало предел точности 1–10 нг/г, что было бы недостаточно для определения их концентраций в установленных нормами для пищевых продуктов пределах.
Использование в качестве растворителя и подвижной фазы хлороформа или дихлор-метана в сочетании с нормально-фазовой колонкой приводило к тому, что флуоресценция афлатоксинов B1 (AFB1) и B2 (AFB2) практически полностью подавлялась, что приводило к необходимости комбинировать UV-детектор для B1 и B2 с FL-детектором для афлатоксинов G1 (AFG1) и G2 (AFG2). В то же время в смесях растворителей с водой в обращенно-фазовой хроматографии сильно подавляется флуоресценция токсинов AFB1 и AFG1 [11].
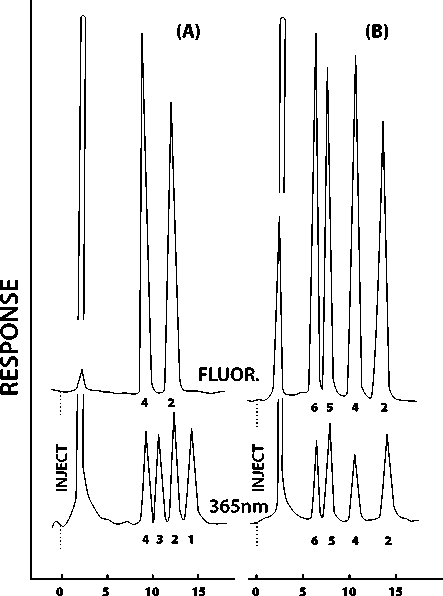
Общепринятым способом усиления флуоресценции афлатоксинов является их де-риватизация. Впервые усиление флуоресценции дериватов афлатоксина B1 по сравнению с исходным веществом упомянуто в работе N. Davis, U. Diener в 1980 году (использовалась предколоночная де-риватизация микотоксинов йодом). Было показано более чем двукратное усиление сигнала деривата в сравнении с исходным микотоксином AFB1. Кроме того, снизилось время удержания деривата: для AFB1 с 12 до 7,5 минут, для AFG1 – с 10 до 6 минут [12]. В настоящее время дериватизи-рующим агентом в анализе афлатоксинов чаще всего выступает бром. Бромпроизвод-ные афлатоксинов имеют существенно более сильную флуоресценцию. При использовании в качестве подвижной фазы смеси ацетонитрила и воды также можно избежать существенного ослабления флуоресценции деривата. Дериватизация бромом применяется, как правило, в постколоночном варианте, для которого время удержания микотоксинов остается прежним. Показателен и метод дериватизации о-фталевым альдегидом в варианте пред-колоночной дериватизации, в котором он применим для анализа фумонизина5 [13]. Вариантом метода предколоночной дериватизации является дериватизация афлатоксинов трифторуксусной кислотой (TFA). Он также позволяет усилить сигнал деривата по отношению к исходному афлатоксину и повысить предел обнаружения до 0,5 нг/г для всех четырех афлатоксинов (рис. 1) [11; 14].
В табл. 2 представлены диапазоны частот детектирования микотоксинов (в варианте флуориметрического определения с дериватизацией) и пределы детектирования и количественного анализа. В за-
TIME (minutes)
Рис. 1. Обращенно-фазовая хроматограмма афлатоксинов (содержание в пробе – 25 нг).
-
(А) – недериватизированные образцы,
-
(В) – дериватизация с TFA.
Цифрами отмечены:
-
1 – AFB1, 2 – AFB2,
-
3 – AFG1, 4 – AFG2,
-
5 – AFB2a (гидратированный),
-
6 – AFG2a (гидратированный)
Источник: Kok W.T. Derivatization reactions for the determination of aflatoxins by liquid chromatography with fluorescence detection. Journal of Chromatography B. Biomedical Sciences and Applications, 1994, vol. 659, no. 1–2, pp. 127–137.
висимости от реализации методики, типа колонки, детектора и других факторов эти параметры могут изменяться как в большую, так и в меньшую сторону.
Сочетание классической ВЭЖХ и FL-детектора позволяет реализовать несколько методик определения микотоксинов, обладающих достаточно высоким пределом обнаружения. Возможность варьирования условий разделения (включая различные компоненты подвижной фазы и их соотношений, ее рН, скоростей потока элюэн-
Таблица 2. Частоты детектирования и пределы обнаружения микотоксинов при детектировании FL-детектором
Стабильность микотоксинов применительно к методу ВЭЖХ
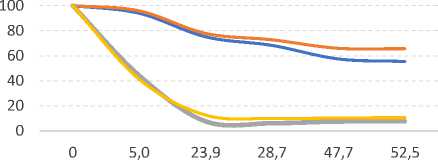
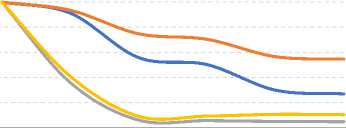
Определенную проблему представляет стабильность обнаруживаемых методами ВЭЖХ микотоксинов. Экстракция и элюирование, как правило, проводятся одним и тем же растворителем. Известно, что классические растворители в обращенно-фазовой хроматографии негативно влияют на растворенные микотоксины, приводя к их деградации и снижению концентрации. На степень деградации влияют время нахождения микотоксинов в растворителе, температура и экспозиция светом. Эмпирические данные, отражающие динамику их определяемой концентрации [15], показывают, что влияние этих факторов даже внутри одной группы токсинов не единообразно (рис. 2).
- - B1 ^^^^^^^^^^^ B2 G1 ^^^^^^^^ш G2
0,0 4,6 23,5 28,4 47,3 52,2
i B1 ^^^^^^^^ш B2 ^^^^^^^^ш G1 ^^^^^^^^^^^ G2
б)
а)
- - B1 ^^^^^^^^™ B2 ^^^^^^^^™ G1 ^^^^^^^^ш G2
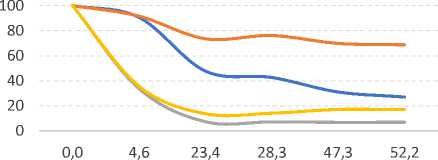
i B1 ^^^^^^^^ш B2 ^^^^^^^^ш G1 ^^^^^^^^™ G2
в)
г)
Рис. 2. Динамика концентрации микотоксинов группы афлатоксинов в растворах при различных условиях хранения в зависимости от времени хранения (часы):
-
а) ацетонитрил/вода (50/50), 22°С, темнота;
-
б) ацетонитрил/вода (50/50), 22°С, свет;
-
в) метанол/вода (50/50), 22°С, темнота;
-
г) метанол/вода (50/50), 22°С, свет.
Колебания в сторону превышения предыдущих концентраций являются следствием усреднения значений концентрации нескольких проб и несовершенства детектора.
Источник: Beaver R.W. Degradation of aflatoxins in common HPLC solvents. Journal of High Resolution Chromatography, 1990, vol. 13, no. 12, pp. 833–835.
Без учета этого фактора определение становится неточным. Классическая хроматография работает с давлениями внутри колонки в диапазоне от 20 до 40 Мпа, что увеличивает время анализа. Для группы афлатоксинов, как мы указали выше, максимальное время удержания равняется приблизительно 23 минутам. Таким образом, последние пробы в серии содержат заведомо более низкие концентрации определяемых веществ по причине деградации их в растворителе. Этот эффект необходимо учитывать в процессе анализа.
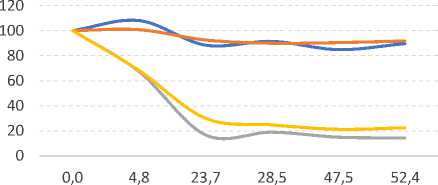
Частично снизить степень деградации микотоксинов в ожидающих пробах мож- но за счет охлаждения проб до температур замерзания экстракционной смеси. При температуре –18°С экстрагированные метанолом токсины остаются относительно стабильными для проведения анализа, но недостаточно – для хранения готовых проб (рис. 3).
Аналогичные результаты представлены в работе M. Kiseleva [et al.]. Они доказывают стабильность всей группы афлатоксинов в чистых органических растворителях (метанол) при соблюдении условий хранения [16].
С целью снижения степени деградации возможно применение других раствори-

0,0 4,8 23,9 28,7 47,7 52,2
- - B1 ^^^^^^^^^^^ B2 ^^^^^^^^^^^ G1 ^^^^^^^^ш G2
Рис. 3. Динамика изменения концентрации афлатоксинов в смеси метанола и воды (50:50) при температуре -18°С (часы)
Источник: Beaver R.W. Degradation of aflatoxins in common HPLC solvents.Journal of High Resolution Chromatography, 1990, vol. 13, no. 12, pp. 833–835.
телей. В смесях бензола и ацетонитрила (в соотношении 98:2) афлатоксины стабильны в течение многих лет при условии хранения в темноте и холоде. Аналогично в смесях ацетонитрила и воды (50:50) при рН < 7 не обнаруживается существенного снижения концентрации афлатоксинов. В работе G. Diaz [et al.] показано, что деградация афлатоксинов может быть связана с влиянием воды в составе смеси растворителей, а также с их адсорбцией на поверхности стеклянной виалы, и предложен способ снижения влияния этого фактора путем обработки стеклянных виал 50% азотной кислотой6 [17]. Результаты испытаний стабильности афлатоксинов представлены в табл. 3, 4. Хороший результат дает также силанизация – обработка поверхности виал силанизирующими агентами (триметилхлорсилан, диметил-дихлорсилан, дисилазаны).
Комбинируя различные способы предотвращения деградации, выбирая отвечающие требованиям растворители и их смеси, мы получаем возможность минимизировать ошибку оценки содержания микотоксинов (в частности – афлатоксинов) в исследуемых образцах. Также открывается возможность долговременного
Таблица 3. Стабильность афлатоксинов в смесях растворителя и воды с различным соотношением компонентов при комнатной температуре с 24-часовой экспозицией
|
% растворителя |
Растворитель |
0 часов |
24 часа |
%a |
|
AFB1,нг/г |
||||
|
20 |
ACN |
5.0 ± 0.35 c |
4.31 ± 0.26 d |
86 |
|
MeOH |
5.0 ± 0.38 c |
3.70 ± 0.26 d |
74 |
|
|
40 |
ACN |
5.0 ± 0.39 c |
4.58 ± 0.30 c |
92 |
|
MeOH |
5.0 ± 0.20 c |
4.43 ± 0.16 d |
89 |
|
|
60 |
ACN |
5.0 ± 0.22 c |
4.78 ± 0.20 c |
96 |
|
MeOH |
5.0 ± 0.09 c |
4.75 ± 0.09 c |
95 |
|
|
100 |
ACN |
5.0 ± 0.47 c |
5.08 ± 0.46 c |
102 |
|
MeOH |
5.0 ± 0.07 c |
4.78 ± 0.06 c |
96 |
|
|
AFB2,нг/г |
||||
|
20 |
ACN |
1.5 ± 0.10 c |
1.35 ± 0.05 c |
90 |
|
MeOH |
1.5 ± 0.18 c |
1.17 ± 0.09 d |
78 |
|
|
40 |
ACN |
1.5 ± 0.11 c |
1.39 ± 0.08 c |
93 |
|
MeOH |
1.5 ± 0.09 c |
1.38 ± 0.04 c |
92 |
|
|
60 |
ACN |
1.5 ± 0.05 c |
1.42 ± 0.06 c |
95 |
|
MeOH |
1.5 ± 0.02 c |
1.46 ± 0.03 c |
97 |
|
|
100 |
ACN |
1.5 ± 0.14 c |
1.51 ± 0.12 c |
101 |
|
MeOH |
1.5 ± 0.02 c |
1.46 ± 0.02 c |
97 |
|
|
AFG1,нг/г |
||||
|
20 |
ACN |
5.0 ± 0.37 c |
1.43 ± 0.37 d |
29 |
|
MeOH |
5.0 ± 0.41 c |
1.02 ± 0.10 d |
20 |
|
|
40 |
ACN |
5.0 ± 0.34 c |
1.50 ± 0.27 d |
30 |
|
MeOH |
5.0 ± 0.22 c |
1.89 ± 0.17 d |
38 |
|
|
60 |
ACN |
5.0 ± 0.20 c |
2.28 ± 0.18 d |
46 |
|
MeOH |
5.0 ± 0.11 c |
2.53 ± 0.14 d |
51 |
|
|
100 |
ACN |
5.0 ± 0.47 c |
4.94 ± 0.40 c |
99 |
|
MeOH |
5.0 ± 0.06 c |
4.73 ± 0.06 c |
95 |
|
|
AFG2,нг/г |
||||
|
20 |
ACN |
1.5 ± 0.09 c |
0.58 ± 0.07 d |
39 |
|
MeOH |
1.5 ± 0.07 c |
0.48 ± 0.04 d |
32 |
|
|
40 |
ACN |
1.5 ± 0.09 c |
0.57 ± 0.07 d |
38 |
|
MeOH |
1.5 ± 0.07 c |
0.74 ± 0.05 d |
49 |
|
|
60 |
ACN |
1.5 ± 0.04 c |
0.80 ± 0.06 d |
53 |
|
MeOH |
1.5 ± 0.02 c |
1.07 ± 0.25 d |
71 |
|
|
100 |
ACN |
1.5 ± 0.13 c |
1.52 ± 0.11 c |
101 |
|
MeOH |
1.5 ± 0.02 c |
1.46 ± 0.02 c |
97 |
|
|
a – соответствует доле афлатоксина в %, остающегося после 24-часовой экспозиции; c, d – средние значения и стандартное отклонение в трех повторах, индексы показывают степень различия в парах 0–24 часа (индексы с-с – несущественная, индексы c-d – значительная). Источник: Diaz G.J., Cepeda S.M., Martos P.A. Stability of aflatoxins in solution. Journal of AOAC International, 2012, vol. 95, no. 4, pp. 1084–1088. |
||||
Таблица 4. Стабильность афлатоксинов в смесях растворителя и воды с различным соотношением компонентов при температуре 5°С с 24-часовой экспозицией
Выводы
Метод классической жидкостной хроматографии имеет большой потенциал при выявлении как минимум некоторых групп микотоксинов, обладая высокой чувствительностью и позволяя производить точное количественное определение.
Несмотря на некоторые недостатки (как, например, требования к квалификации персонала, использование специализированных и дорогостоящих средств очистки и концентрирования исходной пробы, ограничения, связанные с собственной природой микотоксинов), хроматографическое определение данной группы веществ с флу-ориметрическим детектированием следует расценивать как важный и показательный метод. При соблюдении порядка пробопод-готовки результат такого определения имеет высокую репрезентативность.
Нужно принимать во внимание, что в статье подробно разбирается лишь метод классической жидкостной хроматографии с FL-детектированием дериватов микотоксинов. Однако внутри самого метода можно выделить два блока операций, влияющих на результат определения:
-
1) хроматографическое разделение на нормально- или обращенно-фазовой колонке;
-
2) детектирование веществ, прошедших разделение.
Различные сочетания хроматографических колонок и подвижной фазы, а также применение градиентной элюции позволяют существенно улучшить разделение микотоксинов. Переход от классической хроматографии к ультравысокоэффективной (УВЭЖХ, UHPLC) с давлением 60–130 МПа повышает качество разделения и на порядок снижает время разделения. В зависимости от длины привитого радикала можно существенно варьировать условия и качество разделения в обоих методах.
Детектирование также можно производить множеством способов. Одним из наиболее перспективных и широко распро- страненных в настоящее время стал метод масс-спектрометрии в различных реализациях. Подобные детекторы позволяют значительно повысить пределы обнаружения и чувствительность метода, получить возможность определять не только группу афлатоксинов, охратоксин и зеарале-нон. Практически все микотоксины могут быть определены на системе ВЭЖХ/МС (УВЭЖХ/МС) с различными вариантами масс-спектрометрического детектора.
Таким образом, метод ВЭЖХ с FL-детектированием, а также в сочетании с другими методами детектирования следует считать, наравне с другими распространенными методами, уместным в практике проведения научных исследований и, с определенными ограничениями, в практике коммерческого анализа, а благодаря возможностям масштабирования блочные системы ВЭЖХ можно адаптировать для анализа практически любых микотоксинов.
Список литературы Применимость метода флуориметрического детектирования и классической жидкостной хроматографии при определении микотоксинов в различных матрицах
- Kolawole O. [et al.]. Low doses of mycotoxin mixtures below EU regulatory limits can negatively affect the performance of broiler chickens: A longitudinal study. Toxins, 2020, vol. 12, no. 7.
- Betina V. Production, isolation, separation and purification. In: Betina V. [ed.]. Mycotoxins. Elsevier Science Publishers BV, Amsterdam, Netherlands, 1984, pp. 183–215.
- Berthiller F. [et al.]. Chromatographic methods for the simultaneous determination of mycotoxins and their conjugates in cereals. International Journal of Food Microbiology, 2007, vol. 119, no. 1–2, pp. 33–37.
- Саркисов А.Х. Микотоксикозы (грибковые отравления). М.: Сельхозгиз, 1954. 215 p.
- The Cambridge World History of Human Disease. Ed. Kiple K.F. Cambridge University Press, 1993.
- McElhinney C. [et al.]. Mycotoxins in farm silages – a 2-year Irish national survey. Grass and Forage Science, 2016, vol. 71, no. 2, pp. 339–352.
- Rasmussen R.R. [et al.]. Multi-mycotoxin analysis of maize silage by LC-MS/MS. Analytical and Bioanalytical Chemistry, 2010, vol. 397, no. 2, pp. 765–776.
- Kosicki R. [et al.]. Multiannual mycotoxin survey in feed materials and feedingstuffs. Animal Feed Science and Technology, 2016, vol. 215, pp. 165–180.
- Streit E. [et al.]. Mycotoxin occurrence in feed and feed raw materials worldwide: long-term analysis with special focus on Europe and Asia. Journal of the Science of Food and Agriculture, 2013, vol. 93, no. 12, pp. 2892–2899.
- Ellis W.O. [et al.]. Aflatoxins in food: Occurrence, biosynthesis, effects on organisms, detection, and methods of control. Critical Reviews in Food Science and Nutrition, 1991, vol. 30, no. 4, pp. 403–439.
- Kok W.T. Derivatization reactions for the determination of aflatoxins by liquid chromatography with fluorescence detection. Journal of Chromatography. B, Biomedical Sciences and Applications, 1994, vol. 659, no. 1–2, pp. 127–137.
- Davis N.D., Diener U.L. Confirmatory test for the high pressure liquid chromatographic determination of aflatoxin B1. Journal of AOAC International, 1980, vol. 63, no. 1, pp. 107–109.
- Sedova I., Kiseleva M., Tutelyan V. Mycotoxins in tea: Occurrence, methods of determination and risk evaluation. Toxins, 2018, vol. 10, no. 11, pp. 444.
- NC M.-R. [et al.]. Mutagens and carcinogens called aflatoxins and their hydroxylated metabolites in food for domestic cats. Biochem. Anal. Biochem. OMICS Publishing Group, 2018, vol. 7, no. 04.
- Beaver R.W. Degradation of aflatoxins in common HPLC solvents. Journal of High Resolution Chromatography, 1990, vol. 13, no. 12, pp. 833–835.
- Kiseleva M. [et al.]. Stability of mycotoxins in individual stock and multi-analyte standard solutions. Toxins, 2020, vol. 12, no. 2, p. 94.
- Diaz G.J., Cepeda S.M., Martos P.A. Stability of aflatoxins in solution. Journal of AOAC International, 2012, vol. 95, no. 4, pp. 1084–1088.


