Присутствие внеклеточных везикул фолликулярного происхождения в среде созревания донорских ооцитов коров повышает их способность к эмбриональному развитию in vitro
Автор: Сингина Г.Н., Шедова Е.Н., Uzbekov R., Чинаров Р.Ю., Луканина В.А., Uzbekova S.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вспомогательные репродуктивные технологии
Статья в выпуске: 6 т.58, 2023 года.
Бесплатный доступ
Технология получения эмбрионов in vitro (in vitro embryo production, IVEP) с использованием ооцитов, выделенных посредством трансвагинальной пункции фолликулов (ovum-pickup, OPU) позволяет получать большее число потомков от лучших матерей и все чаще используется в скотоводстве в программах по тиражированию и сохранению ценных генотипов. Для повышения эффективности OPU/IVEP-технологии в представленной работе мы впервые культивировали OPU-ооциты коров в присутствии внеклеточных везикул (extracellular vesicles, EVs) из фолликулярной жидкости (ФЖ) яичников коров и определили способность таких ооцитов к эмбриональному развитию in vitro после экстракорпорального оплодотворения. Цель работы заключалась в изучении влияния EVs на OPU-ооциты коров с точки зрения их созревания и последующей способности развиваться до стадии бластоцисты, а также устойчивости полученных бластоцист к замораживанию. EVs из ФЖ выделяли методом дифференциального центрифугирования и ультрацентрифугирования при 100000 g. Образцы проанализировали с использованием трансмиссионной электронной микроскопии, которая подтвердила, что в выделенных препаратах присутствуют EVs, соответствующие по размерам экзосомам. Донорами ооцитов были половозрелые телки ярославской породы ( n = 6) с естественным половым циклом. OPU проводили 2 раза в неделю. Для созревания выделенные ооциты культивировали в среде ТС-199, дополненной фетальной бычьей сывороткой (10 %), фолликулостимулирующим и лютеинизирующим (10 мкг/мл) гормонами, эпидермальным фактором роста (10 нг/мл) в отсутствие (контроль) или в присутствии EVs (опыт). Везикулярный белок добавляли в среду in vitro созревания (in vitro maturation, IVM) в физиологической концентрации (на 1 мл среды - количество EVs, выделенное из 1 мл ФЖ). Через 24 ч созревания ооциты подвергали экстракорпоральному оплодотворению и культивированию для эмбрионального развития. На 3-и сут после оплодотворения изучали морфологию раздробившихся оплодотворенных ооцитов, на 7-е сут культивирования определяли число эмбрионов, развившихся до стадии бластоцисты (Бл). Полученные Бл замораживали, некоторое время хранили при -196 °С, после чего размораживали и культивировали до стадии вылупления, определяя жизнеспособность эмбрионов. Всего провели 10 независимых экспериментов. Число ооцитов в контроле и опыте было одинаковым и составило соответственно 57 и 56 клеток. Мы не выявили влияния условий культивирования на завершение ядерного созревания. Доля созревших ооцитов была сходной в обеих группах и составила в контроле и опыте соответственно 90,4±5,6 и 94,3±3,1 %. Также присутствие EVs в среде IVM не изменяло долю раздробившихся ооцитов после оплодотворения in vitro, которая составила 78,6±7,3 и 86,7±4,9 % соответственно для контроля и опыта. Тем не менее обнаружено положительное влияние EVs на развитие созревших ооцитов до стадии Бл. При культивировании OPU-ооцитов в контрольной среде выход Бл составлял 26,6±5,81 %. Введение EVs в среду IVM повышало этот показатель до 41,2±3,2 % (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Внеклеточные везикулы, фолликулярная жидкость, ооциты коров, in vitro созревание, эмбриональное развитие
Короткий адрес: https://sciup.org/142240681
IDR: 142240681 | УДК: 636.2:591.39 | DOI: 10.15389/agrobiology.2023.6.1100rus
Текст научной статьи Присутствие внеклеточных везикул фолликулярного происхождения в среде созревания донорских ооцитов коров повышает их способность к эмбриональному развитию in vitro
Биотехнологии, направленные на получение эмбрионов от живых доноров и их трансплантацию животным-реципиентам, широко используются в скотоводстве для увеличения числа потомков от лучших матерей с целью более полной реализации их генетического потенциала в последующих поколениях и ускорения генетического прогресса в селекции у крупного рогатого скота (КРС) (1, 2).
Получают эмбрионы либо in vivo, используя технологию множественной овуляции и трансплантации эмбрионов (Multiple Ovulation and embryo transfer, MOET), либо in vitro. В случае MOET суть подхода заключается в индукции суперовуляции у коров-доноров посредством гормональной обработки, их искусственного осеменения с последующим вымыванием эмбрионов и пересадкой свежих либо заморожено-оттаянных эмбрионов реципиентам (1). Технология получения эмбрионов in vitro (in vitro embryo production, IVEP), в свою очередь, включает выделение женских половых клеток (ооцитов), их созревание и оплодотворение in vitro, а также последующее культивирование образовавшихся зигот до эмбриональных стадий, пригодных к заморозке и трансплантации (2). Выделяют ооциты из фолликулов яичников живых коров и телок чаще всего методом трансвагинальной пункции фолликулов (ovum pick up, OPU). В отличие от MOET, OPU можно проводить многократно и в течение сравнительно длительного времени (3, 4). Кроме того, для выделения ооцитов из фолликулов необязательно проводить гормональную стимуляцию яичников, а следовательно, процедуру можно повторять через более короткие интервалы времени (как правило, два или один раз в неделю) по сравнению с получением эмбрионов in vivo (не чаще одного раза в 2 мес). Согласно статистике последних лет, число in vivo эмбрионов, используемых на практике для трансплантации реципиентам, находится примерно на одном уровне (5, 6), а полученных in vitro (in vitro production, IVP) — продолжает увеличиваться со среднегодовым темпом роста 12 % (7). Связано это, в первую очередь, с тем обстоятельством, что технология IVEP, предусматривающая использование донорских OPU-ооцитов (OPU/IVEP-технология), стала в настоящее время альтернативой традиционной программе получения эмбрионов in vivo (6) и все чаще используется в коммерческих целях во многих странах (7, 8).
Важным условием для практического использования OPU/IVEP-технологии остается ее эффективность, которая, несомненно, если сравнивать ретроспективно, существенно повысилась в последние годы, но тем не менее уступает по ряду показателей MOET. В первую очередь, речь идет о снижении качества получаемых с использованием OPU-ооцитов эмбрионов и устойчивости OPU/IVEP-эмбрионов к замораживанию, а также о снижении их жизнеспособности после трансплантации по сравнению c таковыми, полученными in vivo (9-11). Продолжение исследований по оптимизации этапов OPU/IVEP-технологии и выявлению факторов, влияющих на ее эффективность, позволит решить эту проблему.
Как известно, эффективность OPU/IVEP-технологии в первую очередь определяется качеством ооцитов перед процедурой экстракорпорального оплодотворения, приобретаемым ими в процессе созревания in vitro (in vitro maturation, IVM) (12, 13). При этом условия IVM все еще остаются субоптимальными и требуют усовершенствования.
В рутинных практиках репродуктивных биотехнологий КРС in vitro созревание ооцитов коров проводят в оптимизированных средах, содержащих, как минимум, ростовые факторы типа ЕGF и сыворотку зародышей коров (14), и также используют коммерческие бессывороточные среды. При разработке бессывороточных сред, исходно менее эффективных, использовали различные компоненты (гормоны, аминокислоты, антиоксиданты, жирные кислоты, витамины, ионы металлов и различные биологические препараты), добавление которых бы могло положительно повлиять на цитоплазматическое созревание яйцеклетки и увеличить число и качество бластоцист in vitro, способных развиться в жизнеспособный плод (15, 16). Тем не менее качество OPU-ооцитов, созревающих in vitro, как правило, в маленьких группах, обычно ниже, чем в культуре с большим числом ооцит-кумулюсных комплексов (ОКК), обычно от 25 до 50 в 0,5 мл среды. Также OPU-ооциты, полученные от некоторых коров, зачастую окружены меньшим количеством клеток кумулюса (КК), что может снизить результаты созревания in vitro (в первую очередь цитоплазматического). Добавление в среду IVM 5 % фолликулярной жидкости (ФЖ), являющейся оптимальной средой для созревания ооцитов, повышает их способность к эмбриональному развитию in vitro, особенно в культуре индивидуальных ооцитов (17). Кроме гормональных и стероидных составляющих ФЖ, продукты секреции фолликулярных клеток и плазматические производные содержатся во внеклеточных везикулах (extracellular vesicles, EVs), в частности в нановезикулах диаметром 30-150 нм, называемых экзосомами. Такие EVs содержат различные регуляторные факторы, участвующие в молекулярном диалоге ооцита с фолликулярными клетками, и в первую очередь, c клетками куму-люса. EVs, сконцентрированные в фолликулярной жидкости, поглощаются целевыми клетками через межклеточные соединения и трансзональные проекции между ооцитом и окружающими его КК (18, 19). EVs ФЖ коров содержат различные белки (20), липиды (21) и нуклеиновые кислоты, в том числе микроРНК, регулирующие экспрессию генов в таргетных клетках, в частности в ооците (22, 23). Эти компоненты необходимы для развития ооцита и формирования его способности к последующему эмбриональному развитию. Везикулярные факторы ФЖ вовлечены в регуляцию сигнальных путей, контролирующих развитие фолликула и ооцита в нем, служат медиаторами реакции клеток на гормональные и экологические стрессы, а также влияют на созревание ооцитов. In vitro, EVs из ФЖ усиливают пролиферацию фолликулярных гранулозных клеток, повышают осуществляемый ими синтез стероидов, увеличивают экспансию кумулюса, уменьшают апоптоз в КК и ооцитах и влияют на активацию различных сигнальных путей в ОКК (22). EVs ФЖ при добавлении в среду IVM улучшают эффективность IVEP и качество эмбрионов у коров in vitro (24, 25) и положительно влияют на развитие и выживание эмбрионов в условиях термического стресса у коров (25). Хотя механизмы этих эффектов изучены далеко не полностью, они включают регуляцию с помощью микроРНК функций специфических белков и липидов, которые опосредуют молекулярные сигналы в ооцитах и КК и таким образом влияют на процесс созревания ооцитов.
В представленной работе мы впервые исследовали влияние EVs ФЖ, добавленных в среду созревания, на способность OPU-ооцитов коров к эмбриональному развитию in vitro.
Цель работы заключалась в изучении влияния EVs ФЖ коров на созревание OPU-ооцитов в процессе IVM и на их последующую способность развиваться in vitro до стадии бластоцисты. Также оценивали влияние тестируемых условий на устойчивость полученных бластоцист к замораживанию.
Методика . В работе применяли реагенты фирмы «Sigma-Aldrich» (США) (за исключением специально указанных случаев).
Для выделения EVs полученные с мясокомбината яичники коров доставляли в лабораторию на льду. Далее их освобождали от окружающих тканей и отмывали в стерильном физиологическом растворе, который был предварительно охлажден до +4 °С и содержал антибиотики (100 МЕ/мл пенициллина и 50 мкг/мл стрептомицина; «БиоФармГарант», Россия). Для получения EVs ФЖ отсасывали из антральных фолликулов диаметром 3-6 мм и центрифугировали 15 мин при +20 °С и 300 g для удаления соматических клеток. Все последующие центрифугирования проводили также при температуре +20 °С. Далее супернатант повторно центрифугировали 15 мин при 2000 g для удаления апоптотических телец размером 1-5 мкм. Третье центрифугирование (15 мин при 12000 g) было проведено для удаления крупных микровезикул размером 200-1000 нм. После этой предварительной очистки ФЖ EVs осаждали ультрацентрифугированием в течение 90 мин при 100000 g (центрифуга CS 150 NX, «Hitachi», Япония). Супернатант разводили стерильным фосфатно-солевым буфером (ФСБ) (pH 7,4) и повторно центрифугировали 90 мин при 100000 g для более полного выделения EVs. Осадки двух ультрацентрифугирований объединяли и разводили ФСБ. Из полученных образцов отбирали две аликвоты по 5 мкл. Одну из аликвот использовали для определения количества EVs по концентрации белка на приборе Qubit™ 4 Fluorometer с использованием набора Qubit Protein Assay Kit («Thermo Fisher Scientific», США) и белкового стандарта Qubit с концентрацией от 0,125 до 5 мг/мл. Вторую аликвоту использовали для уль-траструктурного анализа препарата частиц с помощью трансмиссионной электронной микроскопии (ТЭМ), для чего ее смешивали с равным объемом 2 % раствора глутарового альдегида (качество для электронной микроскопии, ЭМ) на ФСБ («Agar Scientific, Ltd.», Великобритания) и фиксировали в течение 1 ч при комнатной температуре. По 2 мкл фиксированных образцов EVs наносили на никелевые ЭМ сеточки («Agar Scientific, Ltd.», Великобритания), покрытые формваровой пленкой с углеродным напылением, и инкубировали 60 мин во влажной камере. Далее сеточки с осажденными на поверхность пленки EVs промывали дистиллированной водой для удаления солей, содержащихся в ФСБ. Для этого на поверхность пленки 3 раза наносили каплю объемом 10 мкл, через 10 с ее удаляли, касаясь фильтровальной бумаги краем сеточки. Негативное контрастирование 2 % водным раствором уранилацетата («Electron Microscopy Science», США) проводили аналогичным образом (3 раза по 10 с), удаляя каплю раствора касанием краем сеточки фильтровальной бумаги. После удаления последней капли сеточку сушили на воздухе. Для ультраструктурного исследования использовали трансмиссионный электронный микроскоп JEOL 1011 («JEOL, Ltd.», Япония). Образцы фотографировали с помощью цифровой камеры GATAN RIO 9 с использование программы DigitalMicrograph3 («Gatan, Inc.», США). По результатам электронно-микроскопического анализа устанавливали наличие EVs в полученных образцах и оценивали их морфологию.
Концентрацию EVs определяли с использованием аппарата анализа наночастиц ZetaView («Particle-Metrix», Германия), откалиброванного контрольными частицами размером 100 нм. Препараты EVs из ФЖ коров разводили в соотношении с 1:1000 до 1:5000 в стерильном ФСБ (фильтр 0.1 мкм) и исследовали в режиме лазерного ( X = 488 нм) измерения, используя 1 мл разведенного препарата. Концентрацию рассчитывали с помощью специализированной программы ZetaView (версия 8.05.14 SP7).
При получении IVEP эмбрионов c использованием OPU-технологии донорами ооцитов были половозрелые клинически здоровые телки ( Bos taurus ) ярославской породы ( n = 6) в возрасте 3,2-3,5 года. Рационы доноров были сбалансированы по энергии, питательным и биологически активным веществам в соответствии с нормами потребностей животных. OPU выполняли 2 раза в неделю с интервалом 3 или 4 сут.
Трансвагинальную пункцию фолликулов проводили, используя систему для OPU, в комплект которой входил ультразвуковой сканер Versana
Active с конвекциональным широкополосным зондом (частота 5 МГц) и держателем зонда («GE HealthCare», США), а также вакуумный насос («Mini-tube», Германия). Животных индивидуально фиксировали в станке и выполняли эпидуральную анестезию 2 % раствором новокаина. Видимые фолликулы аспирировали иглой, соединенной силиконовым шлангом с центрифужной пробиркой объемом 50 мл. В качестве аспирационной использовали среду в модификации Дюльбекко с добавлением 10 % фетальной бычьей сыворотки (ФБС) («Биолот», Россия) и гепарина (18 МЕ/мл). Аспираты от каждого донора (1 сессия OPU) фильтровали индивидуально, промывали ФСБ, дополненным 1 % ФБС («Биолот», Россия), после чего под стереомикроскопом («Nikon», Япония) искали ооциты и переносили их в чашки Петри со средой ТС-199, содержащей 5 % ФБС и 50 мкг/мл гентамицина (ТС-199М).
Общий пул собранных от каждого донора ооцитов промывали трижды в ТС-199М, после чего разделяли по морфологическим критериям на три категории качества — хорошего, среднего и плохого. К хорошим по качеству относили ооциты с гомогенной цитоплазмой, окруженные более чем одним слоем компактного кумулюса, к средним — ооциты с гомогенной или умеренно гетерогенной цитоплазмой, с одним слоем кумулюсных клеток (КК) или частично окруженные КК, к плохим — ооциты, имеющие неоднородную цитоплазму с признаками грануляции или лизиса, голые клетки, а также созревшие ооцит-кумулюсные комплексы (ОКК). Пригодными для дальнейшей работы считались только ооциты хорошего и среднего качества.
Отобранные ооциты хорошего и среднего качества объединяли и культивировали группами (4-8 ооцитов) в каплях среды объемом 200 мкл, нанесенных на дно лунки 4-луночного планшета («Биомедикал», Россия) и полностью покрытых минеральным маслом. В контроле в качестве среды IVM использовали ТС-199 с ФБС (10 %), пируватом натрия (0,5 мМ), фолликулостимулирующим гормоном (10 мкг/мл), лютеонизирующим гормоном (10 мкг/мл), эпидермальным фактором роста (20 нг/мл) и гентамицином (50 мкг/мл). В опыте к этой среде добавляли EVs в физиологической концентрации, то есть к 1 мл среды IVM добавляли везикулярный белок, выделенный из 1 мл фолликулярной жидкости. Культивирование проводили в инкубаторе (MCO-18AIC, «Sanyo», Япония) при 38,5 ° С и 5 % СО 2 в атмосфере. Через 24 ч созревания ооциты подвергали процедуре экстракорпорального оплодотворения, как описано ранее (26).
Для экстракорпорального оплодотворения соломинки с замороженной спермой быка ярославской породы размораживали, активные сперматозоиды получали методом swim-up, применяя среду Sperm-TALP (27), как описано ранее (28). Выделенные сперматозоиды, добавляли к среде оплодотворения с предварительно перенесенными туда ОКК, так чтобы концентрация сперматозоидов составила 1,5½106 на 1 мл.
Половые клетки совместно культивировали в течение 10-11 ч, затем ооциты отделяли от КК и налипших сперматозоидов и оценивали морфологически. Выявляли наличие у ооцитов полярных телец (ПП) и таким образом определяли процент созревания (долю ооцитов с ПП к общему числу ооцитов). Очищенные оплодотворенные яйцеклетки переносили в среду BO-IVC («IVF Bioscience», Великобритания) для развития эмбрионов. Культивирование происходило в инкубаторе (MCO-50M-PE, «Sanyo», Япония) при температуре 38,5 °С и газовой атмосфере, содержащей 5 % СО2, 5 % О2 и 90 % N2, в каплях среды BO-IVC объемом 100 мкл, нанесенных на дно лунки 4-луночного планшета («Nunc», Дания). Через 3 сут после опло- дотворения ооцитов проводили смену среды и морфологическую оценку раздробившихся зигот, на 7-е сут культивирования оценивали число эмбрионов, развившихся до стадии бластоцисты.
Полученные бластоцисты замораживали с использованием автоматизированного программного замораживателя CL-8800 («Cryologic», Австралия) в 1,5 М растворе этиленгликоля («IVM Technologies», Франция), после чего хранили в парах жидкого азота не менее 1 мес. Для оценки жизнеспособности эмбрионы размораживали и культивировали в среде BO-IVC («IVF Bioscience», Великобритания), дополненной 5 % ФБС, в течение 3 сут до стадии вылупления.
Оценку дробления, развития до стадии бластоцисты и вылупившейся бластоцисты проводили под стереомикроскопом («Nikon», Япония). В некоторых случаях развивающиеся in vitro эмбрионы фотографировали, используя микроскоп Eclipse Ti-U («Nikon», Япония).
Статистическую обработку данных проводили методом однофакторного дисперсионного анализа в программе SigmaStat («Systat Software, Inc.», США). Данные выражали как средние значения ( M ) и стандартные ошибки средних (±SEM). Достоверность различий сравниваемых средних значений оценивали с использованием критерия Тьюки (p не более 0,05).
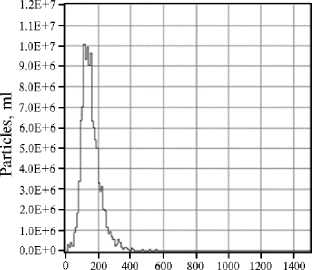
Результаты . Препараты, обогащенные внеклеточными нановезикулами, были получены в результате последовательных центрифугирований ФЖ, выделенной из антральных фолликулов размером 3-6 мм. Выделение завершалось ультрацентрифугированием при 100000 g и отмывкой излишнего белка с помощью ФСБ. Такие препараты, разведенные в фосфатном буфере, содержали EVs, по размеру относящиеся к экзосомам (29, 30), а также кластеры липопротеинов (рис. 1, А). В препаратах, приготовленных таким образом, содержание общего белка составило 31,18±4,4 мкг в расчете на 1 мл ФЖ. Концентрация EVs в расчете на 1 мл ФЖ составляла 2.4-4.5½1012 со средним размером частиц 132,4-135,9 нм (см. рис. 1, Б).
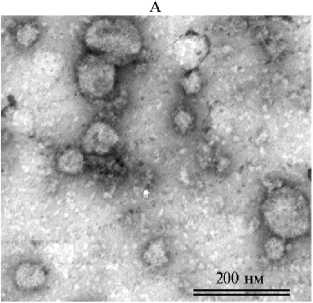
Рис. 1. Анализ пула внеклеточных везикул (EVs) , выделенных из фолликулярной жидкости (ФЖ) антральных фолликулов коров: А — препарат EVs (трансмиссионная электронная микроскопия, JEOL 1011, «JEOL, Ltd.», Япония); Б — график распределения размеров (diameter) и концентрации частиц (particles) в разведенном препарате EVs из ФЖ яичников коров (Лаборатория клеточной биологии и электронной микроскопии Медицинского факультета Турского университета, 2022 год).
Б
Diameter, nm
Всего за 34 сессии OPU аспирировали 321 УЗИ-видимый фолликул, из этих фолликулов выделили 156 ооцитов разного качества. После морфологической оценки ооциты хорошего и среднего качества культивировали c целью созревания либо в контрольной среде IVM, либо в среде, содержащей EVs. Из таблицы 1 видно, что группы имели сопоставимые показатели как по эффективности процедуры OPU (число аспирированных фолликулов на одну сессий OPU и доля извлеченных ооцитов от числа аспирированных фолликулов), так и по качеству используемых для исследования ооцитов (доля ооцитов хорошего и среднего качества, то есть пригодных для культивирования, от общего числа выделенных ооцитов).
-
1. Выделение и оценка качества OPU-ооцитов телок ( Bos taurus ) ярославской породы в контрольной и опытной (EVs) группах (ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, 2023 год)
Показатель
Контроль
EVs
Число сессий OPU, N
18
16
Аспирированно фолликулов, n
164
157
Число аспирированных фолликулов на 1 сессию OPU, n
9,11
9,81
Общее число выделенных ооцитов, n
80
76
Доля извлечения ооцитов от числа аспирированных фолликулов, %
55,7±7,2
53,3±7,3
Доля ооцитов хорошего качества от общего числа выделенных ооцитов, %
33,3±7,3
32,5±8,7
Доля ооцитов среднего качества от общего число выделенных ооцитов, %
39,6±5,2
46,7±8,8
Доля пригодных для культивирования ооцитов от общего числа выделенных, %
72,9±4,3
79,3±5,5
Примечани е. Контрольная и опытная группы — среда in vitro созревания
соответственно
без или с
внеклеточными везикулами (EV) из фолликулярной жидкости коров.
-
2. Способность к эмбриональному развитию после оплодотворения in vitro OPU-ооцитов телок ( Bos taurus ) ярославской породы при воздействии внеклеточных везикул (EVs) из фолликулярной жидкости в среде созревания (ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, 2023 год)
Результаты созревания и эмбрионального развития OPU-ооцитов представлены в таблице 2.
Показатель КонтрольEVs
Число повторов, N 1010
Число ооцитов, n 5756
Доля созревших ооцитов, % 90,4±5,6 94,3±3,1
Доля раздробившихся ооцитов, % 78,6±7,3 86,7±4,9
Доля ооцитов, развившихся до стадии бластоцисты, % 26,6±5,8 41,2±3,2*
Примечани е. Контроль — среда для in vitro созревания IVM.
* Различия с контролем статистически значимы при p < 0,05.
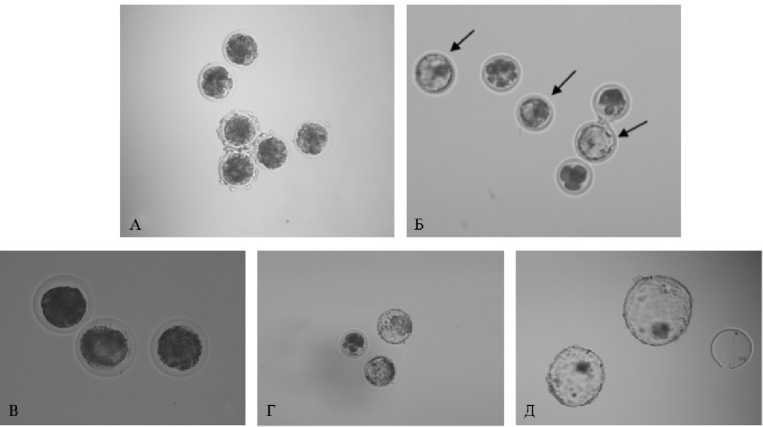
Рис. 2. Эмбрионы крупного рогатого скота ( Bos taurus ) ярославской породы, развившиеся после in vitro оплодотворения OPU-ооцитов: А — раздробившиеся ооциты; Б — эмбрионы, развившиеся до стадии бластоцисты (Бл, отмечены стрелками); В — замороженные Бл непосредственно после процедуры размораживания (увеличение ½200); Г — размороженные Бл через 24 ч культивирования; Д — размороженные Бл, достигшие стадии вылупления через 3 сут культивирования. Микроскоп Eclipse Ti-U, «Nikon», Япония (увеличение ½100 за исключением указанного для В) (ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, 2023 год).
Присутствие EVs в среде IVM не влияло на ядерное созревание OPU-ооцитов. Процент созревания (доля ооцитов с ПП) оказался равно высоким в обеих группах (более 90 %). Также мы не выявили влияния везикул на способность созревших в их присутствии ооцитов вступать в первое деление дробления (рис. 2, А). Доля раздробившихся яйцеклеток после экстракорпорального оплодотворения была выше 70 %. Тем не менее обнаружено положительное влияние EVs из ФЖ на развитие созревших и оплодотворенных in vitro ооцитов до стадии бластоцисты (см. рис. 2, Б). При культивировании OPU-ооцитов в контрольной среде IVM выход бластоцист составил 26,6±5,8 %. Введение EVs в среду IVM повышало этот показатель в 1,5 раза (p < 0,05). Как следствие, в расчете на одну сессию OPU в опыте получили 1,37 бластоцисты против 0,77 в контроле.
Мы также определили долгосрочные эффекты присутствия EVs ФЖ в среде созревания ооцитов, используя тест на устойчивость развившихся из них бластоцист к замораживанию. При исследовании выживаемости бластоцист после процедуры замораживания-размораживания было обнаружено позитивное влияние препаратов везикул на созревающие ооциты (табл. 3). Воздействием EVs во время созревания OPU-ооцитов было обусловлено увеличение (хотя и недостоверное) доли вылупившихся бластоцист (см. рис. 2, Д), что, вероятно, стало следствием повышения их жизнеспособности и/или потенциала к развитию, наблюдаемого до замораживания.
3. Влияние внеклеточных везикул (EVs) из фолликулярной жидкости в среде созревания OPU-ооцитов телок ( Bos taurus ) ярославской породы на жизнеспособность заморожено-оттаянных бластоцист после кратковременного культивирования in vitro (ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Группа |
Число |
Доля вылупившихся |
|
повторов, N 1 бластоцист, n |
бластоцист, % |
Контроль (среда для in vitro созревания IVM) 10 14 29,1±8,8
EVs (IVM + EVs) 10 22 53,3±9,2*
* Различия с контролем: p = 0,081.
Внеклеточные везикулы представляют собой покрытые мембраной секреторные гранулы, присутствие которых обнаружено во всех типах биологических жидкостей (18), в том числе в жидкости из фолликулов яичников самок, которая является естественным окружением ооцитов при их развитии in vivo. Показано, что EVs активно участвуют в межклеточных коммуникациях внутри фолликула, так как они секретируются клетками и способны переносить свое содержимое в другие клетки за счет способности последних их поглощать (18, 19). В связи с этим EVs активно изучаются как потенциальные регуляторы качества ооцитов (в том числе, у коров) и их компетенции к эмбриональному развитию в условиях in vitro (24, 25, 31-33).
К настоящему времени показано, что внесение EVs в среду IVM post mortem ооцитов коров увеличивает выход бластоцист с 26 % (контроль) до 37 % (32), а также повышает качество эмбрионов (24). Кроме того, установлено, что EVs могут улучшать функциональное состояние зрелых ооцитов, повышая их устойчивость к возрастным трансформациям (34), а также защищая их от стресса (25).
В представляемой работе объектом исследования служили ооциты коров, выделенные из фолликулов яичников индивидуальных доноров методом OPU. Насколько нам известно, это первое исследование, в котором OPU-ооциты культивировали с целью созревания в отсутствие (контроль) или в присутствии EVs, после чего оплодотворяли in vitro и культивировали до стадии бластоцисты. При этом мы изучали не только влияние EVs на созревание OPU-ооцитов и их развитие до стадии бластоцисты, но также устойчивость полученных бластоцист к замораживанию-оттаиванию. Выделенные из ФЖ антральных фолликулов (диаметр 3-6 мм) EVs, согласно общепринятой классификации (29, 30), представляли собой по размеру экзо-сомы (см. рис. 1, А, Б). Их присутствие в среде созревания не влияло на ядерное созревание OPU-ооцитов и их способность после оплодотворения вступать в первое деление дробления (см. табл. 2). Тем не менее мы показали, что EVs, выделенные из ФЖ яичников коров, во время созревания ооцитов могут улучшать развитие эмбрионов in vitro. При воздействии EVs доля ооцитов, достигших стадии Бл, увеличивалась по сравнению с контролем с 26 до 42 %, что было даже несколько выше, чем в исследованиях других авторов на post mortem ооцитах коров (32). Кроме того, присутствие EVs в среде IVM, возможно, имеет долгосрочный эффект, так как обнаружилась тенденция к повышению жизнеспособности полученных Бл после процедуры замораживания-размораживания. На наш взгляд, статистическая недостоверность при определении характера влияния EVs в среде IVM на криоустойчивость Бл может быть связана с присутствием в среде фетальной сыворотки крупного рогатого скота. О негативном влиянии некоторых компонентов ФБС ранее сообщалось в аналогичных исследованиях по использованию EVs, выделенных из сред, кондиционированных эпителиальными клетками яйцевода (35).
Таким образом, использование внеклеточных везикул EVs из фолликулярной жидкости (ФЖ) яичников коров в процедуре in vitro созревания (IVM) улучшает качество ооцитов и, как следствие, их компетенцию к эмбриональному развитию после экстракорпорального оплодотворения. Следовательно, препараты, обогащенные внеклеточными везикулами из ФЖ коров, могут быть применены на этапе экстракорпорального созревания яйцеклеток для более эффективного получения высококачественных эмбрионов крупного рогатого скота с помощью OPU/IVEP технологии.
Список литературы Присутствие внеклеточных везикул фолликулярного происхождения в среде созревания донорских ооцитов коров повышает их способность к эмбриональному развитию in vitro
- Mapletoft R.J. History and perspectives on bovine embryo transfer. Animal Reproduction, 2013, 10(3): 168-173.
- Sirard M.A. 40 years of bovine IVF in the new genomic selection context. Reproduction, 2018, 156(1): 1-7 (doi: 10.1530/REP-18-0008).
- Qi M., Yao Y., Ma H., Wang J., Zhao X., Liu L., Tang X., Zhang L., Zhang S., Sun F. Trans-vaginal ultrasound-guided Ovum Pick-up (OPU) in cattle. Journal of Biomaterials and Tissue Engineering, 2013, 18: Article 118 (doi:10.4172/1662-100X.1000118).
- Boni R. Ovum pick-up in cattle: A 25 yr retrospective analysis. Animal Reproduction, 2012, 9(3): 362-369.
- Viana J. 2019 Statistics of embryo production and transfer in domestic farm animals. Embryo Technology Newsletter, 2020, 38(4): 7-26.
- Viana J. 2021 Statistics of embryo production and transfer in domestic farm animals. Embryo Technology Newsletter, 2022, 38(4): 22-40.
- Ferré L.B., Kjelland M.E., Strøbech L.B., Hyttel P., Mermillod P., Ross P.J. Review: Recent advances in bovine in vitro embryo production: reproductive biotechnology history and methods. Animal, 2020, 14(5): 991-1004 (doi: 10.1017/S1751731119002775).
- Sanches B.V., Zangirolamo A.F., Seneda M.M. Intensive use of IVF by large-scale dairy pro-grams. Animal Reproduction, 2019, 16(3): 394-401 (doi: 10.21451/1984-3143-AR2019-0058).
- Ashry M., Smith G.W. Application of embryo transfer using in vitro produced embryos: intrinsic factors affecting efficiency. Cattle Practice: Journal of the British Cattle Veterinary Association, 2015, 23(Pt. 1): 1-8.
- Ferré L.B., Kjelland M.E., Taiyeb A.M., Campos-Chillon F., Ross P.J. Recent progress in bovine in vitro-derived embryo cryotolerance: impact of in vitro culture systems, advances in cryopres-ervation and future considerations. Reproduction in Domestic Animals, 2020, 55(6): 659-676 (doi: 10.1111/rda.13667).
- Marsico T.V., de Camargo J., Valente R.S., Sudano M.J. Embryo competence and cryosurvival: Molecular and cellular features. Animal Reproduction, 2019, 16(3): 423-439 (doi: 10.21451/1984- 3143-AR2019-0072).
- Thompson J.G., Lane M., Gilchrist R.B. Metabolism of the bovine cumulus-oocyte complex and influence on subsequent developmental competence. Society of Reproduction and Fertility Supple-ment, 2007, 64: 179-190 (doi: 10.5661/rdr-vi-179).
- Wrenzycki C., Stinshoff H. Maturation environment and impact on subsequent developmental competence of bovine oocytes. Reproduction in Domestic Animals, 2013, 48(1): 38-43 (doi: 10.1111/rda.12204).
- Mingoti G.Z., Castro V.S., Méo S.C., Sά Barreto L.S., Garcia J.M. The effects of macromolec-ular and serum supplements and oxygen tension during bovine in vitro procedures on kinetics of oocyte maturation and embryo development. In Vitro Cellular & Developmental Biology. Animal, 2011, 47: 361-367 (doi: 10.1007/s11626-011-9400-0).
- Lonergan P., Fair T. Maturation of oocytes in vitro. Annual Review of Animal Biosciences, 2016, 4: 255-268 (doi: 10.1146/annurev-animal-022114-110822).
- Luciano A.M., Franciosi F., Barros, R.G., Dieci C., Lodde V. The variable success of in vitro maturation: can we do better? Animal Reproduction, 2018, 15: 727-736 (doi: 10.21451/1984-3143-AR2018-0021).
- Peixoto de Souza V., Jensen J., Whitler W., Estill C.T., Bishop C.V. Increasing vitamin D levels to improve fertilization rates in cattle. Journal of Animal Science, 2022, 100(7): Article skac168 (doi: 10.1093/jas/skac168).
- Raposo G., Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends. Journal of Cell Biology, 2013, 200(4): 373-383 (doi: 10.1083/jcb.201211138).
- Record M., Carayon K., Poirot M., Silvente-Poirot S. Exosomes as new vesicular lipid transport-ers involved in cell-cell communication and various pathophysiologies. Biochimica et Biophysica Acta, 2014, 1841(1): 108-120 (doi: 10.1016/j.bbalip.2013.10.004).
- Uzbekova S., Almiñana C., Labas V., Teixeira-Gomes A.P., Combes-Soia L., Tsikis G., Car-valho A.V., Uzbekov R., Singina G. Protein cargo of extracellular vesicles from bovine follicular fluid and analysis of their origin from different ovarian cells. Frontiers in Veterinary Science, 2020, 7: Article 584948 (doi: 10.3389/fvets.2020.584948).
- Maugrion E., Shedova E.N, Uzbekov R., Teixeira-Gomes A.P., Labas V., Tomas D., Banliat C., Singina G.N., Uzbekova S. Extracellular vesicles contribute to the difference in lipid composition between ovarian follicles of different size revealed by mass spectrometry imaging. Metabolites, 2023, 13: Article 1001 (doi: 10.3390/metabo13091001).
- Tesfaye D., Hailay T., Salilew-Wondim D., Hoelker M., Bitseha S., Gebremedhn S. Extracellular vesicle mediated molecular signaling in ovarian follicle: Implication for oocyte developmental competence. Theriogenology, 2020, 150: 70-74 (doi: 10.1016/j.theriogenology.2020.01.075).
- Hailay T., Hoelker M., Poirier M., Gebremedhn S., Rings F., Saeed-Zidane M., Salilew-Wondim D., Dauben C., Tholen E., Neuhoff C., Schellander K., Tesfaye D. Extracellular vesicle-coupled miRNA profiles in follicular fluid of cows with divergent post-calving metabolic status. Scientific Reproduction, 2019, 9(1): Article 12851 (doi: 10.1038/s41598-019-49029-9).
- Asaadi A., Dolatabad N.A., Atashi H., Raes A., Van Damme P., Hoelker M., Hendrix A., Pascottini O.B., Van Soom A., Kafi M., Pavani K.C. Extracellular vesicles from follicular and ampullary fluid isolated by density gradient ultracentrifugation improve bovine embryo develop-ment and quality. International Journal of Molecular Sciences, 2021, 22(2): Article 578 (doi: 10.3390/ijms22020578).
- Rodrigues T.A., Tuna K.M., Alli A.A., Tribulo P., Hansen P.J., Koh J., Paula-Lopes F.F. Fol-licular fluid exosomes act on the bovine oocyte to improve oocyte competence to support devel-opment and survival to heat shock. Reproduction, Fertility, and Development, 2019, 31(5): 888-897 (doi: 10.1071/RD18450).
- Singina G.N., Chinarov R.Yu., Lukanina V.A., Voroshbit T.A. The effect of prolactin on the quality of heifer oocytes retrieved by transvaginal puncture of follicles. Sel'skokhozyaistvennaya Biologiya [Agricultural Biology], 2021, 56(6): 1148-1155 (doi: 10.15389/agrobiology.2021.6.1148eng).
- Parrish J.J. Bovine in vitro fertilization: in vitro oocyte maturation and sperm capacitation with heparin. Theriogenology, 2014, 81(1): 67-73 (doi: 10.1016/j.theriogenology.2013.08.005).
- Singina G.N. Change of culture medium positively influences the development and quality of in vitro cattle embryos. Sel'skokhozyaistvennaya Biologiya [Agricultural Biology], 2022, 57(6): 1197-1207 (doi: 10.15389/agrobiology.2022.6.1197eng).
- Kowal J., Arras G., Colombo M., Jouve M., Morath J.P., Primdal-Bengtson B., Dingli F., Loew D., Tkach M., Théry C. Proteomic comparison defines novel markers to characterize het-erogeneous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sci-ences of the United States of America, 2016, 113(8): E968-E977 (doi: 10.1073/pnas.1521230113).
- Pavani K.C., Hendrix A., Van Den Broeck W., Couck L., Szymanska K., Lin X., De Koster J., Van Soom A., Leemans B. Isolation and characterization of functionally active extracellular ves-icles from culture medium conditioned by bovine embryos in vitro. International Journal of Mo-lecular Sciences, 2018, 20(1): 38 (doi: 10.3390/ijms20010038).
- Hung W.-T., Navakanitworakul R., Khan T., Zhang P., Davis J.S., McGinnis L.K., Christen-son L.K. Stage-specific follicular extracellular vesicle uptake and regulation of bovine granulosa cell proliferation. Biology of Reproduction, 2017, 97(4): 644-655 (doi: 10.1093/biolre/iox106).
- da Silveira J.C., Andrade G.M., Del Collado M., Sampaio R.V., Sangalli J.R., Silva L.A., Pin-affi F.V.L., Jardim I.B., Cesar M.C., Nogueira M.F.G., Cesar A.S.M., Coutinho L.L., Pe-reira R.W., Perecin F., Meirelles F.V. Supplementation with small-extracellular vesicles from ovarian follicular fluid during in vitro production modulates bovine embryo development. PLoS ONE, 2017, 12(6): e0179451 (doi: 10.1371/journal.pone.0179451).
- Giacomini E., Makieva S., Murdica V., Vago R., Viganó P. Extracellular vesicles as a potential diagnostic tool in assisted reproduction. Current Opinion in Obstetrics and Gynecology, 2020, 32(3): 179-184 (doi: 10.1097/GCO.0000000000000621).
- Shedova E.N., Singina G.N., Uzbekova S. Uzbekov R., Lukanina V.A., Tsyndrina E.V. Effect of extracellular vesicles of follicular origin during in vitro maturation and ageing of bovine oocytes on embryo development after in vitro fertilization. Sel'skokhozyaistvennaya Biologiya [Agricultural Biology], 2022, 57(6): 1178-1187 (doi: 10.15389/agrobiology.2022.6.1178eng)
- Lopera-Vásquez R., Hamdi M., Fernandez-Fuertes B., Maillo V., Beltrán-Breña P., Calle A., Redruello A., López-Martín S., Gutierrez-Adán A., Yañez-Mó M., Ramirez M.Á., Rizos D. Ex-tracellular vesicles from BOEC in in vitro embryo development and quality. PLoS ONE, 2016, 11(2): e0148083 (doi: 10.1371/journal.pone.0148083.


