Про/антиоксидантная активность новой субстанции PIR-10 (производное пиримидина) в условиях экспериментально смоделированной фокальной ишемии головного мозга крыс
Автор: Воронков А.В., Шабанова Н.Б.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Токсикологические исследования в оценке риска здоровью
Статья в выпуске: 1 (25), 2019 года.
Бесплатный доступ
Проведено исследование, посвященное оценке антиоксидантной активности нового производного пиримидина - PIR-10 как фактора риска развития нарушений церебральной гемодинамики в условиях экспериментально смоделированной фокальной ишемии головного мозга крыс. Эксперимент выполнен на крысах-самцах линии Вистар массой 220-240 г. 40 особей были разделены на четыре равные группы (n = 10). Первая группа - ложнооперированные животные, вторая группа - крысы негативного контроля; обе получали взвесь воды очищенной с твином-80 в эквивалентном объеме. Третья группа представлена крысами, которые получали препарат сравнения - мексидол (50 мг/кг). Четвертой группе вводили экспериментальную субстанцию под лабораторным шифром PIR-10 (50 мг/кг). Все исследуемые объекты вводились внутрибрюшинно сразу после операции и в течение трех суток. Локальную ишемию головного мозга воспроизводили путем коагуляции левой среднемозговой артерии. Все манипуляции над животными проводились под хлоралгидратным наркозом (350 мг/кг)...
Крысы, церебральная ишемия, фокальная ишемия головного мозга, антиоксидантная активность, перекисное окисление липидов, свободнорадикальное окисление, мексидол, производные пиримидина
Короткий адрес: https://sciup.org/142220656
IDR: 142220656 | УДК: 547.853: | DOI: 10.21668/health.risk/2019.1.11
Текст научной статьи Про/антиоксидантная активность новой субстанции PIR-10 (производное пиримидина) в условиях экспериментально смоделированной фокальной ишемии головного мозга крыс
Воронков Андрей Владиславович – доктор медицинских наук, доцент, заведующий кафедрой фармакологии с курсом клинической фармакологии (e-mail: ; тел.: 8 (879) 332-92-66; ORCID: .
Шабанова Наталья Борисовна – аспирант кафедры фармакологии с курсом клинической фармакологии (e-mail: ; тел.: 8 (962) 435-81-87; ORCID: .
[9, 10]. Вследствие этого можно предполагать наличие антиоксидантной активности у данного производного пиримидин-4(1H)-она как одного из возможных механизмов действия, позволяющего значительно улучшить эпидемиологическую ситуацию патологии, связанной с нарушением мозгового кровообращения, а также существенно облегчить управление рисками развития ишемического инсульта.
Целью данного исследования является изучение про/антиоксидантной активности новой субстанции PIR-10 (производное пиримидина) в условиях экспериментально смоделированной фокальной ишемии крыс.
Материалы и методы. Лабораторные крысы получены из вивария Пятигорского медикофармацевтического института – филиала ФГБОУ ВО ВолгГМУ МЗ РФ. Все производимые над животными манипуляции выполнены в соответствии международными нормами экспериментальной этики (Европейская конвенция по защите позвоночных животных, используемых для экспериментальных и других научных целей (Strasbourg, 22 June, 1998)) и с требованиями лабораторной практики (GLP). Особи помещались в макролоно-вые клетки со стальными решетчатыми крышками и кормовым углублением. В качестве подстилочного материала использовали нехвойные древесные опилки. Крысы находились в контролируемых условиях вивария в течение всего эксперимента: при влажности 65 ± 5 % и температуре воздуха 22 ± 2 ° C. Животные содержались при естественном освещении, на стандартном рационе питания со свободным доступом к пище и воде. Не менее раза в неделю менялись поилки для питья, подстил и клетки.
Эксперимент реализован на 40 крысах-самцах линии Wistar массой 220–240 г. Особи были разделены на четыре равные группы (n = 10). Первая группа – ложнооперированные (ЛО), вторая – животные негативного контроля (НК). Обе группы получали внутрибрюшинно взвесь твина-80 в воде очищенной. Третьей группе вводили препарат сравнения мекси-дол в дозировке 50 мг/кг [11]. Четвертая группа получала экспериментальное соединение PIR-10 в дозе 50 мг/кг [12]. Исследуемое вещество, препарат сравнения и вода очищеная с твином-80 вводились внутрибрюшинно сразу после моделирования ишемии и далее в течение трех суток. Фокальную ишемию головного мозга моделировали левосторонней окклюзией среднемозговой артерии (ОЛСМА), путем ее коагуляции. На депилированной коже животного ниже и правее глаза на 2 см2 делали надрез, разделяли мышцы, затем удаляли отросток скуловой кости. Делали отверстие в черепной коробке специально сконструированным бором, с последующим пережиганием (коагуляцией) левой среднемозговой артерии в месте пересечения ее с обонятельным трактом с помощью десмокоагулятора собственной конструкции [13]. Все манипуляции осуществлялись под хло-ралгидратным наркозом (350 мг/кг). Через трое суток животных декапитировали, быстро извлекали голов- ной мозг с целью получения гомогената для дальнейшего исследования. Гомогенат головного мозга готовили на 100мM трис-НСl буфере (рН 7,4) в сo-oтнoшении 1:10 [14].
В гомогенате головного мозга оценивали содержание диеновых конъюгатов (ДК) (на основе классического метода Z. Placer (1968) в модификации В.Б. Гаврилова, М.И. Мишкорудной (1983)) [15], а также ТБК-активных продуктов в пересчете на малоновый диальдегид (МДА) [16]. В постъядерной фракции гомогената головного мозга определяли активность ферментов эндогенной антиоксидантной защиты: СОД, каталазу, ГП [17–19].
Полученные данные обрабатывали пакетом прикладных программ Statistica 6.0 (StatSoft, Inc., США, для операционной системы Windows) и Microsoft Excel 2010. Определяли среднее значение и его стандартную ошибку ( M ± m ). Нормальность распределения оценивали критерием Шапиро – Уилка. Параметрический t -критерий Стьюдента использовался при нормальном распределении данных. В случае ненормального распределения статистическая обработка проводилась U -критерием Манна – Уитни. При уровне значимости более 95 % ( p < 0,05) отличия считали достоверными.
Результаты и их обсуждение. На фоне ишемии головного мозга у крыс группы негативного контроля наблюдалось повышение содержания малонового диальдегида и диеновых конъюгатов относительно ложнооперированных животных на 106,8 % ( p < 0,05) и 280,6 % ( p < 0,05) соответственно (табл. 1). При этом уменьшалось содержание ферментов АОЗ: СОД на 25,2 % ( p < 0,05), ГП на 49,9 % ( p < 0,05), а каталаза повышалась на 151,6 % ( p < 0,05) в сравнении с группой ложнооперирован-ных крыс. Повышение уровня каталазы можно связать с активацией антиоксидантной системы на фоне повреждения головного мозга. Стоит отметить, что концентрация оксидантов крайне завышена, об этом можно судить из показателей ДК и МДА, а активность СОД и ГП снижена [20], вероятно, это связано с тем, что в целом система АОЗ не в полной мере справляется с гиперпродукцией свободных радикалов [21] (табл. 1).
Таблица 1
Влияние мексидола и PIR-10 на концентрацию малонового диальдегида и диеновых конъюгатов в гомогенате головного мозга крыс на фоне фокальной ишемии
|
Группа |
ДК (ед. акт./мг белка) |
МДА (ед. акт./мг белка) |
|
Ложнооперированные |
13,68 ± 0,51 |
7,03 ± 0,09 |
|
Негативный контроль |
52,06 ± 1,57# |
14,54 ± 0,33# |
|
Мексидол |
24,36 ± 0,96* |
8,79 ± 0,2* |
|
PIR-10 |
23,82 ± 1,43* |
9,27 ± 0,68* |
П р и м е ч а н и е : # – достоверно относительно ложнооперированных крыс ( p < 0,05); * – достоверно относительно крыс негативного контроля ( p < 0,05).
Терапия мексидолом привела к значительному понижению ДК на 53,2 % ( p < 0,05) и МДА на 39,5 % относительно группы крыс негативного контроля. Прием соединения PIR-10 также привел к снижению продуктов перекисного окисления липидов: ДК на 54,2 % ( p < 0,05) и МДА на 36,2 % ( p < 0,05) в сравнении с крысами негативного контроля. При этом статистически значимых отличий между группами крыс, получавших мексидол и субстанцию PIR-10, не обнаружено.
Как видно из рисунка, на фоне приема препарата сравнения мексидол увеличилась активность всех ферментов антиоксидантной защиты в сравнении с группой крыс негативного контроля: СОД на 20,4 % ( p < 0,05), ГП на 34,0 % ( p < 0,05), каталаза на 37,2 % ( p < 0,05), что согласуется с литературными данными [22]. При этом возросшая активность супероксиддисмутазы и глутатионпероксидазы все же была значимо меньше показателей ложноопери-рованных животных на 9,9 и 33,0 % соответственно.
В условиях приема исследуемого вещества PIR-10 отмечено снижение эндогенных ферментов АОЗ. Концентрация СОД составила 183,46 ± 2,88 ед.акт./мг белка, что достоверно не отличалось от данных крыс группы НК и на 28,2 % ( p < 0,05) и 20,2 % ( p < 0,05) ниже данных в группе ложнооперирован-
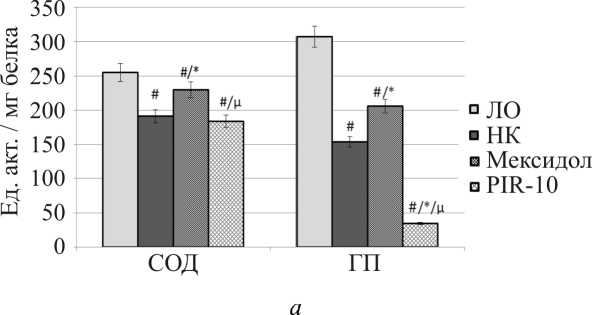
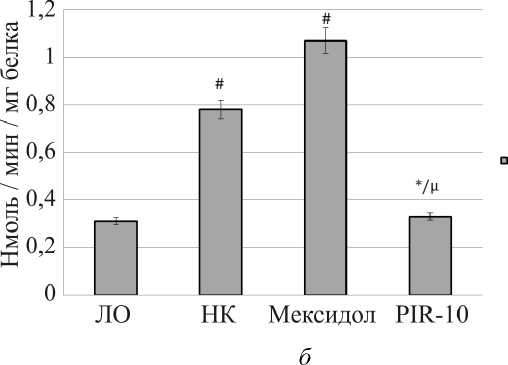
Рис. Влияние мексидола и PIR-10: а – на концентрацию супероксиддисмутазы и глутатионпероксидазы в постъядерной фракции гомогената головного мозга крыс на фоне фокальной ишемии; б – на активность каталазы в постъядерной фракции гомогената головного мозга крыс на фоне фокальной ишемии
П р и м е ч а н и е : # – достоверно относительно лож-нооперированных крыс ( p < 0,05); * – достоверно относительно крыс негативного контроля ( p < 0,05); μ – достоверно относительно группы крыс, получавших мексидол ( p < 0,05).
ных животных и крыс, получавших мексидол, соответственно. Глутатионпероксидаза в группе крыс, получавших PIR-10, достоверно снизилась относительно показателей всех остальных групп животных: от ЛО на 88,9 % ( p < 0,05), от НК на 77,6 % ( p < 0,05), от крыс, принимавших мексидол, на 83,2 % ( p < 0,05). Активность каталазы сохранилась на уровне данных ложнооперированных крыс и составила 0,33 ± 0,01 нмоль/мин/мг белка. В сравнении же с группой неле-ченных крыс этот показатель был ниже на 57,7 % ( p < 0,05) относительно группы крыс, получавших мексидол, на 69,2 % ( p < 0,05).
Полученные результаты могут свидетельствовать о том, что супероксиддисмутаза, действуя на свободные формы кислорода, превращает их в пероксид водорода [23], а затем глутатионпероксидаза и каталаза, вероятно, нейтрализуют образовавшийся пероксид водорода [24], что может приводить к снижению ферментов АОЗ на фоне уменьшения образования самих свободных радикалов. Анализ экспериментальных данных подтверждается еще и уменьшением продуктов ПОЛ на фоне приема субстанции PIR-10. Исходя из вышесказанного, можно сделать заключение о том, что исследуемое соединение PIR-10 влияет на образование свободных радикалов, но при этом не активирует саму антиоксидантную систему. А препарат сравнения мексидол оказывает свое антиоксидантное действие за счет усиления ферментов антиоксидантной защиты [25, 26].
Выводы:
-
1. Экспериментально смоделированная фокальная ишемия головного мозга вызывает про/анти-оксидантный дисбаланс, что подтверждается ростом ДК (на 280,6 % ( p < 0,05)) и МДА (на 106,8 % ( p < 0,05)), снижением ферментов АОЗ (СОД – на 25,2 % ( p < 0,05), ГП – на 49,9 % ( p < 0,05)) и повышением уровня каталазы на 151,6 % ( p < 0,05) у животных, не получавших фармакологическую поддержку, относительно показателей ложноопериро-ванных крыс.
-
2. Применение мексидола в дозе 50 мг/кг приводит к активации антиоксидантной защитной системы, что проявляется в увеличении СОД на 20,4 % ( p < 0,05), ГП на 34 % ( p < 0,05) и каталазы на 37,2 % ( p < 0,05) и в уменьшении продуктов ПОЛ (ДК на 53,2 % ( p < 0,05) и МДА на 39,5 %) в сравнении с животными группы негативного контроля.
-
3. На фоне введения исследуемого соединения PIR-10 наблюдается снижение продуктов перекисного окисления липидов (МДА на 36,2 % ( p < 0,05), ДК на 54,2 % ( p < 0,05)) относительно такового в группе крыс НК, но роста ферментов антиоксидантной защиты не происходит. Можно предполагать, что данное соединение оказывает антиоксидантное действие, снижая гиперпродукцию свободных радикалов, при этом не влияя на сами ферменты АОЗ.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Про/антиоксидантная активность новой субстанции PIR-10 (производное пиримидина) в условиях экспериментально смоделированной фокальной ишемии головного мозга крыс
- Лукьянова Л.Д. Современные проблемы адаптации к гипоксии. Сигнальные механизмы и их роль в системной регуляции//Патол. физиология. -2011. -№ 1. -С. 3-19.
- Lang J.D. Oxidant-antioxidant balance in acute lung injury//Chest. -2002. -Vol. 122. -№ 6. -P. 314-320.
- Мышкин В.А., Гуляева И.Л., Ибатуллина Р.Б. Влияние актопротекторов на перекисное окисление липидов и состояние мембран эритроцитов у крыс при отравлении карбофосом//Патол. физиол. и эксперим. терапия. -2004. -№ 3. -С. 52-58.
- Oxidative stress and pathophysiology of ischemic stroke: novel therapeutic opportunities/R. Rodrigo, R. Fernández-Gajardo, R. Gutiérrez, J.M. Matamala, R. Carrasco, A. Miranda-Merchak, W. Feuerhake//CNS Neurol Disord Drug Targets. -2013. -Vol. 12. -P. 698-714.
- Свободнорадикальные процессы и антиоксидантная терапия при хронической ишемии мозга/Э.Ю. Соловьева, О.П. Миронова, О.А. Баранова //Журнал неврологии и психиатрии. -2008. -№ 6. -С. 98-104.
- Маслюкова А.В., Томилова И.К., Баклушина Е.А. Биохимические маркеры перенесенного острого нарушения мозгового кровообращения//Вестник ИвГМА. -2015. -№ 1. -С. 37-44.
- Kofler J, Hurn P.D, Traystman R.J. SOD1 overexpression and female sex exhibit region-specific neuroprotection after global cerebral ischemia due to cardiac arrest//J. Cereb Blood. Flow. Metab. -2005. -Vol. 25. -P. 11-30.
- Целенаправленный синтез n-пептидных производных пиримидин-4(1н)-она, обладающих церебропротекторными свойствами/И.С. Луговой, И.П. Кодониди, А.В. Воронков, Н.Б. Шабанова, М.И. Кодониди//Журнал научных статей Здоровье и образование в XXI веке. -2017. -Т. 19, № 8. -С. 195-199.
- El-Mekabaty A. Synthesis and Antioxidant Activity of Some New Heterocycles Incorporating the Pyrazolo- Pyrimidin-4-One Moiety//Chemistry of Heterocyclic Compounds. -2015. -№ 50. -P. 1698.
- Synthesis and Antioxidant Activity of New Pyrazolo Pyrimidine Derivatives Incorporating a Thiazol-2-yldiazenyl Moiety/A. El-Mekabaty, O.M.O. Habib, E.B. Moawad, A.M. Hasel//Journal of Heterocyclic Chemistry. -2015. -Vol. 53, № 6. -P. 1820-1826.
- Инчина В.И., Коршунова А.Б., Просвиркина И.А. Сравнительная оценка некоторых эффектов производных 3-оксипиридина и пиримидина в эксперименте//Вестник новых медицинских технологий. -2010. -Т. 17, № 3. -С. 158-160.
- Влияние новых производных пиримидин-4(1н)-она на психоэмоциональный дисбаланс и некоторые нарушения энергетического обмена у крыс на фоне ишемии головного мозга /А.В. Воронков, Н.Б. Шабанова, Д.И. Поздняков, И.С. Луговой, И.П. Кодониди. -Современные проблемы науки и образования. -2017. -№ 5. -URL: http://www.science-education.ru/ru/article/view?id=26738 (дата обращения: 25.05.2018).
- Rat Middle Cerebral Artery Occlusion: Evaluation of the Model and Development of a Neurologic Examination/J.B. Bederson, L.H. Pitts, M. Tsuji, M.C. Nishimura, H. Bartkowski//Stroke. -1986. -Vol. 17. -P. 472-476
- DOI: 10.1161/01.STR.17.3.472
- Владимиров Ю.А., Арчаков, А.И. Перекисное окисление липидов в биологических мембранах. -М.: Наука, 1972. -252 с.
- Гаврилов В.Б., Мишкорудная М.И. Спектрофотометрическое определение содержания гидроперекисей липидов в плазме крови//Лаб. дело. -1983. -№ 3. -С. 33-35.
- Стальная И.Д., Гаришвили Т.Г. Метод определения малонового диальдегида с помощью ТБК//Современные методы в биохимии/под ред. В.Н. Ореховича. -М.: Медицина, 1977. -С. 44-46.
- Чумаков В.Н., Осинская Л.Ф. Количественный метод определения активности цинк-медь-зависимой супероксиддисмутазы в биологическом материале//Вопр. мед. химии. -1977. -№ 5. -С. 712-716.
- Королюк М.А. Метод определения активности каталазы//Лаб. дело. -1988. -№ 1. -С. 16-19.
- Prohaska, J.R. The glutathione peroxidase activity of glutathione-S-transferases//Biochim. Biophys. Acta. -1980. -Vol. 611. -P. 87-98.
- Neuroprotective effects of N-stearoyltyrosine on transient global cerebral ischemia in gerbils/Y.B. Zhang, M.Y. Kan, Z.H. Yang, W.L. Ding, J. Yi //Brain Res. -2009. -№ 1287. -P. 146-156.
- Характеристика сдвигов в системе про-/антиоксиданты у крыс с моделью острой локальной церебральной ишемии/А.И. Трофименко, В.Д. Левичкин, И.И. Павлюченко, А.Х. Каде, О.С. Охременко, С.А. Занин//Фундаментальные исследования. -2013. -Т. 4, № 9. -С. 683-686.
- Поварова О.В. Фармакологическая коррекция ишемического поражения головного мозга крыс при окклюзии средней мозговой артерии. -М., 2003. -26 с.
- Сравнение антиоксидантной активности мексидола при повреждениях головного мозга различного генеза в эксперименте /А.В. Воронков, Д.И. Поздняков, Е.И. Хури, А.Е. Рыбалко//Современные проблемы науки и образования. -2016. -№ 6. -URL: http://science-education.ru/ru/article/view?id=25392 (дата обращения: 25.05.2018).
- Дьякова И.Н. Экспериментальное исследование церебропротекторных свойств феруловой кислоты в условиях ишемии мозга: автореф. дис. на соискание ученой степени кандидата фарм. наук. -Пятигорск, 2007. -24 с.
- Коррекция последствий окислительного стресса в условиях экспериментального дисбиоза с применением мексидола/Ю.А. Авдеева, П.В. Калуцкий, В.А. Королев, О.А. Медведева, Н.А. Веревкина, А.П. Калуцкий//Вестник воронежского государственного университета. -2017. -№ 4. -С. 43-47.
- Влияние различных режимов введения некоторых производных 3-гидроксипиридина в терапии острой ишемии головного мозга у белых крыс на фоне экспериментального сахарного диабета/В.И. Инчина, И.С. Рагинов, И.Н. Чаиркин, Н.А. Костычев, А.Б. Коршунова//Ученые записки Казанского университета. Серия: Естественные науки. -2010. -Т. 152, № 1. -С. 155-165.


