Прогностическое значение параметров Т2* МР-перфузии в оценке выживаемости больных глиобластомой головного мозга
Автор: Ребрикова В.А., Солодкий В.А., Сергеев Н.И., Цаллагова З.С., Котляров П.М., Нуднов Н.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая диагностика
Статья в выпуске: 4 т.22, 2022 года.
Бесплатный доступ
Использование данных МР-перфузии в качестве прогностического маркера является перспективным, но недостаточно изученным направлением в нейроонкологии, что и послужило стимулом к выполнению данной работы. Объектом исследования были выбраны 47 больных: 26 женщин (55,3%) и 21 мужчина (44,7%), в возрасте 26-89 лет, с подтверждённым диагнозом глиобластома WHO Grade IV, обследованные и пролеченные в ФГБУ РНЦРР в период 2018- 2021 гг. У всех больных перед ЛТ по данным МРТ с Т2* перфузией в остаточной опухоли были определены основные перфузионные параметры и рассчитаны их относительные значения (rCBV; rCBF; rMTT). Сравнение выживаемости больных в зависимости от показателей Т2* перфузии в остаточных фрагментах первичной опухоли до начала ЛТ проводилось с помощью лог-рангового критерия. Для анализа выживаемости использован метод Каплан-Мейера. Время наблюдения варьировало от 3 до 42 месяцев. В результате была выявлена определённая тенденция в виде преимущества выживаемости больных с признаками гипоперфузии в остаточной опухоли; так продолжительность жизни была дольше и число летальных исходов меньше при относительно невысоких значения МР-перфузии: rCBV ≤ 3,30, rCBF ≤ 2,02, rMTT ≤ 1,10. Выявлена положительная корреляция между низкими значениями скорости церебрального кровотока rCBF и ВБП.
Глиобластома головного мозга, выживаемость, мрт, т2* мр-перфузия
Короткий адрес: https://sciup.org/149142267
IDR: 149142267
Текст научной статьи Прогностическое значение параметров Т2* МР-перфузии в оценке выживаемости больных глиобластомой головного мозга
Котляров Петр Михайлович – д.м.н., профессор, руководитель лаборатории лучевой диагностики заболеваний (включая заболевания молочной железы) научно-исследовательского отдела комплексной диагностики заболеваний и радиотерапии ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, SPIN-код: 1781-2199, Author ID: 194339, ORCID:
Нуднов Николай Васильевич – д.м.н., профессор, руководитель научно-исследовательского отдела комплексной диагностики заболеваний и радиотерапии, заместитель директора по научной работе ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, Author ID: 7004927053, ORCID:
Специфическими особенностями глиобластомы головного мозга являются крайне агрессивное течение, высокая частота рецидивов и низкие показатели выживаемости больных. По последним данным статистического отчёта CBTRUS встречаемость глиобластом от числа злокачественных опухолей головного мозга составляет 50,1%, а среди всех опухолей ЦНС этот показатель равен 14,2% [1]. После подтверждённого диагноза, несмотря на выполненную операцию и адьювантную терапию, достигнуть однолетней выживаемости удаётся примерно 40% больным, а пятилетней выживаемости лишь 5%, к тому же следует отметить, что у пациентов старше 65 лет этот показатель снижается до 2% [2,3].
Исследуя факторы прогноза у больных глиобластомой, авторы выделили молодой возраст, индекс Карновского 80–100%, мутации в гене IDH1 , также отмечено преимущество в случае метилирования промотора гена MGMT , более интенсивного лечения, предусматривающего радиотерапию с ежедневным приёмом темозоломида. Следует отметить, что радикальность выполненной операции, по мнению авторов, не имеет существенного значения для прогноза, за исключением тех случаев, когда единственным возможным способом вмешательства была стереотаксическая биопсия [4,5].
Стандартным диагностическим методом у больных глиобластомой является магнитнорезонансная томография с контрастированием, которая позволяет определить локализацию, объём поражения и макроструктуру опухоли [6]. Для повышения информативности МР-визуализации у больных глиобластомой протоколы исследований, в зависимости от технических возможностей, могут быть дополнены функциональной МРТ для планирования хирургического доступа [7], диффузионно-тензорной трактографией, МР-спектроскопией, бесконтрастной ASL перфузией [8–10] и более предпочтительными для онкологической практики методиками МР-перфузии с экзогенным контрастированием [11], при этом более широкое применение в нейровизуализации принадлежит Т2* перфузии, возможности которой позволяют дать количественную характеристику измененных тканей, уточнить границы поражения, а также дифференцировать изменения, обусловленные лечением от опухолевой прогрессии [12–14].
Перспективным направлением является использование данных мультипараметрической МР-визуализации в качестве прогностических факторов, влияющих на клинический исход у пациентов с глиобластомой [15–17]. На сегодняшний день немногочисленное количество работ, посвящённых изучению прогностической ценности перфузионных показателей при глиобластоме, имеют довольно многообещающие результаты. В исследовании Kim с соавторами представили результаты лечения больных мультиформной глиобластомой, у которых наблюдалась положительная корреляция между значением нормализованного показателя объёма церебрального кровотока (nCBV) в контрастпозитивных участках поражения и выживаемостью без прогрессирования (ВБП) (P=0,044). Кроме того, медиана ВБП была больше у пациентов со значением nCBV ≥ 4,5, чем у пациентов со значением <4,5 (4,4 против 3,1 месяца, P=0,036). Авторы сформулировали вывод, что значение nCBV можно использовать в качестве прогностического маркера [18]. Voglein с соавторами установили, что рост в динамике значений скорости церебрального кровотока сочетался с ранним прогрессированием (Р=0,01), а дополнительно рассматриваемый авторами диаметр опухоли не оказывал существенного влияния на этот показатель (Р=0,049) [19]. В исследовании Mangla с соавторами при изучении данных больных через месяц после ЛТ, было установлено, что увеличение нормализованного параметра церебрального объёма кровотока (nCBV) являлось предиктором меньшей годовой общей выживаемости больных глиобластомой (чувствительность 90% и специфичность 69%), а размеры опухоли, также как в предыдущем исследовании, не имели прогностической значимости [20].
Sorensen с соавторами при исследовании перфузии у больных глиобластомой на фоне дополнительного противоопухолевого лечения ингибиторами протеинкиназ установили, что 25% пациентов демонстрируют повышенную перфузию и имеют более высокую выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ), чем больные с признаками снижения перфузии или относительно стабильными её показателями, что, вероятно, можно объяснить взаимосвязью повышенной перфузии с оксигенацией, увеличенной доставкой лекарственных веществ и большей чувствительностью опухолевых клеток к лучевому воздействия [21].
Показатели МР-перфузии в настоящее время рассматриваются в качестве биомаркеров при антиангиогенной терапии злокачественных глиом, благоприятными прогностическими факторами при этом являются: более низкий уровень rCBV до или после лечения, меньшее изменение rCBV во время лечения [22].
В совокупности, имеющиеся данные демонстрируют, что МР-перфузионная визуализация вызывает высокий интерес; возможности метода могут быть использованы в качестве инструмента для персонифицированного подхода к лечению больных глиобластомой, при этом необходима консолидация имеющихся данных и проведение дальнейших проспективных исследований.
Цель работы: изучить прогностическое значение количественных параметров МР-перфузии опухоли до адьювантного лечения в оценке общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП) у больных первичной глиобластомой головного мозга.
Материалы и методы
В исследование были включены данные 47 больных – 26 женщин (55,3%) и 21 мужчина (44,7%) в возрасте 26 – 89 лет, с гистологически подтверждённым диагнозом глиобластома WHO Grade IV посредством хирургического вмешательства с частичным удалением опухоли. На до госпитальном этапе и во время пребывания в стационаре в ФГБУ РНЦРР в период 2018 – 2021 гг. каждому больному перед планируемым курсом химиолучевого лечения выполнялась МРТ с Т2* перфузией на высокопольных томографах 1,5 Тл с использованием экзогенного контрастирования на основе редкоземельного металла гадолиния. Предварительно от всех больных было получено письменное согласие на проведение диагностического исследования с введением контрастного вещества.
МР-протокол состоял из нативного этапа сканирования с получением Т2ВИ, Т2 FLAIR, 3DT1 с толщиной 1 мм, диффузионных изображений и опционально последовательности Т2* чувствительной к продуктам крови. В дальнейшем выполнялось перфузионное исследование с болюс-трекингом в Т2* режиме с использованием инжектора для одновременного введения 20 мл гадолиний содержащего контрастного препарата с 20 мл физиологического раствора, со скоростью 2 мл/с. На завершающем этапе исследования выполнялась 3DT1 с контрастированием (Рис. 1). Все исследования были выполнены без осложнений.
Постпроцессинговая обработка данных с использованием цветовых перфузионных карт для исследования гемодинамических показателей и расчёта их относительных значений проводилась на отдельной рабочей станции. Зонами интереса были обозначены: ROI 1 – остаточная ткань глиобластомы с наиболее ярким сигналом по цветовой шкале; референтным значением ROI 2 являлся неизмененный участок белого вещества, симметрично отмеченный в противоположном полушарии головного мозга у каждого пациента. В режиме синхронизации осуществлялся математический расчёт с вычислением абсолютных значений основных перфузионных параметров с построением аппроксимирующих кривых, соответствующих обозначенным ROI (Рис. 1G).
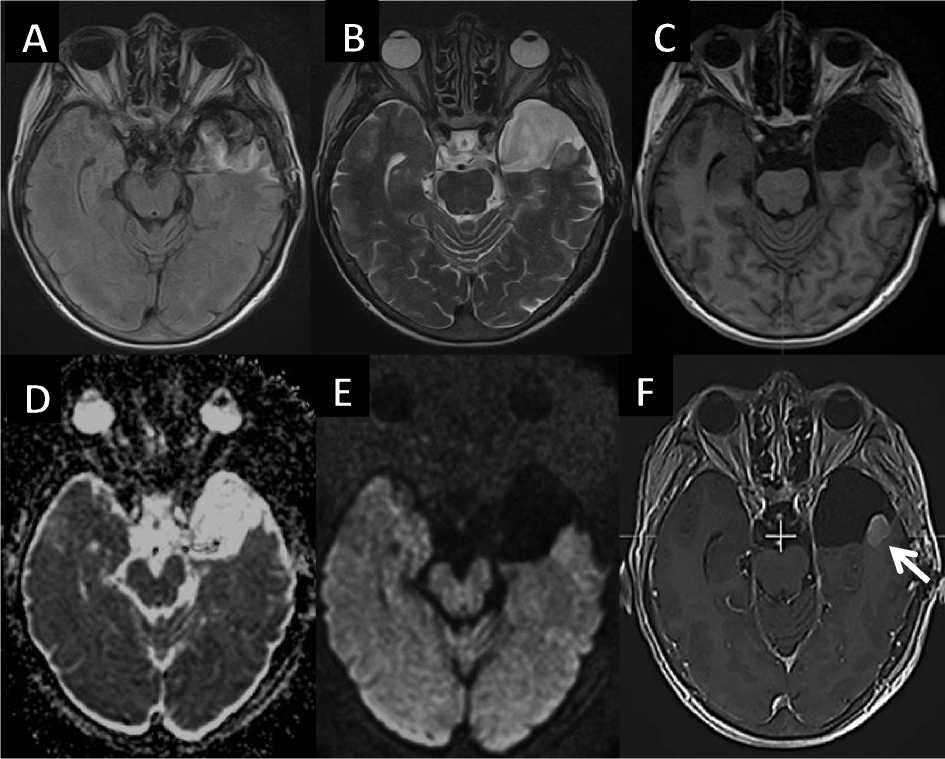
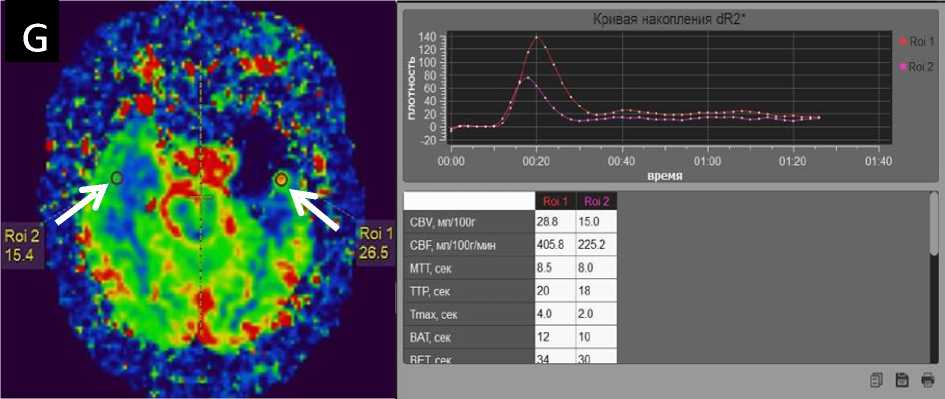
Рис. 1. Пациент Г., 71 год, состояние после субтотального удаления глиобластомы левой височной доли. Аксиальные МР-томограммы Т2-FLAIR (A), T2ВИ (B), T1ВИ (В), карта измеряемого коэффициента диффузии (D), DWI с фактором b=1400 (E) и T1- с контрастированием (F) демонстрируют наличие в левой височной области послеоперационной кисты с остаточной тканью глиобластомы по задней стенке. Постпроцессинговый анализ T2* перфузии (G): слева – цветовая карта перфузии, где ROI 1 – наиболее активный гиперперфузионный участок остаточной опухоли, ROI 2 – симметричный неизмененный участок белого вещества противоположного полушария; справа графики, соответствующие ROI 1 и ROI 2, рядом в таблице абсолютные параметры Т2* перфузии.
Основные исследуемые перфузионные параметры: 1) объем мозгового кровотока (CBV); 2) скорость мозгового кровотока (CBF); 3) среднее время прохождения/задержки контрастного вещества в обозначенном регионе мозга (MTT). Относительные значения основных перфузионных параметров (rCBV, rCBF, rMTT) рассчитывались с использованием соответствующих абсолютных и референтных значений.
Адьювантный курс лечения 27 больным проводился с выполнением стандартной радиотерапии с разовой очаговой дозой (РОД) 2 Гр до суммарной очаговой дозы (СОД) 60 Гр с отступом на CTV + 2см; 20 больных получали радиотерапевтическое лечение по методике «буст» с РОД 2 Гр до СОД 46 Гр (на объем CTV 46), на втором этапе которой последовательный буст подводился на объем CTV60 с отступом 0,5 – 0,7см.
Всем больным, по общепринятым стандартам, во время курса радиотерапии применялся темозоломид в клинически рекомендуемой дозировке 75 мг/м2. Кроме этого, в качестве сопроводительного лекарственного лечения применялась глюкокортикостероидная терапия с дозировкой, соответствующей выраженности симптоматики. При положительной динамике с регрессией неврологического дефицита лечебные дозы постепенно уменьшали до полной отмены.
В дальнейшем осуществлялся анализ выживаемости путем построения таблиц дожития и графиков с помощью метода Каплан-Мейера. Время наблюдения варьировало от 3 до 42 месяцев. Сравнение выживаемости в зависимости от параметров Т2* перфузии (rCBV; rCBF; rMTT) в остаточных фрагментах первичной опухоли в отсроченный постоперационный период перед адьювантным лечением, проводилось с помощью лог-рангового критерия. Обработка данных осуществлялась в статистическом пакете SPSS Statistics 27 (IBM).
Результаты и обсуждение
В представленном исследовании нами изучалась общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП) в зависимости от параметров T2* перфузии (rCBV, rCBF, rMTT) в резидуальной опухоли у больных первичной глиобластомой головного мозга до адьювантного лечения. Известно, что за время наблюдения 9 больных (19,1%) умерли от прогрессирования глиобластомы, 38 пациентов (80,9%) живы на момент окончания исследования.
ОВ больных глиобластомой в зависимости от параметра rCBV
Расчет медианы параметров объёма кровотока (rCBV) в опухолевом остатке позволил определить группы с высокими и низкими значениями. Так, у 25 больных (53,2%) с показателями rCBV ≤ 3,30 продолжительность жизни была дольше и число летальных исходов меньше, чем у 22 пациентов (46,8%), значения rCBV которых были выше ≥ 3,31, продолжительность жизни их была короче, случаев гибели от прогрессирующей опухоли было в 2 раза больше. Графики выживаемости представлены на рисунке 2.
Ё
5 i л CD
О
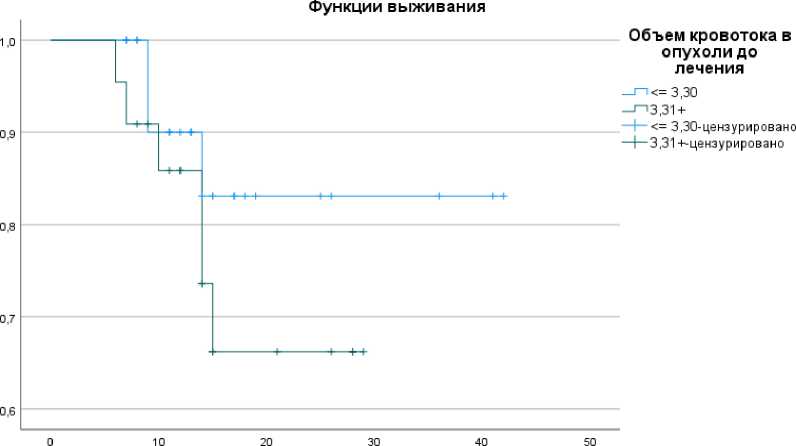
Рис. 2. Показатель ОВ больных глиобластомой в зависимости от параметра rCBV.
Средние значения для времени выживания больных в зависимости от объёма кровотока, как представлено в таблице 1, в случае невысоких значений rCBV, составили 36,8 месяцев (95% доверительный интервал (ДИ): от 31,3 до 42,2). В группе с высокими показателями rCBV в опухоли 23,1 месяца (95% ДИ: 19,2 до 27,0). Медиана выживаемости не достигнута.
В результате по показателю ОВ выявлено некоторое преимущество в выживаемости при менее высоких значениях объёма кровотока rCBV ≤ 3,30 в опухолевом остатке, разница прослеживается после 12 месяцев, как видно на графике (Рис. 2), однако, отмеченные различия статистически незначимы (P=0,287), что можно объяснить ограниченной выборкой данных и непродолжительностью наблюдений [23].
ОВ больных глиобластомой в зависимости от параметра rCBF
При исследовании скорости церебрального кровотока в остаточной ткани глиобластом 24 пациента (51,1%) имели невысокие значения rCBF ≤ 2,02, а 23 пациента (48,9%) были с повышенным rCBF ≥ 2,03. В результате было установлено, что процент выживших больных с невысокими значениями скорости кровотока в опухоли составил 87,5%, три пациента умерли. В группе больных, где rCBF были выше, процент выживших составил 73,9%, шесть летальных случаев, что в 2 раза превышает число умерших в группе с меньшими гемодинамическими показателями, как и в случае с высокими параметрами rCBV. Таким образом, отмечено, что при низких значениях rCBF выживаемость больных была выше, а число летальных исходов в 2 раза меньше, чем при высоких значениях rCBF [23]. Средние значения, как представлено в таблице 1, в случае относительно невысоких значений rCBF составили 31,9 (95% ДИ: 27,6 до 36,2 месяцев), при высоких показателях скорости rCBF ≥ 2,03 среднее значение составило 32,1 (95% ДИ: 25,4 до 38,8 месяцев) (Рис. 3).
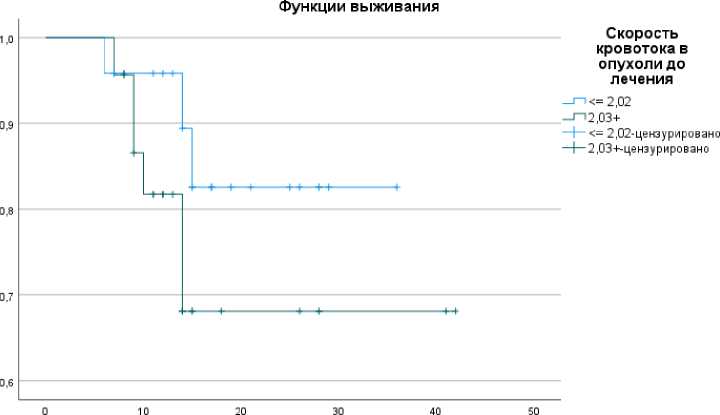
Рис. 3. Показатель ОВ больных с глиобластомой в зависимости от параметра rCBF.
Как видно на рисунке 3, у пациентов с невысокими показателями rCBF выживаемость выше, летальных исходов в 2 раза меньше, чем в группе повышенного rCBF. В группе с высокими значениями скорости кровотока в остаточной опухоли выживаемость ниже, случаев с летальным исходом на сроке примерно год от начала заболевания больше, однако, наблюдаемые различия не доказаны (P=0,241) [23].
ОВ больных глиобластомой в зависимости от параметра rMTT
Расчет медианы времени прохождения/задержки контрастного вещества (rMTT) в опухолевом остатке позволил выделить 2 группы: 26 больных (55,3%) с относительными значениями rMTT в опухолевом остатке ≤ 1,10 и 21 пациент (44,7%) со значениями rMTT ≥ 1,11.
Процент выживших больных в группе с показателями rMTT ≤1,10 составил 88,5%, на фоне прогрессирования опухоли три пациента умерли. В группе больных с показателями rMTT ≥ 1,11 выживших было 71,4%, шесть больных умерли. Средние значения для времени выживания в зависимости от показателя rMTT: в первой группе 36,9 месяцев (95% ДИ: 31,6 до 42,2 месяцев), во второй группе 23,1 месяца (95% ДИ: 19,2 до 27,1 месяцев), при этом различия статистически незначимы (P=0,272) (Рис. 4).
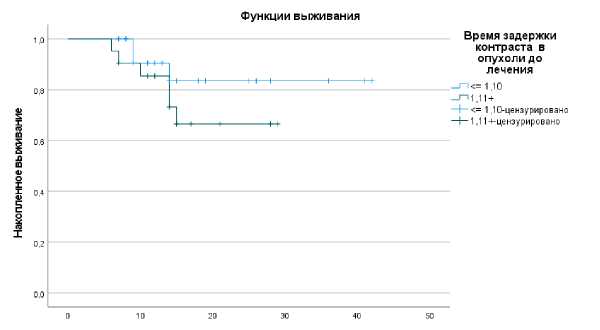
Рис. 4 . Показатель ОВ больных глиобластомой в зависимости от параметра rMTT.
Как представлено на графиках (Рис. 4) после 13–14 месяцев отмечены различия: так продолжительность жизни была дольше и число летальных исходов меньше у больных с показателями rMTT в опухолевом остатке ≤ 1,10; в 2 раза больше случаев с летальным исходом и меньшая продолжительность жизни отмечалась у больных c показателями rMTT ≥ 1,11, высокие значения которых, вероятно, были обусловлены некротической трансформацией внутренней структуры патологической зоны [23].
Таким образом, как видно из результатов, представленных в таблице 1, благоприятным прогностическим фактором можно рассматривать низкий уровень значений параметров rCBV ≤ 3,30, rMTT ≤ 1,10, что касается параметра rCBF, то разница по средним значениям несущественная, тем не менее, преимущество в выживаемости было у больных с невысокими показателями скорости в остаточной ткани глиобластом.
Таблица 1. Анализ ОВ в зависимости от перфузионных параметров rCBV, rCBF, rMTT в опухоли до адьювантного лечения больных глиобластомой головного мозга
|
Группы сравнения |
Общая выживаемость |
||
|
Среднее (месяцы) |
Медиана (месяцы) |
P |
|
|
rCBV ≤ 3,30 (n=25) |
36,8 (88%) |
Не достигнута |
0,287 |
|
rCBV ≥ 3,31 (n=22) |
23,1 (72,7%) |
Не достигнута |
|
|
rCBF ≤ 2,02 (n=24) |
31,9 (87,5%) |
Не достигнута |
0,241 |
|
rCBF ≥ 2,03 (n=23) |
32,1 (73,9%) |
Не достигнута |
|
|
rMTT ≤ 1,10 (n=26) |
36,9 (88,5%) |
Не достигнута |
0,272 |
|
rMTT ≥ 1,11 (n=21) |
23,1 (71,4%) |
Не достигнута |
|
ВБП у больных глиобластомой в зависимости от параметра rCBV
В нашем исследовании при относительно невысоких значениях rCBV ≤ 3,30 развитие прогрессирования заболевания по средним значениям происходило на 1 месяц позднее и имело несколько больший временной интервал, что прослеживается на графиках (Рис. 5).
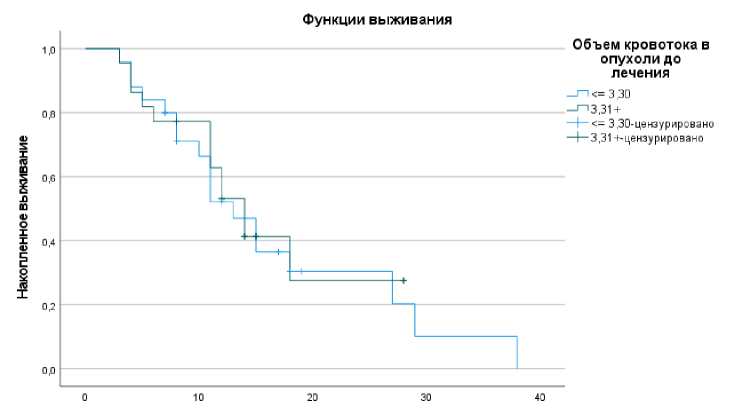
Рис. 5. Показатель ВБП у больных глиобластомой в зависимости от параметра rCBV.
Как видно из таблицы 2, среднее значение ВБП составило 16,5 месяцев (95% ДИ: 11,7 до 21,4 месяцев), при этом медиана ВБП составила 13 месяцев (95% ДИ: 9,5 до 16,5 месяцев). В группе с повышенным rCBV ≥ 3,31 прогрессирование болезни возникало в интервале 11,4–19,8 месяцев, средние значения ВБП составили 15,6 месяцев (95% ДИ: 11,4 до 19,8 месяцев), медиана составила 14 месяцев (95% ДИ: 10,9 до 17,1 месяцев) (P=0,796).
ВБП у больных глиобластомой в зависимости от параметра rCBF
При изучении влияния параметра rCBF в опухоли на ВБП, в отличие от ранее приведенных результатов, было установлено, что более длительный период без прогрессирования наблюдался у больных с более высокими значениями rCBF, т.е. относительно благоприятным признаком отличались больные со значениями rCBF ≥ 2,03; в этой же категории частота развития прогрессирования была меньше. Так, среди больных с rCBF в остаточной опухоли ≤ 2,02, случаев без прогрессирования выявлено 33,3%, при высокой скорости кровотока ≥ 2,03 этот показатель составил 34,9% (Рис. 6).
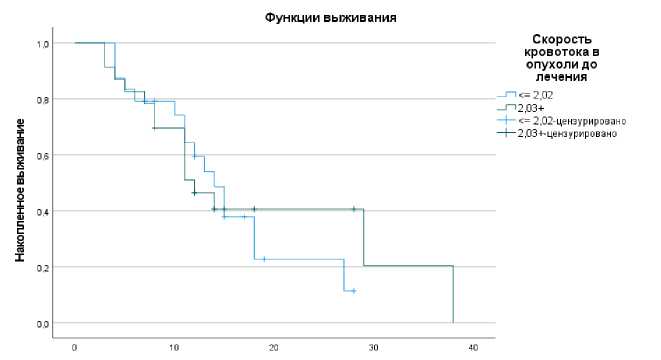
Рис. 6. Показатель ВБП у больных глиобластомой в зависимости от параметра rCBF.
В результате длительный период ВБП со средним значением 18,7 месяцев (95% ДИ: 12,5-24,7) был определён в группе с высокими значениями rCBF, а в группе с более низкими показателями скорости кровотока среднее значение ВБП составило 15,2 месяца (95% ДИ: 11,718,7). Но при этом, как видно на рисунке 6 и представлено в таблице 2, в группе с высокими rCBF медиана достигнута на 12 месяцах, а у больных со значениями скорости кровотока rCBF ≤ 2,02 медиана составила 14 месяцев (P=0,771). Таким образом, отмечалась положительная корреляция между низкими значениями параметра скорости церебрального кровотока в опухоли rCBF ≤ 2,02 и выживаемостью без прогрессирования у больных глиобластомой.
Таблица 2. Анализ ВБП в зависимости от перфузионных параметров rCBV, rCBF, rMTT в опухоли до адьювантного лечения больных глиобластомой головного мозга
|
Группы сравнения |
Выживаемость без прогрессирования |
||
|
Среднее (месяцы) |
Медиана (месяцы) |
P |
|
|
rCBV ≤ 3,30 (n=25) |
16,5 (28%) |
13 (28%) |
0,796 |
|
rCBV ≥ 3,31 (n=22) |
15,6 (40,9%) |
14 (40,9%) |
|
|
rCBF ≤ 2,02 (n=24) |
15,2 (33,3%) |
14 (33,3%) |
0,771 |
|
rCBF ≥ 2,03 (n=23) |
18,7 (34,9%) |
12 (34,9%) |
|
|
rMTT ≤ 1,10 (n=26) |
16,7 (30,8%) |
13(30,8%) |
0,874 |
|
rMTT ≥ 1,11 (n=21) |
15,2 (38,1%) |
14(38,1%) |
|
ВБП у больных глиобластомой в зависимости от параметра rMTT
При анализе ВБП в зависимости от параметра rMTT в группе с относительными значениями указанного перфузионного параметра менее ≤ 1,10, что говорит о быстром прохождении контрастного вещества через остаточную ткань глиобластомы, случаи без прогрессирования отмечены в 30,8%. В группе с замедленным прохождением контрастного вещества через ткань опухоли (rMTT ≥ 1,11) отсутствие прогрессирования выявлено в 38,1%. У больных с низким параметром rMTT ≤ 1,10 среднее значение ВБП составило 16,7 месяцев (95% ДИ: 11,8–21,5), медиана достигнута на 13 месяцах. У больных с rMTT ≥ 1,11 среднее значение ВБП отмечено на 15,2 месяцах (95% ДИ: 10,9–19,4), медиана достигнута на 14 месяцах. Графики выживаемости представлены на рисунке 7.
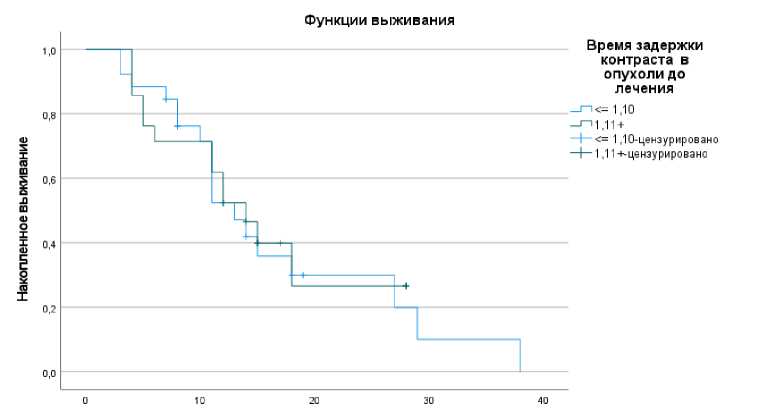
Рис. 7. Показатель ВБП у больных глиобластомой в зависимости от параметра rMTT.
В результате анализа ВБП в зависимости от параметра rMTT достоверных различий не выявлено (P=0,874).
Заключение
Резюмируя полученные данные, можно сказать, что была выявлена определённая тенденция в виде преимущества ОВ больных с относительно невысокими значениями T2* перфузии в остатке глиобластомы до ЛТ. Средняя ОВ имела большие значения при rCBV ≤ 3,30 (36,8 против 23,1 месяца, Р=0,287), rMTT ≤ 1,10 (36,9 против 23,1 месяца, Р=0,272). Средние значения в группе низких и высоких rCBF были примерно на одном уровне (31,9 против 32,1, Р=0,241), однако выживших больных с rCBF ≤ 2,02 было больше (87,5% против 73,9%), летальных случав в два раза меньше (3 против 6). Медиана ВБП оказалась больше у пациентов с низкими значениями скорости церебрального кровотока rCBF ≤ 2,02 (14 против 12 месяцев, Р=0,771), что указывает на положительную корреляцию между низкими значениями относительного параметра скорости церебрального кровотока и ВБП у больных первичной глиобластомой головного мозга. Таким образом, можно высказать предположение, что невысокие показатели МР-перфузии первичной опухоли до адьювантного лечения следует рассматривать как относительно благоприятный прогностический фактор у данной категории онкологических больных, что согласуется с результатами других исследований [19, 20, 22] и требует дальнейшего изучения.
Список литературы Прогностическое значение параметров Т2* МР-перфузии в оценке выживаемости больных глиобластомой головного мозга
- Ostrom Q.T., Price M., Neff C., et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2015–2019, Neuro Oncol. 2022. V. 24 (Suppl 5). P. v1–v95. DOI: 10.1093/neuonc/noac202.
- Ostrom Q.T., Cioff G., Gittleman H., et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2012– 2016. Neuro Oncol. 2019. V. 21 (Suppl. 5). P. v1–v100. DOI: 10.1093/neuonc/noz150.
- Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология. 2009. Т. 2. С. 33-59.
- Воинов Н.Е., Улитин А.Ю., Мацко М.В., Скляр С.С. Факторы длительной выживаемости у больных глиобластомой. Вопросы онкологии. 2022. Т. 68. № S3. С. 299-300.
- Измайлов Т.Р. Клинико-генетические факторы, влияющие на результаты комплексного лечения пациентов с первичной глиобластомой головного мозга. Трудный пациент. 2016. Т. 14. № 1. С. 29-33.
- Захарова Н.Е., Пронин И.Н., Баталов А.И. и др. Современные стандарты МРТ-диагностики опухолевых поражений головного мозга. Вопросы нейрохирургии им. Н.Н. Бурденко. 2020. Т. 84. № 3. С. 102-112.
- Смирнов А.С., Шараев М.Г., Мельникова-Пицхелаури Т.В. и др. Функциональная МРТ покоя головного мозга в предоперационном планировании. Медицинская визуализация. 2018. Т. 22. № 5. С. 6-13.
- Жуков В.Ю., Горяйнов С.А., Огурцова А.А.и др. Диффузионно-тензорная трактография и интраоперационный нейрофизиологический мониторинг в хирургии внутримозговых опухолей. Вопросы нейрохирургии им. Н.Н. Бурденко. 2016. Т. 80. № 1. С. 5-18.
- Тюрина А.Н., Пронин И.Н., Фадеева Л.М. и др. Протонная 3D-МР-спектроскопия в диагностике глиальных опухолей головного мозга. Медицинская визуализация. 2019. Т. 23. № 3. С. 8-18.
- Шульц Е.И., Баталов А.И., Афандиев Р.М. и др. ASL-перфузия в дифференциальной диагностике опухолей боковых желудочков и прозрачной перегородки. Радиология - практика. 2020. Т. 4. № 82. С. 16-26.
- Ребрикова В.А., Сергеев Н.И., Падалко B.В., Котляров П.М., Солодкий В.А. Возможности МР-перфузии в оценке эффективности лечения злокачественных опухолей головного мозга. Вопросы нейрохирургии им. Н. Н. Бурденко. 2019. Т. 83. № 4. С. 113–120.
- Сергеев Н.И., Ребрикова В.А., Котляров П.М., Солодкий В.А. Т2* - перфузия в определении фрагментов остаточной ткани опухоли у пациентов с глиомами высокой степени злокачественности после хирургического лечения в подострый постоперационный период. Вестник РНЦРР. 2020. Т. 20. № 1. С 15-27.
- Ребрикова В.А., Солодкий В.А., Сергеев Н.И. и др. Возможности Т2* перфузии в оценке результатов лечения различных методик лучевой терапии глиобластом головного мозга. Вестник РНЦРР. 2022. Т. 22. № 1. С. 92-119.
- Савинцева Ж.И., Трофимова Т.Н., Скворцова Т.Ю. Применение T2* MP-перфузии в дифференциальной диагностике продолженного роста церебральных опухолей и лучевых повреждений головного мозга. Медицинская визуализация. 2012. № 6. C. 9-15.
- Leimgruber A., Ostermann S., Yeon E.J., et al. Perfusion and diffusion MRI of glioblastoma progression in a four-year prospective temozolomide clinical trial. Int J Radiat Oncol Biol Phys. 2006. V. 64. No. 3. P. 869-875. DOI: 10.1016/j.ijrobp.2005.08.015.
- Li Y., Lupo J.M., Polley M.Y., et al. Serial analysis of imaging parameters in patients with newly diagnosed glioblastoma multiforme. Neuro Oncol. 2011. V. 13. No. 5. P. 546-557. DOI: 10.1093/neuonc/noq194.
- Boonzaier N.R., Larkin T.J., Matys T., et al. Multiparametric MR Imaging of Diffusion and Perfusion in Contrast-enhancing and Nonenhancing Components in Patients with Glioblastoma. Radiology. 2017. V. 284. No. 1. P. 180-190. DOI: 10.1148/radiol.2017160150.
- Kim J.H., Choi S.H., Ryoo I., et al. Prognosis prediction of measurable enhancing lesion after completion of standard concomitant chemoradiotherapy and adjuvant temozolomide in glioblastoma patients: application of dynamic susceptibility contrast perfusion and diffusion-weighted imaging. PLoS One. 2014. V. 24. No. 9. No. 11. Article ID e113587. DOI: 10.1371/journal.pone.0113587.
- Voglein J.1., Tuttenberg J., Weimer M., et al. Treatment monitoring in gliomas: comparison of dynamic susceptibility-weighted contrast-enhanced and spectroscopic MRI techniques for identifying treatment failure. Invest. Radiol. 2011. V. 46. No. 6. P. 390-400. DOI: 10.1097/RLI.0b013e31820e1511.
- Mangla R., Singh G., Ziegelitz D., et al. Changes in relative cerebral blood volume 1 month after radiation-temozolomide therapy can help predict overall survival in patients with glioblastoma. Radiology. 2010. V. 256. No. 2. P. 575-584. DOI: 10.1148/radiol.10091440.
- Sorensen A.G., Batchelor T.T., Zhang W.T. A “Vascular normalization index” as potential mechanistic biomarker to predict survival after a single dose of cediranib in recurrent glioblastoma patients. Cancer Res. 2009. V. 69. No. 13. P. 5296-5300. DOI: 10.1158/0008-5472.CAN-09-0814.
- Kong Z., Yan C., Zhu R., Wang J., et al. Imaging biomarkers guided anti-angiogenic therapy for malignant gliomas. Neuroimage Clin. 2018. V. 20. P. 51-60. DOI: 10.1016/j.nicl.2018.07.001.
- Ребрикова В.А. Возможности магнитно-резонансной томографии с перфузионной визуализацией в планировании лучевой терапии и оценке её эффективности у больных с глиобластомами головного мозга. Дисс. … канд. мед. наук: 14.01.13, 14.01.12. М. 2022. С. 107-117.


