Прогностическое значение скорости снижения индивидуального уровня BCR - ABL для достижения большого молекулярного ответа у больных хроническим миелолейкозом
Автор: Фоминых М.С., Абдулкадыров К.М., Туркина А.Г., Шуваев В.А., Мартынкевич И.С., Цаур Г.А., Бедерак Н.В., Челышева Е.Ю., Шухов О.А., Абдуллаев А.О., Удальева В.Ю., Зотова И.И., Шихбабаева Д.И., Полушкина Л.Б., Иванова М.П., Петрова Е.В., Мартыненко Л.С., Клеина Е.В., Цыбакова Н.Ю.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Актуальность. Больные хроническим миелолейкозом представляют собой гетерогенную группу. Наиболее актуальным вопросом их лечения в настоящее время является персонализация терапии, основанная на индивидуальных характеристиках больного. Цель исследования. Изучение индивидуального прогностического значения скорости снижения уровня BCR-ABL в течение первых трех месяцев терапии ингибиторами тирозинкиназ. Материалы и методы. В исследование включено 54 больных хроническим миелолейкозом в хронической фазе. В качестве терапии первой линии больные получали: Иматиниб 400 мг/сут (n=41), Нилотиниб 600 мг/сут (n=12) и Дазатиниб (n=1). Уровень относительной экспрессии BCR-ABL гена определяли по международной шкале в момент диагностики, через 3, 6 и 12 месяцев терапии ингибиторами тирозинкиназ. Оценивались: отношение уровня экспрессии BCR-ABL через 3 месяца терапии к уровню в момент диагностики; частота достижения пациентами раннего молекулярного ответа через 3 месяца лечения ( BCR-ABL ≤10%) и большой молекулярный ответ (БМО) через 12 месяцев терапии; а также отношение уровня экспрессии BCR-ABL через 3 месяца к уровню, достигнутому к 1-му месяцу терапии. Результаты. У 26 из 34 пациентов (76,5%) с отношением уровня BCR-ABL меньше 0,1 был достигнут БМО к 12 месяцам терапии, в то время как только 9 из 20 (45%) пациентов с отношением больше 0,1 достигли оптимального ответа на 1 год терапии (p=0,02). Отношение уровня экспрессии через 3 месяца к уровню через 1 месяц также показало хорошие результаты - 5 из 6 пациентов (83,3%) с отношением меньше 0,1 достигли БМО на 1 год терапии, при этом только 1 пациент (16,7%) с отношением больше 0,1 достиг оптимального ответа (p=0,04). При сравнении этих данных с группой больных, достигших раннего молекулярного ответа через 3 месяца терапии ( BCR-ABL менее 10% IS) получены следующие результаты: 33 из 46 (71,7%) пациентов с уровнем BCR-ABL ≤10% достигли БМО к 12 месяцам лечения, в то время как 2 из 8 (25%) с уровнем BCR-ABL >10% достигли БМО через 1 год терапии (p=0,02). Таким образом, при использовании для прогнозирования отношения уровня BCR-ABL через 3 месяца терапии к начальному уровню среди больных с ранним молекулярным ответом ( BCR-ABL ≤10% на 3 месяца терапии) дополнительно были выявлены 5 пациентов с высоким риском прогрессирования заболевания, которые не достигли БМО к 12 месяцам терапии. Выводы. Индивидуальная скорость снижения уровня BCR-ABL в течение первых трех месяцев терапии по отношению к начальному индивидуальному уровню может быть использована как прогностический маркер вероятности достижения БМО через 12 месяцев терапии.
Хронический миелолейкоз, индивидуализация терапии, ингибиторы тирозинкиназ, большой молекулярный ответ
Короткий адрес: https://sciup.org/170149944
IDR: 170149944
Текст научной статьи Прогностическое значение скорости снижения индивидуального уровня BCR - ABL для достижения большого молекулярного ответа у больных хроническим миелолейкозом
Применение ингибиторов тирозинкиназ (ИТК) в течение последнего десятилетия позволило значительно повысить выживаемость больных хроническим миелолейкозом (ХМЛ). По данным исследования IRIS общая восьмилетняя выживаемость на терапии ингибитором ти-розинкиназ первого поколения составляет 85 %, выживаемость без прогрессирования до фазы акселерации (ФА) и бластного криза (БК) — 92 % [1]. Частота прогрессирования в продвинутые фазы при терапии Иматинибом более 5 лет не превышает 0,5 % в год. Больные с ранним молекулярным ответом, то есть с уровнем BCR-ABL по международной шкале (IS) ≤ 10 % через 3 месяца терапии ИТК, достигают 95 % общей выживаемости к 5 годам терапии [2].
Несмотря на высокую эффективность ИТК, у некоторых больных наблюдается первичная или вторичная резистентность к проводимой терапии. Основой развития резистентности могут быть как несоблюдение протокола терапии и необоснованные перерывы в лечении, так и биологически обусловленные механизмы ( BCR-ABL -зависимые или независимые). К сожалению, далеко не все механизмы резистентности при ХМЛ могут быть оценены в реальной клинической практике [3]. Резистентные больные ХМЛ требуют своевременного переключения на терапию ИТК второго поколения (ИТК2), а в некоторых случаях — проведения аллогенной трансплантации костного мозга [4].
С целью раннего выявления больных с высоким риском прогрессирования заболевания, склонных к резистентности к терапии, было введено понятие групп риска, применяемое к больным только в хронической фазе (ХФ) ХМЛ. В настоящее время в клинической практике применяются следующие шкалы: Sokal [5], Hasford [6], EUTOS [7]. В дополнение к перечисленным выше шкалам, согласно рекомендациям по диагностике и лечению ХМЛ European LeukemiaNet и Российского Национального гематологического общества, в качестве прогностических маркеров используется скорость достижения цитогенетического и молекулярно-генетического ответов на определенных этапах терапии. Эффект терапии первой линии может быть расценен как оптимальный, предупреждение и неудача терапии [8, 9, 10]. Неудача терапии предполагает низкую вероятность длительной безрецидивной выживаемости и является показанием к её смене [11]. В данных рекомендациях делается акцент на том, что экспрессия гена BCR-ABL выше 10 % после 3-х месяцев терапии ИТК свидетельствует о неблагоприятном прогнозе, и после подтверждения данного факта при повторном молекулярном исследовании необходимо решить вопрос о переключении на вторую линию терапии ИТК. В последние годы опубликованы результаты некоторых исследований, направленных на персонализацию терапии с учетом динамики индивидуального ответа на лечение [12, 13].
Целью нашего исследования являлась оценка информативности методики установления индивидуального отношения, определяющего динамику снижения уровня экспресcии BCR-ABL в течение первых 3-х месяцев терапии больных ХМЛ ИТК для прогнозирования ее эффективности.
Пациенты и методы. В исследование было включено 54 больных ХМЛ, соответствующих критериям включения и исключения. Критериями включения были: диагноз ХФ ХМЛ, наличие результатов исследования уровня BCR-ABL в момент диагностики, а также через 3, 6 и 12 месяцев лечения (при возможности — данные через 1 и 2 месяца терапии), наличие результатов цитогенетического исследования костного мозга через 3, 6 и 12 месяцев терапии ИТК, приверженность к терапии. Критерии исключения: продвинутые фазы хронического миелолейкоза (акселерации и бластного криза), наличие атипичных транскриптов гена BCR-ABL.
Медиана возраста пациентов составила 52 года (19–84 года). Выборка состояла из 24 мужчин и 30 женщин (табл. 1). При стратификации по группам риска больные распределялись следующим образом: Sokal — 30 пациентов низкого риска, 14 промежуточного и 10 высокого риска; EUTOS — 48 пациентов низкого и 6 высокого риска. Сорок один пациент получал терапию Иматинибом в дозировке 400 мг в сутки, 12 пациентов получали Нилотиниб в дозировке 600 мг в сутки и 1 пациент лечился Дазатини-бом в дозе 100 мг в сутки. Медиана экспрессии гена BCR-ABL в момент диагностики составила 41,46 % (мин. 3,39, макс. 3185,36 %). Мониторирование уровня экспрессии BCR-ABL проводилось у всех пациентов в момент диагностики и через 3, 6 и 12 месяцев терапии ИТК. У 12 пациентов из этой группы уровень BCR-ABL дополнительно оценивался через 1 месяц терапии. Медиана наблюдения составила 27 месяцев (диапазон 12–59 месяцев).
Для всех пациентов было оценено отношение уровня экспрессии BCR-ABL через 3 месяца к уровню в момент диагностики. У 12 больных дополнительно было оценено отношение уровня BCR-ABL через 3 месяца к уровню на 1 месяц терапии. По результатам ранее проведенного ROC-анализа характеристик чувствительности и специфичности отношения уровня экспрессии BCR-ABL через 3 месяца к уровню в момент диагностики для прогноза достижения БМО к 1-му году терапии ИТК было принято пороговое значение 0,1 [14]. Чувствительность данного порогового уровня (0,1) составляла 83,33 (доверительный интервал (ДИ) 62,6–95,3); специфичность 66,67 (ДИ 34,9–90,1) [15, 16].
Было проведено сравнение предсказательной способности методики индивидуального отношения, определяющего динамику снижения уровня экспреcсии BCR-ABL в течение первых 3-х месяцев терапии ИТК с достижением раннего молекулярного ответа через 3 месяца лечения ( BCR-ABL ≤10 %). Статистический анализ значимости различий проводили с помощью точного критерия Фишера. Зависимость между уровнем BCR-ABL на год терапии и динамикой индивидуального уровня BCR-ABL в течение первых 3-х месяцев терапии оценивали с помощью многофакторного регрессионного анализа. Различия считали статистически значимыми при уровне p < 0,05.
Таблица 1.
|
N (%) |
|
|
Возраст (медиана) |
52 года (мин. 19 лет, макс. 84 года) |
|
Мужчины |
24 (44,4%) |
|
Женщины |
30 (55,6%) |
|
Группы риска EUTOS: низкий риск высокий риск |
48 (88,9%) 6 (11,1%) |
|
Группы риска Sokal: низкий риск промежуточный высокий риск |
30 (55,6%) 14 (25,9%) 10 (18,5%) |
|
Медиана экспрессии гена BCR-ABL на момент диагностики |
41,46% (мин. 3,39, макс. 3185,36%) |
|
Терапия: Иматиниб 400 мг/сут Нилотиниб 600 мг/сут Дазатиниб 100 мг/сут |
41 (76%) 12 (22,2) 1 (1,8%) |
|
Всего |
54 |
Клинико-лабораторная характеристика пациентов в момент установления диагноза
Результаты. У 26 из 34 пациентов (76,5 %) с отношением уровня BCR-ABL меньше 0,1 был достигнут БМО к 12 месяцам терапии, в то время как только 9 из 20 (45 %) пациентов с отношением больше 0,1 достигли оптимального ответа на 1 год терапии (p = 0,02) (рис. 1). Отношение уровня экспрессии через 3 месяца к уровню через 1 месяц также показало хорошие результаты — 5 из 6 пациентов (83,3 %) с отношением меньше 0,1 достигли БМО на 1 год терапии, при этом только 1 пациент (16,7 %) с отношением больше 0,1 достиг оптимального ответа (p = 0,04) (рис. 2). При сравнении этих данных с группой больных, достигших раннего молекулярного ответа через 3 месяца терапии (BCR-ABL менее 10 % IS), получены следующие результаты: 33 из 46 (71,7 %) пациентов с уровнем BCR-ABL ≤10 % достигли БМО к 12 месяцам лечения, в то время как 2 из 8 (25 %) с уровнем BCR-ABL >10 % достигли БМО через 1 год терапии (p = 0,02) (рис. 3). Таким образом, при использовании для прогнозирования отношения уровня BCR-ABL через 3 месяца терапии к начальному уровню среди больных с ранним молекулярным ответом (BCR-ABL ≤10 % на 3 месяца терапии) дополнительно были выявлены 5 пациентов с высоким риском прогрессирования заболевания, которые не достигли БМО к 12 месяцам терапии (табл. 2).
Таблица 2.
|
Группа больных |
Число больных |
Число больных, достигших БМО к 12 месяцам (%) |
p |
|
BCR-ABL на три месяца терапии ≤10% |
46 |
33 (71,7 %) |
p = 0,02 |
|
BCR-ABL на три месяца терапии >10% |
8 |
2 (25 %) |
|
|
Отношение уровней BCR-ABL 3 мес к начальному уровню < 0,1 |
34 |
26 (76,5 %) |
p = 0,02 |
|
Отношение уровней BCR-ABL 3 мес к начальному уровню >0,1 |
20 |
9 (45 %) |
|
|
Отношение уровней BCR-ABL 3 мес к 1 мес < 0,1 |
6 |
5 (83,3 %) |
p = 0,04 |
|
Отношение уровней BCR-ABL 3 мес к 1 мес > 0,1 |
6 |
1 (16,7 %) |
Результаты исследования
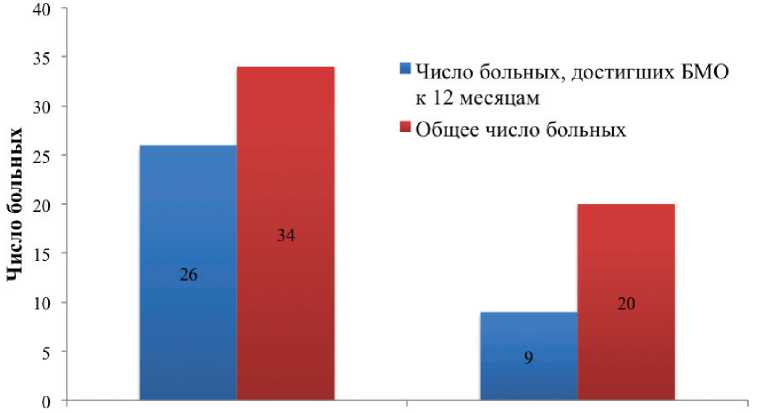
Больные с отношением меньше 0,1 Больные с отношением больше 0,1
Рисунок 1.
Частота достижения БМО у больных с отношением уровня BCR-ABL после 3-х месяцев терапии к начальному уровню, (p = 0,02)
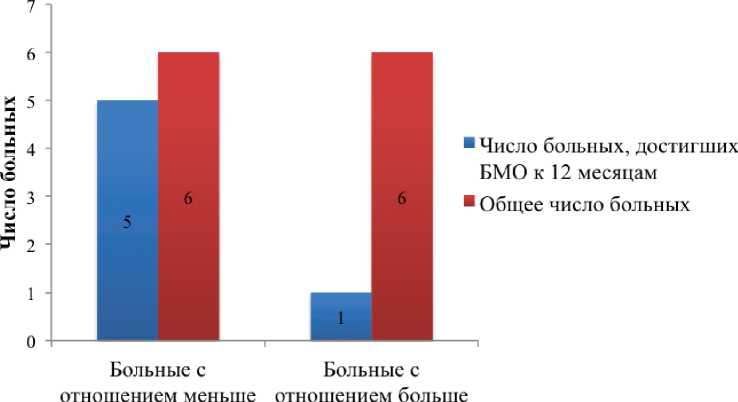
0,1 0,1
Рисунок 2.
Частота достижения БМО у больных с отношением уровня BCR-ABL через 3 месяца к уровню через 1 месяц терапии, (p = 0,04)
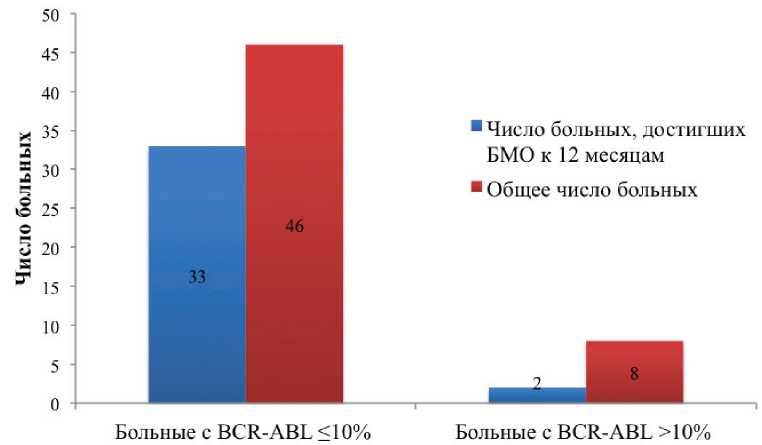
Рисунок 3.
Частота достижения БМО к 12 месяцам терапии у больных с ранним молекулярным ответом (BCR-ABL ≤10 % через три месяца терапии), (p = 0,02)
При разделении больных по частоте достижения оптимального ответа на терапию различными ИТК получены следующие данные: 41 пациент получал начальную терапию ИТК 1-го поколения — Иматиниб (в дозе 400 мг в сутки) и 13 пациентов ИТК 2-го поколения (Нилоти-ниб 600 мг в сутки — 12 пациентов, Дазатиниб 100 мг в сутки — 1 пациент). В группе ИТК1 23 пациента из 33 с ранним молекулярным ответом (69,7 %) и 2 из 8 пациентов (25 %) с уровнем BCR-ABL >10 % достигли БМО к 1 году лечения; 17 из 23 пациентов (73,9 %) с отношением уровня BCR-ABL меньше 0,1 и 8 из 18 (44,4 %) пациентов с отношением больше 0,1 достигли оптимального ответа на 1 год терапии. У 15 пациентов из этой группы на различных этапах лечения в течение первого года была проведена смена терапии на ИТК 2-го поколения. В результате смены терапии 4 пациента из 6 (66,7 %) с уровнем BCR-ABL ≤10 % на 3 месяца терапии, и 2 из 8 (25 %) без раннего молекулярного ответа показали оптимальные результаты на 12 месяцев. Десять из 13 пациентов группы ИТК2 (76,9 %) с ранним молекулярным ответов достигли БМО к 1 году лечения, пациентов с уров- нем BCR-ABL >10 % в этой группе не было, при сравнении прогностической значимости отношения уровня BCR-ABL получены следующие данные: 9 из 11 пациентов (81,8 %) с отношением уровня BCR-ABL меньше 0,1 и 1 из 2 пациентов с отношением больше 0,1 достигли оптимального ответа на 1 год терапии. Более подробная информация представлена в табл. 3. Интересным фактом, полученным нами, является то, что в случае неэффективности ИТК1 своевременная смена терапии на ИТК2 у резистентных больных приводила к частоте достижения БМО на 1 год лечения, схожей с общей группой ИТК1.
В результате многофакторного регрессионного анализа оценена значимость взаимосвязи уровня BCR-ABL на 1 год терапии со следующими параметрами: уровнем BCR-ABL на 3 месяца лечения (≤10 % / >10 %) — p = 0,51, индивидуальным отношением уровня экспрессии BCR-ABL на 3 месяца к уровню на момент диагностики ( < 0,1 / >0,1) — p = 0,044, видом терапии пациентов в первой линии (ИТК1 / ИТК2) — p = 0,0002, сменой терапии при недостаточной эффективности ИТК1 на ИТК2 (да/нет) — p < 0,0001.
Таблица 3.
|
Группа больных |
ИТК1 (n = 41) |
ИТК1 со сменой на ИТК2 (n = 14) |
ИТК2 (n = 13) |
|||
|
n |
БМО 12 м |
n |
БМО 12 м |
n |
БМО 12м |
|
|
BCR-ABL на три месяца терапии ≤ 10 % |
33 |
23 (69,7 %) |
6 |
4 (66,7 %) |
13 |
10 (76,9 %) |
|
BCR-ABL на три месяца терапии >10 % |
8 |
2 (25 %) |
8 |
2 (25 %) |
0 |
0 |
|
Отношение уровней BCR-ABL 3 мес к начальному уровню < 0,1 |
23 |
17 (73,9 %) |
1 |
1 (100 %) |
11 |
9 (81,8 %) |
|
Отношение уровней BCR-ABL 3 мес к начальному уровню > 0,1 |
18 |
8 (44,4 %) |
13 |
5 (38,5 %) |
2 |
1 (50 %) |
Частота достижения БМО через 1 год терапии (оптимальный ответ)
в зависимости от использованных препаратов ИТК1 и ИТК2.
Выводы и обсуждение. Поиск суррогатных маркеров для раннего определения больных ХМЛ с высоким риском прогрессирования заболевания — до сих пор актуальная задача. Часть больных остается резистентными к проводимой таргетной терапии. Существующие шкалы определения групп риска, как известно, учитывают только фазу заболевания на момент диагностики и не оценивают дальнейшее течение болезни после начала терапии. Указанные шкалы также не учитывают индивидуальную скорость элиминации опухолевого клона и возможную переносимость проводимой терапии. Некоторая часть больных низкой группы риска по всем прогностическим шкалам может не достигнуть оптимального ответа на определенных этапах терапии по разным причинам — неудовлетворительная переносимость лечения (гематологическая и негематологическая токсичность), первичная резистентность, несоблюдение приверженности к терапии. Токсичность, которая развивается в ходе терапии, очень часто приводит к временной отмене ИТК, что в свою очередь снижает эффективность лечения.
Именно поэтому последние исследования ведущих клинических центров в первую очередь направлены на персонализацию терапии, основанную на индивидуальных характеристиках пациентов. В одном из таких исследований [12] был показан хороший прогностический потенциал скорости снижения отношения уровня экспрессии BCR-ABL через 3 месяца терапии к уровню на момент диагностики. При проведении этого исследования в качестве контрольного гена был использован GUS. Однако в настоящее время повсеместно для количественного определения уровня BCR-ABL в качестве гена-нормализатора применяется ген ABL. Одним из препятствий для применения уровня BCR-ABL/ABL в момент диагностики является искажение (нелинейность) ре- зультатов измерения значений экспрессии гена BCR-ABL выше 10 % [12].
В исследовании S. Branford et al. продемонстрирована возможность применения для прогнозирования эффективности терапии так называемой двукратной скорости снижения экспрессии BCR-ABL . В группе больных, у которых не было достигнуто снижения уровня экспрессии BCR-ABL менее 10 % через 3 месяца терапии, дополнительно проводилась оценка «двукратного снижения». При этом было отмечено, что в группе больных, «двукратная скорость снижения» которых была менее 76 дней, 4-х летняя общая выживаемость значительно выше, чем в группе больных, где этот же показатель был более 76 дней — 95 и 58 %, соответственно, p = 0,0002. Кроме того, у 54 % больных получен БМО в первой группе и только у 5 % — во второй группе, p = 0,008 [13].
Известно, что после начала терапии ИТК у больных ХМЛ происходит быстрое снижение размеров опухолевой массы, что делает возможным оценку отношения уровня экспрессии BCR-ABL через 3 месяца терапии к уровню через 1 месяц терапии и помогает избавиться от «нелинейности».
Учитывая все эти факторы, которые в конечном счете влияют на эффективность лечения, гипотеза о потенциальном прогностическом значении скорости снижения уровня BCR-ABL во время лечения представляется заслуживающей внимания.
Полученные нами данные свидетельствуют о том, что индивидуальная скорость снижения уровня BCR-ABL в течение первых 3-х месяцев терапии по отношению к начальному уровню может быть использована как прогностический маркер — вероятность достижения большого молекулярного ответа через 12 месяцев терапии. При этом отношение индивидуального уровня
BCR-ABL через 3 месяца терапии к начальному уровню, так же как вид терапии первой линии (ИТК1 / ИТК2) и фактор смены терапии при неэффективности ИТК1, оказывает статистически значимое влияние на уровень BCR-ABL к 12 месяцам терапии, тогда как достижение раннего молекулярного ответа ( BCR-ABL ≤10 % через 3 месяца терапии) не показывает данной взаимосвязи.
Учитывая, что в течение первого месяца терапии ИТК у больных ХМЛ происходит ча- стичная элиминация опухолевого клона, тем самым достигается уменьшение риска примеси нормального гена ABL к BCR-ABL, о чем свидетельствуют полученные нами результаты. Отношение уровня BCR-ABL через 3 месяца терапии к уровню через 1 месяц может также применяться как суррогатный прогностический маркер, но требует дальнейшего изучения в последующих исследованиях. Полученные данные позволяют применять ABL как контрольный ген при проведении сравнительного анализа.
Список литературы Прогностическое значение скорости снижения индивидуального уровня BCR - ABL для достижения большого молекулярного ответа у больных хроническим миелолейкозом
- Deininger M., O'Brien S.G., Guilhot F. et al. International randomized study of interferon vs STI571 (IRIS) 8-year follow up: sustained survival and low risk for progression or events in patients with newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP) treated with imatinib. ASH Annual Meeting Abstracts 2009; 114: 1126.
- Hanfstein B., Muller M.C., Hehlmann R. et al. Early molecular and cytogenetic response is predictive for long-term progression-free and overall survival in chronic myeloid Leukemia (CML). Leukemia 2012; 26: 2096-102.
- Quintás-Cardama A., Kantarjian H.M., Cortes J.E. Mechanisms of primary and secondary resistance to imatinib in chronic myeloid leukemia. Cancer Control 2009; 16 (2): 122-31.
- Saussele S., Lauseker M., Gratwohl A. et al. Allogeneic hematopoietic stem cell transplantation (allo SCT) for chronic myeloid leukemia in the imatinib era: evaluation of its impact within a subgroup of the randomized German CML Study IV. Blood 2010; 115: 1880-85.
- Sokal J.E., Cox E.B., Baccarani M. et al. Prognostic discrimination in "good-risk" chronic granulocytic leukemia. Blood 1984; 63: 789-99.
- Hasford J., Pfirrmann M., Hehlmann R. et al. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. Writing Committee for the Collaborative CML Prognostic Factors Project Group. J Natl Cancer Inst 1998; 90: 850-58.
- Hasford J., Baccarani M., Hoffmann V. et al. Predicting complete cytogenetic response and subsequent progression-free survival in 2060 patients with CML on imatinib treatment: the EUTOS score. Blood 2011; 118: 686-92.
- Baccarani M., Cortes J., Pane F. et al. Chronic myeloid leukemia: an update of concepts and management recommendations of European LeukemiaNet. J Clin Oncol 2009; 27: 6041-51.
- Baccarani M., Deininger M.W., Rosti G. et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013; 122: 872-84.
- Абдулкадыров К.М., Абдуллаев А.О, Авдеева Л.Б., Афанасьев Б.В., Виноградова Е.Ю., Виноградова О.Ю., и др. Федеральные клинические рекомендации по диагностике и терапии хронического миелолейкоза. Вестник гематологии. 2013; 9(3): 4-41.
- Marin D., Milojkovic D., Olavarria E. et al. European LeukemiaNet criteria for failure or suboptimal response reliably identify patients with CML in early chronic phase treated with imatinib whose eventual outcome is poor. Blood 2008; 112 (12): 4437-44.
- Hanfstein B., Shlyakhto V., Lauseker M. et al. Velocity of early BCR-ABL transcript elimination as an optimized predictor of outcome in chronic myeloid Leukemia (CML) patients in chronic phase on treatment with imatinib. Leukemia 2014; 28 (10): 1988-92.
- Branford S., Yeung D.T., Parker W.T. et al. Prognosis for patients with CML and >10% BCR-ABL1 after 3 months of imatinib depends on the rate of BCR-ABL1 decline. Blood 2014; 124 (4): 511-8.
- Shuvaev V., Fominykh M., Martynkevich I. et. al. Prognostic Value of the Rate of BCR-ABL Decline for Patients with Chronic Myelogenous Leukemia in Chronic Phase on Tyrosine Kinase Inhibitors Treatment. Blood (56th ASH Annual Meeting Abstracts), 2014; 124 (21): 3148.
- Фоминых М.С., Шуваев В.А., Абдулкадыров К.М. и др. Прогностическое значение снижения индивидуального уровня BCR-ABL в течение первых трех месяцев терапии для достижения большого молекулярного ответа у больных хроническим миелолейкозом (ХМЛ) в хронической фазе (ХФ). Медицинская генетика. 2015; 14 (4) (154): 31-32.
- Fominykh M., Shuvaev V., Martynkevich I. et. al. The rate of BCR-ABL decline as an optimized predictor of outcome for patients with chronic myeloid leukemia in chronic phase on treatment with tyrosine kinase inhibitors. Haematologica 2015; 100 (s1): 444.


