Прогнозирование антимикробной активности пищевого пептида и оценка его эффективности in vitro
Автор: Мерзлякова Н. В., Тихонов С. Л., Тихонова Н. В., Пестова И. Г., Кулагова Е. П.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология пищевых продуктов и биологически активных веществ
Статья в выпуске: 3 т.26, 2023 года.
Бесплатный доступ
Пищевые антимикробные пептиды (АМП) актуальны при лечении бактериальных инфекций и имеют ряд преимуществ в сравнении с лекарственными средствами: более медленное возникновение резистентности у штаммов бактерий, высокая активность в отношении антибиотикопленки и иммуномодулирующие свойства. К физико-химическим свойствам, обусловливающим антимикробные свойства, относятся: катионный заряд, гидрофобность, молекулярная масса и аминокислотная последовательность. Перспективным источником АМП являются молочные белки, в частности, белки молозива коров. Цель работы – выделение из пепсинового гидролизата молозива коров пептида, прогнозирование его антимикробной активности с использованием биоинформационного подхода и подтверждение его эффективности in vitro. Молекулярно-массовое распределение пептида оценивали масс-спектрометрическим методом. Микросеквенирование осуществляли с использованием секвенатора MiSeq. Моделирование пространственной структуры выделенного пептида – с помощью программы молекулярного моделирования Schrodinger Maestro. Антимикробную активность пептида изучали диско-диффузионным методом на грамположительных и грамотрицательных бактериях. Из пепсинового гидролизата молозива коров выделен пептид, который отсутствует в известных протеомных базах Protein NCBI и AVPdb и, соответственно, биологическая активность и функции его не исследованы. Полученный пептид относится к линейным альфа-спиральным пептидам, состоит из 11 аминокислот ANRKLRANKSR, молекулярная масса – 8,2 кДа, изоэлектрическая точка на уровне 12,79, заряд +5 (катионный), гидрофильность (гидрофобность) +20,84 Ккал*моль-1. В результате исследований in vitro установлено, что выделенный пептид обладает антимикробной активностью в отношении E. coli ATCC 25922 и B. subtilis и противогрибковым действием к C. albicans.
Антимикробный пептид, структура, заряд, аминокислотная последовательность, молекулярная масса, antimicrobial peptide, structure, charge, amino acid sequence, molecular weight
Короткий адрес: https://sciup.org/142238263
IDR: 142238263 | УДК: 636.03 | DOI: 10.21443/1560-9278-2023-26-3-232-241
Текст статьи Прогнозирование антимикробной активности пищевого пептида и оценка его эффективности in vitro
Мерзлякова Н. В. и др. Прогнозирование антимикробной активности пищевого пептида и оценка его эффективности in vitro. Вестник МГТУ. 2023. Т. 26, № 3. С. 232–241. DOI:
Пищевые антимикробные пептиды (АМП) становятся более актуальными при лечении бактериальных инфекций и имеют ряд преимуществ в сравнении с лекарственными средствами: медленное возникновение резистентности у штаммов бактерий, высокая активность в отношении антибиотикопленки и иммуномодулирующие свойства. Поскольку AMП имеют белковую природу, их можно относительно легко спроектировать и синтезировать. В качестве недостатка использования AMП следует отметить низкую стабильность к действию протеолитических ферментов желудочно-кишечного тракта ( Magana et al., 2020 ) .
Антимикробная активность пептидов связана с физико-химическими свойствами, в частности, катионным зарядом и гидрофобностью ( Lee et al., 2018 ) . Положительный заряд улучшает взаимодействие с отрицательно заряженной поверхностью клетки, а высокая гидрофобность позволяет пептидам проходить сквозь мембраны бактериальных клеток. Важным фактором, влияющим на антимикробную активность пептидов, является аминокислотная последовательность ( Porto et al., 2018 ) .
Целесообразно кратко рассмотреть механизм действия АМП, который по данным ( Silva et al., 2017 ) заключается в следующем:
-
– разрушение бактериальной мембраны с образованием пор или с помощью электропорации;
-
– взаимодействие с бактериальными компонентами и индукция гибели клеток;
-
– ингибирование биосинтеза клеточной стенки.
Следует отметить, что АМП эффективно действуют в комбинации с другими лекарственными средствами ( Magana et al., 2020; Gaglione et al., 2020; Mehta et al., 2022 ).
Для прогнозирования биологической активности пептидов, в том числе АМП, применяют биоинформационный подход, основанный на использовании протеомных баз данных, в частности, PeptideCutter, Protein NCBI, BIOPEP, AVPdb и других.
В качестве источника АМП используется ферментированный пепсином или трипсином соевый белок ( Соколов и др., 2023 ), белок мяса и мясопродуктов ( Chernukha et al., 2020 ), белок яичного альбумина ( Жамсаранова и др., 2021 ), ферменты бактериофагов ( Peng et al., 2017 ) .
Одним из перспективных источников АМП являются молочные белки, в частности, белки молозива коров ( Flom et al., 2019; Yang et al., 2019 ). Следует отметить, что нативные молочные белки – казеин (CN), β-лактоглобулин (BLG) и α-лактальбумин (ALA) – могут вызывать пищевую аллергию ( Hattori et al., 2004 ) .
После ферментативного гидролиза молочного белка полученные пептиды, как правило, не содержат эпитопы аллергенов ( Picariello et al., 2013 ) .
Важным фактором, обусловливающим использования молозива коров в качестве источника АМП, является то, что оно содержит пептиды и белки с прямым противомикробным действием ( Stelwagen et al., 2009 ) .
Целью работы является выделение из пепсинового гидролизата молозива коров пептида, прогнозирование его антимикробной активности с использованием биоинформационного подхода и подтверждение его эффективности in vitro.
Материал и методы
Для выделения пептида использовали молозиво коров черно-пестрой породы, отобранное через 4 часа после отела (агрокомплекс Аверино, Свердловская область).
В качестве белка-предшественника использовали лактоферрин. Гидролиз белков молозива проводили по следующим параметрам: продолжительность – 4,5 ч, количество фермента (пепсин, КФ 3.4.23.1, активность 1 200 ЕД (Сигма, Германия)) - 3,6 %, pH = 1,6; t = 39 ° C. Математическое моделирование процесса гидролиза белков молозива и прогнозирование биологической активности полученных пептидов проводили с помощью программы Microsoft Excel 2021 с учетом авторской программы исследователей ( Агаркова и др., 2023 ) и с использованием баз данных белков APD, BIOPEP, Protein NCBI, PeptideCutter, противовирусных пептидов CSIR и других.
Для исследования пептидного состава ферментативного гидролизата молозива коров удаляли осадок центрифугированием при 3 900 об/мин в течение 5 мин и работали с надосадочной жидкостью и осадком. Надосадочную жидкость разделяли методом препаративной хроматографии на силикагеле 60 PF 254, элюэнт PBS и EtOH в изократическом соотношении 9 : 1.
Далее изучение белкового состава надосадочной жидкости ферментативного гидролизата молозива проводили осаждением белков сульфатом аммония. После осаждения образцы центрифугировали (3 900 об/мин в течение 5 мин) и собирали белковый осадок. Белковый осадок гидролизата, полученный при центрифугировании гидролизата молозива, и осадок надосадочной жидкости очищали от солей и неорганических примесей на колонке с Amberlit XAD2, элюэент: Буфер А: 10 mM CH3COONa pH = 6; 10 mM CH3COONa pH = 4; 10 mM KCl/HCl pH = 1,5 с градиентом соли буфер А + 0,2 %, 0,4 %, 1 % NaCl.
Фракции каждого образца изучали на наличие белка методом Брэдфорда. Полученные фракции пептидов из раствора образцов были разделены методом препаративной хроматографии на силикагеле, элюэнт PBS и EtOH в изократическом соотношении 9 : 1 соответственно.
В результате гидролиза было получено 9 пептидов с содержанием (мг/мл гидролизата) и чистотой более 95,4 %: LREGIKNK (1,9), ANRKLRANKSR (3,4), MANRKLRARSR (1,6), MRKAKCCIR (1,7), YKTVTWVCLNDFFPKKDSLDYVLK (1,6), PAFAASSSKA (1,4), IRHGRCVSCSR (2,2), EKLAKNKLARGLKRK (2,1), LRQLSVVVAYKGKDVGLNDCEEADRHKSSHRDEVSSFRRNSYSIYENHGP SAKCAREVGR (0,8).
При прогнозировании антимикробной активности пептидов с использованием баз данных Protein NCBI и AVPdb установлено, что пептид ANRKLRANKSR, возможно, обладает антимикробными свойствами. В связи с этим он был использован для дальнейших исследований.
Молекулярно-массовое распределение пептида оценивали масс-спектрометрическим методом и идентифицировали методом MALDI-TOF на MALDI-времяпролетном масс-спектрометре Ultraflex (Bruker, Германия). Анализ масс-спектров проводили с помощью программы Mascot, опция Peptide Fingerprint (Matrix Science, США) с использованием базы данных Protein NCBI. Микросеквенирование – с использованием секвенатора MiSeq (Illumina, США) и системы для высокопроизводительного секвенирования PGM Ion Torrent и системы спектрофотометрической оценки качества образца (Life Technologies, США).
Моделирование пространственной структуры выделенного пептида осуществляли с помощью программы молекулярного моделирования Schrodinger Maestro (США).
Антимикробную активность пептида в концентрации изучали диско-диффузионным методом на грамположительных и грамотрицательных бактериях. В качестве тест-штаммов выбраны Escherichia coli , грамположительная бактерия Bacillus subtilis и гриб C. albicans . Культивирование штаммов бактерий проводили на плотной питательной среде LB (агар – 1,5 %, триптон – 1 %, дрожжевой экстракт – 0,5 %, NaCl – 1 %) и жидкой питательной среде LB (триптон – 1 %, дрожжевой экстракт – 0,5 %, NaCl – 1 %) при температуре 37 ºC. Тест-штамм высевали на агаризованную питательную среду газоном. Одновременно на газон помещали пептид в количестве 27 мг, так как указанная концентрация пептидов молозива коров показала высокую эффективность по снижению интернационализации лентивируса в геном клетки и взаимодействия с рецепторами для проникновения в мембрану ( Тихонов, 2023 ). В качестве контроля использовался бумажный диск с питательной средой; в качестве препарата сравнения – диск с антибиотиком (канамицин из стандартного набора). Чашки Петри инкубировали при температуре, соответствующей оптимальной температуре роста каждого тест-штамма микроорганизма, в течение 24,0 ± 0,5 ч. Результаты учитывались по наличию и размеру (в мм) прозрачной зоны отсутствия роста микроорганизмов вокруг диска.
Результаты и обсуждение
Из пепсинового гидролизата молозива коров выделен пептид, который отсутствует в известных протеомных базах Protein NCBI и AVPdb и его биологическая активность и функции не исследованы.
По данным ( Moretta et al., 2021 ) механизмы действия АМП зависят от различных физико-химических свойств: молекулярная масса, заряд, структура, длина аминокислотной последовательности, гидрофобность и аминокислотный состав.
На основании анализа масс-спектра пептида (рис. 1) определены состав аминокислотной последовательности и молекулярная масса пептида.
На рис. 1 представлен масс-спектр пептида.
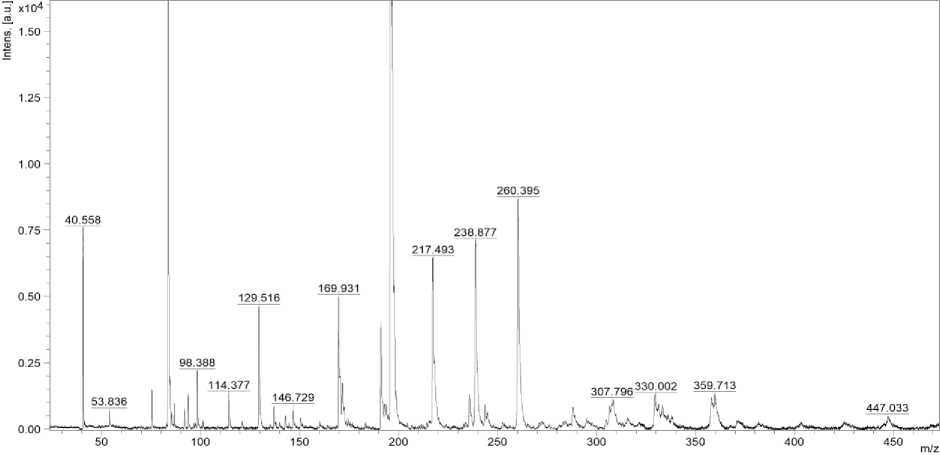
Рис. 1. Масс-спектр пептида
Fig. 1. Mass spectrum of the peptide
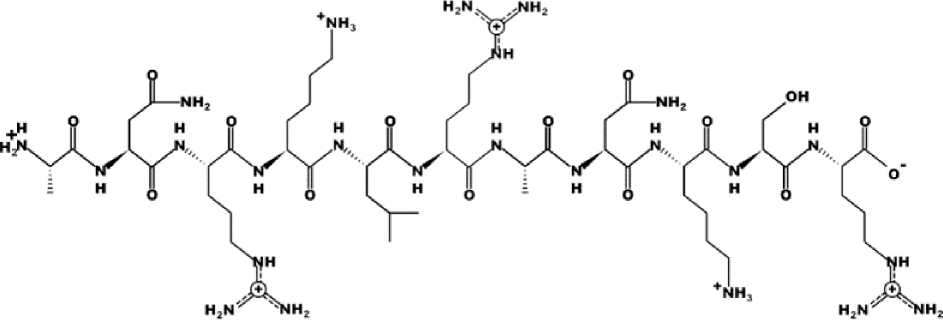
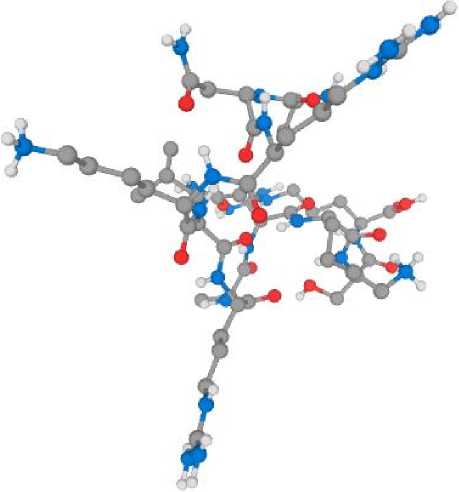
При моделировании структуры пептида (рис. 2) удалось определить его заряд, гидрофобность и изоэлектрическую точку.
а
б
Рис. 2. Двухмерная ( a ) и трехмерная ( б ) структура пептида
Fig. 2. Two-dimensional ( a ) and three-dimensional ( б ) structure of the peptide
Полученный пептид относится к линейным альфа-спиральным пептидам и состоит из 11 аминокислотных последовательностей ANRKLRANKSR, его молекулярная масса – 8,2 кДа, изоэлектрическая точка на уровне 12,79, заряд +5 (катионный), гидрофильность (гидрофобность) +20,84 Ккал*моль–1.
Можно предположить, что пептид обладает антимикробными свойствами, так как большинство АМП относятся к линейным α-спиральным пептидам ( Mishra et al., 2018 ), аминокислотная последовательность включает менее 50 аминокислот, пептид имеет молекулярную массу менее 10 кДа и положительный заряд (катионный) ( Travis et al., 2000 ) .
По данным ( Dürr et al., 2006 ) АМП являются катионными и способны связываться с отрицательно заряженным внешним листком микробной мембраны, приводя к ее разрушению .
Катионные пептиды предоставляют новые возможности в лечении инфекций, вызванных грамотрицательными патогенами, поскольку они часто могут проницать анионные ЛПС внешней мембраны, что приводит к лизису клеток. Аналогичным образом AMП могут действовать как усилители антимикробной активности обычных антибиотиков в отношении грамотрицательных патогенов ( Bhattacharjya et al., 2020 ). Однако некоторые грамотрицательные бактерии обладают врожденной устойчивостью к катионным АМП, связанной с изменениями ЛПС наружной мембраны ( Ghimire et al., 2022 ) .
Для пептидов с α-спиралью характерен механизм действия на основе модели бочкообразных пор (рис. 3), в которой α-спираль создает вертикальные поры поперек мембраны, а пептиды накапливаются в бочкообразных агрегатах, демонстрирующих водопроницаемые и трансмембранно ориентированные поры (Mink et al., 2021; Zhang et al., 2021).
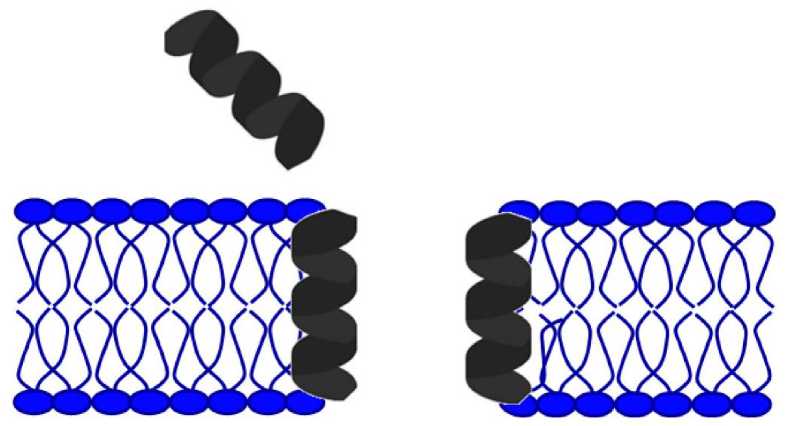
Рис. 3. Модель бочкообразных пор в мембране бактериальных клеток под действием антимикробных пептидов
Fig. 3. A model of barrel-shaped pores in the membrane of bacterial cells under the action of antimicrobial peptides
В последние годы поиск пептидных последовательностей с известными биологическими свойствами стал очень популярным, и соответствующие подходы постоянно разрабатываются. Авторами ( Yan et al., 2022 ) представлены передовые вычислительные стратегии и выделены две группы исследовательских подходов: во-первых, открытие новых пептидов из встречающихся в природе последовательностей, во-вторых, разработка искусственных пептидов путем модификации известных или разработки de novo . Подход к открытию AMП предсказывает потенциальные пептиды путем виртуального скрининга больших библиотек известных пептидов, в частности, в поисках пептидов, которые структурно наиболее близки по последовательности к известным AMP.
Следует отметить, что помимо положительного заряда и гидрофобности альфа-спиральные пептиды могут иметь различные аминокислотные последовательности, что приводит к усилению цитолитического и антибактериального эффектов ( Pino-Angeles et al., 2016 ).
В табл. 1 представлен аминокислотный состав последовательности пептида.
Таблица 1. Аминокислотный состав последовательности пептида Table 1. Amino acid composition of the peptide sequence
|
Наименование показателя аминокислотного состава последовательности пептида |
Аминокислотный состав |
|
Гидрофобная аминокислота |
I: 0 V: 0 L: 1 F: 0 C: 0 M: 0 A: 2 W: 0 |
|
Количество G и Р |
G: 0 P: 0 |
|
Отрицательно заряженная аминокислота |
E: 0 D: 0 |
|
Положительно заряженная аминокислота |
K: 2 R: 3 H: 0 |
|
Другая аминокислота |
T: 0 S: 1 Y: 0 Q: 0 N: 2 |
Анализ аминокислотной последовательности позволяет утверждать, что в пептиде содержатся 2 гидрофобные аминокислоты, которые обеспечивают ему высокий уровень гидрофобности и обусловливают антимикробную активность.
Исследуемый нами пептид имеет аминокислотную последовательность KL, что свидетельствует о возможных противомикробных свойствах, так как вышеуказанная последовательность повторяется 5 раз в известном и испытанном антимикробном пептиде, состоящем из 18 аминокислот LKLLKKLLKKLKKLLKKL, разработанным и полученным синтетическим путем ( Blondelle et al., 1992 ) . Также подтверждением наличия антимикробной активности исследуемого пептида является то, что последовательность KL присутствует еще в одном известном пептиде Ac-LKLLKKLLKKLKKLLKKL-NH 2 , обладающем бактерицидным действием в отношении E. coli и P. aeruginosa ( Yan et al., 2022 ), и в антимикробных пептидах G-A и G-G в отношении MCF7, A549, E. coli и С. aureus ( Liu et al., 2022; Dean et al., 2020; Tucs, 2020 ).
Проведены исследования антимикробной и противогрибковой активности пептида (табл. 2).
Таблица 2. Антимикробная и противогрибковая активность пептида Table 2. Antimicrobial and antifungal activity of the peptide
|
Наименование образца |
Диаметр зоны лизиса, мм |
||
|
E. coli ATCC 25922 |
B. subtilis |
C. albicans |
|
|
Пептид |
18 |
17 |
12 |
|
Контроль |
0 |
0 |
0 |
|
Антибиотик "Канамицин" |
22 |
24 |
Не исследовали |
|
Противогрибковый препарат "Флуконазол" |
Не исследовали |
Не исследовали |
26 |
В результате исследований in vitro установлено, что выделенный пептид обладает антимикробной активностью в отношении E. coli ATCC 25922 и B. subtilis и противомикробным действием к C. albicans. Так, зона лизиса бактерий под действием пептида составила 18 и 17 мм, но в то же время она ниже на 18,2 и 29,2 % по сравнению с действием антибиотика "Канамицин". Под действием пептида происходит гибель C. albicans (зона лизиса 12 мм), что меньше на 53,8 % по сравнению с действием противогрибкового препарата "Флуконазол".
Следовательно, предложенная нами на основании физических свойств пептида и аминокислотной последовательности гипотеза о его противомикробном действии подтверждена в эксперименте in vitro .
Заключение
За последние несколько десятилетий возрос научный интерес к биоактивным пептидам пищевого происхождения в качестве альтернативы фармакологическим методам лечения заболеваний бактериальной этиологии, которые представляют серьезную проблему для здоровья человека во всем мире, так как антибиотикорезистентность возрастает. АМП можно рассматривать как потенциальные противомикробные средства, поскольку они обладают другим механизмом действия в сравнении с антибиотиками. В модели "бочкообразные поры" AMП образуют пучок, который вставляется в мембрану для образования гидрофильной поры, при этом гидрофобные остатки взаимодействуют с липидами, а полярные остатки обращены к каналу поры. Выделенный нами из пепсинового гидролизата молозива коров катионный альфа-спиральный пептид обладает антимикробными и противогрибковыми свойствами, менее выраженными по сравнению с общепринятыми препаратами. Возможно, антимикробную активность полученного пептида можно усилить за счет химических модификаций, в частности, дополнительного введения аминокислотных последовательностей с противобактериальными свойствами. Такой АМП пептид можно получить путем использования методов in silico , что позволит после проведения исследований цитотоксичности/токсичности и противомикробной активности in vitro и in vivo использовать его как профилактическое антибактериальное средство в составе пищевой продукции.
Конфликт интересов


