Прогнозирование гестационных и перинатальных осложнений на основе определения фактора роста плаценты
Автор: Игитова М.Б., Абзалова Н.А., Кореновский Ю.В., Фильчакова О.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2-1 т.26, 2011 года.
Бесплатный доступ
На основании обследования 102 беременных с гестационными осложнениями и 50 женщин с физиологической беременностью установлено, что патологическое течение беременности сопровождается снижением концентрации фактора роста плаценты в сыворотке крови. Наиболее выраженное снижение уровня маркера наблюдалось у женщин с неблагоприятными перинатальными исходами. Оценка клинической информативности теста позволила установить диагностический порог концентрации маркера для прогнозирования перинатальных исходов: при снижении концентрации плацентарного фактора роста в 28-32 недели менее 350 пкг/мл риск неблагоприятного перинатального исхода увеличивается 3,7 раза. Включение данного маркера в программу обследования беременных позволяет объективно оценивать риск развития осложнений гестации и перинатальных заболеваний и может оказать помощь в выборе срока и способа родоразрешения, которые во многом должны определяться функциональным состоянием фето#плацентарного комплекса.
Беременность, фактор роста плаценты, перинатальные осложнения, рregnancy
Короткий адрес: https://sciup.org/14919462
IDR: 14919462 | УДК: 618.3
Текст научной статьи Прогнозирование гестационных и перинатальных осложнений на основе определения фактора роста плаценты
Ранняя диагностика осложнений беременности и возможность прогнозирования их развития остаются актуальными проблемами современного акушерства. Перспективным направлением в изучении регуляции, а, следовательно, и управляемости гестационных процессов, является исследование функциональной значимости ро- стовых факторов. Биологической роли факторов роста – клеточных полипептидов, способных стимулировать или тормозить рост тканей, – в последние годы отводится важное значение как в общей физиологии и патологии человека, так и в морфофункциональном становлении фето-плацентарного комплекса при беременности [3–6, 8]. Известно, что с наступлением беременности в области имплантации запускается важнейший биологи- ческий процесс – ангиогенез, обеспечивающий нормальное развитие сосудистой сети и формирование плаценты [2]. Ключевую роль в данном процессе играет система сосудисто-эндотелиальных факторов роста, к числу которых относится фактор роста плаценты (ФРП, P1GF). С одной стороны, данные факторы являются стимуляторами ангиогенеза, а с другой, посредством аутокринного механизма регулируют инвазию, дифференцировку и метаболическую активность трофобласта в период формирования, роста и развития плаценты [6, 7, 9]. Это обусловливает значимость определения факторов роста как ранних маркеров плацентарной недостаточности.
Цель исследования: оценить клинико-диагностическое значение концентрации фактора роста плаценты для прогнозирования гестационных и перинатальных осложнений.
Материал и методы
Проведено проспективное безвыборочное обследование 152 женщин, находившихся на диспансерном учете по беременности. У всех пациенток проведен сравнительный анализ анамнестических данных, результатов клинического, лабораторного и ультразвукового обследования, исходов беременности и родов. После завершения беременности в зависимости от особенностей ее течения и исхода женщины были разделены на следующие клинические группы: I группу составили 66 женщин, беременность у которых протекала с различными акушерскими осложнениями (угрозой прерывания беременности, гестозом, нарушением состояния плода) и завершилась неблагоприятным перинатальным исходом: преждевременными родами, рождением доношенных детей с пренатальной гипотрофией, заболеваниями постгипоксического генеза или их сочетанием; II группу составили 36 женщин, беременность у которых также имела осложненное течение, но завершилась рождением здоровых доношенных детей; III группу составили 50 женщин с физиологическим течением и исходом беременности.
Статистическую обработку результатов проводили с использованием компьютерных программ Sigma Stat 3.5, STATISTIСA 6.0 для Windows. Нормальность распределения в группах оценивали по критерию Шапиро–Уилки (W-тест). Результаты работы представлены в виде значений M (средняя арифметическая) ±m (ошибка средней). Критический уровень достоверности (p) принимался равным 0,05. Понятие клинической информативности фактора роста плаценты, как показателя фето-плацентарно- го гомеостаза, включало комплекс рассчитываемых с позиций клинической эпидемиологии (доказательной медицины) характеристик – относительного риска (IP-ratio, ОР), чувствительности, специфичности, отношения правдоподобия (likelihood ratio, ОП), диагностического порога (cut-off level). Общепринятым способом оценки клинической информативности диагностических тестов является ROC-анализ (receiver operating characteristic analysis), для которого в настоящее время разработаны специальные компьютерные программы. Наилучшей программой в этой группе, по мнению специалистов, является MedCalc (9.1.0.1) для Windows [10], которую мы применили в нашей работе.
Результаты и обсуждение
По возрастным характеристикам, социальному статусу и акушерскому паритету беременные в группах сравнения существенных различий не имели. Возраст беременных варьировал в пределах от 17 до 42 лет. Средний возраст женщин I группы составил 25,7±0,3 года, II группы – 25,6±0,4 года, III группы – 25,8±0,4 года (p>0,05). В социальном статусе беременных существенных различий также установлено не было: во всех клинических группах преобладали служащие (60,6, 61,1 и 58,0%, p>0,05), удельный вес представительниц других социальных групп был сопоставимым. Однако обращаем внимание, что женщины, курящие и отказавшиеся от курения в период беременности, были только в I и II группах (11 и 4 беременные, что составляет 16,7 и 11,1% соответственно, p<0,05 в сравнении с III группой).
При анализе особенностей акушерско-гинекологического анамнеза выявлено, что частота всех гинекологических заболеваний у пациенток сравниваемых групп была практически одинаковой. В то же время при оценке акушерского анамнеза был установлен ряд существенных различий. У пациенток I и II групп значительно чаще регистрировались самопроизвольные аборты (15,2 и 16,7%, в III группе – 6,0%, p<0,05), а у повторнородящих женщин I и II групп достоверно чаще отмечался гестоз (35,3; 25,0 и 7,7%, p<0,05) и преждевременные роды (23,5; 12,5 и 0%, p<0,05). Частота искусственных абортов в анамнезе была в группах сравнения идентичной (40,9; 38,9 и 36,0%), но самопроизвольное прерывание беременности значительно чаще выявлялось у пациенток с гестационными осложнениями и неблагоприятным перинатальным исходом, чем у женщин с физиологической беременностью (31,9 и 6,0%, p<0,05).
При анализе соматической отягощенности установлено, что удельный вес большинства заболеваний в группах сравнения был практически одинаковым. Однако женщины I группы в сравнении как с пациентками II, так и III группы значительно чаще страдали гипертонической болезнью (10,6; 2,8 и 2,0%, p<0,05), а ожирение регистрировалось достоверно чаще в I и II группах в сравнении с III группой (19,7; 22,2 и 4,0% соответственно, p<0,05).
В ходе проведенного исследования установлено, что, несмотря на принципиально различный перинатальный исход, все осложнения гестационного процесса (ранний токсикоз, угроза прерывания беременности, гестоз) регистрировались у женщин как I, так и II групп. При этом у женщин с неблагоприятными перинатальными исходами в сравнении со II группой отмечается повышенная частота угрозы прерывания беременности, потребовавшей длительных и повторных госпитализаций (25,8 и 13,9% соответственно, p<0,05), а также гестоза средней и тяжелой степени (12,1% в I группе и 2,8% во II группе, p<0,05).
Общая частота преждевременных родов среди обследованного контингента составила 10,5% (у 16 пациенток), при этом 6 беременным I группы было предпринято досрочное оперативное родоразрешение, показаниями к которому послужили предлежание плаценты, осложнившееся кровотечением (1 случай), декомпенсированное нарушение состояния плода (1 случай) и неэффективность терапии и прогрессирующее течение гестоза (4 случая).
Показатель перинатальной заболеваемости в рамках нашего исследования составил 434,2‰. Показатель перинатальной смертности составил 6,6‰ и был представлен одним случаем ранней неонатальной смертности недоношенного ребенка вследствие тяжелого респираторного дистресс-синдрома.
Среди детей, рожденных с теми или иными заболеваниями (n=66), у 30 (45,5%) наблюдалась пренатальная гипотрофия и у 41 (62,1%) имело место перинатальное поражение центральной нервной системы, тяжесть которого в 58,5% случаев была расценена как средняя или тяжелая. Таким образом, в структуре заболеваний новорожденных доминирующими нозологическими формами были постгипоксические осложнения и задержка развития плода, которые с позиций современной перинатологии рассматриваются как результат нарушения основных функций плаценты – дыхательной и трофической.
На сегодняшний день в практической деятельности наиболее распространенным способом диагностики, дающим объективную информацию о морфологическом и функциональном состоянии фето-плацентарного комплекса и позволяющим выявлять доклинические нарушения жизнедеятельности плода, является одновременное использование двух ультразвуковых методов: эхографии и допплерометрии. Исследования выполнены в рамках стандартной программы обследования беременных в сроки гестации 12–14 недель, 22–24 недели и 32–35 недель; дополнительные исследования проводились вне зависимости от срока беременности в процессе лечения акушерских осложнений. Результаты ультразвукового исследования состояния фето-плацентарного комплекса во втором и третьем триместрах беременности (табл. 1) показали, что существенные различия в частоте выявления задержки роста плода у пациенток сравниваемых групп были установлены только в III триместре беременности. Во II триместре, несмотря на принципиально различный перинатальный исход, беременные по большинству параметров были сопоставимы. Кроме того, выраженные нарушения
Таблица 1
морфофункционального состояния фето-плацентарного комплекса на доклинической стадии плацентарной недостаточности у пациенток, родивших больных детей, выявлялись в единичных случаях.
Обращаем внимание, что частота гемодинамических нарушений плодово-плацентарного кровообращения (ППК) как во II, так и в III триместре в зависимости от перинатального исхода существенно не различалась, что свидетельствует о возможности транзиторного характера изменений и ставит под сомнение возможность своевременного и точного прогнозирования перинатальных осложнений указанным методом.
В целом, как показало наше исследование, патологические изменения морфофункционального состояния фето-плацентарного комплекса по результатам ультразвуковой диагностики во II триместре беременности выявлялись у 10 пациенток (15,2%) I группы и у 5 беременных (13,9%) II группы (p>0,05). В III триместре беременности выявляемость патологических изменений увеличилась соответственно до 30,3% (у 20 пациенток I группы) и 19,4% (у 7 женщины II группы, p>0,05). Следовательно, информативные ультразвуковые маркеры регистрируются у женщин с неблагоприятными перинатальными исходами достаточно поздно, и высокая информативность применяемых тестов очевидна только при тяжелых формах плацентарной недостаточности.
Результаты оценки функционального состояния плода в III триместре беременности и в родах по результатам комплексного ультразвукового обследования с использованием кардиотокографии (КТГ) в группах сравнения существенных различий не имели. Антенатальный дистресс плода, как показание к оперативному родораз-решению, регистрировался практически с идентичной частотой: у 2 пациенток I группы (3,0%) и одной женщины II группы (2,8%, p>0,05).
Проведенный анализ свидетельствует о недостатке пренатальной информации, характеризующей резервные функциональные возможности фето-плацентарного комплекса, что определяет необходимость поиска новых информативных маркеров плацентарной недостаточности с целью оптимизации лечения и родоразрешения беременных.
Частота нарушений состояния фето-плацентарного комплекса по результатам ультразвукового обследования в зависимости от перинатального исхода
|
Признак |
I группа (n=66) |
II группа (n=36) |
|||
|
Абс. |
% |
Абс. |
% |
||
|
Задержка роста плода |
во II триместре |
4 |
6,1 |
- |
|
|
в III триместре |
9 |
13,6** |
1 |
2,8 |
|
|
Многоводие и маловодие |
во II триместре |
7 |
10,6 |
3 |
8,3 |
|
Гемодинамические |
в III триместре |
8 |
12,1 |
6 |
16,7 |
|
нарушения ППК* |
во II триместре |
4 |
6,1 |
4 |
11,1 |
|
в III триместре |
11 |
16,7 |
4 |
11,1 |
|
|
Критическое нарушение ППК* |
2 |
3,0 |
|||
Примечание: ППК – плодово-плацентарное кровообращение; ** – достоверность различия, p<0,05.
Исследование сывороточной концентрации фактора роста плаценты показало, что у пациенток с физиологической беременностью (III группа) уровень данного фактора плацентарного ангиогенеза прогрессивно нарастал в процессе формирования и развития плаценты, достигал пика в 27–31 недели и несколько снижался к 32–35 неделям гестации (рис. 1). Максимальная скорость количественного прироста концентрации PlGF (более чем в 3 раза), отражающая процессы роста плаценты и увеличение объема плацентарного кровообращения, была отмечена во II триместре.
Из представленных на рисунке 1 данных также видно, что у пациенток с гестационными осложнениями, беременность которых завершилась рождением здоровых детей (II группа), существенные различия с III группой в показателях концентрации фактора роста плаценты отсутствовали. Тем не менее, в период формирования и интенсивного роста плаценты у них отмечена тенденция к снижению концентрации PlGF (149,7±19,8 пкг/мл и 170,1±25,7 пкг/мл в начале II триместра, p>0,05 и 345,8±57,2 пкг/мл и 436,0±53,1 пкг/мл в сроки с 21 по 26 недели, p>0,05).
Однако количественный прирост показателя в течение II триместра беременности у них был более выра- женным (в 4 раза), что, вероятно, является отражением компенсаторных реакций и усиленного ангиогенеза, и, следовательно, достаточных резервных возможностей плаценты.
У женщин с неблагоприятными перинатальными исходами (I группа) снижение экспрессии PlGF было выявлено уже в процессе формирования плаценты, сохранялось и прогрессировало на протяжении всей беременности, а максимальные значения показателя даже не достигали уровня, характерного для женщин с физиологической беременностью в сроки 21–26 недель. Этот факт указывает на нарушение процессов плацентарного ангиогенеза и, следовательно, неполноценность ее компенсаторных возможностей. Более того, существенные различия в концентрации маркера у беременных данной группы отмечались в сравнении не только с показателями у женщин, имевших физиологическое течение беременности, но и с уровнем фактора роста плаценты у пациенток с гестационными осложнениями, беременность которых завершилась рождением здоровых детей.
В таблице 2 представлена концентрация фактора роста плаценты в зависимости от характера гестационных осложнений.
Из представленных данных видно, что у пациенток с
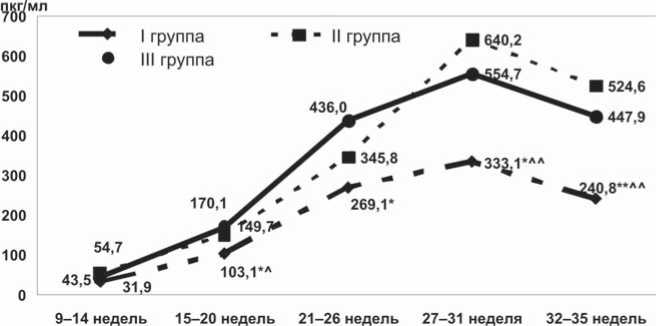
Рис. 1. Концентрация фактора роста плаценты в сыворотке крови у пациенток сравниваемых групп (пкг/мл)
Примечание: * – p<0,05; ** – p<0,01 – статистическая значимость различий с III группой; ^ – p<0,05; ^^ – p<0,01 – статистическая значимость различий со II группой.
Таблица 2
Уровень плацентарного фактора роста в сыворотке крови беременных в зависимости от варианта гестационных осложнений, пкг/мл (M±m)
|
Срок беременности |
Вариант осложненного течения беременности |
Физиологическая беременность (n=50) |
||
|
Угроза прерывания (n=36) |
Гестоз (n=39) |
Плацентарная недостаточность (n=27) |
||
|
9–14 недель |
37,6±5,4 |
36,5±5,7 |
31,3±6,4* |
43,5±4,9 |
|
15–20 недель |
108,3±16,1* |
98,3±12,8* |
111,2±13,9* |
170,1±25,7 |
|
21–26 недель |
251,5±39,9* |
279,6±39,7* |
281,1±56,9* |
436,0±53,1 |
|
27–31 недели |
398,5±68,8 |
353,0±62,5* |
324,7±60,3* |
554,7±77,0 |
|
32–35 недель |
369,8±55,5 |
299,6±45,4* |
238,0±34,6** |
447,9±39,9 |
Примечание: достоверность различия с физиологической беременностью: * – p<0,05; ** – p<0,01.
гестационными осложнениями, вне зависимости от характера патологического процесса, отмечалась тенденция к снижению продукции PlGF с ранних сроков беременности, и его уровень оставался таковым в течение всего периода гестации, достоверно отличаясь во II и III триместрах от показателей у женщин с физиологической беременностью. Снижение сывороточной концентрации фактора роста плаценты у беременных с гестационными осложнениями косвенно свидетельствует об их прямой сопряженности с нарушением механизмов клеточной пролиферации в формирующейся и растущей плаценте, а однотипность выявленных изменений отражает схожесть патогенетических механизмов, лежащих в основе формирования типичных акушерских осложнений. Проведенный анализ также позволяет заключить, что особенности клинического течения беременности являются косвенной характеристикой полноценности фето-плацентарного гомеостаза.
Полученные результаты позволяют подчеркнуть исключительно важную роль фактора роста плаценты в формировании и развитии фето-плацентарного комплекса и предположить, что определение данного маркера может служить информативным тестом для прогнозирования развития осложнений беременности и не- благоприятных перинатальных исходов. Мы произвели расчет клинической информативности теста с позиций клинической эпидемиологии в 12–13 недель беременности для составления прогноза развития осложнений гестации (табл. 3). Результаты ROC-анализа показали, что диагностический порог теста, судя по отношению правдоподобия, составил <=66,4 пкг/мл. С позиций доказательной медицины риск развития геста
Таблица 3
Клиническая информативность определения сывороточной концентрации фактора роста плаценты по результатам ROC-анализа
|
Сроки гестации (недели) |
Диагностический порог теста (пкг/мл) |
Чувствительность (%) |
Специфичность (%) |
+ОП (+LR) |
-ОП (-LR) |
|
12–13 |
<=66,4 |
59,1 (43,3–73,7) |
76,0 (54,9–90,6) |
2,46 |
0,54 |
|
28–32 |
<=350,0 |
74,3 (56,7–87,5) |
96,3 (81,0–99,0) |
20,06 |
0,27 |
Примечание: +ОП – положительное отношение правдоподобия; -ОП – отрицательное отношение правдоподобия; в скобках – 95%-й доверительный интервал.
ционных осложнений при показателе сывороточной концентрации фактора роста плаценты в 12–13 недель <=66,4 пкг/мл возрастал 1,6 раза (ОР=1,57; 95% ДИ 1,03– 2,08).
В своих исследованиях мы также поставили задачу определить диагностический порог концентрации фактора роста плаценты в период его “пиковой” продукции и произвели расчет клинической информативности теста в сроки беременности от 28 до 32 недель (30,6±1,7 недели). Результаты исследования показали, что у пациенток с неблагоприятными перинатальными исходами сывороточная концентрация фактора роста плаценты составила 313,8±23,5 пкг/мл. В то же время у женщин, родивших здоровых детей, показатель был выше и составил 558,8±47,9 пкг/мл (p<0,01). Результаты ROC-анализа позволили установить диагностический порог теста, который, судя по отношению правдоподобия, в 28–32 недели беременности составил <=350,0 пкг/мл.
С позиций доказательной медицины риск неблагоприятного перинатального исхода при показателе сывороточной концентрации фактора роста плаценты в 28– 32 недели <=350 пкг/мл возрастал в 3,7 раза (ОР=3,74; 95% ДИ 2,12–6,61).
Таким образом, сывороточная концентрация фактора роста плаценты характеризует начальные признаки патологических изменений в фето-плацентарном комплексе. Включение данного маркера в программу обследования беременных позволит обеспечить доклиническую диагностику и возможность своевременной коррекции плацентарной недостаточности для снижения частоты и степени тяжести гестационных осложнений, перинатальной заболеваемости и летальности. Определение сывороточной концентрации фактора роста плаценты также может оказать помощь в выборе срока и способа родоразрешения для оптимизации перинатальных исходов, которые во многом должны определяться функциональным состоянием фето-плацентарного комплекса.
Выводы
-
1. Все осложнения беременности, повышающие перинатальный риск, – угроза прерывания, гестоз, плацентарная недостаточность – сопровождаются снижением сывороточной концентрации фактора роста плаценты в сравнении с показателями физиологической беременности.
Концентрация фактора роста плаценты позволяет объективно оценивать риск развития осложнений гестации и перинатальных заболеваний. При показателе концентрации плацентарного фактора роста в 28– 32 недели менее 350 пкг/мл риск неблагоприятного перинатального исхода возрастает 3,7 раза.
Список литературы Прогнозирование гестационных и перинатальных осложнений на основе определения фактора роста плаценты
- Игнатко И.В., Рыбин М.В., Налбандян С.П. Профилактика и терапия плацентарной недостаточности и гестоза у беременных с гипертонической болезнью//Вопросы гинекологии, акушерства и перинатологии. -2008. -Т. 7, № 5. -С. 20-27.
- Никитина Л.А., Демидова Е.М., Радзинский В.Е. и др. Роль матриксных белков, цитокинов и факторов ангиогенеза маточно-плацентарного комплекса в регуляции имплантации и плацентации//Акушерство и гинекология. -2007. -№ 3. -С. 5-10.
- Шевченко А.О., Эль-Бустани С. Плацентарный фактор роста -маркер неоартериогенеза у больных ИБС//Лаборатория. -2007. -№ 4. -С. 3-5.
- Chang Y.T., Chang M.C., Wei S.C. et al. Serum vascular endothelial growth factor/soluble vascular endothelial growth factor receptor 1 ratio is an independent prognostic marker in pancreatic cancer//Pancreas. -2008. -Vol. 37, Nо. 2. -P. 145-150.
- Findley C.M., Mitchell R.G., Duscha B.D. et al. Plasma levels of soluble Tie2 and vascular endothelial growth factor distinguish critical limb ischemia from intermittent claudication in patients with peripheral arterial disease//J. Am. Coll. Cardiol. -2008. -Vol. 52, Nо. 5. -P. 387-393.
- Fitzgerald J.S., Busch S., Wengenmayer T. et al. Signal transduction in trophoblast invasion//Chem. Immunol. Allergy. -2005. -Vol. 88. -P. 181-199.
- Hill D.J., Petrik J., Arany E. Growth factors and the regulation of fetal growth//Obstet. Gynecol. -1998. -Vol. 92, Nо. 2. -P. 179-183.
- Lacal P.M., Morea V., Ruffini F. et al. Inhibition of endothelial cell migration and angiogenesis by a vascular endothelial growth factor receptor-1 derived peptide//Eur. J. Cancer. -2008. -Vol. 44, Nо. 13. -P. 1914-1921.
- Lala P.K., Lysiak J.J. Autocrine#paracrine regulation of human placental growth and invasion by locally active growth factors//Immunology of Human Reproduction. -1995. -P. 235-249.
- Stephan C., Wesseling S., Schink T. et al. Comparison of eight computer programs for receiver-operating characteristic analysis//Clin. Chem. -2003. -Vol. 43, Issue 3. -P. 433-439.


