Прогнозирование развития респираторных осложнений после резекции легкого
Автор: Тонеев Е.А., Шагдалеев Р.Ф., Комаров А.С., Мидленко В.И., Мидленко О.В., Исаев Д.Н.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Цель. Изучить частоту и структуру респираторных осложнений после резекции легкого, а также факторы, влияющие на их развитие. Материалы и методы. Исследование проведено на базе хирургического отделения торакальной онкологии ГУЗ ОКОД г. Ульяновска. В анализ были включены данные 468 пациентов, которым в период с 01.01.2021 по 31.12.2023 была выполнена лобэктомия или атипичная резекция по поводу новообразований посредством переднебоковой торакотомии. Результаты. Частота развития респираторных осложнений в послеоперационном периоде составила 19,02 %. При проведении однофакторного анализа было определено, что анамнез курения, пиковая объемная скорость (ПОС), прогнозируемый послеоперационный объем форсированного выдоха за 1 с (ппоОФВ1), продолжительность оперативного вмешательства и лобэктомия являются значимыми факторами для прогнозирования риска развития респираторных осложнений. При увеличении ПОС на 1 % вероятность возникновения респираторных осложнений уменьшалась в 1,080 раз (ОШ=1,080 (95 % ДИ 1,034–1,127)). Наличие хронической обструктивной болезни легких (ХОБЛ) увеличивало риски развития осложнений: при GOLD2 в 16,392 раза (ОШ=16,392 (95 % ДИ 2,686– 100,083), при GOLD3 в 35,082 раза (ОШ=35,082 (95 % ДИ 1,267–970,683). При проведении операции в объеме лобэктомии вероятность развития осложнений возрастала в 3,251 раза (ОШ=0,308 (95 % ДИ 0,105–0,899), p=0,031). Выводы. В проведенном исследовании частота развития послеоперационных респираторных осложнений составляла 19,02 %. Значимыми предикторами развития осложнений являются ХОБЛ (GOLD 2 и GOLD 3), ПОС и хирургическое вмешательство в объеме лобэктомии.
Торакотомия, резекция легкого, лобэктомия, респираторные осложнения
Короткий адрес: https://sciup.org/14132985
IDR: 14132985 | УДК: 616-089.1 | DOI: 10.34014/2227-1848-2025-2-37-54
Текст научной статьи Прогнозирование развития респираторных осложнений после резекции легкого
Введение. Несмотря на развитие хирургических методик и оптимизацию периопераци-онного ведения пациентов торакального профиля, проблема респираторных осложнений, возникающих после резекции легкого, остается актуальной. Их частота значительно варьирует и, по данным отечественных и зарубежных исследователей, составляет от 14 до 25 % [1, 2]. В хирургических центрах с большим количеством операций и хорошо отрабо- танной периоперационной программой ведения пациентов количество легочных осложнений меньше, чем в центрах с малым количеством вмешательств [3]. Также значимым фактором в последние десятилетия стало широкое внедрение миниинвазивных технологий, которые существенно уменьшают операционную травму, обеспечивая оптимальные условия для восстановления функционального состояния легких после операции [4].
В работах, посвященных оценке результатов лечения пациентов после резекции легкого, было отмечено, что при возникновении легочных осложнений госпитальная летальность составляет до 5–10 % [1, 2]. Изучение индивидуальных факторов, влияющих на развитие осложнений, проводилось многими исследователями. Наиболее часто в публикациях встречаются следующие: курение, наличие ХОБЛ, нарушение функции внешнего дыхания, объем выполненной резекции легкого, сниженные показатели функциональных проб [2, 5]. Немаловажными являются и интраоперационные параметры: объем кровопотери, время операции [6]. С учетом того, что некоторые факторы являются модифицируемыми и подвержены изменениям на предоперационном этапе, стратификация пациентов по уровню риска позволяет принимать необходимые меры для снижения вероятности развития послеоперационных легочных осложнений.
Цель исследования. Изучить частоту и структуру респираторных осложнений после резекции легкого, а также факторы, влияющие на их развитие.
Материалы и методы. Исследование выполнено на базе хирургического отделения торакальной онкологии ГУЗ Областной клинический онкологический диспансер (г. Ульяновск). В ретроспективный анализ включены данные 468 пациентов, в период с 01.01.2021 по 31.12.2023 перенесших хирургическое вмешательство в объеме лобэктомии или атипичной резекции легкого.
Хирургический доступ осуществлялся через стандартную боковую или переднебоковую торакотомию; выбор межреберного пространства был обусловлен локализацией опухоли и анатомическими особенностями пациента. Дренирование плевральной полости осуществлялось 1 дренажом, установленным в купол плевральной полости.
Медицинская документация и данные обрабатывались в соответствии с унифицированным протоколом исследования. Пациенты, не удовлетворявшие критериям включения или не имевшие полных клинических данных, были исключены.
Критерии включения: лобэктомия или атипичная резекция легкого; наличие необходимых сведений о клинических параметрах (время операции, объем кровопотери, имеющиеся отметки в медицинской документации о сопутствующей патологии, статус пациента по курению); конверсия в торакотомию при торакоскопических резекциях.
Критерии исключения: резекция элементов грудной клетки; пневмонэктомия; острая сердечно-легочная недостаточность в раннем послеоперационном периоде, не позволяющая адекватно оценить развитие респираторных осложнений; торакоскопическая резекция (в т.ч. исключены конверсии, выполненные по экстренным показаниям).
Антибактериальная терапия, в т.ч. анти-биотикопрофилактика, проводилась согласно рекомендациям Стратегии контроля антимикробной терапии. Контроль за заживлением осуществлялся ежедневно на перевязках, что было отражено в медицинской документации. При развитии пневмонии проводился обязательный бактериальный посев мокроты на флору и чувствительность к антибиотикам.
Прогнозируемый послеоперационный ОФВ1 (ппоОФВ1) в процентах от предоперационного значения рассчитывался следующим образом:
-
1) ппоОФВ1 (%) = (19 – количество удаляемых сегментов) / 19 × 100 или
-
2) ппоОФВ1 (%) = [1 – (S × 5,26 / 100)] × 100, где S – количество сегментов, которые планируется удалить.
Продленным сбросом воздуха (ПСВ), согласно рекомендациям Европейского сообщества торакальных хирургов (European Society of Thoracic Surgeons, ESTS), считали его поступление по дренажам более 5 сут после операции.
На основании определения осложнений STS/ESTS выделялись следующие категории и критерии послеоперационных респираторных осложнений [7]:
-
• Grade I: ателектаз, документированный клинически или рентгенологически;
-
• Grade II: пневмония, определяемая в соответствии с критериями, включающими
новый или прогрессирующий и постоянный инфильтрат, консолидацию или полость, обнаруженные на рентгенограммах грудной клетки, наличие по крайней мере одного из следующих признаков: лихорадка (>38 °C) без других признанных причин, лейкопения (<4000 лейкоцитов/мм3 ) или лейкоцитоз (<12000 лейкоцитов/мм3); для пациентов старше 70 лет изменение психического состояния с гнойной мокротой или изменением ее характера, увеличением или появлением необходимости отсасывания респираторных выделений; возникновение или ухудшение симптомов (одышка, тахипноэ и т.д.) или клинических признаков (хрипы, бронхиальные дыхательные шумы и т.д.);
-
• Grade III: респираторный дистресс-синдром взрослых (ОРДС);
-
• Grade IV: искусственная вентиляция легких более 48 ч;
-
• Grade V: сброс воздуха по дренажам более 5 дней;
-
• Grade VI: реинтубация;
-
• Grade VII: возвращение в отделение интенсивной терапии или необходимость трахеостомии;
-
• Grade VIII: эмпиема плевры;
-
• Grade IX: хилоторакс/бронхоплев-ральный свищ.
Под продленным плевральным выпотом подразумевали выделение серозного отделяемого по дренажу в объеме более 100 мл в течение более 5 сут при наличии расправленного легкого по данным рентгенографии ОГК и отсутствии продувания воздуха по дренажам.
Статистический анализ проводился с использованием программы StatTech v. 4.4.1 (ООО «Статтех», Россия).
Количественные показатели оценивались на соответствие нормальному распределению с помощью критерия Шапиро – Уилка (при числе исследуемых менее 50) или критерия Колмогорова – Смирнова (при числе исследуемых более 50).
В случае отсутствия нормального распределения количественные данные описывались с помощью медианы и нижнего и верхнего квартилей (Me [Q1; Q3]).
Категориальные данные описывались с указанием абсолютных значений и процентных долей. 95 % доверительные интервалы для процентных долей рассчитывались по методу Клоппера – Пирсона.
Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна – Уитни.
Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона (при значениях ожидаемого явления более 10), точного критерия Фишера (при значениях ожидаемого явления менее 10).
В качестве количественной меры эффекта при сравнении относительных показателей использовался показатель отношения шансов с 95 % доверительным интервалом (ОШ; 95 % ДИ).
Построение прогностической модели вероятности определенного исхода выполнялось при помощи метода логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент в скорректированном виде (adjusted) R² Найджелкерка.
Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
Различия считались статистически значимыми при p<0,05.
Модель логистической регрессии прошла машинное обучение на искусственном интеллекте (ИИ) до получения наилучших результатов чувствительности и обучаемости с защитой от переобучаемости и недообучаемости.
Калибровка модели оценивалась путем построения сглаженной калибровочной кривой с оценкой уровня наклона (Slope), максимальной и средней ошибок калибровки на ва-лидационном наборе данных. В ходе построения моделей проверялись допущения на ли- нейность независимых переменных и логарифма шансов (графический метод, тест Бокса – Тидвелла), выполнялась проверка на полное (квазиполное) разделение и мультиколлинеарность (через корреляционный анализ ковариат методом Спирмена и вычисление коэффициента инфляции дисперсии VIF).
Программирование выполнялось при помощи R 4.3.0 (R-Project).
Результаты. Медиана возраста исследуемых пациентов составила 64 года. Мужчин было 309 (66 %), женщин – 159 (34 %). Лобэктомия была выполнена в 192 (41 %) случаях, атипичная резекция – в 276 (59 %). Основные клинико-лабораторные данные участников представлены в табл. 1.
Хирургические параметры пациентов представлены в табл. 2.
Таблица 1
Table 1
|
Показатель / Parameter |
Респираторное осложнение / Respiratory complications |
p |
||
|
Наличие / Yes |
Отсутствие / No |
|||
|
Возраст / Age, Me [Q1; Q3] |
66,00 [60,00; 71,00] |
63,00 [57,00; 69,00] |
0,122 |
|
|
Пол, абс (%) Sex, abs. (%) |
Женский / Female |
31 (34,8) |
127 (33,5) |
0,932 |
|
Мужской / Male |
58 (65,2) |
252 (66,5) |
||
|
СД, абс (%) DM, abs. (%) |
Отсутствие / No |
82 (92,1) |
323 (85,42) |
0,250 |
|
Наличие / Yes |
7 (7,9) |
56 (14,8) |
||
|
ХОБЛ, абс (%) COPD, abs. (%) |
Отсутствие / No |
34 (38,2) |
148 (39,0) |
0,812 |
|
GOLD1 |
31 (34,8) |
150 (39,6) |
||
|
GOLD2 |
18 (20,2) |
66 (17,4) |
||
|
GOLD3 |
6 (6,8) |
15 (4,0) |
||
|
ИМТ, Me [Q1; Q3] BMI, Me [Q1; Q3] |
26,00 [24,00; 28,00] |
25,00 [23,00; 28,00] |
0,358 |
|
|
Гепатит, абс (%) Hepatitis, abs (%) |
Наличие / Yes |
2 (2,2) |
11 (2,9) |
0,367 |
|
Отсутствие / No |
87 (97,8) |
368 (97,1) |
||
|
Атеросклероз, абс (%) Atherosclerosis, abs. (%) |
Наличие / Yes |
55 (61,8) |
178 (47,0) |
0,114 |
|
Отсутствие / No |
34 (38,2) |
201 (53,0) |
||
|
Гистологический тип, абс (%) Histological type, abs (%) |
ДНО / BN |
15 (16,9) |
132 (34,8) |
0,550 |
|
ЗНО / MN |
74 (83,1) |
247 (65,2) |
||
|
Давление в ЛА, Me [Q1; Q3] PA pressure, Me [Q1; Q3] |
19,00 [15,00; 21,00] |
20,00 [15,00; 24,00] |
0,330 |
|
|
ФВ, Me [Q1; Q3] EF, Me [Q1; Q3] |
60,00 [58,00; 66,00] |
61,00 [57,00; 66,00] |
0,762 |
|
|
Курение, абс (%) Smoking, abs. (%) |
Наличие / Yes |
64 (72,0) |
198 (52,2) |
0,034* |
|
Отсутствие / No |
25 (28,0) |
181 (47,8) |
||
|
НЛИ, Me [Q1; Q3] NLR, Me [Q1; Q3] |
2,04 [1,66; 2,29] |
1,93 [1,46; 2,47] |
0,722 |
|
|
ПНИ, Me [Q1; Q3] PNI, Me [Q1; Q3] |
44,00 [41,00; 48,00] |
44,00 [41,00; 48,50] |
0,875 |
|
ТЛИ, Me [Q1; Q3] PLR, Me [Q1; Q3] |
188,00 [152,00; 241,00] |
196,00 [140,00; 240,00] |
0,679 |
|
Индекс Тиффно, Me [Q1; Q3] FEV1/FVC ratio, Me [Q1; Q3] |
73,00 [68,00; 82,00] |
76,00 [69,00; 83,00] |
0,333 |
|
ОФВ1 (%), Me [Q1; Q3] FEV1 (%), Me [Q1; Q3] |
81,00 [74,00; 88,00] |
84,00 [72,00; 94,00] |
0,230 |
|
ФЖЕЛ (%), Me [Q1; Q3] FVC (%), Me [Q1; Q3] |
115,00 [93,00; 120,00] |
117,00 [94,50; 120,00] |
0,905 |
|
ПОС (%), Me [Q1; Q3] PFR (%), Me [Q1; Q3] |
80,00 [57,00; 93,00] |
90,00 [81,00; 98,00] |
0,009* |
|
ЖЕЛ (%), Me [Q1; Q3] VC (%), Me [Q1; Q3] |
97,00 [83,00; 101,00] |
97,00 [81,00; 102,00] |
0,826 |
|
ппоОФВ1 (%), Me [Q1; Q3] pFEV1 (%), Me [Q1; Q3] |
65,53 [59,21; 75,00] |
74,21 [63,95; 83,37] |
0,014* |
Примечания: 1. СД – сахарный диабет, ХОБЛ – хроническая обструктивная болезнь легких, ИМТ – индекс массы тела, ДНО – доброкачественное новообразование, ЗНО – злокачественное новообразование, ЛА – легочная артерия, ФВ – фракция выброса, НЛИ – нейтрофильно-лимфоцитарный индекс, ПНИ – прогностический нутритивный индекс, ТЛИ – тромбоцитарно-лимфоцитарный индекс; ОФВ1 – объем форсированного выдоха за 1 с, ФЖЕЛ – форсированная жизненная емкость легких; ПОС – пиковая объемная скорость; ЖЕЛ – жизненная емкость легких, ппоОФВ1 – послеоперационный объем форсированного выдоха за 1 с. 2. * – различия статистически достоверны (p<0,05).
Notes: 1. DM – diabetes mellitus; COPD – chronic obstructive pulmonary disease; BMI – body mass index; BN – benign neoplasm; MN – malignant neoplasm; PA – pulmonary artery; EF – ejection fraction; NLR – neutrophil-to-lymphocyte ratio; PNI – prognostic nutritional index; PLR – platelet-to-lymphocyte ratio; FEV1 – forced expiratory volume in 1 second; FVC – forced vital capacity PFR – peak flow rate; VC – vital capacity; pFEV1 – postoperative forced expiratory volume in 1 second. 2.* – differences are statistically significant (p<0.05).
Таблица 2
Table 2 Хирургические параметры пациентов
Surgical parameters for patients
|
Показатель / Parameter |
Респираторное осложнение / Respiratory complications |
р |
||
|
Наличие / Yes |
Отсутствие / No |
|||
|
Объем кровопотери (мл), Me [Q1; Q3] Extent of blood loss (ml), Me [IQR] |
100,00 [100,00; 200,00] |
100,00 [100,00; 100,00] |
0,090 |
|
|
Продолжительность операции (мин), Me [Q1; Q3] Surgery duration (min), Me [Q1; Q3] |
90,00 [80,00; 115,00] |
65,00 [42,50; 112,50] |
0,023* |
|
|
Объем операции, абс (%) Surgery, abs. (%) |
АР / AR |
9 (31,0) |
266 (60,6) |
0,002* |
|
Лобэктомия / Lobectomy |
20 (69,0) |
173 (39,4) |
||
|
Хирургическое осложнение, абс (%) Surgical implications, abs. (%) |
Отсутствие / No |
28 (96,6) |
374 (85,2) |
0,089 |
|
Наличие / Yes |
1 (3,4) |
65 (14,8) |
||
|
Количество койко-дней, Me [Q1; Q3] Number of bed-days, Me [IQR] |
9,00 [8,00; 13,00] |
10,00 [8,00; 13,00] |
0,765 |
|
Примечания: 1. АР – атипичная резекция. 2.* – различия статистически достоверны (p<0,05).
Notes: 1. AR – atypical resection. 2.* – differences are statistically significant (p<0.05).
Клинико-анамнестические параметры пациентов
Clinical and anamnestic parameters for patients
Продолжительность операции и ее объем являются статистически значимыми предикторами развития послеоперационных респираторных осложнений.
Далее легочные осложнения были стратифицированы согласно классификации Cavi-en – Dindo (табл. 3).
Таблица 3
Table 3
Structure of pulmonary complications
|
Вид осложнения / Complications |
n |
% |
|
|
Малые осложнения / Minor complications |
|||
|
Grade I |
Пневмоторакс Pneumothorax |
2 |
7,0 |
|
Grade II |
Пневмония Pneumonia |
1 |
3,4 |
|
Продленный сброс воздуха (без операции) Persistent air leak (without surgery) |
44 |
13,8 |
|
|
Продленный плевральный выпот (без операции) Prolonged pleural effusion (without surgery) |
24 |
13,8 |
|
|
Ателектаз легкого / Atelectasis |
2 |
7,0 |
|
|
Большие осложнения / Major complications |
|||
|
Grade IIIA |
Продленный сброс воздуха (эндоскопическая коррекция) Persistent air leak (endoscopic correction) |
2 |
7,0 |
|
Продленный плевральный выпот (плевральная пункция) Prolonged pleural effusion (pleural puncture) |
3 |
10,4 |
|
|
Ателектаз легкого (эндоскопическая санация) Atelectasis (endoscope reprocessing) |
1 |
3,4 |
|
|
Grade IIIB |
Продленный сброс воздуха Persistent air leak |
3 |
10,4 |
|
Grade IVA |
Бронхоплевральная фистула Bronchopleural fistula |
1 |
3,4 |
|
Острая дыхательная недостаточность с коррекцией кислородом Acute respiratory failure with oxygen therapy |
1 |
3,4 |
|
|
ОРДС ARDS |
1 |
3,4 |
|
|
Grade IVB |
Тяжелая пневмония с ИВЛ Severe pneumonia with ALV |
1 |
3,4 |
|
Дыхательная недостаточность с сердечной недостаточностью Respiratory failure with cardiac failure |
1 |
3,4 |
|
|
Grade V |
Дыхательная недостаточность на фоне ТЭЛА мелких ветвей Respiratory failure due to PE of small branches |
1 |
3,4 |
|
Дыхательная недостаточность на фоне пневмонии Respiratory failure due to pneumonia |
1 |
3,4 |
|
|
Всего / Total |
89 |
100 |
|
Структура легочных осложнений
Примечание. ТЭЛА – тромбоэмболия легочной артерии.
Note. ARDS – acute respiratory distress syndrome; ALV – artificial lung ventilation; PE - pulmonary embolism.
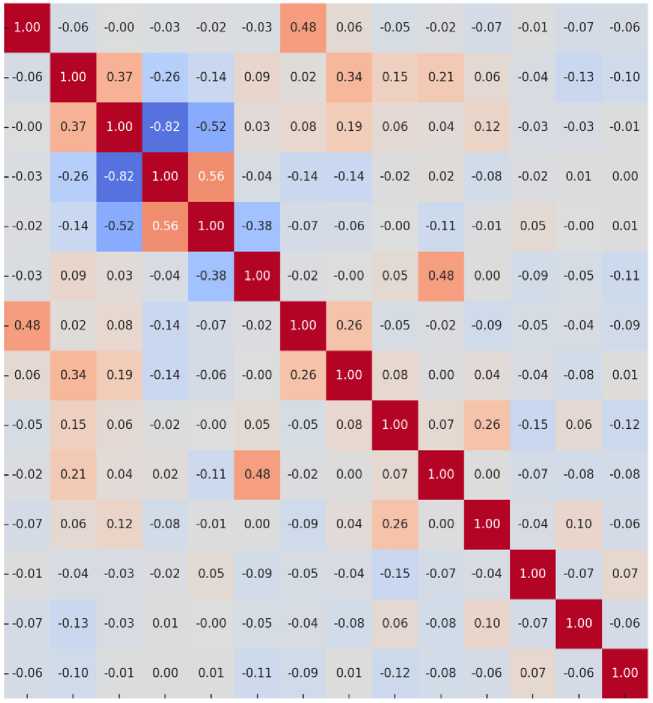
На рис. 1 изображена тепловая карта взаимосвязи между переменными: значения, мультиколлинеарности, которая отображает близкие к +1 или -1, указывают на сильную корреляцию, а значения, близкие к 0, свидетельствуют о слабой или отсутствующей связи. При анализе определено, что уровень мультиколлинеарности не превышает критических значений, т.е. можно утверждать, что включение данных переменных в модель ло- гистической регрессии не приведет к значительному искажению результатов. Таким образом, модель может быть использована для прогноза респираторных осложнений без значительных рисков возникновения мультиколлинеарности.
Пол
Возраст
ХОБЛ
ПОС (%)
ппоОФВ! (%)
Объем операции
Курение
Атеросклероз
СД
ЗНО/добро
Ожирение
ИЛИ
ТЛИ
ПНИ
и
Ф
о
ш
Ф
о
ф
ф
ГО
ГП
О

О
е о
о
О
I m
Рис. 1. Тепловая карта мультиколлинеарности. Рисунок представлен на русском языке
Fig. 1. Multicollinearity Heat Map. The figure is presented in Russian (пол – sex; возраст – age; ХОБЛ – chronic obstructive pulmonary disease; ПОС – peak flow rate; ппоОФВ1 – postoperative forced expiratory volume in 1 second; объем операции – surgery; курение – smoking; атеросклероз – atherosclerosis;
СД – diabetes mellitus; ЗНО/добро – malignant neoplasm/benign neoplasm; ожирение – obesity; НЛИ – neutrophil-to-lymphocyte ratio; ТЛИ – platelet-to-lymphocyte ratio; ПНИ – prognostic nutritional index)
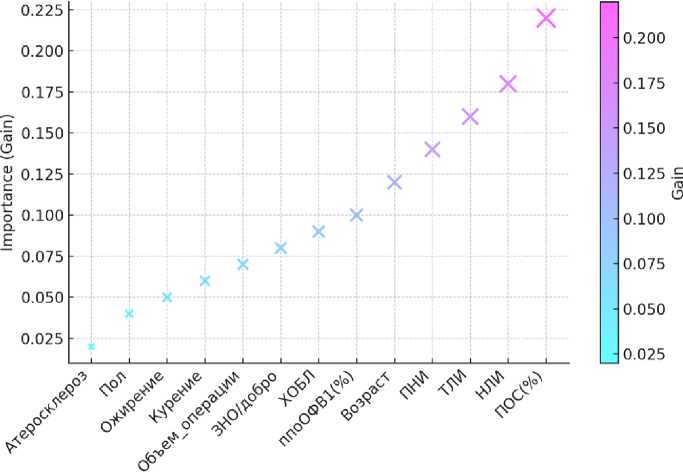
На рис. 2 представлена диаграмма важности признаков, полученная в результате анализа с использованием алгоритма Light Gradient Boosted Machine (LightGBM). Важность признаков оценивалась по критерию Gain, который отражает вклад каждого из них в улучшение модели. Чем выше значение Gain, тем более значи- мым является данный признак для точности предсказаний. Исходя из карты мультиколлинеарности и диаграммы важности признаков были определены факторы для построения логистической регрессии прогнозирования развития респираторных осложнений после резекции легкого. Результаты представлены в табл. 4.
LGBM Feature Importances
Feature
Рис. 2. Диаграмма важности признаков. Рисунок представлен на русском языке
Fig. 2. Feature importance diagram. The figure is presented in Russian
(пол – sex; возраст – age; ХОБЛ – chronic obstructive pulmonary disease; ПОС – peak flow rate; ппоОФВ1 – postoperative forced expiratory volume in 1 second; объем операции – surgery; курение – smoking; атеросклероз – atherosclerosis; ЗНО/добро – malignant neoplasm/benign neoplasm; ожирение – obesity; НЛИ – neutrophil-to-lymphocyte ratio; ТЛИ – platelet-to-lymphocyte ratio;
ПНИ – prognostic nutritional index)
Таблица 4
Table 4
Характеристики связи предикторов модели с вероятностью выявления респираторных осложнений
Correlation between model predictors and the probability of respiratory complications
|
Предиктор / Predictor |
Не связано / Unadjusted |
Связано / Adjusted |
||
|
COR; 95 % ДИ COR; 95 % CI |
p |
AOR; 95 % ДИ AOR; 95 % CI |
p |
|
|
ппоОФВ1 / pPEFV1 |
1,030; 1,005–1,054 |
0,017* |
1,012; 0,966–1,060 |
0,624 |
|
ПОС (%) / PFR (%) |
1,026; 1,007–1,045 |
0,007* |
1,080; 1,034–1,127 |
0,001* |
|
ХОБЛ: GOLD1 / COPD: GOLD1 |
1,119; 0,463–2,705 |
0,802 |
2,210; 0,818–5,972 |
0,118 |
|
ХОБЛ: GOLD2 / COPD: GOLD2 |
0,826; 0,295–2,314 |
0,715 |
16,392; 2,686–100,083 |
0,002* |
|
ХОБЛ: GOLD3 / COPD: GOLD3 |
0,547; 0,112–2,672 |
0,456 |
35,082; 1,267–970,683 |
0,036* |
|
Объем операции: атипичная резекция» / Surgery: Atypical resection |
0,293; 0,130–0,658 |
0,003* |
0,308; 0,105–0,899 |
0,031* |
Примечание. * – влияние предиктора статистически значимо (p<0,05).
Note: pPEFV1 – postoperative forced expiratory volume in 1 second; PFR – peak flow rate; COPD – chronic obstructive pulmonary disease; * – the predictor influence is statistically significant (p<0.05).
При увеличении ПОС (%) на 1 % риск возникновения респираторных осложнений снижался в 1,080 раза. Наличие хронической обструктивной болезни легких (ХОБЛ) увеличивало риски развития осложнений: при GOLD2
в 16,392 раза, при GOLD3 в 35,082 раза. При проведении операции в объеме лобэктомии вероятность развития осложнений возрастала в 3,251 раза (рис. 3).
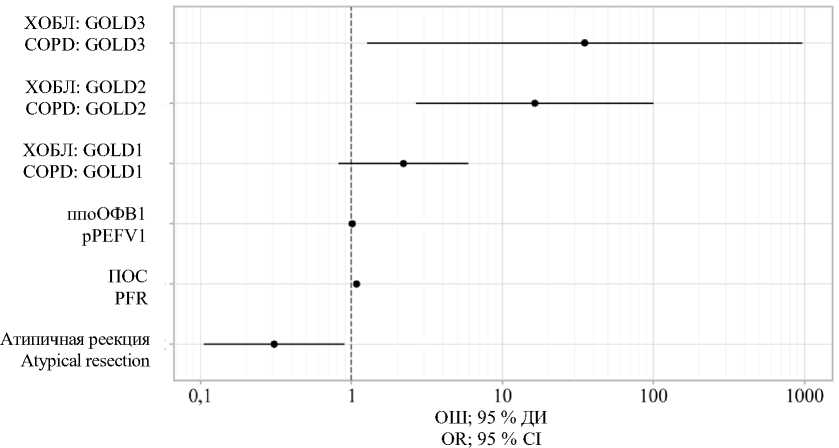
Рис. 3. Оценки ОШ с 95 % ДИ для изучаемых предикторов респираторной осложнения
Fig. 3. OR estimates with 95 % CI for the studied predictors of respiratory complications
При оценке зависимости вероятности отсутствия респираторных осложнений от значения логистической функции P с помощью
ROC-анализа была получена кривая, пред ставленная на рис. 4.
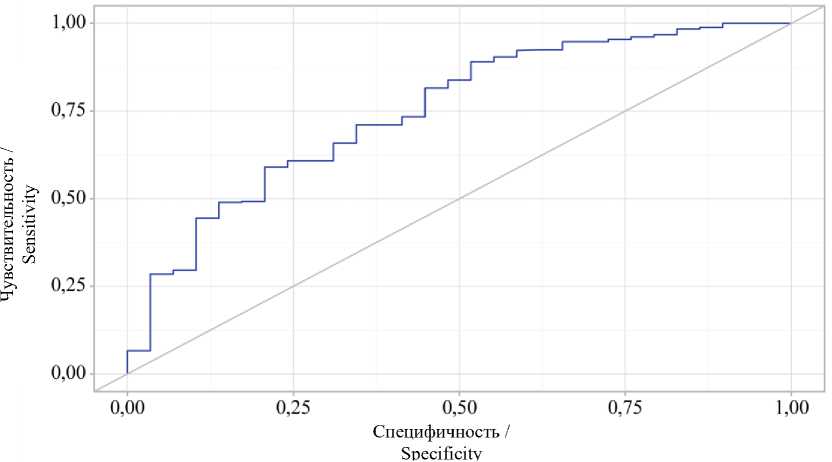
Рис. 4. ROC-кривая, характеризующая зависимость вероятности респираторных осложнений от значения логистической функции P
Fig. 4. ROC curve characterizing the correlation between the probability of respiratory complications and the value of the logistic function P
Площадь под ROC-кривой составила 0,750±0,039 (95 % ДИ 0,674–0,825). Полученная модель была статистически значимой (p<0,001). Пороговое значение логистической функции P в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,953. Отсутствие прогнозировалось при значении логистической функции P выше данной величины или равном ей. Чувствительность и специфичность модели составили 59,0 % и 79,3 % соответственно. После применения логистической регрессии для первичной оценки предсказательной способности переменных, таких как объем операции (лобэктомия), ПОС и ХОБЛ по степени GOLD, было установлено, что эти факторы являются значимыми предикторами респираторных осложнений. Однако логистическая регрессия имеет ограничения, связанные с линейностью модели и предположениями о взаимозависимости переменных. В целях преодоления этих ограничений и повышения точности прогнозов были использованы методы машинного обучения ИИ.
Модели машинного обучения, такие как LightGBM и искусственная нейронная сеть multilayer perceptrons (MLP), были выбраны из-за их способности обрабатывать сложные нелинейные зависимости между перемен- ными и предоставлять более глубокую оценку факторов, влияющих на развитие осложнений. В ходе анализа было обнаружено, что выявленные с помощью логистической регрессии предикторы, такие как ПОС, степень ХОБЛ (GOLD2 и GOLD3) и лобэктомия, подтвердили свою прогностическую ценность и в моделях машинного обучения. LightGBM продемонстрировала высокую точность предсказаний, хотя и с нулевой полнотой в выявлении осложнений, что говорит о ее фокусе на более «безопасных» случаях без осложнений. В то же время MLP показала наивысшую точность среди всех методов (94 %), а также чувствительность 71 %. Это указывает на то, что нейросети могут быть более чувствительными, чем логистическая регрессия, которая показала лучшую сбалансированность, но меньшую чувствительность (табл. 5). Тем не менее результаты машинного обучения подтвердили значимость ключевых предикторов, таких как ПОС, степень ХОБЛ (GOLD2 и GOLD3) и объем операции (лобэктомия), что подчеркивает их важность в прогнозировании респираторных осложнений. Применение моделей машинного обучения расширило возможности анализа, позволив учитывать более сложные взаимосвязи и повысить общую точность предсказаний.
Таблица 5
Table 5
Сравнение результатов различных моделей прогнозирования респираторных осложнений
Comparison of the results of different models for predicting respiratory complications
|
Модель Model |
Площадь под кривой Area under the Curve |
Точность Accuracy |
Полнота Completeness |
Специфичность / Specificity |
|
Логистическая регрессия Logistic Regression |
0,75 |
0,85 |
0,59 |
0,79 |
|
LightGBM |
0,61 |
0,89 |
0,0 |
0,96 |
|
MLP |
0,61 |
0,94 |
0,71 |
0,94 |
Использование методов машинного обучения позволило нам расширить границы стандартных статистических подходов и рассмотреть более сложные модели предсказания, способные учитывать многомерные зависимости. Эти модели обладают потенциальными преимуществами при использовании в клинической практике, улучшая точность прогнозирования и способствуя выявлению пациентов с высоким риском осложнений.
Обсуждение. Хирургическое лечение новообразований легких является приоритетным при локализованных формах рака легкого, а также местно-распространенных формах у некоторых больных [8]. Широкое применение методов инструментальной визуализации органов грудной клетки в последнее десятилетие позволило значительно увеличить число пациентов, с показаниями к оперативному вмешательству [9].
Несмотря на значительное развитие технологий периоперационного ведения пациентов, частота развития послеоперационных легочных осложнений остается высокой и зависит от многих факторов, в т.ч. связанных с пациентами [10, 11]. Разработка периоперационных стратегий для пациентов торакального профиля позволила снизить частоту развития респираторных осложнений, но не решила эту проблему полностью [12]. Кроме того, в исследовании S. Shinohara et al. говорится о негативном влиянии развития респираторных осложнений на долгосрочную выживаемость пациентов с немелкоклеточным раком легкого [13]. В проведенном исследовании было продемонстрировано, что частота развития тяжелых послеоперационных респираторных осложнений составила 3,4 %. Такой низкий процент связан с плановым порядком проведения операций, а также с тщательной периоперационной программой ведения пациентов, включающей в себя использование преабили-тации пациентов с высоким риском развития послеоперационных осложнений, комплексного подхода к послеоперационной профилактике и ранней диагностике респираторных осложнений (отказ от курения за 2–3 нед. до операции, использование дыхательной гимнастики, коррекция нутритивного статуса, выполнение назначений пульмонолога).
При проведении однофакторного анализа было установлено, что анамнез курения, ПОС, ппоОФВ, время операции и объем оперативного вмешательства (лобэктомия) являются статистически значимыми предикторами развития респираторных осложнений. Курение, которое является основной причиной рака легкого, вызывает хроническую обструктивную болезнь легких, что значимо снижает функциональные резервы при выполнении резекции [14]. Отечественные и зарубежные исследования, касавшиеся влияния показателей функции внешнего дыхания на развитие респираторных послеоперационных осложне- ний, подтвердили, что ОФВ1 и ппоОФВ1 являются критически важными компонентами прогнозирования [15, 16].
ПОС отражает проходимость и сопротивление дыхательных путей, силу дыхательных мышц и другие показатели функции внешнего дыхания, а снижение значений данного параметра фиксируется при различных хронических заболеваниях легких [17]. Обоснованность использования ПОС для оценки функции внешнего дыхания была подтверждена многочисленными исследованиями [16, 18]. ПОС у пациентов с легочными осложнениями была на 10 % ниже, чем у больных с гладким послеоперационным периодом (p=0,009). В исследовании Y. Lai et al., проведенном на выборке из 725 пациентов, перенесших лобэктомию, было показано, что ПОС является независимым фактором риска развития послеоперационных респираторных осложнений. При значении ПОС ≤300 л/мин риск их развития возрастал статистически значимо (ОШ 8,551; 95 % ДИ: 5,692–12,845; p<0,001) [19]. Продолжительность хирургического вмешательства также оказывала статистически значимое влияние, что обусловливалось техническими трудностями при выполнении оперативного пособия, более длительной анестезией, влияющей на снижение показателей дыхания [20].
Отметим также, что активное внедрение в клиническую практику сегментэктомий и снижение доли лобэктомий привели к уменьшению количества хирургических осложнений и положительно сказались на отдаленных онкологических результатах [21]. Из нашего исследования пациенты с сегментэктомиями были исключены ввиду их небольшого количества. Было выявлено, что лобэктомия оказывает значимое влияние на развитие послеоперационных респираторных осложнений, что указывает на важность отбора пациентов для данного объема оперативного вмешательства.
Предыдущие исследования изучали только прогностическую ценность отдельных параметров пациентов, которым планировалось оперативное лечение. Включение нескольких факторов риска в модель может да- вать синергетический эффект; таким образом, объединение двух или более параметров может улучшить диагностическую эффективность [22, 23]. При проведении многофакторного анализа было установлено, что значимыми предикторами возникновения послеоперационных респираторных осложнений являются ХОБЛ (GOLD 2 и GOLD 3), объем оперативного вмешательства (лобэктомия) и низкие показатели ПОС. Эти параметры вошли в прогностическую модель оценки частоты послеоперационных респираторных осложнений. Эффективность модели доказана ROC-кривой, площадь по которой составила 0,750±0,039 (95 % ДИ 0,674– 0,825). Полученная модель была статистически значимой (p<0,001).
В настоящее время ИИ играет существенную роль в клинической диагностике и лечении [17]. Методы машинного обучения имеют определенные преимущества перед стандартными методами в прогнозировании явлений или состояний пациентов [24]. Одним из них является их способность делать более стабильные прогнозы путем обработки сложных нелинейных связей между прогностическими переменными [25]. В проведенном исследовании использовались два подхода ИИ: LightGBM и MLP. Они подтвердили прогностическую ценность первичной логистической регрессии, но использование MLP позволило получить более точную модель, что повышает вероятность правильной стратификации пациентов по уровню риска. Высокая чувствительность и специфичность MLP улучшает клинические исходы и снижает неопре- деленность при принятии клинических решений. В этом заключается преимущество машинного обучения ИИ перед традиционными методами, такими как логистическая регрессия, которые могут демонстрировать меньшую точность и вызывать сомнения в выборе тактики лечения.
Таким образом, полученные результаты подчеркивают важность использования нескольких моделей машинного обучения для предсказания медицинских осложнений. Логистическая регрессия может быть предпочтительнее для стандартных и простых ситуаций, когда требуется более сбалансированная модель с высокой точностью и приемлемой полнотой, тогда как LightGBM и MLP позволяют выявить сложные взаимодействия между множеством факторов и специфических случаев. MLP в настоящем исследовании и в более ранних продемонстрировала, что использование данного метода позволяет получать более качественные модели, повышая клиническую значимость для принятия решений [26].
Заключение. Частота развития послеоперационных респираторных осложнений составила 19 %. Значимыми предикторами являлись ХОБЛ (GOLD 2 и GOLD3), ПОС и объем операции (лобэктомия).
Методика MLP показала высокую эффективность в построении прогностических моделей, обеспечила более точные прогнозы за счет способности моделировать сложные нелинейные зависимости в данных, что делает ее более предпочтительной по сравнению с традиционными методами.


