Проспективное несравнительное клиническое исследование по изучению эффективности и безопасности биологически активной добавки "Альфа" в лечении пациентов с гипогонадизмом
Автор: Ефремов Е.А., Коршунов М.Н., Золотухин О.В., Мадыкин Ю.Ю., Красняк С.С.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 1, 2018 года.
Бесплатный доступ
Введение. Мужской гипогонадизм бывает первичным (гипергонадотропным) и вторичным (гипогонадотропным). В то время как первый вид вызван тестикулярными причинами, второй относится к гипоталамическим или гипофизарным нарушениям, лежащим в основе нарушения функции яичка с дефицитом андрогенов. Синдром дефицита тестостерона характеризуется снижением либидо, повышением жировой и снижением мышечной массы тела, потерей концентрации, эректильной дисфункцией (ЭД), депрессией и уменьшенной минеральной плотностью костей, а также недостаточным уровнем сывороточного тестостерона. Подобные симптомы с возрастом испытывают до 80% мужчин. В свете информации о неблагоприятных эффектах заместительной гормональной терапии становится интересной возможность альтернативы ЗГТ - безопасных и эффективных методов повышения уровня тестостерона для мужчин с возрастным гипогонадизмом. Одной из таких альтернатив может стать биологическая активная добавка к пище «Альфа», имеющая в своем составе комбинацию компонентов, одним из эффектов которых является повышение уровня тестостерона и устранение симптомов андрогенного дефицита. Материалы и методы. Исследование проведено в формате наблюдательной программы. Врачи-урологи г. Москвы и г. Воронежа собирали и оценивали информацию о пациентах с вновь диагностированным андрогенным дефицитом, которым назначался препарат «Альфа», который принимались внутрь по 1 капсуле (400 мг) в сутки. Длительность оцениваемого периода составила не менее 3 месяцев. Эффективность препарата определяли по динамике оценки по опросникам AMS и IIEF-5 и по изменению уровня сывороточных гормонов (общий тестостерон, ГСПГ, ЛГ, ФСГ, пролактин). Результаты. Повышение либидо отметили 36,7% пациентов, достоверное повышение уровня тестостерона на 8,4% наблюдалось у 74% мужчин, клинический эффект уменьшения симптомов андрогенного дефицита отмечался у 95,4% мужчин, принимавших препарат «Альфа» в течение 90 дней. Выводы. Результаты проведенного исследования позволяют рекомендовать использовать биологически активную добавку «Альфа» в составе комплексной терапии пациентов с умеренными и, особенно, начальными проявлениями андрогенодефицита. Требуются дальнейшие плацебо-контролируемые исследования для оценки влияния препарата на качество жизни мужчин с симптомами гипогонадизма.
Гипогонадизм, андрогенный дефицит, биологически активная добавка "альфа", заместительная гормональная терапия
Короткий адрес: https://sciup.org/142213101
IDR: 142213101
Текст научной статьи Проспективное несравнительное клиническое исследование по изучению эффективности и безопасности биологически активной добавки "Альфа" в лечении пациентов с гипогонадизмом
ужской гипогонадизм определяется как неадекватное функционирование яичек и может разделен на первичный (гипергонадотропный) и вторич ный (гипогонадотропный) гипогонадизм. В то время как первый вид вызван тестикулярными причинами, второй относится к гипоталамическим или гипофизарным нарушениям, лежащим в основе нарушения функции яичка с дефицитом андрогенов. Клиническая картина дефицита тестостерона в конечном счете зависит от времени его возникновения (во время эмбрионального периода, полового созревания или в зрелом возрасте), а также его степени [1].
Синдром дефицита тестостерона характеризуется снижением либидо, повышением жировой и снижением мышечной массы тела, потерей концентрации, эректильной дисфункцией (ЭД), депрессией и уменьшением минеральной плотности костей. Подобные симптомы с возрастом испытывают до 80% мужчин [2].
До тех пор, пока мужчина не достигнет 30-40 лет, уровень биодо-ступного тестостерона остается довольно постоянным. Однако после 40-летнего возраста концентрация тестостерона в сыворотке мужчин снижается ежегодно на 0,4 – 2,6% для общего тестостерона и на 0,87 – 1,7% для свободного тестостерона [3–6]. В конечном итоге это снижение приводит к тому, что уровень тестостерона в сыворотке крови в возрасте около 60 лет составляет 40-50% от его содержания в молодом возрасте.
Это значительное снижение уровня тестостерона очень тесно связано с такими заболеваниями, как ожирение, метаболический синдром, диабет или гипертония [2,7,8]. Обычным способом лечения гипогонадизма является заместительная гормональная терапия препаратами те- стостерона (ЗГТ), имеющимися на фармацевтическом рынке. Однако помимо положительных эффектов, были описаны значительные неблагоприятные побочные явления при применении ЗГТ.
Известно, что тестостерон индуцирует образование эритропоэтина, вызывая увеличение концентрации гемоглобина и эритроцитов (гематокрит), это, в свою очередь, увеличивает риск развития инсульта и/или сердечно-сосудистых событий из-за повышенной вязкости крови [9–11]. По данным литературы, эритроцитоз является наиболее частой причиной прекращения ЗГТ [12]. Было доказано, что ЗГТ усугубляет обструктивное апноэ сна и увеличивает частоту возникновения сердечной аритмии, которая связана с этим состоянием [13–15]. Помимо вышеперечисленного, ЗГТ имеет ряд противопоказаний: повышение уровня ПСА и подозрении на наличие рака предстательной железы.
В свете данной информации становится интересной возможность альтернативы ЗГТ – безопасных и эффективных методов повышения уровня тестостерона для мужчин с возрастным гипогонадизмом.
Одной из таких альтернатив может стать биологическая активная добавка (БАД) к пище «Альфа», имеющая в своем составе комбинацию компонентов, одним из эффектом которых является повышение уровня тестостерона и устранение симптомов андрогенного дефицита.
Одним из компонентов БАД «Альфа» является Eurycoma longifo-lia (Эврикома длиннолистная) широко известная как Tongkat Ali в Малайзии, Pasak Bumi – в Индонезии и Cay Ba Bihn – во Вьетнаме – среднеразмерное тонкое дерево семейства Simarauba-ceae, достигающее 10 м в высоту [16,17]. В значительной степени оно встречается в низменных лесах на Малазийском полуострове и в других регионах Юго-Восточной Азии [18].
-
E. longifolia содержит широкий спектр химических соединений, включая алкалоиды, квазиноиды, квазииноидные дитерпены, эврико-манон, эврикомолактон [19–21]. Помимо этих соединений был идентифицирован биоактивный пептид с 4.3 кДа со свойствами афродизиака [22,23]. Биоактивные сложные полипептиды из экстракта корня Эври-комы длиннолистной, названные эврипептидами, увеличивают биосинтез различных андрогенов и усиливают их активность [24]. Механизм действия, вероятнее всего, связан с непосредственным усилением биосинтеза различных андрогенов под воздействием пептидов, содержащихся в водных экстрактах корней Эврикомы [24]. Было показано, что термин «эврипептиды» был предложен для описания пептида, активирующего фермент CYP17 (17 α-гид-роксилаза/17, 20-лиаза) для усиления метаболизма прегненолона и 17-OH-прегненолона с получением большего количества дегидроэпиандро-
- стерона (DHEA). Прогестерон и 17-OH-прогестерон дополнительно метаболизируются до 4-андростен-диона и тестостерона. В недавнем отчете B.S. Low и соавт. объясняют усиленное продуцирование тестостерона экспрессией клеток Лейдига посредством ингибирования фосфодиэстеразы и ароматазы эврикома-ноном – основным квазиноидным соединением, присутствующим в экстракте корня E. longifolia [25]. Другой возможный способ действия для увеличения уровней тестостерона был описан A. Pihie и соавт. [26]. Авторами было установлено, что Эв-рикома длиннолистная повышает уровень цАМФ, увеличивает использование глюкозы, что может быть связано с эффектами увеличения энергии в клетках Лейдига.
Имеется множество исследований на животных, в которых показано влияние экстракта корня Эв-рикомы длиннолистной на выработку тестостерона [27]. Кроме того, имеется ряд исследований в мужской популяции, которые показали, что применение Эврикомы увеличивает уровень тестостерона [28–31].
Другим компонентом препарата «Альфа» является Горянка крупноцветковая или Epimedium, основным действующим веществом которой является Икариин.
Икариин вовлечен в производство тестостерона через мРНК-зави-симую регуляцию экспрессии генов, таких как периферические рецепторы к бензодиазепинам (PBR) и острофазный стероидогенный регуляторный белок (StAR) [32,33]. Они отвечают за трансмембранный перенос холестерина из наружной мембраны митохондрий к внутренней мембране, что является ключевым шагом в производстве тестостерона. Икариин вызывает дозозависимое повышение уровня PBR.
Икариин также повышает концентрацию рецепторов к лютеинизирующему гормону (ЛГ). Дальнейшее связывание молекул ЛГ с соот-ветствющими рецепторами активи- рует аденилатциклазу, последующее повышение уровня цАМФ в клетках Лейдига, который запускает каскад внутриклеточных событий и в конечном итоге выработку тестостерона в клетках Лейдига [34,35].
Икариин связывается с андрогенными рецепторами и действует как тестостерон со всеми его положительными эффектами [36].
Третьим компонентом препарата «Альфа» является высокоочи-щенный экстракт цветков Ромашки аптечной с 98% содержанием активного вещества – Апигенина, который был открыт венгерским химиком Альбертом Сент-Дьерди в 1938 году и с тех пор активно изучается. Было показано, что водно-спиртовой раствор, содержащий апигенин, стимулирует секрецию тестостерона [37].
Помимо этого апигенин является наиболее мощным ингибитором ароматазы и единственным известным ингибитором 17b-гидроксисте-роиддегидрогеназы (17β-HSD) – ферментов, отвечающих за инактивацию тестостерона [38]. Апигенин модифицирует активность рецептора TBXA2 и активность ароматазы так, что это благоприятствует повышению активности тестостерона, в том числе, при его относительно низких концентрациях [39]. Апигенин также непосредственно повышает активность белка, известного как острофазный стероидогенный регуляторный белок (StAR), соответственно увеличивая синтез тестостерона (индуцированный цАМФ) в клетках Лейдига в яичках [40].
В ходе исследования, проведенного в формате наблюдательной программы в условиях рутинной клинической практики, врачи-урологи г. Москвы и г. Воронежа, принявшие участие в проекте, собирали и регистрировали информацию о пациентах с вновь диагностированным андрогенным дефицитом, которым назначался препарат «Альфа». В исследовании участвовали урологи амбулаторного звена как государственных и муниципальных, так и частных учреждений здравоохранения.
Целью исследования было оценить динамику симптомов андрогенного дефицита у мужчин (на основании анкетирования по шкалам AMS, IIEF-5) и уровня гормонов (общий тестостерон, глобулин, связывающий половые гормоны – ГСПГ, ЛГ, пролактин, фолликулостимулирующий гормон – ФСГ) после терапии препаратом «Альфа». Одной из задач программы было определение отличий реальной практики лечения гипогонадизма от практики, принятой при проведении контролируемых клинических исследований. Также собиралась информация о переносимости и безопасности препарата.
Для статистического анализа применялся парный t-критерий с уровнем достоверности p <0,05. Для учета ошибок I рода применялась поправка Бонферрони.
Препарат «Альфа» назначался в соответствии с листком-вкладышем. Капсулы принимались внутрь по 1 капсуле (400 мг) в сутки. Длительность оцениваемого периода составила не менее 3 месяцев. Оценка эффективности и безопасности проводилась каждым центром, в соответствии с принятыми в нем процедурами и протоколами. Она включала в себя 3 визита.
-
• Визит 1 – включение в исследование и оценка базовых показателей.
-
• Визит 2 – через 1 месяц после начала терапии.
-
• Визит 3 – через 3 месяца после начала терапии.
Эффективность отмечали по динамике оценки по опросникам AMS и IIEF-5, а также по изменению уровня сывороточных гормонов (общий тестостерон, ГСПГ, ЛГ, ФСГ, пролактин).
В соответствии с критериями включения и исключения в исследовании приняли участие 87 мужчин в возрасте от 22 до 60 лет с установленным диагнозом нормогонадотропный гипогонадизм.
Средний возраст пациентов составил 38,1±9,5 лет. Среднее значение индекса массы тела составило 26,6±0,6.
Сумма баллов по шкале IIEF-5 до и после курсового приема «Альфы» составила 15,2±4,1 и 18,6±4,1 баллов, соответственно. Увеличение суммы баллов по шкале IIEF-5 на фоне приема препарата составило 3,4 ( p <0,001) (рис. 1).
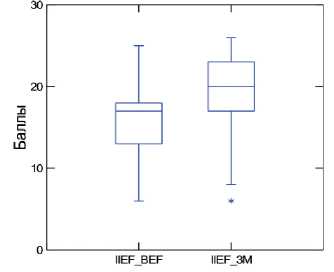
Рис. 1. Динамика суммы баллов по шкале IIEF-5
Качество эрекции по результатам анкетирования улучшилось у 77 из 87 мужчин (88,5%).
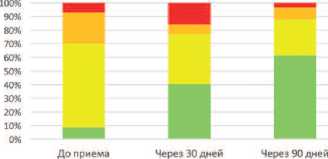
Также было отмечено значительное изменение распределения степени тяжести ЭД в ход применения препарата «Альфа», которое отображено на рисунке 2. Из 57 мужчин, для которых была доступна информация об эректильной функции на 2 визите, 42 (73,7%) перешли в более легкую категорию. У 30 человек (52,6%) эректильная функция полностью восстановилась.
Степень тяжести ЭД
-
■ Нет ЭД Легкая ЭД 1 Умеренная ЭД ■ Тяжелая ЭД
Рис. 2. Распределение и изменение степени тяжести ЭД в ходе приема препарата «Альфа»
Сумма баллов по шкале AMS до и после курсового приема «Альфы» составила 36,4±7,7 и 30,7±7,2 баллов, соответственно. Среднее уменьшение суммы баллов по шкале AMS на фоне приема препарата составило 5,5 баллов ( p <0,001). По результатам анкетирования клинический эффект уменьшения симптомов андрогенного дефицита отмечался у 95,4% (83 из 87) мужчин, принимавших препарат «Альфа». При этом у 32 мужчин
(36,8%) снижение суммы баллов по шкале AMS составило 7 и более баллов (рис. 3).
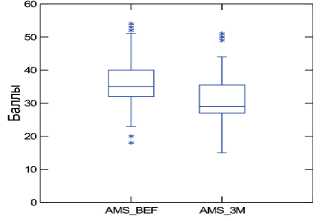
Рис. 3. Динамика суммы баллов по шкале AMS до и после 3-х месяцев приема препарата «Альфа»
Для определения уровня половых гормонов применяли иммунофер-ментный анализ. В качестве нормальных значений уровня тестостерона принимался уровень 12,1 нмоль/л в соответствии с рекомендациями Европейской Ассоциации урологов по мужскому гипогонадизму. Из 87 мужчин, включенных в исследование, данные об уровне общего тестостерона на визите 1 и 3 были доступны для 87 (100%), в то время как на визите 2 – для 57 (65%) мужчин.
Средний уровень тестостерона до начала лечения составил 13,5± 5,46 нмоль/л. После 3-месячного курса лечения уровень тестостерона достоверно увеличивался в среднем на 8,4% и составил 14,23±5,1 нмоль/л ( р <0,001). При этом среди мужчин с исходным уровнем тестостерона ниже 12,0 нмоль/л, через 3 месяца приема «Альфы» значение показателя достоверно увеличилось на 11,6%, и составило 11,36±2,5 нмоль/л против 10,1± 1,9 нмоль/л в начале исследования.
Лабораторно определяемое повышение уровня общего тестостерона после 3 месяцев приема произошло у 65 (74%) обследованных мужчин. Доля мужчин, которые перешли из категории лабораторного гипогонадизма в группу с нормальным уровнем тестостерона составило 49% (рис. 4).
Для определения уровня лютеинизирующего гормона применяли иммуноферментный анализ. Нормальными признавались значения 1,8-8,6 мМЕ/мл в соответствии с рекомендациями L. Kaplan и соавт. [41]. Данные уровня ЛГ на визите 1 и 3 были доступны для 87 (100%) мужчин, в то время как на визите 2 – для
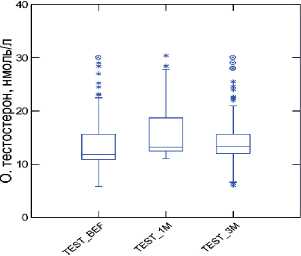
Рис. 4. Динамика уровня общего тестостерона на фоне 3-х месяцев приема препарата «Альфа»
57 (65%). Средний уровень ЛГ у пациентов на первом визите составил 4,8±1,2 (95% ДИ 4,6-5,1) мМЕ/мл, а на третьем визите – 4,7±1,2 (95% ДИ 4,4-4,9) мМЕ/мл. Динамика уровня ЛГ в ходе исследования показана на рисунке 5.
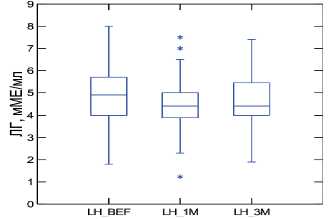
Рис. 5. Динамика уровня ЛГ на фоне 3-х месяцев приема препарата «Альфа»
Уровень ГСПГ был определен на визитах 1, 2 и 3 у 58 (66,7%) мужчин. Содержание ГСПГ в сыворотке крови перед началом исследования и через 3 месяца наблюдения составило 31,5±12,1 (95% ДИ 28,3 – 34,7) и 30,9±11,8 нмоль/л (95% ДИ 27,8 – 34,0) В течение 3-х месяцев наблюдения уровень ГПСГ по-
Таблица 1. Содержание гормонов в сыворотке крови в ходе исследования
|
Показатель |
Визиты |
Среднее значение |
95%-ный доверительный интервал |
Стандартное отклонение |
|
Тестостерон, нмоль/л |
Визит 1 |
13,5 |
12,3 - 14,6 |
5,5 |
|
Визит 2 |
15,9 |
14,6 - 17,2 |
5,0 |
|
|
Визит 3 |
14,2 |
13,1 - 15,3 |
5,2 |
|
|
Визит 1 |
31,5 |
28,3 - 34,7 |
12,1 |
|
|
ГСПГ, нмоль/л |
Визит 2 |
38,4 |
32,8 - 44,0 |
14,4 |
|
Визит 3 |
30,9 |
27,7 - 34,0 |
11,8 |
|
|
Визит 1 |
4,9 |
4,6 - 5,1 |
1,2 |
|
|
ЛГ, мМЕ/мл |
Визит 2 |
4,6 |
4,3 - 4,9 |
1,2 |
|
Визит 3 |
4,7 |
4,4 - 4,9 |
1,2 |
|
|
Пролактин, мЕд/л |
Визит 1 |
155,0 |
138,9 - 170,9 |
60,3 |
|
Визит 2 |
158,7 |
144,4 - 172,8 |
53,1 |
|
|
Визит 3 |
151,8 |
136,1 - 167,4 |
59,0 |
|
|
Визит 1 |
6,3 |
5,7 - 6,8 |
2,1 |
|
|
ФСГ, мМЕ/мл |
Визит 2 |
6,2 |
5,7 - 6,6 |
1,8 |
|
Визит 3 |
6,3 |
5,7 - 6,8 |
2,0 |
казал тенденцию к уменьшению, но данные изменения были недостоверны ( р =0,065).
Уровень фолликулстимулирующего гормона, был определен на визитах 1, 2 и 3 у 58 (66,7%) мужчин. Содержание ФСГ в сыворотке крови перед началом исследования и через 3 месяца наблюдения достоверно не изменялся (рис. 6).
В таблице 1 представлена суммарная информация об изменении уровня репродуктивных гормонов.
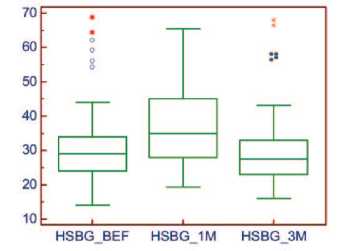
Рис. 6. Динамика уровня ЛГ на фоне 3-х месяцев приема препарата «Альфа»
Данное наблюдательное исследование биологически активной добавки «Альфа» продемонстрировало ее клиническую эффективность и безопасность применения у мужчин с клиническими и/или лабораторными проявлениями андрогенного дефицита. Являясь негормональным стимулятором гипофизарно-гипоталамической- гонадной системы, препарат «Альфа» способствовал увеличению случаев нормализации клинических и лабораторных проявлений андрогенодефи-цита: восстановление либидо, улучшение эректильной функции, повышение уровня общего тестостерона. Не отмечено развития каких-либо нежелательных побочных эффектов, которые характерны, например, для ЗГТ. Безопасность применения БАД «Альфа» также подтверждена отсутствием нарушений параметров функционирования жизненно важных органов и систем и какими-либо изменениями основных лабораторных показателей (клинический анализ крови, мочи, биохимический анализ крови).
Результаты проведенного исследования позволяют рекомендовать использование биологически активной добавки «Альфа» в составе комплексной терапии пациентов с умеренными и, особенно, начальными проявлениями андрогенодефицита. Требуются дальнейшие плацебо-кон-тролируемые исследования для оценки влияния препарата на качество жизни мужчин с симптомами гипогонадизма.
-
1. Повышение либидо отметили к концу лечения 36,7% пациентов;
-
2. К третьему месяцу приема препарата «Альфа» у 74% мужчин отмечается достоверное увеличение уровня общего тестостерона в среднем на 8,4%;
-
3. Клинический эффект уменьшения симптомов андрогенного дефицита отмечен у 95,4% мужчин, принимавших препарат «Альфа» в течение 90 дней;
-
4. Качество эрекции по результатам анкетирования улучшилось у 88,5% мужчин, принимавших препарат «Альфа». Сумма баллов по IIEF-5 составила 3,4 балла;
-
5. Каких-либо нежелательных или побочных эффектов в ходе лечения у пациентов отмечено не было.
Резюме:
Введение. Мужской гипогонадизм бывает первичным (гипергонадотропным) и вторичным (гипогонадотропным). В то время как первый вид вызван тестикулярными причинами, второй относится к гипоталамическим или гипофизарным нарушениям, лежащим в основе нарушения функции яичка с дефицитом андрогенов.
Синдром дефицита тестостерона характеризуется снижением либидо, повышением жировой и снижением мышечной массы тела, потерей концентрации, эректильной дисфункцией (ЭД), депрессией и уменьшенной минеральной плотностью костей, а также недостаточным уровнем сывороточного тестостерона. Подобные симптомы с возрастом испытывают до 80% мужчин.
В свете информации о неблагоприятных эффектах заместительной гормональной терапии становится интересной возможность альтернативы ЗГТ - безопасных и эффективных методов повышения уровня тестостерона для мужчин с возрастным гипогонадизмом. Одной из таких альтернатив может стать биологическая активная добавка к пище «Альфа», имеющая в своем составе комбинацию компонентов, одним из эффектов которых является повышение уровня тестостерона и устранение симптомов андрогенного дефицита.
Материалы и методы. Исследование проведено в формате наблюдательной программы. Врачи-урологи г. Москвы и г. Воронежа собирали и оценивали информацию о пациентах с вновь диагностированным андрогенным дефицитом, которым назначался препарат «Альфа», который принимались внутрь по 1 капсуле (400 мг) в сутки. Длительность оцениваемого периода составила не менее 3 месяцев. Эффективность препарата определяли по динамике оценки по опросникам AMS и IIEF-5 и по изменению уровня сывороточных гормонов (общий тестостерон, ГСПГ, ЛГ, ФСГ, пролактин).
Результаты. Повышение либидо отметили 36,7% пациентов, достоверное повышение уровня тестостерона на 8,4% наблюдалось у 74% мужчин, клинический эффект уменьшения симптомов андрогенного дефицита отмечался у 95,4% мужчин, принимавших препарат «Альфа» в течение 90 дней.
Выводы. Результаты проведенного исследования позволяют рекомендовать использовать биологически активную добавку «Альфа» в составе комплексной терапии пациентов с умеренными и, особенно, начальными проявлениями андрогенодефицита. Требуются дальнейшие плацебо-контро-лируемые исследования для оценки влияния препарата на качество жизни мужчин с симптомами гипогонадизма.
Список литературы Проспективное несравнительное клиническое исследование по изучению эффективности и безопасности биологически активной добавки "Альфа" в лечении пациентов с гипогонадизмом
- Ali J, Saad J. Biochemical effect of Eurycoma Longifolia Jack on the sexual behavior, fertility, sex hormone and glycolysis . 1993. University of Malaya.
- Ang HH, Lee KL. Effect of Eurycoma longifolia Jack on orientation activities in middle-aged male rats. Fundam Clin Pharmacol 2002;16(6): 479-483. doi: 10.1046/j. 1472-8206.2002.00106.x
- Ang HH, Sim MK. Eurycoma longifolia increases sexual motivation in sexually naive male rats. Arch Pharm Res 1998;21(6): 779-781.
- Asiah O, Nurhanan MY, Mohd Ilham A. Determination of bioactive peptide (4.3 KDA) as an aphrodisiac marker in six Malaysian plants. J Trop Forest Sc 2007;19(1): 61-63. doi: 10.2307/43 594699
- Bedir E, Abou-Gazar H, Ngwendson JN, Khan IA. Eurycomaoside: a new quassinoid-type glycoside from the roots of Eurycoma longifolia. Chem Pharm Bull 2003;51(11): 1301-1303. doi: 10.1248/cpb. 51.1301
- Bhasin S. Effects of testosterone administration on fat distribution, insulin sensitivity, and atherosclerosis progression. Clin Infect Dis 2003;37 (SUPPL. 2): S142-S149 DOI: 10.1086/375878
- Calof OM, Singh AB, Lee ML, Kenny AM, Urban RJ, Tenover JL, et al. Adverse events associated with testosterone replacement in middle-aged and older men: a meta-analysis of randomized, placebo-controlled trials. J Gerontol A Biol Sci Med Sci. 2005;60(11): 1451-7 DOI: 10.1093/gerona/60.11.1451
- Chen G, Li S, Dong X, Bai Y, Chen A, Yang S, et al. Investigation of Testosterone, Androstenone, and Estradiol Metabolism in HepG2 Cells and Primary Culture Pig Hepatocytes and Their Effects on 17ßHSD7 Gene Expression. PLoS ONE, 2012;7(12) DOI: 10.1371/journal.pone.0052255
- Coonce MM, Rabideau AC, McGee S, Smith K, Narayan P. Impact of a constitutively active luteinizing hormone receptor on testicular gene expression and postnatal Leydig cell development. Mol Cell Endocrinol 2009;298(1-2): 33-41 DOI: 10.1016/j.mce.2008.10.016
- Feeley RJ, Traish AM. Obesity and Erectile Dysfunction: Is Androgen Deficiency the Common Link? ScientificWorldJournal 2009;(9), 676-684 DOI: 10.1100/tsw.2009.79
- Feldman HA, Longcope C, Derby CA, Johannes CB, Araujo AB, Coviello AD, et al. Age trends in the level of serum testosterone and other hormones in middle-aged men: Longitudinal results from the Massachusetts Male Aging Study. J Clinl Endocrin Metabol 2002;87(2): 589-598 DOI: 10.1210/jc.87.2.589
- Fernandez-Balsells, M. M., Murad, M. H., Lane, M., Lampropulos, J. F., Albuquerque, F., Mullan, R. J., et al. Clinical review 1: Adverse effects of testosterone therapy in adult men: a systematic review and metaanalysis. The Journal of Clinical Endocrinology and Metabolism, 2010;95(6): 2560-75 DOI: 10.1210/jc.2009-2575
- Gagnon, D. R., Zhang, T. J., Brand, F. N., Kannel, W. B. Hematocrit and the risk of cardiovascular disease-The Framingham Study: A 34-year follow-up. American Heart Journal, 1994;127(3): 674-682 DOI: 10.1016/0002-8703(94)90679-3
- Goreja W. Tongkat Ali: The Tree that Cures a Hundred Diseases, Vol. 2. 2004; New York, NY, USA: Amazing Herb Press, TNC International Inc. C. 96.
- Hamzah S., Yusof A. The ergogenic effects of Tongkat Ali (Eurycoma longifolia). Br J Sports Med, 2003;(37): 465-466.
- Harman S.M., Metter E.J., Tobin J.D., Pearson J., Blackman M.R. Longitudinal Effects of Aging on Serum Total and Free Testosterone Levels in Healthy Men. The Journal of Clinical Endocrinology Metabolism, 2001;86(2): 724-731 DOI: 10.1210/jcem.86.2.7219
- Henkel R., Maass G., Schuppe H.C., Jung A., Schubert J., Schill, W B. Molecular aspects of declining sperm motility in older men. Fertility and Sterility, 2005;84(5): 1430-1437 DOI: 10.1016/j.fertnstert.2005.05.020
- Jockenhovel, F. Male Hypogonadism. 2004; 1-e изд. Bremen: Uni-Med, 2004:18.
- Joseph S., Sugumaran M., Kate L., Lee W Herbs of Malaysia. An Introduction to the Medicinal, Culinary, Aromatic and Cosmetic Use of Herbs. 2005; Kuala Lumpur, Malaysia: Federal Publications Sdn Berhad. C. 120
- Kaplan L., Pesce A. Clinical Chemistry: Theory, Analysis, and Correlation. (S. Kazmierczak, Ed.) (3-е изд.). St. Louis, MO: Mosby-Year Book, Inc. 1996:1179
- Kaufman J.M., Vermeulen A. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocrine Reviews. 2005;26(6):833-76 DOI: 10.1210/er.2004-0013
- Kerishchi P., Nasri S., Amin G., Tabibian M. The effects of Apium graveolens extract on sperm parameters and H-G hormonal axis in mice. Взято из: Proceedings of the International Congress of Physiology and Pharmacology. 2011; Hamadan Iran.
- Krauss D.J., Taub H.A., Lantinga L.J., Dunsky M.H., Kelly C.M. Risks of blood volume changes in hy-pogonadal men treated with testosterone enanthate for erectile impotence. The Journal of Urology, 1991;146(6): 1566-70. Получено из: http://www.ncbi.nlm.nih.gov/pubmed/1942342
- Leisegang K., Udodong A., Bouic P. J. D., Henkel R.R. Effect of the metabolic syndrome on male reproductive function: A case-controlled pilot study. Andrologia, 2014;46(2): 167-176 DOI: 10.1111/and.12060
- Li W., Pandey A.K., Yin X., Chen J.-J., Stocco D.M., Grammas P., Wang X. Effects of apigenin on steroidogenesis and steroidogenic acute regulatory gene expression in mouse Leydig cells. The Journal of Nutritional Biochemistry, 2011;22(3): 212-218 DOI: 10.1016/j.jnutbio.2010.01.004
- Low B.S., Choi S.B., Abdul Wahab H., Kumar Das P., Chan K. L.Eurycomanone, the major quassinoid in Eurycoma longifolia root extract increases spermatogenesis by inhibiting the activity of phosphodiesterase and aromatase in steroidogenesis. Journal of Ethnopharmacology, 2013;149(1): 201-207 DOI: 10.1016/j.jep.2013.06.023
- Matsumoto A.M., Sandblom R.E., Schoene R.B., Lee K.A., Giblin E.C., Pierson D.J., Bremner W.J. Testosterone replacement in hypogonadal men: effects on obstructive sleep apnoea, respiratory drives, and sleep. Clinical Endocrinology, 1985;22(6): 713-721 DOI: 10.1111/j.1365-2265.1985.tb00161.x
- Morita H., Kishi E., Takeya K., Itokawa H., Iitaka Y. Squalene derivatives from Eurycoma longifolia. Phytochemistry, 1993;34(3): 765-771 DOI: 10.1016/0031-9422(93)85356-V
- Papadopoulos V, Lecanu L., Brown R.C., Han Z., Yao Z.X. Peripheral-type benzodiazepine receptor in neurosteroidbiosynthesis, neuropathology and neurological disorders. Neuroscience. 2005;138(3):749-756 DOI: 10.1016/j.neuroscience.2005.05.063
- Payne A.H., Hales D.B. (2004). Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones. Endocrine Reviews DOI: 10.1210/er.2003-0030
- Pihie A. Tongkat Ali, Kacip Fatimah and Pegaga: New Dimensions in Complementary Health Care. In C. Shyun, M. Mohtar, N. Yunos (ред.): Proceedings of the Seminar on Medicinal Plants 2002; C 12).
- Sambandan T.G., Rha C., Kadir A.A., Aminudim N., Saad J.M. Bioactive Fraction of Eurycoma longifolia. United State Patent. 2001; получено из: https://www.google.com/patents/US7132117
- Sandblom R.E., Matsumoto A.M., Schoene R.B., Lee K.A., Giblin E.C., Bremner W.J., et al. Obstructive sleep apnea syndrome induced by testosterone administration. New England Journal of Medicine, 1983;308(9): 508-510. Получено из: http://www.nejm.org/doi/pdf/10.1056/NEJM198303033080908
- Schulman C.C., Fusco F., Martin Morales A., Tostain J., Vendeira P., Zitzmann M. Testosterone Deficiency: A Common, Unrecognised Syndrome? European Urology, Supplements. 2009;8(9)772-777 DOI: 10.1016/j.eursup.2009.05.003
- Shiraishi K., Ascoli M. Lutropin/choriogonadotropin stimulate the proliferation of primary cultures of rat leydig cells through a pathway that involves activation of the extracellularly regulated kinase 1/2 cascade. Endocrinology, 2007;148(7): 3214-3225 DOI: 10.1210/en.2007-0160
- Tambi M. Eurycoma Longifolia Jack: a potent adaptogen in the form of water-soluble extract with the effect of maintaining men’s health. Asian J Androl, 2006;8(Supplement 1): 49-50.
- Tambi M. Nutrients and botanicals for optimizing men’s health. Examining the evidence for Eurycoma longifolia Jack, the Malaysian Ginseng in men. Asian J Androl, 2009;11 (Suppl. 5): 37-38.
- Tambi M.I.B.M., Imran M.K., Henkel R.R. Standardised water-soluble extract of Eurycoma longifolia, Tongkat ali, as testosterone booster for managing men with late-onset hypogonadism? Andrologia, 2012;44(Suppl.1): 226-230 DOI: 10.1111/j.1439-0272.2011.01168.x
- Vibes, J., Lasserre, B., Gleye, J., Declume, C. Inhibition of thromboxane A2biosynthesis in vitro by the main components of Crataegus oxyacantha (Hawthorn) flower heads. Prostaglandins, Leukotrienes and Essential Fatty Acids, 1994;50(4): 173-175 DOI: 10.1016/0952-3278(94)90141-4
- Zhang, Z. B., Yang, Q. T. The testosterone mimetic properties of icariin. Asian Journal of Andrology, 2006;8(5): 601-605 DOI: 10.1111/j.1745-7262.2006.00197.x
- Zhari, I., Ismail, N., Lassa, J. Malaysian Herbal Monograph. Radix Eurycoma, Eurycoma root. 1999;Kuala Lumpur: Malaysian Monograph Committee


