Протеиназа бацилл на основе генной конструкции как кормовая добавка для птицеводства
Автор: Корягина А.О., Рудакова Н.Л., Лутфуллин М.Т., Хадиева Г.Ф., Тойменцева А.А., Марданова А.М., Шарипова М.Р.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Кормовые растения и добавки
Статья в выпуске: 6 т.53, 2018 года.
Бесплатный доступ
Усвояемость питательных пищевых веществ рациона и, как следствие, его удешевление определяются не только составом и активностью ферментов в организме, но и кормовыми ферментными добавками. Применение бактериальных ферментов, в частности протеиназ, в качестве биодобавок в птицеводстве активно развивается. Расщепляя белки, протеиназы повышают их доступность (как следствие, экономятся средства на приобретение синтетических аминокислот) и снижают негативный эффект ингибиторов пищеварения. Биотехнологии получения ферментов основаны на применении бактерий или микроскопических грибов, при этом для увеличения выхода и направленного воздействия на свойства продукта используются методы генной инженерии. Бактериальные сериновые протеиназы обладают высокой термостабильностью и устойчивы к ингибиторам животного происхождения. В настоящем сообщении мы впервые представляем данные о получении высокоочищенной секретируемой субтилизиноподобной сериновой протеиназы Bacillus pumilus при экспрессии рекомбинантного вектора в штаммах B...
Рекомбинантная субтилизиноподобная сериновая протеиназа, субстратная специфичность, стабильность, активность, влияние ph и температуры, кормовая добавка, цыплята-бройлеры
Короткий адрес: https://sciup.org/142220075
IDR: 142220075 | УДК: 636.087.8:573.6.086.83:577.15 | DOI: 10.15389/agrobiology.2018.6.1274rus
Текст научной статьи Протеиназа бацилл на основе генной конструкции как кормовая добавка для птицеводства
Получение экономической выгоды от более полного усвоения зерновых кормов за счет повышения усвояемости питательных веществ оста-
∗ Работа выполнена в рамках государственной программы повышения конкурентоспособности Казанского (Приволжского) федерального университета среди ведущих мировых научно-образовательных центров и поддержана грантом РНФ ¹ 16-16-04062.
ется актуальной проблемой в птицеводстве (1-5). Задача может быть решена с помощью комплекса ферментов, включая бациллярные протеиназы. Протеиназы повышают переваримость белковых компонентов, необходимых для роста бройлеров, а также разрушают связи между белками, крахмалом или клетчаткой, что положительно влияет на усвояемость крахмала, повышая его биодоступность (6-10). Применение микробных протеаз также позволяет улучшить усвояемость кормов с высоким содержанием некрахмалистых полисахаридов (11-13). Введение в рацион кур-несушек мультиферментных комплексов (протеаза/ β -клюканаза/пектиназа) приводило к увеличению живой массы птицы, повышению массы яйца и образованию более темного желтка, а также положительно влияло на органы пищеварения (14). Кроме того, введение экзогенных протеиназ в корма повышает переваримость питательных веществ вследствие воздействия на антипитательные факторы рациона, например за счет деструкции ингибиторов трипсина и лектинов в соевом шроте (15, 16). Экзогенные протеазы служат профилактическим средством, снижая количество непереваренного белка, который служит фактором колонизации кишечника патогенными микроорганизмами, приводя к развитию кокцидиоза и некротического энтерита у цыплят (17, 18). Установлена роль непереваренного белка в развитии дисбактериоза, вызывающего некротический энтерит (19, 20). Добавление протеазы улучшало продуктивность бройлеров, инфицированных Eimeria spp. (каузативный агент некротического энтерита) (21) . Комплексные препараты живых бактерий или спор в комбинации с экзогенными протеазами оказывают на цыплят ростостимулирующее и профилактическое действие (22, 23)
Поиск новых продуцентов и получение эффективных рекомбинантных микробных ферментов, применяемых в качестве кормовых добавок, — важная биотехнологическая задача (24-26). Для получения кормовых добавок на основе микробных протеиназ в необходимом количестве разрабатывают эффективные экспрессионные системы (27). Недорогие компоненты сред для культивирования бацилл, а также безопасный статус этих микроорганизмов определяют перспективность их использования в птицеводстве.
В настоящем сообщении мы впервые представляем данные о получении высокоочищенной секретируемой субтилизиноподобной сериновой протеиназы Bacillus pumilus при экспрессии рекомбинантных векторов в штаммах B. subtilis и приводим основные физико-химические и биологические характеристики рекомбинантного продукта, определяющие перспективность его применения в качестве кормовой добавки.
Цель нашего исследования — получение с использованием экс-прессионной системы высокоочищенной субтилизиноподобной сериновой протеиназы Bacillus pumilus как кормовой добавки для птицеводства.
Методика . В работе использовали штаммы и плазмиды из музея лаборатории микробных биотехнологий Казанского федерального университета: природный изолят B. pumilus 7P, его стрептомицинустойчивый мутант B. pumilus 7Р/3-19, плазмиды pCS9 с геном субтилизиноподобной протеиназы B. pumilus (предоставлена С.В. Костровым, Институт молекулярной генетики РАН, г. Москва), pGP382 (предоставлена Dr Prof. Т. Mas-cher, Ludwig-Maximilians-Universit a t M u nchen, Германия). В качестве реципиента использовали протеазодефицитный штамм B. subtilis BG 2036 (любезно предоставлен Prof. E. Ferrarri, «Genencor Int., Inc.», США). Рекомбинантными векторами pTN 3036 (pLIKE-rep + aprBp ), pTN 3050 (pLIKE-rep + SP Pac + aprBp ), pTN 3093 (pLIKE-rep + SP Yngk + aprBp ) и pTN 3801 (pGP382 + aprBp ) трансформировали клетки протеазодефицитного штамма
B. subtilis BG 2036, в результате получили штаммы соответственно B. sub-tilis MRB044, B. subtilis MRB045, B. subtilis MRB046 и B. subtilis MRB072.
Штаммы выращивали в среде следующего состава (г/л): пептон бактериологический («Sigma», США) — 20, CaCl2•2H2O — 0,6, MgSO4•7H2O — 0,5, NaCl — 3, MnSO 4 — 0,1, Na 2 HPO 4 — 0,2, NH 4 Cl — 0,2. Штаммы B. sub-tilis , содержащие рекомбинантные конструкции, культивировали с добавлением эритромицина и линкомицина (соответственно 10 и 25 мкг/мкл), рекомбинантный штамм B. subtilis pCS9 — с добавлением эритромицина (20 мкг/мкл). Продуктивность синтеза субтилизиноподобной протеиназы оценивали отношением протеолитической активности к величине биомассы и выражали в условных единицах.
Активность протеиназы определяли по гидролизу азоказеина («Sigma», США) согласно описанию (28, 29). За единицу активности (EU) принимали количество фермента, гидролизующего в условиях эксперимента 1 мкг субстрата за 1 мин. Специфичность протеиназы изучали по действию на p -цепь окисленного инсулина овцы (30). Измерения проводили на спектрофотометре xMark («Bio-Rad», США).
Для накопления протеиназы использовали биореактор (Biotron LiFlus SP30L («Biotron, Inc.», Корея). В реактор помещали 15 л среды, которую стерилизовали 30 мин при 121 ° С, рН среды доводился до рН 8,5 автоматически и поддерживался добавлением 2 н. NaOH через перистальтическую систему биореактора. В ферментер вносили 300 мл 16-часовой культуры (2 % от объема среды, OD 6 00 инокулята — 3 опт. ед.), антибиотик эритромицин (до конечной концентрации 10 мкг/мл) и пеногаситель Софэксил 1250 («Софэкс», г. Москва). Культивирование проводили в течении 24 ч при 37 ° С с постоянной аэрацией при скорости потока 10 л/мин (содержание О2 не ниже 20 %) и постоянном перемешивании (150-900 об/мин). К 24 ч роста культуры, когда активность фермента достигала максимума (4,4 ед/мл, OD 6 00 — 6 опт. ед.) клетки удаляли центрифугированием (5000 об/мин, 15 мин, Beckman Avanti JXN-26, «Beckman Coulter, Inc.», США). Очистку протеиназы проводили на колонке с карбоксиметилцел-люлозой (КМЦ) («Sigma», США). Супернатант, полученный после центрифугирования, разводили в 10 раз дистиллированной водой, доводили рН до 6,3 и смешивали с КМЦ, уравновешенной 0,02 М Na-ацетатным буфером (рН 6,3). Смесь выдерживали в течение 90 мин при постоянном перемешивании для сорбции фермента. Затем КМЦ осаждали, удаляли надосадочную жидкость и помещали сорбент на колонку. Колонку промывали тем же буфером, элюировали белок 0,2 М Na-ацетатным буфером, рН 6,3 и измеряли активность фермента в полученных фракциях.
Молекулярную массу продуцируемой протеиназы определяли с помощью SDS-электорофореза (31) .
Физико-химические свойства полученного препарата протеиназы оценивали по температурному оптимуму в присутствии и в отсутствие ионов кальция (5 мМ СаCl2). Для изучения термостабильности растворы ферментов в 0,05 М Tрис-HCl буфере (рН 7,2) инкубировали при температурах от 0 до 70 ° С в течение 30 мин, затем определяли активность при 37 ° С, как описано выше. Для оценки рН-оптимума определяли активность фермента в 0,05 М Tрис-HCl буфере. При изучении рН-стабильности инкубировали растворы белков в 0,05 М Tрис-HCl буфере в течение 1 ч при 25 ° С, далее добавляли раствор азоказеина и определяли активность при 37 ° С согласно приведенному выше описанию.
Влияние ингибиторов на протеиназу изучали с использованием фенилметилсульфонилфторида (PMSF), этилендиаминтетрауксусной кис-1276
лоты (EDTA), о-фенантролина (специфический ингибитор металлопротеиназ) и овомукоида (ингибитор трипсина). Раствор белка инкубировали с ингибитором в течение 1 ч при 37 ° С в Трис-HCl буфере (рН 7,2) и определяли протеолитическую активность, как описано выше.
Для имитации условий желудочно-кишечного тракта (ЖКТ) кур использовали универсальный буфер Бриттона-Робинсона (32). Готовили серию из четырех аликвот универсального буфера (0,04 M) с разными значениями рН (2,9; 5,5; 6,0; 6,3 и 8,0). Фермент переносили из одного раствора в другой методом последовательных разведений и выдерживали в каждом из растворов соответствующее время; итоговое разведение фермента — в 200 раз. Последовательность аликвот соответствовала последовательности отделов ЖКТ кур: рН 5,5 (50 мин) — модель «зоб»; рН 2,9 (90 мин) — модель «желудок»; рН 6,5 (30 мин) — модель «тонкий кишечник», рН 8 (70 мин) — модель «толстый кишечник». На протяжении всего эксперимента температура буфера составляла 40 ° С.
Желчь, полученную от цыплят-бройлеров 10-суточного возраста, разводили 0,02 М Na-ацетатным буфером (рН 6,3). Пробы с содержанием желчи в ферментном растворе от 0,01 % до 5 % выдерживали при 40 ° С в течение 60 мин. Каждые 15 мин отбирали пробы для измерения активности. В качестве контроля использовали раствор фермента в 0,02 М Na-ацетатном буфере (рН 6,3) без желчи. Контрольный раствор фермента выдерживали при 40 ° С в течение 1 ч и определяли активность протеиназы.
Свойства протеиназы как кормовой добавки изучали в условиях крестьянско-фермерского хозяйства (дер. Среднее Азяково, Медведевский р-н, Республика Марий Эл). Для опыта отобрали 1-суточных цыплят кросса Cobb 500 (225 гол.) со средней живой массой 0,049±0,003 кг, из которых сформировали контрольную группу (75 гол.), получавшую в рационе стандартный комбикорм, и две опытные группы (по 75 гол.), где в комбикорм птице добавляли рекомбинантную протеиназу в дозе 5 EU/кг (I группа) или 15 EU/кг (II группа). Продолжительность опыта составила 42 сут. Цыплята в возрасте 0-10 сут получали комбикорм Старт, 11-20 сут — Рост, 21-42 сут — Финишер в соответствии с технологиями выращивания (ООО «Алгоритм инвестиций», г. Йошкар-Ола, Республика Марий Эл). Ферментный раствор вносили в сухой корм опрыскиванием пульверизатором при постоянном перемешивании. Цыплят содержали в вентилируемых клеточных батареях при температуре 35-36 ° С. Прирост массы у цыплят оценивали от начального до заключительного дня эксперимента ежедневно. Количество потребляемого корма пересчитывали на одного цыпленка. Коэффициент конверсии корма вычисляли, как отношение количества потребленного корма к приросту живой массы.
Токсичность препарата протеиназы исследовали на 1-суточных цыплятах кросса Cobb 500 массой 0,047±0,001 кг, из которых сформировали контрольную группу (15 гол.), получавшую только комбикорм, и опытную группу (15 гол.), где птице в комбикорм добавляли протеиназу (100 EU/кг корма) в течение 10 сут. В период опыта учитывали массу цыплят, наблюдали за их поведением, состоянием помета. Через 10 сут из каждой группы случайным образом отобрали по 3 цыпленка, которых усыпляли ингаляционным наркозом с помощью хлороформа для исследования состояния внутренних органов.
Статистическая обработка результатов включала расчет среднего значения ( M ) и стандартные ошибки среднего (±SEM). Достоверность различий оценивали по t -критерию Стьюдента. Различия считали статистически значимыми при p < 0,05.
Результаты. Мы сравнили экспрессию субтилизиноподобной внеклеточной сериновой протеиназы B. pumilus в природных и рекомбинантных штаммах. Штамм дикого типа B. pumilus 7P — природный изолят, который выделили по признаку повышенной продукции внеклеточной рибонуклеазы и других ферментов, включая протеиназу, B. pumilus 7P/3-19 — его стрептомицинустойчивый мутант. Мы получили рекомбинантный штамм B. subtilis pCS9, который несет мультикопийную плазмиду pCS9, содержащую ген протеиназы B. pumilus ( aprBp ) с собственным сигнальным пептидом под контролем собственного промотора. Для клонирования гена aprBp также использовали оптимизированную LIKE-систему экспрессии на основе промотора liaI B. subtilis , который регулируется двухкомпонентной индуцируемой антибиотиком системой LiaRS (33, 34). В составе вектора pLIKE-rep в штамм B. subtilis MRB044 ввели ген aprBp с собственным сигнальным пептидом (pTN 3036 — pLIKE-rep + aprBp ), в штамм B. subtilis MRB045 — с нуклеотидной последовательностью сигнального пептида гена пенициллинамидазы (пенициллинамидогидролаза, КФ 3.5.1.11) B. megaterium (pTN 3050 — pLIKE-rep + SPPac + aprBp ), в штамм B. subtilis MRB046 — с последовательностью рекомбинантного сигнального пептида гена гликозидгидролазы (КФ 3.2.1.-) B. megaterium (pTN 3093 (pLIKE-rep + SPYngk + aprBp ). Для клонирования гена aprBp также использовали вектор экспрессии pGP382 с сильным конститутивным промотором (P Deg Q ) (35). Ген degQ кодирует белок (46 а.о.), участвующий в фосфорилировании двухкомпонентной системы DegS/DegU, контролирующей синтез протеиназ (36). Штамм B. subtilis MRB072 содержал плазмиду pGP382 (pTN 3801 — pGP382 + aprBp ) с геном aprBp и Strep меткой в составе вектора для аффинной очистки белка. Сравнение экспрессии показало, что наиболее эффективным продуцентом протеиназы был штамм B. subtilis pCS9 (табл. 1), который использовали для продолжения экспериментов.
1. Протеолитическая активность в культуральной жидкости исследуемых природных изолятов Bacillus и рекомбинантных штаммов с геном субтилизино-подобной сериновой протеиназы B. pumilus aprBp в различных конструкциях ( n = 10)
|
Штамм 1 |
Активность, EU 1 |
Продуктивность, усл. ед |
|
B. pumilus 7Р |
1,50±0,02 |
0,50±0,01* |
|
B. pumilus 7Р/3-19 |
2,90±0,01 |
0,93± 0,02 * |
|
B. subtilis pCS9 |
3,50±0,01 |
1,14±0,02* |
|
B. subtilis MRB044 |
0,25±0,05 |
0,10±0,01 |
|
B. subtilis MRB045 |
0,30±0,02 |
0,12±0,02 |
|
B. subtilis MRB046 |
0,42±0,03 |
0,17±0,02* |
|
B. subtilis MRB072 |
0,50±0,01 |
0,20±0,04 |
|
* Различия с контролем статистически значимы при р < 0,05. |
||
2. Очистка рекомбинантной субтилизиноподобной протеиназы, экспрессируемой в штамме Bacillus subtilis pCS9 с геном aprBp B. pumilus в плазмиде pCS9
( n = 5)
|
Стадия очистки |
Объем, мл |
Белок, мг/мл |
Активность |
Степень очистки |
Выход, % |
|
EU/мл п всего, EU1 удельная, EU/мг |
Культуральная
|
жидкость Ионообменная хроматография на карбок- |
12800 |
870±20* |
4,4±0,07* |
56320а |
0,005 |
1,0 |
100 |
|
симетилцеллюлозе |
470 |
383±10* |
33,8±0,1* |
15886а |
0,088 |
17,6 |
28,2 |
Пи мечание. а — средние значения активности.
* Различия с контролем статистически значимы при р < 0,05.
После культивирования B. subtilis pCS9 в биореакторе и очистке протеиназы ее фракции с высокой активностью, полученные при хроматографическом разделении продукта экспрессии, объединили и получили пре- парат с суммарной активностью 15886 EU (табл. 2). Анализ методом SDS-электорофореза подтвердил наличие белка с молекулярной массой 28 кДа. Таким образом, с помощью хроматографии на КМЦ был получен высоко-очищенный препарат рекомбинантной субтилизиноподобной протеиназы в 0,2 М Na-ацетатном буфере (рН 6,3). Так как компоненты буферной смеси нетоксичны для кур, их присутствие в растворе фермента не служило препятствием для использования в экспериментах с птицей.
Температурный оптимум рекомбинантного фермента составил 37 ° С (рис. 1, А). Для практического использования важно, что в присутствии ионов кальция в конечной концентрации 5 мМ температурный оптимум фермента повышался до 50 ° С. При этом активность фермента увеличивалась в среднем на 40 % при 50 ° С и на 60 % — при 55 ° С (см. рис. 1, Б). Протеиназа оставалась стабильной в интервале температуры от 0 до 40 ° С.
Оптимум кислотности для протеиназы приходился на рН 9,5. Протеиназа сохраняла стабильность в интервале рН 7-10. При рН 3 и рН 11 падение активности не превышало 40 % (см. рис. 1, В). Данные по термои рН-стабильности белка свидетельствуют о возможности его применения в качестве кормовой добавки. При разведении аликвоты фермента раствором специфического ингибитора сериновых протеиназ PMSF (1:1000) энзиматическая активность полностью подавлялась, в присутствии ингибиторов металлопротеиназ EDTA и о-фенантролина (соотношение 1:100) — не изменялась. Эти данные свидетельствовали о принадлежности фермента к классу сериновых протеиназ. Активность протеиназы не подавлял ингибитор трипсина, на основании чего мы предположили, что рекомбинантный фермент будет способен функционировать в ЖКТ кур.
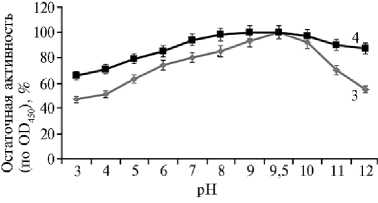
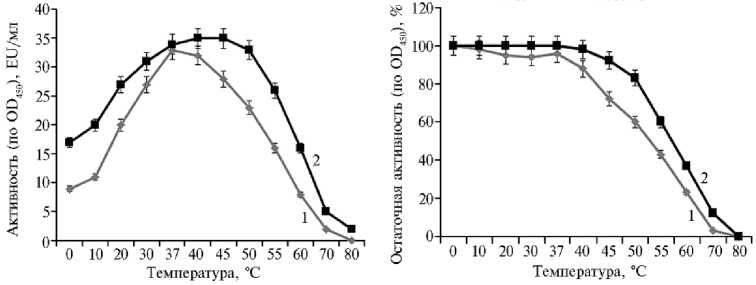
Рис. 1. Температурный оптимум (А), термостабильность (Б) рекомбинантной субтилизи-ноподобной протеиназы Bacillus pumilus в отсутствие (1) и в присутствии (2) Са2+, а также оптимум (3) и рН-стабильность (4) фермента (В) ( n = 5, различия с контролем статистически значимы при р < 0,05).
лина. Гидролиз β -цепи приводил к
Для исследования субстратной специфичности протеиназы использовали β-цепь окисленного инcу-накоплению многочисленных пептид фрагментов, выявляемых при тонкослойной хроматографии (данные не приведены), что указывало на широкую субстратную специфичность, характерную для известных субтилизиноподобных ферментов — протеиназы К, эсперазы B. lentus и субтилизина BPN´ B. amyloliquefaciens (37). Фермент гидролизует связи, образованные карбоксильными группами гидрофобных аминокислот (Phe1-Val2, Leu11-Val12, Leu15-Tyr16, Phe25-Tyr26 и др.), а также гидрофильных аминокислот (Asn3-Gln4, Gln4-His5, Cys7-Gly8, Ser9-His10, Tyr16-Leu17 и др.). Следовательно, полученная протеиназа B. pumilus обладает широкой субстратной специфичностью и способностью к глубокому гидролизу белковых субстратов, что также определяет перспективность фермента как биодобавки, расщепляющей белковые компоненты кормов.
Для эффективной работы в пищеварительном тракте птицы протеиназа должна сохранять активность при повышенной температуре (40 ° С) и агрессивных значениях рН среды, меняющихся от кислого к щелочному. Эксперимент с имитаций условий ЖКТ кур (рН, время и температура) показал, что протеиназа успешно функционирует в таких условиях (рис. 2). В слабокислой среде (рН 5,5, модель «зоб») фермент сохранял активность в пределах контроля. В сильнокислой среде (рН 2,9, модель «желудок») активность фермента снизилась на 40 %, а в щелочных условиях (рН 6,5-8,0, модель «тонкий и толстый кишечник») — возрастала на 10-13 % относительно контроля. Эти данные показали, что протеиназа может оставаться в активном состоянии на всем протяжении пищеварительного тракта птицы.
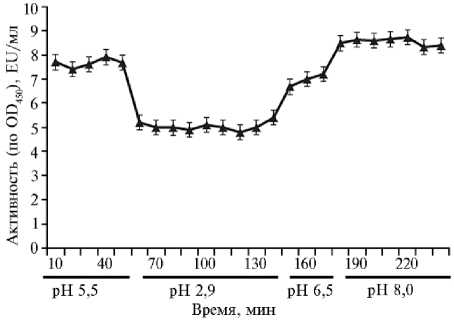
Рис. 2. Активность рекомбинантной суб-тилизиноподобной протеиназы Bacillus pumilus при различных значениях рН, имитирующих условия в желудочно-кишечном тракте цыплят ( n = 5, различия с контролем статистически значимы при р < 0,05).
Изучение активности и стабильности фермента при воздействии желчью в течение 1 ч при 40 °С показало, что при ее концентрации от 0,01 до 0,05 % активность фермента сохранялась в пределах контроля. При увеличении кон- центрации до 1 % активность фермента снижалась на 10 %, а при концентрации 5 % остаточная активность фермента составила 60 % (рис. 3). Следовательно, полученный бактериальный фермент способен сохранять каталитическую активность при воздействии желчи в условиях ЖКТ кур.
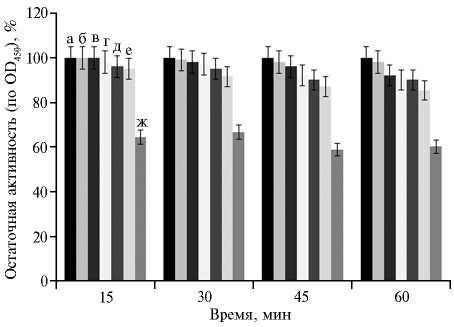
Рис. 3. Активность рекомбинантной субтилизиноподобной протеиназы Bacillus pumilus при разных концентрациях желчи: а — 0,01 %, б — 0,05 %, в — 0,10 %, г — 0,25 %, д — 0,50 %, е — 1 %, ж — 5 % ( n = 5, различия с контролем статистически значимы при р < 0,05).
При оценке токсичности препарата цыплят содержали в вольерах. Предварительно цыплят осматривал ветеринарный специалист для выявления больных и ослабленных особей (их исключали из эксперимента). Использовали стартовый комбикорм в виде крупки. Рас- ход препарата протеиназы составлял 12,5 мл/кг корма на 15 гол. В течение
10 сут (период наблюдения) все цыплята оставались здоровыми, активными, хорошо поедали корм, физиологических отклонений и изменения поведенческих реакций у них не наблюдали. Живая масса цыплят в опыте сохранялась в пределах контроля. Помет цыплят-бройлеров был нормальный. После вскрытия во внутренних органах цыплят повреждений и патологических изменений не выявили. Эти результаты подтвердили, что препарат бактериальной протеиназы был безопасен для птицы и не обладал токсичностью.
3. Динамика основных зоотехнических показателей у цыплят-бройлеров кросса Cobb 500 при добавлении рекомбинантной протеиназы Bacillus pumilus в корма ( M ±SEM, физиологический опыт, крестьянско-фермерское хозяйство, Республика Марий Эл)
|
Показатель |
Контроль ( n = 25) |
I группа, 5 EU/кг корма ( n = 25) |
II группа, 15 EU/кг корма ( n = 25) |
|
Прирост живой массы, кг: 0 сут |
0,049±0,003 |
0,049±0,003 |
0,049±0,003 |
|
1-10 сут |
0,201±0,007 |
0,229±0,008 |
0,214±0,005 |
|
11-20 сут |
0,364±0,014 |
0,402±0,014 |
0,391±0,010 |
|
21-42 сут |
1,551±0,032 |
1,668±0,038 |
1,674±0,039 |
|
Итого |
2,165±0,044 |
2,348±0,044 |
2,328±0,037 |
|
Потребление комбикорма в расчете на одного цыпленка, кг: |
|||
|
Старт (0-10 сут) |
0,343 |
0,336 |
0,347 |
|
Рост (11-20 сут) |
0,729 |
0,705 |
0,719 |
|
Финишер (21-42 сут) |
3,112 |
3,127 |
3,071 |
|
Итого |
4,184 |
4,168 |
4,137 |
|
Конверсия корма: Старт (0-10 сут) |
1,71 |
1,47 |
1,62 |
|
Рост (11-20 сут) |
2,00 |
1,75 |
1,84 |
|
Финишер (21-42 сут) |
2,01 |
1,88 |
1,84 |
|
Итого |
1,98 |
1,81 |
1,82 |
|
Сохранность поголовья |
100 % |
100 % |
100 % |
П р и м е ч а н и е. В I и II группах к основному (контрольному) рациону добавляли препарат субтили-зиноподобной протеиназы Bacillus pumilus (см. раздел «Методика»). Различия с контролем статистически значимы при р < 0,05.
При определении питательной ценности кормов (Рост, Старт, Финишер) в случае добавления бактериальной протеиназы содержание кальция (около 1 %) было достаточным для стабилизации активности вносимого фермента. В течение 42 сут (период наблюдений) все цыплята оставались здоровыми, активными, хорошо поедали корм, их поведенческие реакции не изменялись. Сохранность поголовья составила 100 % в контрольной и опытных группах. К концу откорма живая масса птицы, получавшей протеиназу в качестве добавки, была выше контроля в I группе (5 EU/кг) в среднем на 8,7 % (р < 0,05), во II группе (15 EU/кг) — на 7,7 % (р < 0,05) (табл. 3). В период 0-10 сут (комбикорм Старт) прирост живой массы цыплят в I и II группах был выше, чем в контроле, соответственно на 13,9 % (р < 0,05) и 6,5 % (р < 0,05) (см. табл. 3). Конверсия корма в обеих группах улучшилась (соответственно на 14,0 и 5,3 %, р < 0,05). С 11-х по 20-е сут (комбикорм Рост) прирост массы в I группе был выше на 10,4 % (р < 0,05), во II группе — на 7,4 % (р < 0,05) по сравнению с контролем. При этом конверсия корма улучшалась (соответственно на 12,5 и 8,0 %, р < 0,05). При использовании комбикорма Финишер (21-42-е сут) наблюдали прирост в I группе на 7,5 % (р < 0,05), во II — на 7,9 % (р < 0,05). В этот период конверсия корма в опытных группах улучшалась соответственно на 6,5 и 8,5 % (р < 0,05).
Таким образом, субтилизиноподобная протеиназа Bacillus pumilus, экспрессируемая в клетках Bacillus subtilis pCS9 с геном aprBp в составе плазмиды pCS9, проявляет широкую субстратную специфичность, стабильна (выдерживает колебания pH, температуры, высокие концентрации желчи), высокоактивна (способна сохранять активность как в верхних, так и в нижних отделах кишечника цыплят кросса Cobb 500) и нетоксична для птицы. Эти свойства препарата необходимы в условиях желудочнокишечного тракта бройлеров, поскольку фермент должен удалять субстраты, которые могли бы нарушить пищеварение и баланс микрофлоры, по мере продвижения химуса по всему кишечнику. Полученные данные позволили нам сделать заключение, что на ранних стадиях роста (0-10 сут) при использовании рецептуры Старт эффективная доза протеиназы — 5 EU/кг корма (проявляется тенденция к улучшению конверсии корма). То же отмечали позднее (21-42-е сут) при добавлении протеиназы в дозе 15 EU/кг к комбикорму Финишер. Полученная рекомбинантная бациллярная протеиназа может рассматриваться как потенциальная кормовая добавка для повышения прироста живой массы и снижения потребления корма при выращивании цыплят-бройлеров.
Л И Т Е Р А Т У Р А
ФГАОУ ВО Казанский (Приволжский) федеральный Поступила в редакцию университет, Институт фундаментальной 19 сентября 2018 года медицины и биологии,
420008 Россия, Республика Татарстан, г. Казань, ул. Кремлевская, 18,
Sel’skokhozyaistvennaya biologiya [ Agricultural Biology ], 2018, V. 53, ¹ 6, pp. 1274-1284
GENE CONSTRUCT-BASED SERINE PROTEASE OF Bacillus pumilus AS A FEED ADDITIVE FOR POULTRY FARMING
A.O. Koryagina, N.L. Rudakova, M.T. Lutfullin, G.F. Khadieva, A.A. Toymentseva, A.M. Mardanova, M.R. Sharipova
The authors declare no conflict of interests
Acknowledgements:
This work is a part of the State Program to improve the world research and education competitiveness of the Kazan
(Volga Region) Federal University
Supported financially by Russian Science Foundation (science project No. 16-16-04062)
Список литературы Протеиназа бацилл на основе генной конструкции как кормовая добавка для птицеводства
- Zhu H.L., Hu L.L., Hou Y.Q., Zhang J., Ding B.Y. The effects of enzyme supplementation on performance and digestive parameters of broilers fed corn-soybean diets. Poultry Sci., 2014, 93(7): 1704-1712 ( ) DOI: 10.3382/ps.2013-03626
- Stefanello C., Vieira S.L., Santiago G.O., Kindlein L., Sorbara J.O., Cowieson A.J. Starch digestibility, energy utilization, and growth performance of broilers fed corn-soybean basal diets supplemented with enzymes. Poultry Sci., 2015, 94(10): 2472-2479 ( ) DOI: 10.3382/ps/pev244
- Pekel A.Y., Horn N.L., Adeola O. The efficacy of dietary xylanase and phytase in broiler chickens fed expeller-extracted camelina meal. Poultry Sci., 2017, 96(1): 98-107 ( ) DOI: 10.3382/ps/pew183
- Cowieson A.J., Adeola O. Carbohydrases, protease, and phytase have an additive beneficial effect in nutritionally marginal diets for broiler chicks. Poultry Sci., 2005, 84(12): 1860-1867 ( ) DOI: 10.1093/ps/84.12.1860
- Ушакова Н.А., Некрасов Р.В., Правдин В.Г., Кравцова Л.З., Бобровская О.И., Павлов Д.С. Новое поколение пробиотических препаратов кормового назначения. Фундаментальные исследования. Научные обзоры, 2012, 1: 184-192.
- Kaczmarek S.A., Rogiewicz A., Mogielnicka M., Rutkowski A., Jones R.O., Slominski B.A. The effect of protease, amylase, and nonstarch polysaccharide-degrading enzyme supplementation on nutrient utilization and growth performance of broiler chickens fed corn-soybean meal-based diets. Poultry Sci., 2014, 93(7): 1745-1753 ( )
- DOI: 10.3382/ps.2013-03739
- Yuan C., Ding Y., Qiang He, Azzam M.M.M., Lu J.J., Zou X.T. L-arginine upregulates the gene expression of target of rapamycin signaling pathway and stimulates protein synthesis in chicken intestinal epithelial cells. Poultry Sci., 2015, 94(5): 1043-1051 ( )
- DOI: 10.3382/ps/pev051
- Toghyani M., Wu S.B., Pérez-Maldonado R.A., Iji P.A., Swick R.A. Performance, nutrient utilization, and energy partitioning in broiler chickens offered high canola meal diets supplemented with multicomponent carbohydrase and mono-component protease. Poultry Sci., 2017, 96(11): 3960-3972 ( )
- DOI: 10.3382/ps/pex212
- Goodarzi Boroojeni F., Senz M., Kozłowski K., Boros D., Wisniewska M., Rose D., Männer K., Zentek J. The effects of fermentation and enzymatic treatment of pea on nutrient digestibility and growth performance of broilers. Animal, 2017, 11(10): 1698-1707 ( )
- DOI: 10.1017/S1751731117000787
- Adebiyi A.O., Olukosi O.A. Metabolizable energy content of wheat distillers’ dried grains with solubles supplemented with or without a mixture of carbohydrases and protease for broilers and turkeys. Poultry Sci., 2015, 94(6): 1270-1276 ( )
- DOI: 10.3382/ps/pev089
- Romero L.F., Sands J.S., Indrakumar S.E., Plumstead P.W., Dalsgaard S., Ravindran V. Contribution of protein, starch, and fat to the apparent ileal digestible energy of corn-and wheat-based broiler diets in response to exogenous xylanase and amylase without or with protease. Poultry Sci., 2014, 93(10): 2501-2513 ( )
- DOI: 10.3382/ps.2013-03789
- Olukosi O.A., Beeson L.A., Englyst K., Romero L.F. Effects of exogenous proteases without or with carbohydrases on nutrient digestibility and disappearance of non-starch polysaccharides in broiler chickens. Poultry Sci., 2015, 94(11): 2662-2669 ( )
- DOI: 10.3382/ps/pev260
- Amerah A.M., Romero L.F., Awati A., Ravindran V. Effect of exogenous xylanase, amylase, and protease as single or combined activities on nutrient digestibility and growth performance of broilers fed corn/soy diets. Poultry Sci., 2017, 96(4): 807-816 ( )
- DOI: 10.3382/ps/pew297
- Маркин Ю., Нестеров Н. Разумная альтернатива антибиотикам. Животноводство России, 2018, 2: 8-11.
- Erdaw M.M., Wu S., Iji P.A. Growth and physiological responses of broiler chickens to diets containing raw, full-fat soybean and supplemented with a high-impact microbial protease. Asian-Australas. J. Anim. Sci., 2017, 30(9): 1303-1313 ( )
- DOI: 10.5713/ajas.16.0714
- Erdaw M.M., Perez-Maldonado R.A., Iji P.A. Physiological and health-related response of broiler chickens fed diets containing raw, full-fat soya bean meal supplemented with microbial protease. J. Anim. Physiol. Anim. Nutr., 2018, 102(2): 533-544 ( )
- DOI: 10.1111/jpn.12785
- Williams R.B. Intercurrent coccidiosis and necrotic enteritis of chickens: rational, integrated disease management by maintenance of gut integrity. Avian Pathology, 2005, 34(3): 159-80 ( )
- DOI: 10.1080/03079450500112195
- Khochamit N., Siripornadulsil S., Sukon P., Siripornadulsil W. Antibacterial activity and genotypic-phenotypic characteristics of bacteriocin-producing Bacillus subtilis KKU213: potential as a probiotic strain. Microbiological Research, 2015, 170: 36-50 ( )
- DOI: 10.1016/j.micres.2014.09.004
- Timbermont L., Lanckriet A., Dewulf J., Nollet N., Schwarzer K., Haesebrouck F., Ducatelle R., Van Immerseel F. Control of Clostridium perfringens-induced necrotic enteritis in broilers by target-released butyric acid, fatty acids and essential oils. Avian Pathology, 2010, 39(2): 117-121 ( )
- DOI: 10.1080/03079451003610586
- Yan W., Sun C., Yuan J., Yang N. Gut metagenomic analysis reveals prominent roles of Lactobacillus and cecal microbiota in chicken feed efficiency. Scientific Reports, 2017, 7: 45308 ( )
- DOI: 10.1038/srep45308
- Caly D.L., D’Inca R., Auclair E., Drider D. Alternatives to antibiotics to prevent necrotic enteritis in broiler chickens: a microbiologist's perspective. Front. Microbiol., 2015, 6: 1336 ( )
- DOI: 10.3389/fmicb.2015.01336
- Askelson T.E., Flores C.A., Dunn-Horrocks S.L., Dersjant-Li Y., Gibbs K., Awati A., Lee J.T., Duong T. Effects of direct-fed microorganisms and enzyme blend co-administration on intestinal bacteria in broilers fed diets with or without antibiotics. Poultry Sci., 2018, 97(1): 54-63 ( )
- DOI: 10.3382/ps/pex270
- Wu B.Q., Zhang T., Guo L.Q., Lin J.F. Effects of Bacillus subtilis KD1 on broiler intestinal flora. Poultry Sci., 2011, 90(11): 2493-2499 ( )
- DOI: 10.3382/ps.2011-01529
- Рыбьяков М., Тимошенко Р. Сибенза® ДП 100 для снижения стоимости корма. Животноводство России, 2014, 6: 20-21.
- Павленко А., Головачев Д. Кризис -время использовать эффективные добавки. Животноводство России, 2015, 3: 48-50.
- Демина Т.Б., Фоменко И.Е. Протосубтилин -обновленный и эффективный ферментный препарат. Птицеводство, 2013, 8: 17-19.
- Liu L., Yang H., Shin H.D., Chen R.R., Li J., Du G., Chen J. How to achieve high-level expression of microbial enzymes: strategies and perspectives. Bioengineered, 2013, 4(4): 212-223 ( )
- DOI: 10.4161/bioe.24761
- Charney J., Tomarelli R.M. A colorimetric method for the determination of the proteolytic activity of duodenal juice. J. Biochem., 1947, 177: 501-505.
- Demidyuk I.V., Romanova D.V., Nosovskaya I.V., Demidyuk E.A., Chestukhina G.G., Kuranova I.P., Kostrov S.V. Modification of substrate-binding site of glutamyl endopeptidase from Bacillus intermedius. Protein Engineering, Design and Selection, 2004, 17(5): 411-416 ( )
- DOI: 10.1093/protein/gzh050
- Ицкович Е.Л., Балабан Н.П., Марданова A.M., Шакиров Е.В., Шарипова М.Р., Лещин-ская И.Б., Ксенофонтов А.Л., Руденская Г.Н. Энзиматические свойства тиолзависимой протеиназы Bacillus intermedius 3-19. Биохимия, 1997, 62(1): 60-65.
- Laemmli H.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227(5259): 680-685 ( )
- DOI: 10.1038/227680a0
- Britton H.T.K., Robinson R.A. Universal buffer solutions and the dissociation constant of veronal. J. Chem. Soc., 1931, 0: 1456-1462 ( )
- DOI: 10.1039/JR9310001456
- Toymentseva A.A., Schrecke K., Sharipova M.R., Mascher T. The LIKE system, a novel protein expression toolbox for based on the liaI promoter. Microbial Cell Factories, 2012, 11(1): 143-156 ( )
- DOI: 10.1186/1475-2859-11-143
- Tikhonova A., Toymentseva A., Sharipova M. Screening of heterologous signal peptides for optimization of the LIKE-expression system. BioNanoScience, 2017, 7(2): 408-414 ( )
- DOI: 10.1007/s12668-016-0357-z
- Herzberg C., Weidinger L.A.F., Dörrbecker B., Hübner S., Stülke J., Commichau F.M. SPINE: a method for the rapid detection and analysis of protein-protein interactions in vivo. Proteomics, 2007, 7(22): 4032-4035 ( )
- DOI: 10.1002/pmic.200700491
- Msadek T., Kunst F., Klier A., Rapoport G. DegS-DegU and ComP-ComA modulator-effector pairs control expression of the Bacillus subtilis pleiotropic regulatory gene degQ. J. Bacteriol., 1991, 173(7): 2366-2377.
- Stepanov V.M., Markarian A.N., Strongin A.I., Timokhina E.A. Specific features of intracellular serine proteinase of Bacillus amyloliquefaciens on native and denatured protein substrates. Biokhimiia, 1982, 47(9): 1427-1430.


