Разработка алгоритма прогнозирования свойств пектина, получаемого из протопектина с применением ферментов
Автор: Семенихин С.О., Фабрицкая А.А., Городецкий В.О., Даишева Н.М., Котляревская Н.И., Люсый Н.И., Усманов М.М.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 7, 2024 года.
Бесплатный доступ
Цель исследования - разработка алгоритма прогнозирования свойств пектина, получаемого из протопектина с применением ферментов. Задачи: анализ воздействия различных пектолитических ферментов на протопектин и составление структурных схем трансформации молекулы протопектина. Приведены данные по влиянию наиболее распространенных пектолитических ферментов - эндополигалактуроназы, экзополигалактуроназы, пектинлиазы, пектатлиазы, пектинметилэстеразы, рамногалактуронангидролазы и рамногалактуронанлиазы на химическое строение и прогнозируемые свойства получаемого пектина. Приведены структурные схемы трансформации молекулы свекловичного протопектина под воздействием указанных ферментов. Показано, что применение эндополигалактуроназ, экзополигалактуроназ, пектинлиаз и пектатлиаз неэффективно для получения пектина, так как указанные ферменты гидролизуют гомогалактуронан протопектина до олигомеров галактуроновой кислоты, не обладающих свойствами пектина. Отмечено, что пектинметилэстеразы не оказывают влияние на размер молекулы пектина, а только снижают степень этерификации. Установлено, что для получения пектина из протопектина наиболее перспективными ферментами являются рамногалактуронангидролазы и рамногалактуронанлиазы. Отмечено, что при применении рамногалактуронангидролаз обеспечивается максимальное сохранение нативных свойств пектина, так как не изменяется вид связей внутри молекул галактуроновой кислоты, формирующей основную цепь гомогалактуронана, в отличие от воздействия рамногалактуронангидролаз, приводящих к образованию двойных связей между 4-м и 5-м атомами углеродов в концевых молекулах полигалактуроновой кислоты. Обосновано применение рамногалактуронангидролазы и рамногалактуронанлиазы для получения пектина, обладающего наибольшей молекулярной массой. На основании проведенного анализа по влиянию воздействия наиболее распространенных пектолитических ферментов на химическое строение пектина разработан алгоритм прогнозирования свойств пектина, включающий 7 стадий. Осуществление ферментативного гидролиза протопектина, согласно разработанному алгоритму, позволит получить пектин с заданными свойствами. Разработанный алгоритм прогнозирования свойств пектина может быть использован для разработки технологии и режимов трансформации пектинсодержащего сырья для получения пектина с заданными свойствами.
Растительное сырье, протопектин, пектин, гидролиз, пектолитические ферменты, свойства, алгоритм прогнозирования
Короткий адрес: https://sciup.org/140306732
IDR: 140306732 | УДК: 664.292+577.151 | DOI: 10.36718/1819-4036-2024-7-201-213
Текст научной статьи Разработка алгоритма прогнозирования свойств пектина, получаемого из протопектина с применением ферментов
Введение. Известно, что в растительном сырье, как правило, содержание протопектина выше, чем пектина [1–3]. Следует отметить, что при извлечении пектина традиционным способом – химическим гидролизом, совмещенным с экстракцией, значительная часть протопектина остается в сырье. Эффективным способом доизв-лечения оставшейся в сырье части пектина является направленное воздействие на протопектин, осуществляемое с применением пектолити-ческих ферментов, то есть ферментативный гидролиз [4, 5].
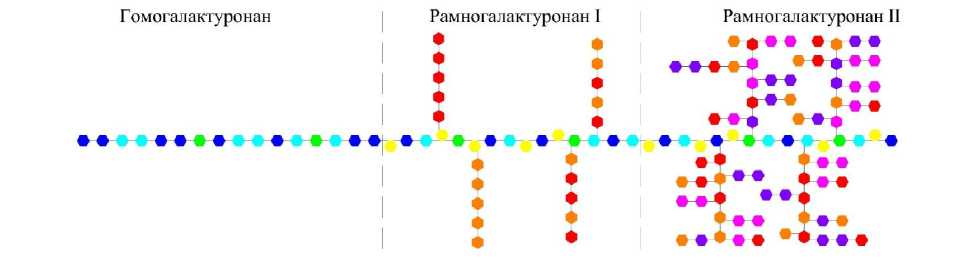
Основу молекулярной структуры протопектина составляет последовательность ковалентно связанных мономеров галактуроновой кислоты и рамнозы [6]. Однако молекула протопектина не прямолинейна и может иметь ответвления двух типов – рамногалактуронан I и рамногалак-туронан II, при этом указанные ответвления появляются на участках полигалактуроновой кислоты протопектина, в которые встроена рамноза, и представляют собой ответвления, состоящие из арабинозы и галактозы в различных соотношениях. Структура рамногалактуронана II, в свою очередь, более разнообразна и может состоять как из арабиногалактановых ответвлений, имеющих собственные ответвления, так и из различных полисахаридных ответвлений, также имеющих собственные ответвления [2].
Структура молекулы протопектина на примере низкоэтерифицированного свекловичного протопектина представлена на рисунке 1, из которого видно, что молекула протопектина состоит из следующих компонентов – гомогалак-туронана, рамногалактуронана I и рамногалак-туронана II.
Следует отметить, что гомогалактуронан растворим в воде, а рамногалактуронаны I и II – нерастворимы в воде. Таким образом, к пектину (в т. ч. пектатам и пектонам) относится структурный компонент молекулы протопектина гомога-лактуронан.
Учитывая это, для получения низкоэтерифи-цированного пектина с максимальной способностью к образованию комплексов с ионами поливалентных металлов необходимо выделить из молекулы протопектина наибольшее количество гомогалактуронана в неизменном виде.
Цель исследования – разработка алгоритма прогнозирования свойств пектина, получаемого из протопектина с применением ферментов.
Задачи: анализ воздействия различных пек-толитических ферментов на протопектин; составление структурных схем трансформации молекулы протопектина.
Результаты и их обсуждение. Наибольшее распространение в отечественных и зарубежных исследованиях, направленных на трансформацию протопектина, получили пектолитические ферменты, такие как эндополигалактуроназы (PGA), экзополигалактуроназы (PGX), пектинлиа-зы (PEL), пектатлиазы (PLY), пектинметилэсте-разы (PME), рамногалактуронангидролазы (RGH) и рамногалактуронанлиазы (RGL) [7].
ф - галактуроновая кислота;
- этерифированная галактуроновая кислота;
- амидированная галактуроновая кислота;
- рамноза;
- арабиноза;
- галактоза;
-
- различные моносахариды;
-
- различные уроновые кислоты
Рис. 1. Структура молекулы протопектина
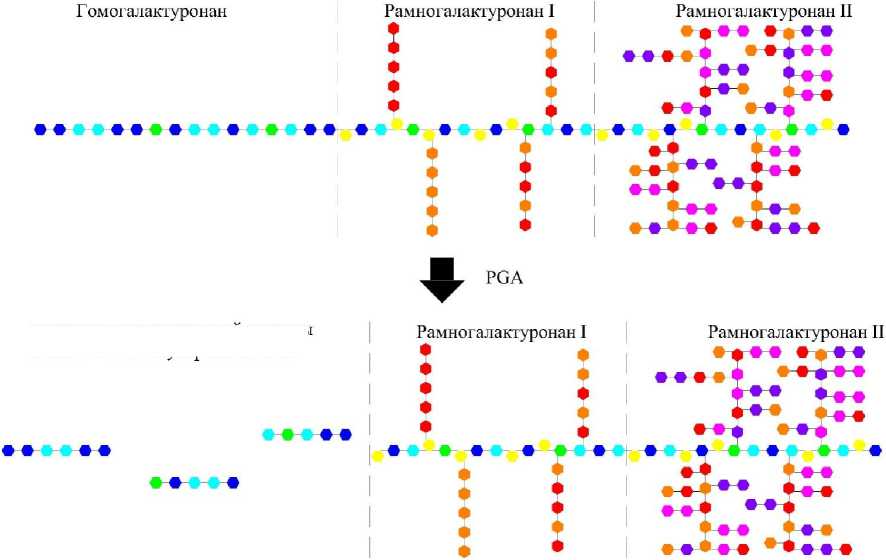
Эндополигалактуроназы гидролизуют по схеме а-элиминирования а-1,4-связи полигалакту-роновой кислоты в молекуле протопектина неупорядоченным, произвольным образом, предпочтительно расщепляются внутренние связи полимеров [8-10].
Структурная схема трансформации молекулы протопектина под воздействием эндополи-галактуроназ представлена на рисунке 2.
Из представленной схемы наглядно видно, что в результате воздействия эндополигалакту-роназ на молекулу протопектина образуются олигомеры галактуроновой кислоты с высокой молекулярной массой. Однако молекулярная масса олигомеров галактуроновой кислоты, получаемых под воздействием эндополигалакту-роназ, будет значительно ниже молекулярной массы пектина, вследствие чего они не будут обладать свойствами пектина.
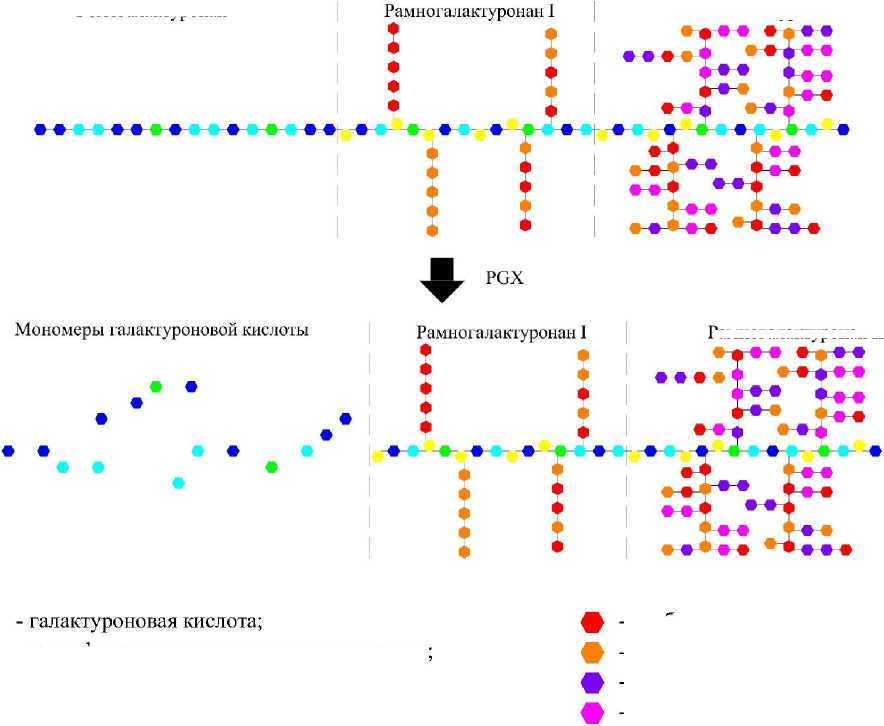
Другими ферментами, гидролизующими по схеме а-элиминирования а-1,4-связи в молекуле протопектина, являются экзополигалактуро-назы [11-13]. Воздействие указанных ферментов имеет направленный характер - они постепенно отщепляют галактуроновую кислоту с конца молекулы гомогалактуронана [7].
Структурная схема трансформации молекулы протопектина под воздействием экзополига-лактуроназ представлена на рисунке 3.
Из представленной схемы наглядно видно, что в результате воздействия экзополигалакту-роназ на молекулу протопектина образуются мономеры галактуроновой кислоты. В связи с этим экзополигалактуроназы не могут использоваться для выделения пектина из протопектина, так как они полностью разрушают пектин.
Олигомеры галактуроновой кислоты с высокой молекулярной массой
- галактуроновая кислота;
- этерифированная галактуроновая кислота;
- амидированная галактуроновая кислота;
- арабино^
- галактоза;
-
- различные моносахариды;
- рамноза;
-
- различные уроновые кислоты
Рис. 2. Структурная схема трансформации молекулы протопектина под воздействием эндополигалактуроназ (PGA)
Г ом-огалактуронан
Рамногалактуронан II
- арабиноза;
- галактоза;
- различные моносахариды;
- различные уроновые кислоты
- этерифированная галактуроновая кислота;
- амидированная галактуроновая кислота;
- рамноза;
Рис. 3. Структурная схема трансформации молекулы протопектина под воздействием экзополигалактуроназ (PGX)
Рамногалактуронан II
Следует также рассмотреть ферменты, гидролизующие по схеме β-элиминирования α-1,4-связи полигалактуроновой кислоты в молекуле протопектина.
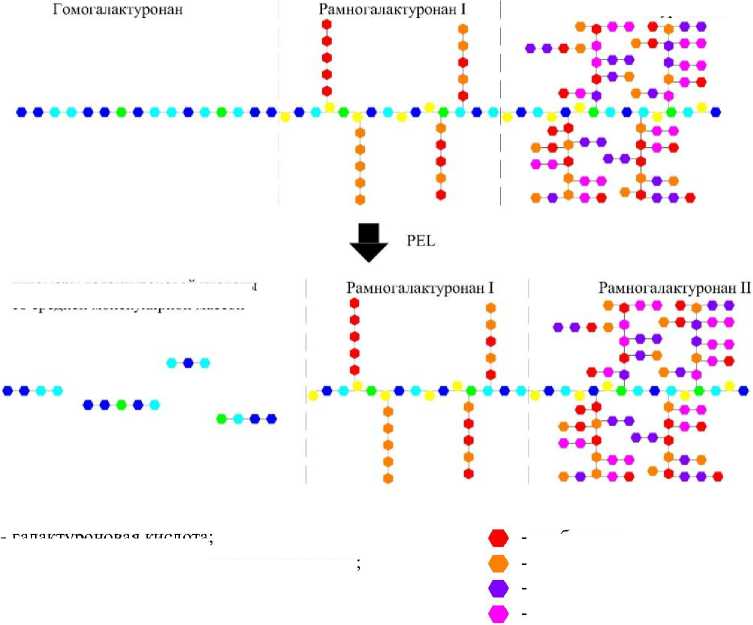
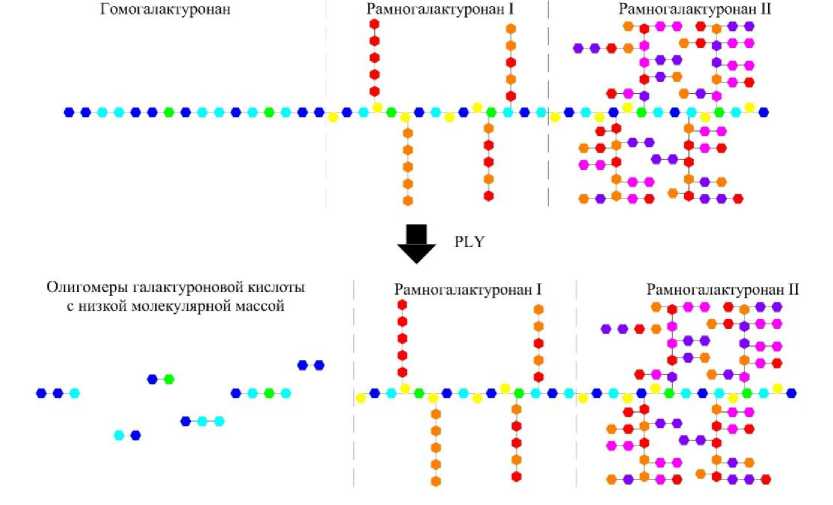
Пектинлиазы гидролизуют пектин в пектон, в результате чего образуется галактуронат с ненасыщенной связью между 4-м и 5-м атомами углерода на невосстанавливающем конце образованной галактуроновой кислоты [14–16]. Следует отметить, что более предпочтительным субстратом для пектинлиаз является высо-коэтерифицированный пектин. Поэтому, воздействуя пектинлиазами на низкоэтерифициро-ванный пектин, гидролиз будет носить хаотичный характер, вследствие чего образуемые в результате гидролиза олигомеры галактуроно-вой кислоты будут иметь преимущественно среднюю молекулярную массу.
Структурная схема трансформации молекулы протопектина под воздействием пектинлиаз представлена на рисунке 4.
Согласно представленной схеме, молекулярная масса олигомеров галактуроновой кислоты, получаемых под воздействием пектин-лиаз (PEL), будет значительно ниже молекулярной массы пектина, вследствие чего получаемые олигомеры не будут обладать свойствами пектина.
Другими ферментами, гидролизующими по схеме β-элиминирования α-1,4-связи полигалак-туроновой кислоты в молекуле протопектина, являются пектатлиазы [17–19].
В отличие от пектинлиаз для эффективности воздействия пектатлиаз степень этерификации субстрата не является существенной.
Структурная схема трансформации молекулы протопектина под воздействием пектатлиаз представлена на рисунке 5.
Рамногалактуронан II
Олигомеры галактуроновой кислоты со средней молекулярной массой
- арабиноза;
- галактоза;
- различные моносахариды;
- различные уроновые кислоты
-
- галактуроновая кислота;
-
- этерифированная галактуроновая кислота;
-
- амидиро ванная галактуроновая кислота;
-
- рамноза;
Рис. 4. Структурная схема трансформации молекулы протопектина под воздействием пектинлиаз (PEL)
ф - галактуроновая кислота;
-
- этерифированная галактуроновая кислота; ф - амидированная галактуроновая кислота;
-
- рамноза;
ф - арабиноза;
ф - галактоза;
ф - различные моносахариды;
ф - различные уроновые кислоты
Рис. 5. Структурная схема трансформации молекулы протопектина под воздействием пектатлиаз (PLY)
Получаемые в результате воздействия пек-татлиаз на протопектин олигомеры галактуро-новой кислоты будут иметь преимущественно низкую молекулярную массу, а также значительное количество двойных связей между 4-м и 5-м атомами углеродов в конечных молекулах галактуроновой кислоты. Таким образом, полученные олигомеры не будут обладать свойствами пектина вследствие низкой молекулярной массы, а также будут проявлять более низкую реакционную способность.
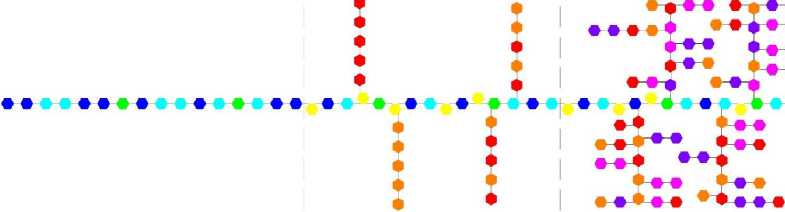
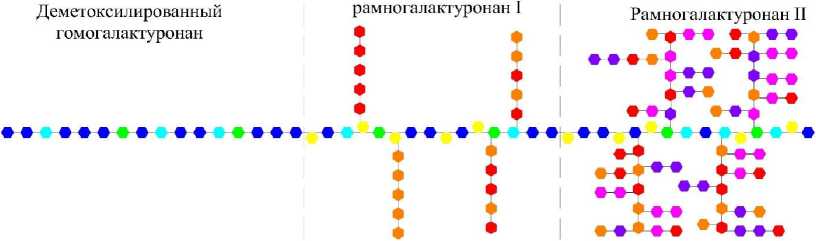
Пектинметилэстеразы катализируют отщепление метильных групп от полиметилгалактуро-новой кислоты с образованием метанола и частично деметоксилированной полигалактуроно-вой кислоты [20–22]. По мере снижения степени этерификации субстратов уменьшается катализирующая способность ферментов, вследствие чего гидролиз не проходит до конца и степень деэтерификации молекул протопектина составляет 60–70 %. Кроме этого следует отметить, что пектинметилэстеразы более эффективно катализируют отщепление метильных групп у молекул с высокой массой, чем с низкой. Поэтому степень деэтерификации олигомеров галактуроновой кислоты будет ниже степени деэтерификации пектина и протопектина.
Структурная схема трансформации молекулы протопектина под воздействием пектинме-тилэстераз представлена на рисунке 6.
Согласно представленной схеме, пектинме-тилэстеразы только снижают степень этерификации протопектина, не оказывая влияния на молекулярную структуру. Учитывая, что степень этерификации, например, свекловичного пектина низкая, то применение пектинметилэстеразы только ухудшит качество получаемого пектина.
Г омогалактуронан
Рамногалактуронан 1
Рамногалактуронан II

Деметоксилированный
ф - галактуроновая кислота;
- этерифированкая галактуроновая кислота;
- амидированная галактуроновая кислота;
- рамноза;
ф - арабиноза;
- галактоза;
ф - различные моносахариды;
ф - различные уроновые кислоты
Рис. 6. Структурная схема трансформации молекулы протопектина под воздействием пектинметилэстераз (PME)
Таким образом, применение пектинметилэ-стераз рационально только для модификации высокоэтерифицированных пектинов в низкоэте-рифицированные.
На основании проведенного анализа следует, что для выделения пектина из протопектина следует применять ферменты, не оказывающие влияние на гомогалактуронан, т. е. применять ферменты, действие которых направлено только на гидролиз рамногалакторунонана I.
Наиболее перспективными ферментами для гидролиза рамногалактуронана являются рам-ногалактуронангидролазы и рамногалактуро-нанлиазы, воздействующие на α-1,4 гликозидные связи между остатками рамнозы и галакту-роновой кислоты [23–27]. Следует отметить, что рамногалактуронангидролазы гидролизуют связь по схеме α-элиминирования с задействованием воды, а рамногалактуронанлиазы – по схеме
β-элиминирования с образованием двойных связей между 4-м и 5-м атомами углерода в концевых молекулах полигалактуроновой кислоты.
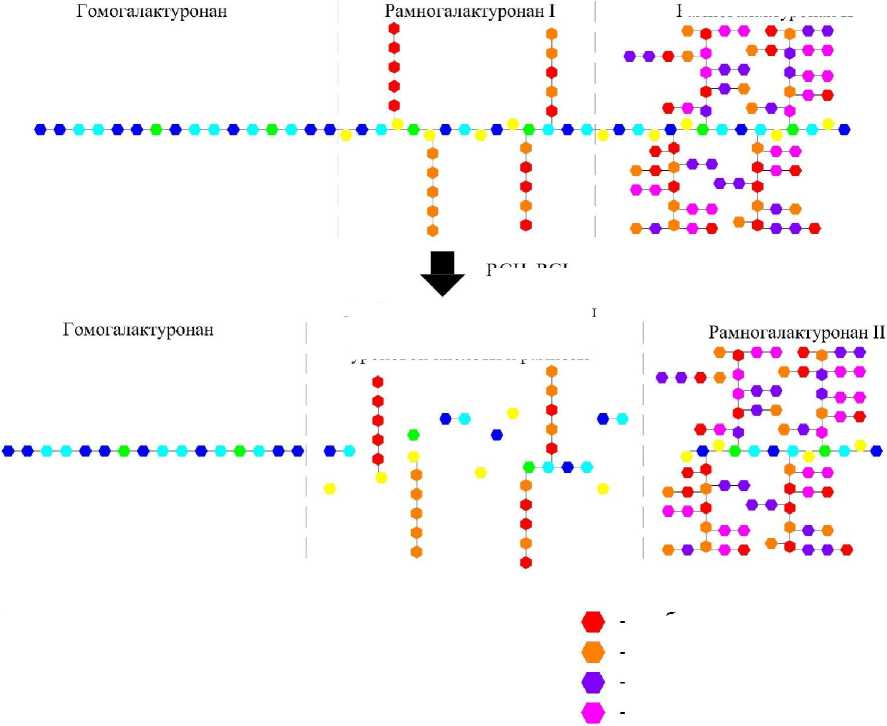
Структурная схема трансформации молекулы протопектина под воздействием рамногалак-туронангидролаз и рамногалактуронанлиаз представлена на рисунке 7.
Как видно из представленной схемы, под воздействием рамногалактуронангидролаз и рамногалактуронанлиаз гомогалактуронан отщепляется в нативном состоянии. Наибольшая трансформация молекулярной структуры протопектина происходит на участке рамногалактуро-нана I, в результате чего образуются моносахариды рамнозы, олигосахариды галактуроновой кислоты, а также арабиногалактаны как в виде отдельных молекул, так и в виде соединений с олигосахаридами галактуроновой кислоты.
Рамногалактуронан II
- арабиноза;
- галактоза;
- различные моносахариды;
- различные уроновые кислоты
- галактуроновая кислота;
- этерифированная галактуроновая кислота;
- амидированная галактуроновая кислота;
- рамноза;
Рис. 7. Структурная схема трансформации молекулы протопектина под воздействием рамногалактуронангидролаз (RGH) и рамногалактуронанлиаз (RGL)
RGH, RGL
Арабиногалактаны, олигомеры уроновых кислот, мономеры уроновой кислоты и рамнозы
Следует отметить, что молекулярная структура рамногалактуронана II не подвергается гидролизу под воздействием рамногалактуро-нангидролаз и рамногалактуронанлиаз, так как их активные центры не способны достичь центральной рамногалактуроновой цепи из-за разветвленных полисахаридных ответвлений. Однако в работах некоторых исследователей отмечается перспективность гидролиза рамнога-лактуронана II при предварительной обработке ферментами, действие которых направлено на полисахаридные ответвления [28].
Таким образом, установлено, что для получения пектина из протопектина наиболее перспективными ферментами являются рамногалакту-ронангидролазы и рамногалактуронанлиазы.
Однако следует отметить, что при применении рамногалактуронангидролаз обеспечивает- ся максимальное сохранение нативных свойств пектина, так как не изменяется вид связей внутри молекул галактуроновой кислоты, формирующей основную цепь гомогалактуронана, в отличие от воздействия рамногалактуронангид-ролаз, приводящих к образованию двойных связей между 4-м и 5-м атомами углеродов в концевых молекулах полигалактуроновой кислоты.
Таким образом, на основании проведенного анализа воздействия различных пектолитиче-ских ферментов на протопектин становится возможной разработка алгоритма прогнозирования свойств пектина.
На рисунке 8 приведен разработанный алгоритм прогнозирования свойств пектина, получаемого из протопектина с применением ферментов.
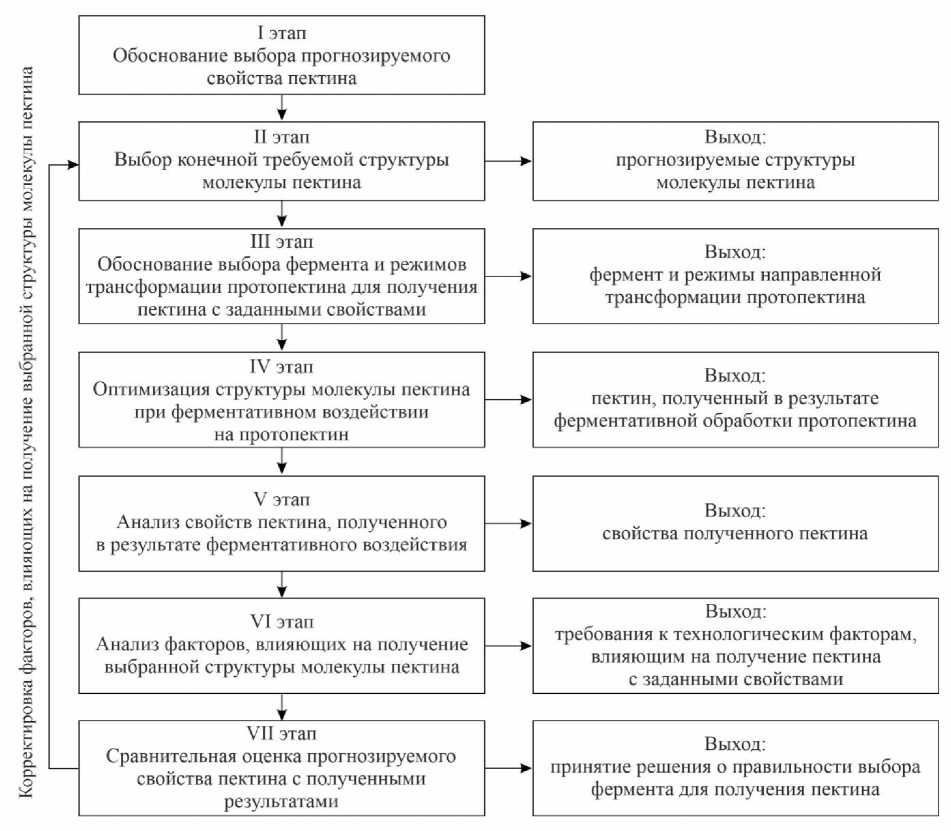
Рис. 8. Алгоритм прогнозирования свойств пектина
Заключение. Осуществление ферментативного гидролиза протопектина, согласно разработанному алгоритму, позволит получить пектин с заданными свойствами.
Предложенный алгоритм прогнозирования свойств пектина может быть использован для разработки технологии и режимов трансформации пектинсодержащего сырья для получения пектина.
Список литературы Разработка алгоритма прогнозирования свойств пектина, получаемого из протопектина с применением ферментов
- Настольная книга чпроизводителя и переработчика плодоовощной продукции / под ред. Н.К. Синха, И.Г. Хью. СПб.: Профессия, 2017. 912 с.
- Донченко Л.В., Сокол Н.В., Красноселова Е.А. Пищевая химия. Гидроколлоиды. М.: Изд. Юрайт, 2019. 80 с.
- Новиков Н.Н. Биохимия растений. М.: Ленанд, 2019. 680 с.
- Влияние композиции ферментов и значения рH экстрагента на эффективность извлечения пектина из свекловичного жома / С.О. Семенихин [и др.] // Вестник КрасГАУ. 2023. № 7. С. 171–178. DOI: 10.36718/1819-4036-2023-7-171-178.
- Направления развития технологии ферментативной экстракции пектиновых веществ / С.О. Семенихин [и др.] // Известия вузов. Пищевая технология, 2022. № 1. С. 6–10. DOI: 10.26297/0579-3009.2022.1.1.
- Zdunek A., Pieczywek P.M., Cybulska J. The primary, secondary, and structures of higher levels of pectin polysaccharides // Food Scien-ce and Food Safety. 2020. № 20 (1). Р. 1101–1117. DOI: 10.1111/1541-4337.12689.
- Уайтхерств Р.Дж. Ферменты в пищевой промышленности / пер. с англ. С.В. Макарова. СПб.: Профессия, 2013. 408 с.
- Structural insights into the processivity of endopolygalacturonase I from Aspergillus niger / Gertie van Pouderoyen [et al.] // FEBS Letters. 2003. Volume 554, Issue 3. P. 462–466. DOI: 10.1016/s0014-5793(03)01221-3.
- 1.68-Å Crystal Structure of Endopolygalac-turonase II from Aspergillus niger and Identifi-cation of Active Site Residues by Site-directed Mutagenesis / Yovka van Santen [et al.] // Journal of Biological Chemistry. 1999. Volume 274, Issue 43. P. 30474–30480. DOI: 10.1074/ jbc.274.43.30474.
- Study of the mode of action of endopolyga-lacturonase from Fusarium moniliforme / E. Bonnin [et al.] // Biochimica et Biophysica Acta (BBA) - General Subjects. 2001. Volume 1526, Issue 3. P. 301–309 DOI: 10.1016/ s0304-4165(01)00141-6
- Maria Angélica dos Santos Cunha Chellegatti, Maria José Vieira Fonseca, Suraia Said. Puri-fication and partial characterization of exopoly-galacturonase I from Penicillium frequentans // Microbiological Research. 2002. Volume 157, Issue 1. P. 19–24. DOI: 10.1078/0944-5013-00127.
- The crystal structure of a hyperthermoactive exopolygalacturonase from Thermotoga mariti-ma reveals a unique tetramer / Tjaard Pijning [et al.] // FEBS Letters. 2009. Volume 583, Is. 22. P. 3665–3670. DOI: 10.1016/j.febslet. 2009.10.047.
- Deepak Chand Sharma T. Satyanarayana. Thermostable and alkalistable exopolygalactu-ronase of Bacillus pumilus dcsr1: Characteris-tics and applicability / International Journal of Biological Macromolecules. 2020. Vol. 164. P. 3340–3348. DOI: 10.1016/j.ijbiomac.2020. 08.204.
- Pectin lyase: A review / Sangeeta Yadav [et al.] // Process Biochemistry. 2009. Vol. 44, Is. 1. P. 1–10. DOI: 10.1016/j.procbio.2008. 09.012.
- Ritu Saharan, Kanti Prakash Sharma. Produc-tion, purification and characterization of pectin lyase from Bacillus subtilis isolated from moong beans leaves (Vigna radiata) // Biocatalysis and Agricultural Biotechnology. 2019. Vol. 21. 101306. DOI: 10.1016/j.bcab. 2019.101306.
- Purification and characterization of an alkaline pectin lyase from Aspergillus flavus / Sangeeta Yadav [et al.] // Process Biochemistry. 2008. Vol. 43, Is. 5. P. 547–552. DOI: 10.1016/j. procbio.2008.01.015.
- Selman Uluisik, Graham B. Seymour. Pectate lyases: Their role in plants and importance in fruit ripening // Food Chemistry. 2020. Vol. 309. 125559 DOI: 10.1016/j.foodchem. 2019.125559.
- Production pectin oligosaccharides using Humicola insolens Y1-derived unusual pectate lyase / Zhiyun Wang [et al.] // Journal of Bio-science and Bioengineering. 2020. Vol. 129, Is. 1. P. 16–22. DOI: 10.1016/j.jbiosc.2019. 07.005.
- Biochemical characterization and evolutionary analysis of a novel pectate lyase from Aspergillus parasiticus / Guojun Yang [et al.] // International Journal of Biological Macromole-cules. 2020. Volume 152. P. 180–188. DOI: 10.1016/j.ijbiomac.2020.02.279.
- Sequence, structure and functionality of pectin methylesterases and their use in sustainable carbohydrate bioproducts: A review / Rajender Kumar [et al.] // International Journal of Biolo-gical Macromolecules. 2023. V. 244. 125385. DOI: 10.1016/j.ijbiomac.2023.125385.
- Functional characterization of the gels pre-pared with pectin methylesterase (PME)-treated pectins / Young-Hee Yoo [et al.] // In-ternational Journal of Biological Macromole-cules. 2009. Volume 45, Issue 3. P. 226–230. DOI: 10.1016/j.ijbiomac.2009.05.005.
- Pectin methylesterase and its proteinaceous inhibitor: a review / Ruben P. Jolie [et al.] // Carbohydrate Research. 2010. V. 345, Is. 18. P. 2583–2595. DOI: 10.1016/j.carres.2010.10. 002.
- Mode of action of RG-hydrolase and RG-lyase toward rhamnogalacturonan oligomers. Cha-racterization of degradation products using RG-rhamnohydrolase and RG-galacturono-hydrolase / Margien Mutter [et al.] // Carbohy-drate Research. 1998. Vol. 311, Is. 3. P. 155–164. DOI: 10.1016/s0008-6215(98)00188-8.
- Jun Fu, Rolf Prade, Andrew Mort. Expression and action pattern of Botryotinia fuckeliana (Botrytis cinerea) rhamnogalacturonan hydro-lase in Pichia pastoris // Carbohydrate Re-search. 2001. Vol. 330, Is. 1. P. 73–81. DOI: 10.1016/s0008-6215(00)00268-8.
- Rhamnogalacturonan I modifying enzymes: an update / Inês R. Silva [et al.] // New Biotech-nology. 2016. Volume 33, Issue 1. P. 41–54. DOI: 10.1016/j.nbt.2015.07.008.
- Rhamnogalacturonan lyase reveals a unique three-domain modular structure for polysac-charide lyase family 4 / Michael A. McDo-nough [et al.] // FEBS Letters. 2004. Vol. 565, Is. 1–3. P. 188–194. DOI: 10.1016/j.febslet. 2004.03.094.
- Structural and Biochemical Studies Elucidate the Mechanism of Rhamnogalacturonan Lyase from Aspergillus aculeatus / Malene H. Jensen [et al.] // Journal of Molecular Biology. 2010. Vol. 404, Is. 1. P. 100–111. DOI: 10.1016/j. jmb.2010.09.013.
- Structural and functional analyses of glycoside hydrolase 138 enzymes targeting chain A galacturonic acid in the complex pectin rhamnogalacturonan II / A. Labourel [et al.] // Journal of Biological Chemistry. 2019. V. 294, Is. 19. P. 7711–7721. DOI: 10.1074/jbc.RA 118. 006626.


