Разработка биотехнологических приемов получения устойчивых к низкотемпературному стрессу форм кориандра in vitro
Автор: Егорова Н.А., Ставцева И.В.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 1 (165), 2016 года.
Бесплатный доступ
Изучено действие низкотемпературного стресса на развитие эмбриогенных каллусов и изолированных зародышей in vitro у кориандра, и установлены сублетальные режимы промораживания. Выявлена большая устойчивость к холодовому стрессу у эмбриокультур, чем у каллусов, которые выдерживали снижение температуры до -10 оС (в течение 18 сут.), тогда как скрининг зиготических зародышей можно проводить при снижении температуры до -12 оС с более продолжительной экспозицией (до 27 сут.). Установлена корреляция между зимостойкостью генотипов и основными показателями развития эмбриокультур (коэффициенты корреляции до 0,76-0,96), что свидетельствует о возможности отбора в условиях in vitro форм, устойчивых к действию отрицательной температуры. Разработана схема селекции форм кориандра с повышенной устойчивостью к холодовому стрессу с использованием каллусных культур и изолированных зиготических зародышей.
Клеточная селекция, каллус, эмбриокультура, низкотемпературный стресс
Короткий адрес: https://sciup.org/142151293
IDR: 142151293 | УДК: 633.81:57.085.2
Текст научной статьи Разработка биотехнологических приемов получения устойчивых к низкотемпературному стрессу форм кориандра in vitro
The influence of low temperature stress on the development of embryogenic callus and isolated embryoids in vitro in coriander was studied and sublethal freezing regimes were established. A greater resistance to cold stress at the embryoculture in comparison with calli which kept the temperature decrease up to -10 °C (within 18 days) was revealed, whereas the screening of zygotic embryos may be conducted when the temperature decreases to -12 °C with more extended exposition (up to 27 days). The correlation between the winter hardiness of genotype and the main indicators of embryoculture development (correlation coefficients up to 0.76– 0.96) was found. This demonstrates the possibility of in vitro selection the forms, resistant to low temperatures. The scheme of breeding of the coriander forms with increased resistance to cold stress, using callus cultures and isolated zygotic embryos, has been developed.
Введение. Кориандр посевной (Coriandrum sativum L.) является основной эфиромасличной культурой, возделываемой во многих регионах России, в том числе и в Крыму, где в последние годы наблюдается стабильная тенденция расширения его посевов. В его плодах содержится до 2,6–3,0 % эфирного и 18–28 % жирного масла. Кориандровое эфирное масло применяют для получения отдельных компонентов (линалоола, цитраля, цитронеллола, гераниола и др.), используемых в парфюмерно-косметическом производстве, а также в медицине и для ароматизации пищевых продуктов, вино-водочных изделий, табака. Целые плоды используют как пряное сырье при изготовлении консервов, рыбных, хлебобулочных, кондитерских и ликероводочных изделий [1]. Жирное масло кориандра применяют в текстильной, лакокрасочной промышленности, металлургии и мыловарении.
Во ВНИИЭМК, а затем после его реорганизации в ИЭЛР (который вошел в состав ФГБУН «НИИСХ Крыма») был создан ряд сортов кориандра – Янтарь , Нектар, Ранний, Медун, Силач, Миус. Тем не менее селекционная работа, направленная на повышение продуктивности и массовой доли эфирного масла в плодах, продолжается. Одним из перспективных направлений селекции кориандра является создание сортов, пригод ных для озимого возделывания, однако для этого необходим исходный материал с повышенной зимостойкостью, устойчивый к действию низких температур. Биотехнологические подходы, и в частности метод клеточной селекции, позволяют получать генотипы, устойчивые к некоторым биотическим и абиотическим стрессам [2]. Большая часть работ такого плана посвящена получению растений (или клеточных линий) с повышенной резистентностью к болезням, гербицидам, засолению почв, засухе и другим негативным факторам окружающей среды [3 – 6]. При этом единых методик, приемлемых для разных видов растений и различных стрессовых факторов, на сегодняш ний день нет. При разработке селективных систем чаще всего применяют прямую клеточную селекцию, а в качестве объектов для отбора in vitro – морфоген ные или неморфогенные каллусные ткани [3; 5; 7 – 10] или культуры клеточных суспензий [2; 3]. Значительно реже в качестве объектов для отбора in vitro использовали изолированные органы. В частности, изолированные зиготические зародыши применяли в селекционных схемах у ячменя, пшеницы , шалфея [2; 7; 11]. Достаточно эффективным является последовательное применение различных объектов, которые, например, были использованы для получения форм люцерны, устойчивых к фузариозу [ 7].
Исследований, посвященных разработке методов клеточной селекции на устой- чивость к низким температурам, очень мало. При отборе морозоустойчивых линий in vitro часто используют несколько этапов, включающих закаливание культур при положительных температурах, промораживание до -10…-20 оС и оттаивание [3; 5; 6; 9; 12; 13]. У некоторых видов для отбора холодоустойчивых генотипов использовали низкие положительные температуры. В частности, у хризантемы селекцию проводили при +8 оС [14], а у кукурузы – при +4 оС [10]. Интересный подход для получения морозоустойчивых линий, а затем и растений-регенерантов пшеницы применили Дорфлинг и соавторы, которые в качестве селективного фактора добавляли в питательную среду гидроксипролин [15].
В литературе имеются публикации, свидетельствующие о возможности получения растений - регенерантов кориандра путем соматического эмбриогенеза при использовании различных типов эксплантов [16 ; 17]. Исследований по клеточной селекции, судя по имеющимся данным, у этого вида ранее не проводилось. В задачи данной работы входило изучение действия низкотемпературного стресса на развитие различных биотехнологических объектов (эмбриогенных каллусов и зиготических зародышей) с целью разработки селективной системы отбора устойчивых к низкой температуре форм кориандра in vitro .
Материалы и методы. Материалом для исследований служили ткани и органы кориандра посевного (Coriandrum sativum L.) сортов Медун, Нектар, Янтарь и селекционных образцов N397-04, R-2746, N399-04. В качестве эксплантов для получения каллусов использовали молодые соцветия растений. Приготовление питательных сред, введение в изолированную культуру и культивирование органов проводили с применением традиционных методик, принятых в работах по культуре тканей [18], а также разработанных нами ранее [19]. Каллусные ткани пассировали каждые 30–40 сут., масса трансплантов состав- ляла 100–120 мг. При клеточной селекции в качестве биотехнологических объектов при отборе in vitro использовали эмбриогенные каллусы (массой 40–50 мг) или зрелые зиготические зародыши. Культивирование осуществляли в пробирках на различных модификациях питательной среды Мурасиге и Скуга (МС), оптимизированных для кориандра [19].
Для моделирования действия холодового стресса в холодильной камере проводили закаливание изолированных культур (при снижении температуры от +6 до 0 оС в течение 6 сут . ), затем промораживание (при снижении температуры от 0до -12 оС с различной экспозицией) и оттаивание (6 сут . при повышении температуры от 0 до +6 оС). Испытаны четыре варианта промораживания : 1 – снижение тем - пературы от 0 до -8 оС (12 сут .); 2 – от 0 до -10 оС (14 сут .); 3 – от 0 до -10 оС (18 сут . для каллуса и 20 сут . для зародышей); 4 – от 0 до -12 оС (14 сут . для каллуса и 27 сут . для зародышей). После этого каллусы или зародыши пересаживали на свежие питательные среды и культивировали при +26 оС. Контролем служили культуры, постоянно выращиваемые при +26 оС, 70 %- ной влажности и освещенности 2 –3 тыс. люкс с 16 - часо вым фотопериодом . В конце цикла выращивания каллусов определяли количество жизнеспособных каллусных трансплантов, прирост каллуса, количество прорастающих соматических зародышей и число проростков на 200 мг каллуса. Прирост каллусной ткани определяли визуально, по 3 - балльной системе, при этом за 1 балл принимали прирост каллуса в 2–5 раз , за 2 балла – в 6–9 раз , за 3 балла – в 10–14 раз.
В культуре изолированных зиготических зародышей анализировали на 10-е сутки частоту прорастания зародышей и на 30-е сутки – частоту образования проростков. На 40–45-е сутки, перед переводом в обычные условия выращивания, измеряли длину основного побега, длину главного корня и количество листьев. Пробирочные растения после адаптации in vivo выращивали в полевых условиях. Зимостойкость сортов и образцов кориандра оценивали полевым методом согласно методическим указаниям [20].
В каждом варианте опыта анализи ровали не менее 20 зародышей (или каллусных трансплантов) в 3 - кратной повторности. Все эксперименты были повторены не менее двух раз, а полу ченные данные обработаны статисти чески с использованием программы Microsoft Office Excel 2007.
Результаты и обсуждение. На первом этапе исследований по клеточной селекции кориандра в качестве объектов для отбора in vitro были использованы кал-лусные культуры. При этом проводили холодовую обработку морфогенных каллусов, из которых легче впоследствии индуцировать регенерацию растений. Это связано с тем, что для ряда видов растений было выявлено снижение регенерационной способности у выделенных из неморфогенных культур резистентных клеточных линий [3; 5; 21] . Кроме того, ранее при разработке методов клеточной селекции на устойчивость к осмотическому стрессу у лаванды было показано преимущество использования для селекции in vitro морфогенных каллусов, которые проявили большую устойчивость к селективному фактору по сравнению с неморфогенными [8].
Индукцию каллусов из соцветий кориандра сорта Янтарь, их дальнейшее культивирование и получение регенерантов проводили согласно разработанной ранее методике, используя на разных этапах модификации питательной среды МС с добавлением БАП, 2,4-Д или НУК [19]. При эксплантации на питательную среду молодых соцветий через месяц из нижней части завязи формировался бежевожелтый рыхлый каллус, в котором развивались соматические зародыши. Такой эмбриогенный каллус субкультивировали два раза и затем использовали для селекции in vitro. Небольшие участки каллус- ной ткани (40–50 мг) помещали в пробирки со свежей питательной средой и подвергали холодовой обработке при разных режимах.
Установлено, что после первых трех вариантов промораживания происходило отрастание каллусных тканей, однако по мере увеличения дозы прирост каллуса по сравнению с контролем снижался в 1,5– 5 раз, а количество прорастающих эмбриоидов и проростков – до 7–8 раз (табл. 1).
Таблица 1
Влияние холодового стресса и пассажа на развитие эмбриогенных каллусных культур из соцветий кориандра сорта Янтарь
|
№ пассажа в опы те |
Вариант холодовой обработки |
№ опыта |
Прирост каллуса, балл |
Количество прорастающих зароды-шей/200 мг каллуса, шт. |
Количество проро-стков/200 мг каллуса, шт. |
|
1 |
Контроль |
79-к |
2,21 ± 0,18 |
4,57 ± 0,45 |
1,77 ± 0,31 |
|
1 |
79-1 |
1,50 ± 0,21 |
2,94 ± 0,31* |
0,71 ± 0,18* |
|
|
2 |
79-2 |
0,91 ± 0,17* |
1,41 ± 0,51* |
0,53 ± 0,21* |
|
|
3 |
79-3 |
0,44 ± 0,13* |
0,58 ± 0,14* |
0,17 ± 0,10* |
|
|
4 |
79-4 |
0 |
0 |
0 |
|
|
2 |
Контроль |
79-к |
1,60 ± 0,11 |
4,00 ± 0,66 |
0,67 ± 0,19 |
|
2 |
79-2 |
1,43 ± 0,32 |
4,28 ± 0,78 |
0,78 ± 0,31 |
|
|
3 |
79-3 |
1,29 ± 0,17 |
2,50 ± 0,29 |
0,71 ± 0,22 |
|
|
3 |
Контроль |
79-к |
1,22 ± 0,15 |
5,37 ± 1,17 |
0,56 ± 0,24 |
|
2 |
79-2 |
0,87 ± 0,18 |
6,75 ± 0,87 |
0,56 ± 0,15 |
|
|
3 |
79-3 |
0,62 ± 0,18 |
4,15 ± 0,62 |
0,54 ± 0,14 |
* Различия с контролем достоверны при Р ≤ 0,05
Снижение температуры до -12 оС вызывало почернение каллуса из-за летального эффекта. Сублетальной дозой стресса, по-видимому, является третий вариант, при котором наблюдалась пролиферация каллуса и небольшое число прорастающих зародышей. После 2-го и 3-го вариантов были отобраны устойчивые к низкой температуре каллусные линии, которые в следующем – втором пассаже опыта в значительной степени восстанавливали пролиферацию. При культивировании в течение 2-го и 3-го пассажей после промораживания прирост каллуса, количество прорастающих эм- бриоидов и проростков у линий вариантов 79-2 и 79-3 достоверно не отличалось от контрольной линии варианта 79-к (табл. 1).
Из отобранных устойчивых каллусных линий в дальнейшем было получено 20 регенерантов, при этом многие характеризовались низким ростом, слабым развитием и были большей частью стерильны. Это согласуется с литературными данными о протекании этого процесса у других видов растений, свидетельствующими об угнетении развития регенерантов из устойчивых клеточных линий [5; 22 ]. Однако у нескольких образцов были получены семена, которые использовались для дальнейших исследований и анализа устойчивости.
В дальнейшем в наших экспериментах была изучена возможность использования в качестве эксплантов для отбора in vitro изолированных зиготических зародышей. В исследования включили генотипы, различающиеся по полевой зимостойкости: образец N397-04 и сорта Медун, Нектар с максимальной полевой зимостойкостью (соответственно 100,0; 98,0 и 91,3 %), сорт Янтарь и образцы R-2746 и N399-04 со средней зимостойкостью (соответственно 54,7; 45,0 и 41,0 %) и наименее устойчивый сорт Ранний (27,3 %). Для этого изолированные зрелые зародыши после помещения на питательную среду подвергали холодовому стрессу с использованием четырех режимов промораживания. При анализе влияния низкотемпературного стресса на развитие эмбриокультур в качестве основного показателя использовали частоту формирования проростков (рис. 1), а также определяли частоту прорастания зародышей, длину проростка, количество листьев и длину корня. Как видно из полученных данных, снижение температуры и увеличение экспозиции при промораживании зародышей приводило к уменьшению частоты образования проростков и других показателей по сравнению с контролем у всех изученных генотипов. При этом достаточно четко проявилась зависимость между по- левой зимостойкостью сорта и устойчивостью зародышей in vitro: чем выше была зимостойкость сорта, тем меньше снижались изучаемые показатели по сравнению с контролем.
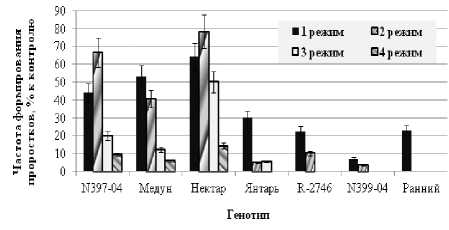
Рисунок 1 – Влияние холодовой обработки на частоту формирования проростков из зародышей in vitro у различных генотипов кориандра
Так, во втором варианте холодовой обработки у зимостойких образцов частота образования проростков составила 40,6– 78,3 % от контроля, у образцов со средней зимостойкостью этот показатель снизился до 3,8– 10,2 % (рис. 1). У наименее устойчивого сорта Ранний формирования проростков в этом варианте вообще не наблюдали.
Значения летальной и сублетальной температур также зависели от изучаемого генотипа. Чем выше зимостойкость сорта, тем при более жестких условиях действия стрессового фактора можно получить проростки из изолированных зародышей. Как следует из представленных данных, четвертый вариант промораживания был сублетальным для устойчивых генотипов (‘Медун’, ‘Нектар’, N397-04), у которых при снижении температуры до -12 оС (в течение 27 сут.) были получены единичные нормально развитые проростки. Для сорта Янтарь сублетальным был третий вариант обработки, а для образцов R2746 и N399-04 – второй вариант холодового стресса. У наименее устойчивого сорта Ранний сублетальным был температурный режим первого варианта обработ- ки, при котором были получены проростки с частотой 23,1 % от контроля. Чем выше была зимостойкость изучаемого генотипа, тем больше вероятность получения полноценных проростков в более жестких условиях промораживания зародышей in vitro. Выявлена достоверно высокая корреляция между полевой зимостойкостью генотипов кориандра и частотой прорастания зародышей (0,87– 0,91), а также частотой образования проростков (0,76–0,94), особенно при втором–четвертом вариантах холодового стресса (табл. 2). Наличие такой корреляции позволяет проводить отбор устойчивых форм, а, возможно, и тестирование на резистентность в условиях эмбриокультуры in vitro.
Таблица 2
Коэффициенты корреляции между полевой зимостойкостью и основными показателями развития зародышей кориандра in vitro
|
Вариант холодовой обработки |
Частота прорастания зародышей, % |
Частота образования проростков, % |
Длина проростка, см |
Длина корня, см |
Количество листьев, шт. |
|
контроль |
0,36 |
0,61 |
0,33 |
0,28 |
0,38 |
|
1 |
0,67 |
0,94** |
0,09 |
0,42 |
0,40 |
|
2 |
0,87** |
0,91** |
0,50 |
0,48 |
0,55 |
|
3 |
0,91** |
0,76* |
0,65 |
0,64 |
0,72 |
|
4 |
0,88** |
0,87* |
0,66 |
0,62 |
0,65 |
Различия с контролем достоверны:
*при Р < 0,05; ** при Р < 0,01
Отобранные в эмбриокультуре после действия холодового стресса образцы кориандра в дальнейшем были переведены в обычные условия in vivo, где после адаптации выращивались до получения плодов. С целью проверки устойчивости к низким температурам и проведения второго этапа отбора зародыши из этих образцов вводили в культуру in vitro и повторно подвергали низкотемпературному стрессу (при использовании второго и третьего режимов промораживания). Как видно из представленных на рисунке 2 данных, частота прорастания зародышей у регенеранта, полученного из исходной контрольной линии (R-К-09), почти не отличалась от этого показателя у исходного сорта Янтарь. Среди регенерантов из устойчивых линий были выделены образцы R-79-34 и R-79-31, у которых частота прорастания зародышей после наиболее жесткого 3-го режима промораживания была в 1,7–3,2 раз выше, чем у исходного сорта. Регенеранты из этих образцов были адаптированы in vivo, и из них было получено семенное потомство для дальнейшего исследования в по- левых условиях.
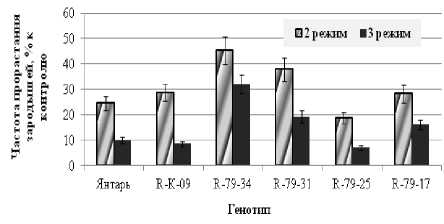
Рисунок 2 – Частота прорастания зародышей in vitro (% к контролю)
у различных генотипов кориандра после холодовой обработки
Экспериментальные данные показали эффективность проведения такого двухэтапного отбора, т . к . не все регенеранты, полученные in vitro , сохраняли признак устойчивости. Кроме того, эти результаты могут косвенно свидетельствовать о сохранении признака устойчивости у отдельных растений, полученных из отоб ранных линий, и, следовательно, о возможности применения у кориандра разработанных методических подходов при создании исходного селекционного материала. В дальнейшем представляется перспективным разработка на основе такой селективной системы с использованием эмбриокультуры методики косвенной оценки селекционных образцов на устойчивость к низким температурам. Такой подход, например, применили С.А. Игнато ва с соавторами для косвенной оценки пшеницы на устойчивость к таким заболеваниям, как фузариоз колоса и альтер-нариоз [7].
Судя по имеющимся литературным данным, при разработке методов клеточной селекции на устойчивость к низким температурам авторы чаще всего для моделирования холодового стресса применяли обработку культивируемых объектов отрицательными температурами [3; 5; 6; 12; 13], а у некоторых видов растений – положительными температурами [10; 14]. При этом иногда использовалось весьма непродолжительное (несколько часов) воздействие отрицательными температурами, например, у свеклы [5]. Некоторые исследователи отмечали важную роль в формировании устойчивости предварительного закаливания культивируемых тканей и органов [5; 12; 13], введения в питательную среду абсцизовой кислоты [23] или высоких концентраций сахарозы [12].
В наших исследованиях были установлены сублетальные режимы промораживания для каллусов и изолированных зародышей кориандра. При сравнении разных биотехнологических объектов можно отметить большую устойчивость эмбриокультур к холодовому стрессу, по сравнению с каллусами, которые выдерживали снижение температуры до -10 оС, тогда как у зиготических зародышей можно было проводить скрининг при промораживании до -12 оС. При моделировании холодового стресса мы использовали более продолжительные экспози ции промораживания зародышей (до 27 сут . ), по сравнению с применяемыми в ряде работ 1– 3- мя сутками [6 ; 23 ]. Выявленная корреляция между зимостойкостью изучаемых генотипов в полевых условиях и показателями развития эмбриокультур свидетельствует о возможности проведения in vitro отбора форм кориандра, устойчивых к действию низкой отрицательной температуры. На основе анализа полученных данных была разработана схема селекции изолированных органов в культуре, согласно которой на первом этапе используются каллусы, из которых после низкотемпературного стресса отбирают устойчивые каллусные линии и получают растения, а на втором этапе отбор устойчивых форм проводится при холодовой обработке изолированных зиготических зародышей.
Выводы. Изучено действие низкотемпературного стресса на развитие эмбрио- генных каллусных культур и изолированных зародышей у кориандра и установлены сублетальные режимы промораживания. При сравнении двух биотехнологических объектов отмечена большая устойчивость к холодовому стрессу у эмбриокультур, чем у каллусов, которые выдерживали снижение температуры до -10 оС (в течение 18 сут.), тогда как скрининг зиготических зародышей можно проводить при снижении температуры до -12 оС и с более продолжительной экспозицией (до 27 сут.). Установлена корреляция между зимостойкостью генотипов, различающихся по полевой зимостойкости (сорта Медун, Нектар, Янтарь, Ранний и образцы N397-04, R-2746 и N399-04), и основными показателями развития эмбриокультур (коэффициенты корреляции до 0,76–0,96), что свидетельствует о возможности отбора в условиях in vitro форм, устойчивых к действию отрицательной температуры. Разработана схема селекции форм кориандра с повышенной устойчивостью к холодовому стрессу с использованием каллусных культур и изолированных зародышей.
Список литературы Разработка биотехнологических приемов получения устойчивых к низкотемпературному стрессу форм кориандра in vitro
- Бочкарев Н.И., Зеленцов С.В., Мошненко Е.В. Морфология, таксономия, методы селекции и характеристика сортов кориандра посевного (обзор)//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2014. -Вып. 2 (159-160). -С. 178-195.
- Сидоров В.А. Биотехнология растений. Клеточная селекция. -Киев: Наукова думка, 1990. -280 с.
- Гiрко В.С. Нетрадицiйнi методи створення селекцiйного матерiалу пшеницi: автореф. дис.. д-ра. с.-г. наук: 06.01.05. -Київ, 1999. -34 с.
- Калашникова Е.А. Клеточная инженерия растений: Учеб. пособие. -М.: Изд-во РГАУ-МСХА, 2012. -318 с.
- Дубровна О.В., Чугункова Т.В., Бавол А.В., Лялько I.I. Бiотехнологiчнi та цитогенетичнi основи створення рослин, стiйких до стресiв. -К.: Логос, 2012. -428 с.
- Kondic-Sipka A., Hristov N., Kobiljski В. In vitro screening for low temperature tolerance of wheat genotypes//Genetica. -2006. -Vol. 38. -No 2. -P. 137-144.
- Игнатова С.А. Клеточные технологии в растениеводстве, генетике и селекции возделываемых растений: задачи, возможности, разработки систем in vitro. -Одесса: Астропринт, 2011. -224 с.
- Егорова Н.А. Влияние осмотического стресса на развитие каллусных культур лаванды in vitro//Бюл. гос. Никит.,ботан. сада. -2012. -№ 105. -С. 139-143.
- Лукаткин А.С., Гераськина А.В. Скрининг клеточных культур огурца на повышенную холодоустойчивость II Биотехнология. -2003. -№ 3.-С. 65-73.
- Dunkan D.R., Widholu J.M. Proline accumulation and its implication in cold tolerance of regenerable maize callus//Plant Physiol. -1987. -Vol. 83. -No 3. -P. 703-708.
- Пат. 68312 Україна, МПК6 А01 H 4/00. Споciб отримання форм шавлiї, стiйких до осмотичного стресу in vitro/Заявитель и патентообладатель Егорова Н. О., Ставцева I. В., Пехова О. А. -№ u 2011 09600; заявл. 01.08.2011; опубл. 26.03.2012, бюл. № 6 -4 с.
- Bartolozzi F., Mencuccini M., Fontanazza G. Enhancement of frost tolerance in olive shoots in vitro by cold acclimation and sucrose increase in the culture medium//Plant Cell, Tissue and Organ Culture. -2001. -Vol. 67. -No 3. -P. 299-302.
- Rugienius R., Stanys V. In vitro screening of strawberry plants for cold resistance//Euphytica. -2001. -Vol. 122. -No 2. -P. 269-277.
- Vojtech B., Kodytek K. Vorauslese der T-Mutanten von Chrysanthemen bei der kultur in vitro//Acta pruhonic. -1988. -Vol. 55. -No 1. -P. 3-13.
- Dorffling K., Dorffling H., Lesselich G. . Heritable improvement of frost tolerance in winter wheat by in vitro selection of hydroxyproline-resistant prolin overproducing mutants//Euphytica. -1997. -93. -No 1. -P. 1-10.
- Kim S. W., Park M.K., Liu J. R. High frequency plant regeneration via somatic embryogenesis in cell suspension cultures of coriander (Coriandrum sativum L.)//Plant Cell Repts. -1996. -Vol. 15. -No 10. -Р. 751-753.
- Stephen R., Jayabalan N. Propagation of Coriandrum sativum L. through somatic embryogenesis//Indian J. of Exp. Biology. -2001. -Vol. 39. -No 4. -P. 387-389.
- Калинин Ф.Л., Сарнацкая В.В., Полищук Е.Е. Методы культуры тканей в физиологии и биохимии растений. -К.: Наукова думка, 1980. -488 с.
- Егорова Н.А., Ставцева И.В. Культура изолированных тканей и органов кориандра и ее использование в селекции//Методические рекомендации. -Симферополь: ИЭЛР НААН, 2011. -24 с.
- Сергеева Д.С., Сильченко В.М. Методические указания по оценке селекционного материала кориандра на морозо-и зимостойкость. -Симферополь, 1989. -9 с.
- Zahed Hossain, Abul Kalam Azad Mandal, Subodh Kumar Datta, Amal Krishna Biswas. Development of NaCl-tolerant line in Chrysanthemum morifolium Ramat. through shoot organogenesis of selected callus line//J. of Biotechnology. -2007. -Vol. 129. -No 4. -P. 658-667.
- Долгих Ю.И. Сомаклональная изменчивость растений и возможности ее практического использования (на примере кукурузы): автореф. дис.. д-ра биол. наук: 03.00.12. -М., 2005. -35 с.
- Lukoseviciute V., Rugienius R., Kavaliauskaite D. Investigation of strawberry hardening in low temperatures in vitro//Scientific works of the Lithuanian Institute of horticulture and Lithuanian University of agriculture. Sodininkyste ir darzininkyste. -2007. -Vol. 26. -No 3. -P. 274-281.


