Разработка фундаментальных аспектов формирования морфофункциональных изменений миокарда при сердечной недостаточности
Автор: Афанасьев Сергей Александрович, Егорова Маргарита Владимировна, Кондратьева Дина Степановна, Канев Александр Федорович, Реброва Татьяна Юрьевна, Луговский Владимир Андреевич, Муслимова Эльвира Фаритовна
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.30, 2015 года.
Бесплатный доступ
В статье представлен материал, отражающий опыт исследования фундаментальных аспектов развития морфофункциональных изменений миокарда при формировании сердечной недостаточности (СН). Приведены результаты электрофизиологических и биохимических, генетических и морфологических исследований, выполненных на биологическом материале как лабораторных животных с моделированием сердечно-сосудистых патологий, так и больных ишемической болезнью сердца (ИБС), поступивших в клинику НИИ кардиологии (Томск). На примере представленных данных показана сопряженность морфофункциональных и биохимических изменений кардиомиоцитов в процессе ремоделирования патологического миокарда. Отмечена возможная связь этих изменений с генетическим полиморфизмом.
Сердечная недостаточность, сахарный диабет, электромеханическое сопряжение, са 2+-атф-аза спр, скорость поглощения кислорода, i/d полиморфизма гена ace, бесклеточный матрикс сосудов
Короткий адрес: https://sciup.org/14920029
IDR: 14920029 | УДК: 616.12-008.
Текст научной статьи Разработка фундаментальных аспектов формирования морфофункциональных изменений миокарда при сердечной недостаточности
Хорошо известно, что СН ишемического генеза является результатом ремоделирования миокарда, сопровождающегося внутриклеточными модификациями, влияющими на метаболизм и структурную организацию кардиомиоцитов [18, 20]. Эти изменения вызывают рассогласование процессов электромеханического сопряжения кардиомиоцитов и, как следствие, формирование сократительной дисфункции [22].
Важным фактором, усугубляющим нарушения функциональной состоятельности миокарда, считается развитие “метаболической ишемии”. Возникновение этого состояния характеризуется увеличением потребности миокарда в кислороде и нарастанием кислородного и энергетического дефицита [5, 10]. Нарушение энергетического обмена является триггером при формировании функциональных и структурных изменений миокарда.
В настоящее время наблюдается увеличение частоты встречаемости сочетанного развития двух и более хронических патологий, в том числе ИБС и сахарного диабета (СД). При этом СД вносит существенный вклад в раз- витие метаболических расстройств и способствует значительному угнетению контрактильных возможностей миокарда при ИБС [16, 19, 20].
Показано, что патогенез хронических сердечно-сосудистых заболеваний и тяжесть их течения определяются сочетанием многих факторов, в том числе генотипом пациента. Одним из генов, полиморфные варианты которого могут быть предикторами сердечно-сосудистых заболеваний (ССЗ), является ген ангиотензинпревраща-ющего фермента – АСЕ [13, 17].
Среди результатов экспериментальных и клинических исследований можно встретить часто противоречащие друг другу данные о сопряженности метаболических и функциональных изменений миокарда [5, 14]. Часто это связано с вынужденным сопоставлением литературных данных, полученных на разных объектах и в разных условиях [15, 21]. В рамках нашей лаборатории предпринята попытка избежать методологического несоответствия биохимических и функциональных исследований.
Материал и методы
Электрофизиологические исследования выполнялись с использованием папиллярных мышц сердца крыс или мышечных полосок из биопсийного материала сердца пациентов, которым выполняли хирургические операции на открытом сердце с использованием техники искусственного кровообращения. Сократительную активность изолированных мышц оценивали в изометрическом режиме, используя датчик Force transducer KG-Series (Scientific Instruments GmbH, Германия). Для оценки функциональной состоятельности механизмов, участвующих в электромеханическом сопряжении кардиомиоцитов, использовались нагрузочные тесты, основанные на изменении режима электрической стимуляции изолированных мышц [2, 9].
Определение уровня экспрессии Са2+-АТФ-азы саркоплазматического ретикулума (СПР) проводили методом иммуноблоттинга. Электрофорез проводили в камере Mini-PROTEAN® II (BioRad, США). Перенос белков из геля на нитроцеллюлозную мембрану (Sigma) осуществляли методом полусухого электроблоттинга при 60V с последующей инкубацией с первичными моноклональными антителами, специфичными к белку SERCA2a (Sigma). Визуализацию результатов проводили методом колориметрической детекции, используя BCIP/NBT (Sigma). Количество общего белка в образце определяли на спектрофотометре (NanoVueTM UV/Visible, Thermo Fisher Scientific) [8].
Определение скорости потребления кислорода изолированными кардиомиоцитами и митохондриями проводили в термостабилизированной ячейке полярографическим методом, используя электрод Кларка [6]. Для инкубации кардиомиоцитов и митохондрий использовали раствор Кребс–Хенселяйта с добавлением 2 мМ CaCl2.
Для определения генетических полиморфизмов использовали образцы крови, взятые из локтевой вены в вакутейнер с ЭДТА. Геномную ДНК выделяли с помощью коммерческого набора Wizard Genomic DNA Purification Kit (Promega, USA) по протоколу производителя. Анализ I/D полиморфизма гена ACE проводился с помощью полимеразной цепной реакции (ПЦР) с использованием доступного коммерческого набора “SNP-express” (Cat. № 01272, Lytech Company, Москва, Россия). Полиморфизм Т-786С гена ENOS определяли методом аллель-специфич-ной ПЦР с использованием коммерческого набора “SNP-express” (Cat. № 01182, Lytech Company, Москва, Россия). Амплификацию осуществляли на T100 Thermal Cycler (Bio-Rad Laboratories). Разделение продуктов ПЦР осуществляли методом электрофореза в 3%-м агарозном геле с бромидом этидия. Детекцию проводили на УФ-трансиллюминаторе Gel Doc 2000 TM (Bio-Rad Laboratories) с использованием программного обеспечения Quantity One [12].
При выполнении исследований сотрудники лаборатории используют собственные или усовершенствованные варианты уже известных методик [1, 3, 4, 6, 7].
А
Б
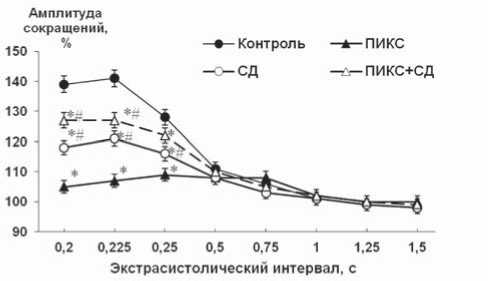
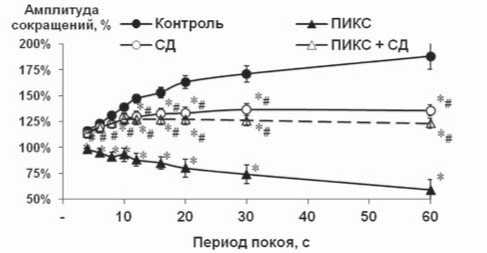
Рис. 1. Постэкстрасистолическое сокращение (А) и тест-паузы (Б) при исследовании интактного и ремоделированного миокарда крыс: * – р<0,01 достоверность различий по сравнению с контролем; # – р<0,01 достоверность различий по сравнению с ПИКС
Результаты
В настоящее время показано, что ишемические воздействия на миокард и СД приводят к развитию специфических расстройств метаболизма кардиомиоцитов. В первую очередь это относится к нарушению энергетического обмена, которое является триггером при формировании функциональных и структурных изменений миокарда. На уровне кардиомиоцитов это проявляется в перестройке работы ион-транспортирующих систем и, как следствие, развитии сократительной дисфункции.
Нами рассмотрено 4 группы животных: интактные, животные с монопатологиями – экспериментальным постинфарктным кардиосклерозом (ПИКС) и СД (развивающимся в результате введения стрептозотацина), а также группа животных с сочетанной патологией. Результаты электрофизиологических исследований представлены на рисунке 1. В условиях ПИКС при малых длительностях экстрасистолических интервалов мы регистрировали слабо выраженную потенциацию инотропного ответа (по сравнению с интактными животными). При СД этот показатель оказался значимо выше, а при сочетанной патологии результаты были еще ближе к показателям интактных животных.
При выполнении теста с задержкой электрических импульсов для миокарда животных с ПИКС была получе-
А
Б
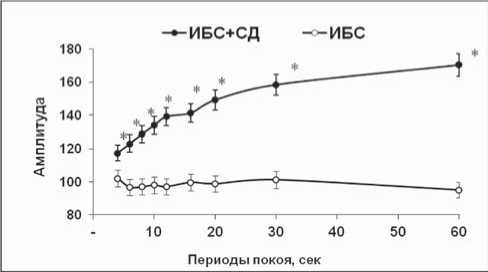
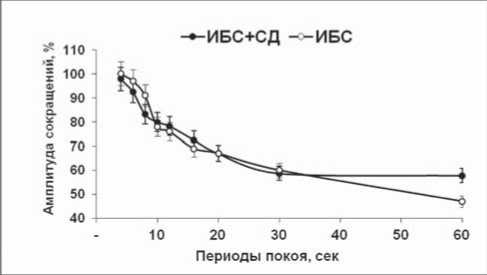
Рис. 3. Тест-паузы на мышечных полосках миокарда пациентов: А – I тип реакции; Б – II тип реакции; * – p<0,05 достоверность различий между группами
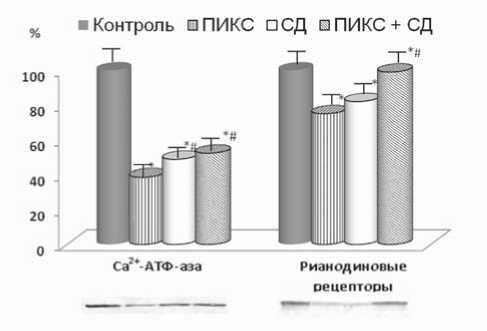
Рис. 2. Уровень Ca2+-АТФ-азы и рианодиновых рецепторов в миокарде крыс: * – р<0,01 достоверность различий по сравнению с контролем; # – р<0,01 достоверность различий по сравнению с ПИКС
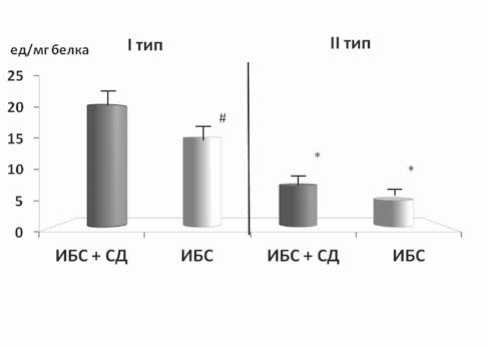
Рис. 4. Уровень Са2+-АТФ-азы СР в миокарде пациентов с СН на фоне и без СД 2-го типа: # – p<0,01 – достоверность различий между группами, * – p<0,01 – достоверность различий между I и II типом
на отрицательная динамика изменения амплитуды сокращений, что указывает на неспособность ион-транспор-тирующих систем СПР обеспечить достаточный пул кальция. У животных с СД мы получили принципиально иной результат, который сохранялся и при сочетанной патологии.
Сопоставляя полученные результаты, видно, что индукция диабета на фоне формирования постинфарктно- го ремоделирования сердца способствует сохранению в кардиомиоцитах функциональной активности систем ионного транспорта, отвечающих за работу СПР как внутриклеточного депо Са2+. К таким системам в первую очередь относят Са2+-АТФ-азу и рианодиновые рецепторы СПР.
Действительно, в нашем случае определение содержания Са2+-АТФ-аза и рианодиновых рецепторов (проведенное в тех же образцах миокарда) выявило сходные результаты с инотропной реакцией миокарда (рис. 2). Наибольшее содержание этих белков наблюдалось в группе именно с сочетанной патологией. Эти результаты подтверждают, что в кардиомиоцитах животных с сочетанной патологией кальций-аккумулирующая способность СПР сохраняется в большей степени.
Известно, что экспериментальные модели патологий не всегда полно отражают реальные заболевания. Поэтому мы предприняли попытку проведения аналогичных исследований на миокарде пациентов с СН, развившейся вследствие ИБС, а также ИБС, ассоциированной с СД. Тестовое воздействие на изолированные трабекулы показало, что вне зависимости от группы больных реакция патологического миокарда человека на тест-паузы может быть 2 типов (рис. 3). I тип инотропной реакции мышц характеризовался тем, что амплитуда сокращений либо оставалась на уровне базовых значений (характерно для миокарда пациентов с ИБС), либо (при сочетанной патологии) превышала базовые значения. При II типе инотропной реакции амплитуда сокращений значительно угнеталась.
Такое расщепление эффектов, видимо, отражает разный путь ремоделирования кардиомиоцитов. При этом в одном случае перестройка внутриклеточного метаболизма позволяет восстановить и поддерживать функциональную активность кальций-транспортирующих систем СПР, а в другом случае – нет. Действительно, при определении уровня Са-АТФ-азы СПР мы обнаружили разделение исследуемых групп пациентов на подгруппы. Уровень Са-АТФазы СПР соответствовал инотропной реакции миокарда (рис. 4). Вполне вероятно, что определенный уро-
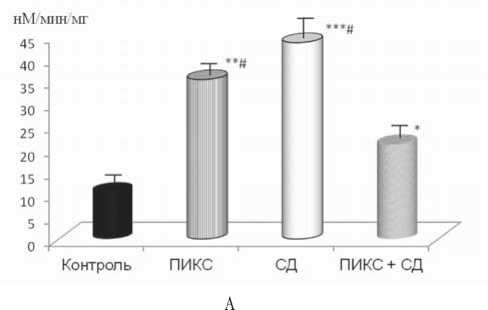
Рис. 5. Скорость потребления кислорода в миокарде крыс (А) и человека (Б): для рисунка А: * – р<0,05, ** – р<0,01, *** – р<0,001 – достоверность различия по сравнению с контролем, # – р<0,01 – достоверность различия по сравнению с группой животных с сочетанной патологией; для рисунка Б: * – p<0,01 – достоверность различий между группами
ИБС + СД ИБС
Б
вень экспрессии Са-АТФ-азы СПР может быть предопределен соответствующим генетическим полиморфизмом.
Хорошо известно, что в кардиомиоцитах кальциевый насос СПР, после миофибрилл, является основным потребителем энергии макроэргов. Следовательно, эффективность работы СПР определяется не только наличием Са2+-АТФ-азы но и ее энергетическим обеспечением. По нашим данным (рис. 5), для животных с сочетанной патологией было характерно сохранение высокой интенсивности дыхания митохондрий и, следовательно, процессы окислительного фосфорилирования. При работе с биопсийным материалом мы тоже получили результаты, свидетельствующие о том, что в кардиомиоцитах пациентов с сочетанной патологией преобладают процессы окислительного фосфорилирования.
В настоящее время среди предикторов неблагоприятного течения ИБС большое внимание уделяют генетическим факторам риска. Есть данные о значительном влиянии полиморфизмов гена АСЕ на функционирование ренин-ангиотензин-альдостероновой системы [11, 17]. Вероятно, эти полиморфизмы могут играть важную роль в формировании каскада метаболических нарушений у больных с сочетанным развитием ИБС и СД.
Мы предприняли сравнительное исследование ассоциации I/D полиморфизма с факторами риска и тяжестью течения ИБС в моновариантном развитии и при ее сопряженности с СД 2-го типа. Результаты, представленные на рисунке 6, свидетельствуют о том, что носительство аллелей I и D гена ACE имеет статистически значимую ассоциацию с вероятностью развития тяжелых ФК СН в случае моновариантного течения ИБС. Этот результат не противоречит существующим представлениям о неблагоприятном влиянии носительства аллеля D. Однако в случае сочетанного развития ИБС и СД мы не выявили наличия ассоциации носительства I/D полиморфизма с тяжестью течения стенокардии напряжения. Для пациентов, имеющих коморбидное развитие ИБС и СД, мы выявили наличие статистически значимой ассоциации носительства аллелей I и D с развитием дислипидемии. В случае моновариантного развития ИБС такая ассоциация, по нашим данным, отсутствовала (рис. 7). Представлен-
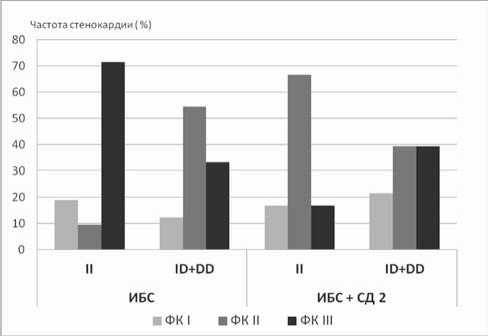
Рис. 6. Тяжесть течения стенокардии напряжения у носителей генотипа II и аллеля D гена ACE больных ИБС, осложненной и не осложненной СД 2-го типа: ФК – функциональный класс стенокардии; * – р<0,05 – достоверность различий между группами
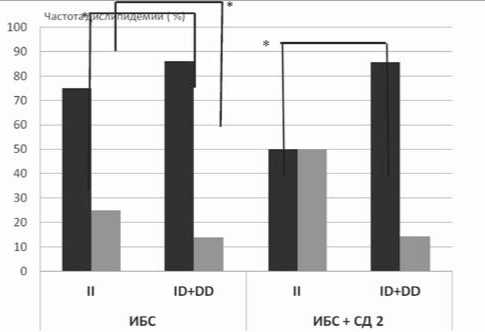
Рис. 7. Выраженность дислипидемии у пациентов, имеющих мо-новариантное развитие ИБС, и ее сопряжение с СД 2-го типа в зависимости от носительства аллелей I и D гена ACE : * – р<0,05 – достоверность различий между группами
Таблица
Уменьшение количества клеток в процессе децеллюляризации фрагмента внутренней грудной артерии человека, Ме (Q25–Q75)
|
Показатели |
Воздействие на сосуд |
|||
|
Исходное состояние |
SDS 30 мин |
SDS 1 ч SDS 1ч + TritonX 100 30 мин |
SDS 1 ч + TritonX 100 1 ч |
|
|
Клеточность стенки |
||||
|
сосуда (на 10 полей зрения) |
355 (351–360) |
289 (240–299)* |
125 (121–133)* 54 (50–55)* |
0* |
Примечание: SDS и TritonX 100 – используемые детергенты; * – статистически значимое различие, по отношению к предыдущему воздействию (р<0,05).
ные данные указывают на то, что сочетанное развитие ИБС и СД нарушает традиционную ассоциацию I/D полиморфизма гена ACE с тяжестью ИБС и формирует ассоциацию с дислипидемией. Полученные нами результаты свидетельствуют о неоднозначной роли полиморфных вариантов гена ACE в прогрессировании ИБС, которая во многом зависит от наличия других факторов риска и особенностей выборки.
В лаборатории проводится цикл исследований по оценке возможности использования природных соединительнотканных матриксов для создания сосудистых имплантов малого диаметра. Одной из задач этой работы является обеспечение гарантированного удаления из исследуемого материала клеточных элементов, несущих чужеродный генетический материал. Результаты, отражающие присутствие клеточных компонентов в стенке сосудов на разных этапах процесса их децеллюляризации, приведены в таблице. Видно, что под воздействием используемых детергентов на каждом этапе происходит достоверное снижение клеточности по сравнению с предыдущим этапом. Так, уже через 30 мин воздействия детергента – SDS в сосуде происходило статистически значимое снижение клеточности, а к моменту окончания децеллюляризации клеточные компоненты из сосудистой стенки полностью исчезали. Эти результаты подтверждают, что предложенный ранее протокол [7] получения бесклеточного матрикса артериальных сосудов животных и человека действительно обеспечивает полную децел-люляризацию сосудистой стенки.
Структура лаборатории и сформировавшиеся направления исследований дают возможность обсуждать полученные результаты с сотрудниками клинических подразделений с целью поиска сопряжения обнаруженных структурно-функциональных изменений миокарда и сосудов с особенностями клинического течения заболевания у конкретных пациентов.
Список литературы Разработка фундаментальных аспектов формирования морфофункциональных изменений миокарда при сердечной недостаточности
- Андреев С.Л., Афанасьев С.А., Ахмедов Ш.Д. и др. Экономичная технология получения бесклеточной матрицы артериального сосуда животных и человека//Клеточные технологии в биологии и медицине. -2011. -№ 2. -С. 110-114.
- Андреева Л.А., Накипова О.В., Чумаева Н.А. и др. Сезонные особенности зависимости частота сила в миокарде суслика Citellus undulatus//Доклады Академии наук. -2001. -Т. 377, № 1. -С. 108-110.
- Афанасьев С.А., Егорова М.В. Выделение митохондрий из клеток и тканей животных и человека: современные методические приемы//Сибирский медицинский журнал (Томск). -2011. -Т. 26, № 1, вып. 1. -С. 22-28.
- Афанасьев С.А., Кондратьева Д.С., Попов С.В. Разработка модели сочетанной патологии сердечной недостаточности и сахарного диабета 1-го типа в эксперименте//Бюл. экспер. биол. мед. -2012. -Т. 153. -С. 523-526.
- Вельков В. Свободные жирные кислоты -фактор риска инсулинорезистентности и ишемии: перспективы для оценки рисков и диагностики//Поликлиника. -2008. -№ 4. -С. 50-51.
- Егорова М.В., Афанасьев С.А., Попов С.В. Роль фосфолипазы А2 в активации дыхания изолированных кардиомиоцитов при постинфарктном кардиосклерозе//Бюл. экспер. биол. мед. -2008. -Т. 146. -С. 631-633.
- Егорова М.В., Афанасьев С.А., Попов С.В. Простой метод выделения кардиомиоцитов из сердца взрослой крысы//Бюл. экспер. биол. мед. -2005. -№ 9. -С. 357-360.
- Кондратьева Д.С., Афанасьев С.А., Канев А.Ф. и др. Сохранение содержания Са2+-АТФ-азы саркоплазматического ретикулума кардиомиоцитов в ишемизированном миокарде при небольшом сроке заболевания сахарным диабетом//Российский кардиологический журнал. -2014. -№ 12 (116). -С. 59-63.
- Накипова О.В., Андреева Л.А., Чумаева Н.А. и др. Влияние инсулина на ритмоинотропные отношения в миокарде суслика Citellus undulatus в период зимней активности//Доклады Академии наук. -2004. -Т. 396 (1). -С. 117-120.
- Оруджева С.А., Звягин А.А. Оценка функциональных резервов сердечно-сосудистой системы у больных сахарным диабетом. Опасности анестезии и возможности анестезиологического обеспечения больных с гнойно-некротическими формами синдрома диабетической стопы//Новости анестезиологии и реаниматологии. -2006. -№ 3. -С. 1-19.
- Пархоменко А.Н., Кожухов С.Н., Лутай Я.М. и др. Полиморфизм T-786C промотора гена эндотелиальной NO-синтазы: связь с эффективностью тромболитической терапии у пациентов с острым инфарктом миокарда//Украинский медицинский журнал. -2008. -№ 4 (66). -С. 20-23.
- Реброва Т.Ю., Муслимова Э.Ф., Панова Н.В. и др. I/D полиморфизм гена ангиотензинпревращающего фермента у больных ИБС разного пола и возраста//Российский кардиологический журнал. -2014. -№ 10 (114). -С. 77-81.
- Тепляков А.Т., Шилов С.Н., Березикова Е.Н. и др. Фармакоге-нетический контроль полиморфизма I/D гена ангиотензин-превращающего фермента -доминирующего фактора риска развития хронической сердечной недостаточности и мишени для лечения эналаприлом//Кардиология. -2013. -№ 3. -С. 9-14.
- Brindley D.N., Kok B.P.C., Kienesberger P.C. et al. Shedding light on the enigma of myocardial lipotoxicity: the involvement of known and putative regulators of fatty acid storage and mobilization//Am. J. Physiol. -2010. -Vol. 298. -P. E897-E908.
- Chowdhury R., Warnakula S., Kunutsor S. et al. Association of dietary, circulating, and supplement fatty acids with coronary risk: a systematic review and meta-analysis//Ann. Intern. Med. -2014. -Vol. 160. -P. 398-406.
- Fontes-Carvalho R., Ladeiras-Lopes R., Bettencourt P. et al. Diastolic dysfunction in the diabetic continuum: association with insulin resistance, metabolic syndrome and type 2 diabetes//Cardiovasc. Diabetol. -2015. -Vol. 14 (1). -P. 4-11.
- Paternoster L., Nahara A., Gonzalez M., Charleton R. et al. Genetic effects on carotid intima-media thickness systematic assessment and meta-analyses of candidate gene polymorphisms studied in more than 5000 subjects//Circ. Cardiovasc. Genet. -2010. -No. 3. -P. 15-21.
- Heusch G., Libby P., Gersh B. et al. Cardiovascular remodelling in coronary artery disease and heart failure//Lancet. -2014. -Vol. 383 (9932). -P. 1933-1939.
- Kahn S.E., Cooper M.E., Del Prato S. Pathophysiology and treatment of type 2 diabetes: perspectives on the past, present, and future//Lancet. -2014. -Vol. 383 (9922). -P. 1068-1077.
- Kolwicz S.C.Jr., Purohit S., Tian R. Cardiac metabolism and its interactions with contraction, growth, and survival of cardiomyocytes//Circ. Res. -2013. -Vol. 113 (5). -P. 603610.
- Van Bilsen M., Planavila A. Fatty acids and cardiac disease: fuel carrying a messagе//Acta Physiol. -2014. -Vol. 2116. -P. 476-490.
- Zima A.V., Bovo E., Mazurek S.R. et al. Ca handling during excitation-contraction coupling in heart failure//Pflugers Arch. -2014. -Vol. 466 (6). -P. 1129-1136.


