Разработка компонента питательной среды из биологических жидкостей репродуктивной системы коров для повышения эффективности производства эмбрионов крупного рогатого скота in vitro
Автор: Касьянов Р.О., Плешков В.А., Смоловская О.В., Касьянова А.Д.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Зоотехния и ветеринария
Статья в выпуске: 6, 2025 года.
Бесплатный доступ
Цель исследований – создание эффективной системы получения эмбрионов крупного рогатого скота путем усовершенствования питательных сред in vitro. Задачи: оценить использование биологических жидкостей репродуктивного тракта крупного рогатого скота при получении эмбрионов методом in vitro; разработать оптимальный способ получения биологических жидкостей крупного рогатого скота; разработать оптимальный способ подготовки компонента питательной среды на основе биологических жидкостей; исследовать подходящую концентрацию компонента питательной среды на основе биологических жидкостей для добавления в питательные среды; сравнить качество эмбрионов, полученных в питательных средах с добавлением разработанного компонента и в питательных средах без добавления компонента; сравнить группы с разным добавлением биологических жидкостей и выявить наиболее оптимальную дозировку; сравнить процент эмбрионов, достигших стадии бластоцисты, и процент бластоцист, пригодных для пересадки, в группе с добавлением жидкости яйцевода и маточной жидкости, с группой без добавления жидкостей. Объект исследования – ооциткумулюсные комплексы крупного рогатого скота. Для проведения опыта по забору маточной жидкости было отобрано 10 голов крупного рогатого скота чернопестрой голштинизированной породы. Для отбора маточной жидкости был выбран метод аспирации образца из рогов матки. Для отбора жидкости яйцевода был выбран метод отбора проб после убоя животного. В результате исследований разработан оптимальный способ отбора биологических жидкостей на основе модификации катетера Фолея. Усовершенствованное устройство позволило отобрать на 30 мл раствора больше, чем оригинальное устройство. Прямое добавление в питательные среды разработанного компонента увеличило выход качественных эмбрионов, в опытной группе этот показатель достиг 64 %.
Эмбрион крупного рогатого скота, маточная жидкость, жидкость яйцеводов, in vitro, полиэтиленгликоль, сахароза
Короткий адрес: https://sciup.org/140310243
IDR: 140310243 | УДК: 636.018:636.2:618:57.08 | DOI: 10.36718/1819-4036-2025-6-160-181
Текст научной статьи Разработка компонента питательной среды из биологических жидкостей репродуктивной системы коров для повышения эффективности производства эмбрионов крупного рогатого скота in vitro
Введение. Животноводство, как отрасль агропромышленного комплекса Российской Федерации, достигло высоких показателей обеспечения продовольственной безопасности страны. Для дальнейшего развития и укрепления отраслей молочного и мясного скотоводства необходимо уходить от импорта скота и генетического материла, при этом следует наращивать собственные репродуктивные биотехнологи для увеличения высокопродуктивного поголовья [1–3].
Успешное размножение млекопитающих во многом зависит от оптимальной среды в яйцеводах и матке, обеспечивающей благоприятные условия для перемещения гамет, оплодотворения и развития раннего эмбриона. В настоящее время отсутствуют полноценные исследования, моделирующие эту естественную среду in vitro, используя питательные растворы, максимально приближенные к составу жидкостей яйцеводов и матки. Однако известно, что добавление белков из яйцеводов в культуральные среды при ЭКО человека статистически значимо повышает показатели успешного рождения [4]. Это подтверждает гипотезу о том, что естественные выделения яйцеводов и матки обеспечивают более эффективную поддержку оплодотворения и эмбрионального развития, чем существующие искусственные среды.
Состав жидкостей репродуктивного тракта имеет решающее значение для выяснения сиг- нальных механизмов, участвующих во взаимодействии между эмбрионом и матерью на ранних стадиях беременности у млекопитающих [5, 6].
Знания взаимодействия эмбриона и матери может привести к разработке новых стратегий, способных уменьшить ранние эмбриональные потери и увеличить частоту наступления стельности после переноса эмбриона [7], и то, и другое принесло бы огромную пользу животноводству. Кроме того, скрининг жидкостей в яйцеводах и матке на наличие критических компонентов может помочь прояснить критические аспекты программирования развития репродукции и будет способствовать производству оптимизированных сред для экстракорпорального оплодотворения и культивирования эмбрионов во вспомогательных репродуктивных технологиях [8, 9]. Ключевым компонентом в исследовании жидкостей репродуктивного тракта является метод отбора проб.
Извлечение чистой или разбавленной OLF (oviductal luminal fluid – просветная жидкость яйцевода) крупного рогатого скота из репродуктивной системы забитых животных проводилось различными методами в нескольких лабораториях по всему миру. Этот метод подвергался критике из-за риска сбора жидкости измененного состава из-за посмертных изменений [10, 11]. Чтобы свести к минимуму посмертные изменения в составе жидкости, рекомендуемый временной интервал отбора проб составляет 1– 2 мин после смерти животного [4]. Тем не менее нет доступных исследований оптимального времени посмертного отбора проб жидкостей репродуктивного тракта крупного рогатого скота. Кроме того, работа с животными после убоя не позволяет проводить серийные или непрерывные отборы проб и может быть дорогостоящей, поскольку для получения биологических жидкостей на убой отправляются коровы с отличным продуктивным потенциалом. Непрерывный или серийный отбор проб можно проводить с помощью методов in situ. Одна из первых попыток собрать OLF крупного рогатого скота in situ была предпринята D. Carlson [12], в эксперименте хирургическая канюляция яйцевода позволила непрерывно контролировать секрецию яйцевода в течение трех эстральных циклов. Основные компоненты первых методов in situ, разработанных для отбора OLF крупного рогатого скота, представляли собой канюлирование яйцеводов в ампулярной области и перевязку ма- точно-трубного соединения с выходом собирающего конца канюли на бок животного. Помимо уточнения характеристик катетера и шовного материала, адаптация к этим методам включала двойную канюляцию (т. е. ампулу и перешеек) яйцевода, экстериоризацию канюли через матку и влагалище, лигирование ампуло-истмического перехода и избежание лигирования маточно-трубного соединения. Отбор проб OLF с помощью этих методов обычно проводится один раз в день в течение нескольких дней или недель. Утверждалось, что долгие канюляции могут привести к сбору жидкости с измененным составом из-за длительного времени сбора и возможных воспалительных реакций в месте канюляции [4]. В связи с этим было высказано предположение, что наиболее подходящим методом восстановления OLF является одноразовый отбор проб. Зарубежные ученые D.A. Kenny et al. [13] решили эту проблему хирургической катетеризацией яйцевода в ампулярной области и сбором жидкости в течение 3 часов. Однако прямое сравнение компонентов OLF, полученных при длительных и одноразовых отборах, не проводилось, и длительная катетеризация яйцевода все еще используется [14, 15]. Оба метода требуют хирургического вмешательства, что является недостатком, поскольку лишь немногие лаборатории располагают соответствующими средствами для проведения операций на крупных животных. В настоящее время хирургическая канюляция яйцеводов является единственным доступным методом in situ для взятия образцов OLF крупного рогатого скота. Применение трансцервикальной эндоскопии с модифицированным эндоскопическим инструментарием и ультраминиатюрных катетеров может стать нехирургическим методом взятия проб OLF крупного рогатого скота in situ (в месте нахождения).
После оплодотворения эмбрион крупного рогатого скота попадает в матку примерно на 4-й день эстрального цикла на стадии морулы. В этот момент слой просветной жидкости матки толщиной 1–2 мм поставляет продукты, необходимые для поддержания образования полости бластоцеля и роста предимплантационных бластоцист [16–18]. До недавних исследований маточная жидкость считалась простой средой для транспортировки сперматозоидов и эмбрионов, в настоящее время функциональный спектр маточной жидкости расширяется [19, 20]. Внекле- точные везикулы и подвижные РНК были обнаружены в маточной жидкости домашнего скота, грызунов и людей. Эти молекулы вместе с ранее известными ионами и белками обеспечивают гомеостаз маточной жидкости и облегчают взаимодействие эмбриона и матери [21–24]. Функциональные некодирующие РНК могут переноситься в бластоцисты, тем самым регулируются функции в генетической и эпигенетической эмбриональных особенностях, которые могут моделировать эмбриональное и плацентарное развитие [25]. Важность углеводов и аминокислот для развития эмбриона определена. Углеводы являются ключевым источником топлива, способствуют посттранскрипционной модификации и посредникам контакта матки с эмбрионом [26], в то время как аминокислоты участвуют в обеспечении энергией, регуляции экспрессии генов, передаче сигналов от матери к эмбриону, протеиногенезе и модуляции иммунной системы [27].
Для успешной плацентации и доношенного развития анализ маточной жидкости (ULF – uterine luminal fluid) является важным шагом для выяснения путей, контролирующих фертильность у жвачных животных [28]. Такая информация также важна для лучшего понимания факторов, влияющих на жизнеспособность сперматозоидов, поскольку ULF обеспечивает микросреду для прохождения сперматозоидов по направлению к яйцеводам [29, 30]. Как и в случае с OLF, пробы чистого или разбавленного ULF с посмертными тканями в течение нескольких лет проводились в учреждениях по всему миру. Однако использование патолого-анатомического материала может быть дорогостоящим.
Поскольку матка анатомически более доступна, чем яйцеводы, было разработано несколько методов in situ для взятия образцов ULF крупного рогатого скота. Первое методологическое исследование по отбору проб ULF на месте было опубликовано M.L. Fahning [31]. Техника включала аспирацию жидкости с помощью вакуумного насоса, соединенного с небольшим виниловым катетером, введенным в матку через маточную пипетку для инфузий. Аналогичная методика использовалась в небольшом числе экспериментов с модифицированными трубками и специализированной системой вакуумной аспирации. В последнем исследовании использовали тефлоновый катетер с перфорированным кончиком, который вводили в просвет маточной пипетки из нержавеющей стали и помещали для сбора жидкости в основание рога матки [32].
Однако наиболее распространенным подходом in situ , используемым несколькими лабораториями, является промывание матки солевыми растворами. На основе принципов предыдущих методов в Институте генетики сельскохозяйственных животных в Мариензее, Германия был разработан метод отбора образцов ULF in situ с использованием устройства Ghent для глубокого внутриматочного осеменения крупного рогатого скота [33]. В экспериментальном исследовании случайным образом были выбраны шесть нелактирующих молочных коров на неизвестных стадиях эстрального цикла. Коров фиксировали и подвергали эпидуральной анестезии с последующим введением устройства Ghent через шейку матки во вход в рог матки под ректальным контролем. Полученный ULF был прозрачным, соломенно-желтого цвета с высокой вязкостью. Сбор образцов у большинства коров занимал около 10 минут. Больше времени требовалось для животных, у которых интрацерви-кальное введение устройства было затруднено.
Однако одним из преимуществ этого метода является сбор более однородных образцов жидкости, поскольку устройство Ghent сконструировано таким образом, чтобы повторять анатомическую форму рогов матки. Эта функция позволяет извлекать жидкость из более глубоких слоев рогов матки.
Анализ работ в области репродуктивной биотехнологии отечественных и зарубежных исследователей показывает, что концепция культивирования клеток в среде, максимально напоминающей их среду обитания in vivo , кажется очевидной [34]. Однако ученым потребовалось последние пятьдесят лет, чтобы воплотить эту концепцию в системах, используемых для пре-димплантационного культивирования эмбрионов млекопитающих, и дальнейшее совершенствование продолжается [3, 35, 36].
Предимплантационные эмбрионы млекопитающего в предшествующий им процесс оплодотворения пригодны для культивирования in vitro , поскольку они существуют в своей естественной среде независимо от тканевых структур. Их питательные вещества и продукты жизнедеятельности постоянно перемещаются через жидкости в маточных трубах и матке [37, 38].
В настоящее время химический состав жидкой среды репродуктивного тракта полностью не изучен. Для создания более точных условий in vitro, идентичных тем, которые существуют в условиях in vivo, требуется более углубленное изучение состава этих биологических жидкостей.
Добавление компонента питательной среды на основе биологических жидкостей позволит имитировать жидкую среду репродуктивного тракта, а также макромолекулярные элементы, которые взаимодействуют с эмбрионом из фиксированных мест в репродуктивном тракте [39].
В настоящее время известно, что с самых ранних стадий развития предимплантационный эмбрион должен запускать набор хорошо организованных молекулярных и морфофизиологических событий для обеспечения жизнеспособности потомства. Эти события включают метаболическую и молекулярную регуляцию, происходящую в динамичной системе, которой является репродуктивный тракт. Успешное развитие эмбриона вне организма напрямую связано с наличием необходимых питательных веществ в соответствующих концентрациях и на определенных этапах развития. Это подчеркивает важность синхронизации между потребностями эмбриона и условиями, которые ему обеспечивает естественная среда яйцевода и матки [3, 40, 41].
В попытке оптимизировать условия производства in vitro и удовлетворить этим очень специфическим требованиям были предложены изменения в составе питательных сред и добавках, чтобы имитировать среду, в которой эмбрионы находятся внутри репродуктивного тракта крупного рогатого скота [42].
Состав питательной среды является жизненно важным, но часто упускаемым из виду компонентом в производстве эмбрионов методом in vitro , поскольку он регулирует рост и морфологию тканей, обеспечивая их необходимыми питательными веществами [43].
Совместное культивирование предимплан-тационных эмбрионов с клетками репродуктивного тракта требует среды, благоприятной как для эмбрионов, так и для клеток [44].
Таким образом, создание эффективной системы получения эмбрионов крупного рогатого скота путем усовершенствования питательных сред in vitro является актуальным направлением.
Цель исследований – создание эффективной системы получения эмбрионов крупного рогатого скота путем усовершенствования питательных сред in vitro .
Задачи : оценить использование биологических жидкостей репродуктивного тракта крупного рогатого скота при получении эмбрионов методом in vitro ; разработать оптимальный способ получения биологических жидкостей крупного рогатого скота, оптимальный способ подготовки компонента питательной среды на основе биологических жидкостей; исследовать подходящую концентрацию компонента питательной среды на основе биологических жидкостей для добавления в питательные среды; сравнить качество эмбрионов, полученных в питательных средах с добавлением разработанного компонента и в питательных средах без добавления компонента; сравнить группы с разным добавлением биологических жидкостей и выявить наиболее оптимальную дозировку; сравнить процент эмбрионов, достигших стадии бластоцисты, и процент бластоцист, пригодных для пересадки, в группе с добавлением жидкости яйцевода и маточной жидкости с группой без добавления жидкостей.
Объекты и методы. Объектом опыта выступали ооцит-кумулюсные комплексы крупного рогатого скота. Для экспериментальных исследований были сформированы одна контрольная группа и пять опытных групп. В каждой группе находилось по 30 яйцеклеток. Все яйцеклетки были идентичны друг другу, с высокой балльной оценкой, проведенной после дозревания. Яйцеклетки, набравшие недостаточно баллов, после оценивания к опыту не допускались.
Для проведения опыта по забору маточной жидкости было отобрано 10 голов крупного рогатого скота черно-пестрой голштинизированной породы. Для отбора маточной жидкости был выбран метод аспирации образца из рогов матки.
Для отбора жидкости яйцевода был выбран метод отбора проб после убоя животного, так как прижизненная манипуляция невозможна из-за отсутствия оснащенности лабораторий для проведения такого рода хирургических операций.
В исследовании были задействованы методы зоотехнии, ветеринарии, физиологии, ультразвуковой диагностики, акушерско-гинекологического обследования и статистического анализа. Опыт проводился на базе лаборатории цитогенетики ФГБОУ ВО «Кемеровский государственный университет» на основе методики планирования экспериментов с учетом создания опытных и контрольных групп методом обособ- ленных групп в соответствии с принципом аналогичных групп.
Статистическую обработку данных проводили на персональном компьютере с помощью программы MS Excel с подтверждением достоверности по критерию t-Стьюдента в следующих значениях: * р < 0,05; ** р < 0,01; *** р < 0,001. Для статистического анализа качественных ха- рактеристик эмбрионов (с помощью U-критерия Манна-Уитни) применялась балльная система оценки.
Результаты и их обсуждение
Отбор проб маточной жидкости. Для отбора маточной жидкости был выбран метод аспирации образца из рогов матки (рис. 1).

Рис. 1. Аспирация маточной жидкости Aspiration of the uterine fluid
Так как в Российской Федерации в продаже нет устройства Ghent, для проведения научного опыта было выбрано устройство Фолея. Это устройство идентично устройству Ghent и свободно продается на территории РФ.
Этот метод включает трансвагинальное устройство Фолея, вводимое через шейку матки (с помощью ректальных манипуляций) в тело матки или рога матки для сбора необходимого образца (рис. 2).


Рис. 2. Отбор маточной жидкости с помощью устройства для аспирации Sampling of the uterine fluid using an aspiration device
Для получения более концентрированного раствора и увеличения объема получаемого образца от одной коровы-донора было усовершенствовано оборудование, используемое для проведения манипуляций по отбору проб биологических жидкостей. Для совершенствования понадобилось удлинить катетер на 3 см (см. рис. 2). В результате увеличился объем получаемой жидкости за счет более глубокого проникновения устройства.
Стерильный катетер вводили в рог матки и вливали 20–50 мл стерильного 0,9 % раствора хлорида натрия, а затем, после ректального массажа рогов матки аспирировали физиологический раствор при помощи вакуумного насоса, отрегулированного на вакуум 80 мм рт. ст. Далее этот раствор привозили в лабораторию, транспортировка осуществлялась с постоянным поддержанием температуры раствора 37,7 °С, при помощи переносного термоса, работающего от встроенной батареи. Это необходимо для избежания потери качества аспирируемой маточной жидкости. В лаборатории образец фильтровался через стерильный фильтр, клетки репродуктивного тракта КРС оставались на фильтре, а жидкость, очищенная от этих примесей, отбиралась в стерильную тару и замораживалась постепенно до температуры –45 °С, для будущей лиофилизации. От каждого животного было получено в среднем 5 мл маточной жидкости. Для определения концентрации криопротектора в замороженном материале проводили расчет объема физиологического раствора (0,9 % раствора хлорида натрия), использованного для разведения исходного образца перед криоконсервацией, и вычитали его из общего объема приготовленного раствора для замораживания.
Отбор проб жидкости яйцеводов. В связи с этическими и экономическими ограничениями, а также отсутствием специализированного хирургического оборудования забор яйцеводной жидкости осуществлялся post mortem у самок, направленных на вынужденный убой по причине травматических повреждений (растяжения связок, переломы конечностей). Альтернативные методы прижизненного отбора, требующие инвазивного хирургического вмешательства с катетеризацией яйцевода, были признаны нецелесообразными на данном этапе исследования.
Отбор жидкости яйцеводов осуществлялся в течение 10 мин после убоя, производилась гистерэктомия матки, перевязка яйцевода в области прикрепления яйцевода к рогам матки, стерильным шприцом вливалась вода для инъекций и методом промывания выкачивали жидкость яйцевода.
Отбор проб происходил следующим методом: репродуктивные пути извлекали на скотобойне в течение 10 мин после забоя, рога матки и яйцеводы, расположенные ипсилатерально к желтому телу, немедленно вырезали в месте бифуркации и промывали при помощи стерильного шприца с содержанием 10 мл фосфатнобуферного физиологического раствора (рис. 3). Разведенную жидкость яйцевода центрифугировали в течение 15 мин при 1000 · 2 g, а надосадочную жидкость аликвировали и замораживали, и хранили при –80 °C до проведения лиофилизации.
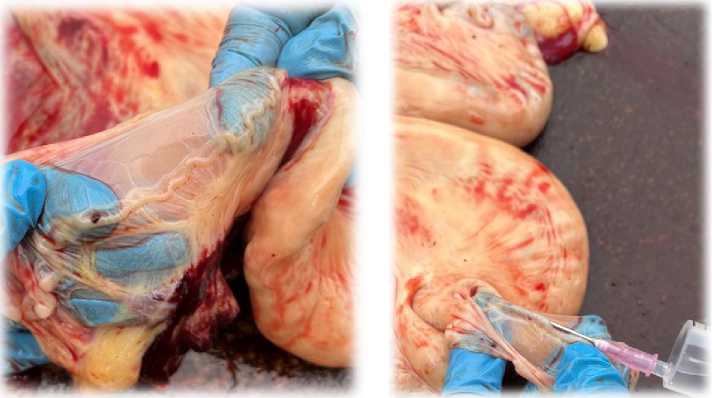
Рис. 3. Отбор жидкости яйцевода на убойном пункте Oviduct fluid sampling at the slaughterhouse
Исследование реактивов для лиофилизации жидкостей и увеличения срока хранения продукта. Образцы замораживали двумя способами: медленным и быстрым. При медленном замораживании образцы помещали в сублиматор при 24 °C, затем охлаждали до –25 °C со скоростью 0,84 °C/мин, далее до –35 °C со скоростью 0,167 °C/мин. После часовой выдержки при –35 °C температуру понижали до –43 °C и выдерживали два часа. Время замораживания образца составило 5 ч.
Во время более быстрого охлаждения компонента до –45 °C применяли следующую методику: температура сублимационной сушки во время помещения в нее компонента, представленного в роли биологической жидкости репродуктивного тракта крупного рогатого скота, составляла 24 °C. До –5 °C производилось охлаждение сушилки в течение 30 мин. Далее компонент охлаждался до -20 °C в течение 60 мин. До –45 °C охлаждение производилось в течение 120 мин.
Флаконы с образцами компонента, включающими в себя криопротектор и липопротек-тор, помещали в камеру сублиматора. Сушилка герметично закрывалась, и начинался процесс охлаждения. При достижении температуры –20 °C включался вакуумный насос, начинался нагрев в камере сублиматора. Вакуум 0,08 мбар достигается через 15 мин после включения насоса. Сублимация занимает 20 ч, далее температура в сублиматоре поднимается до 8 °C и образцы сушатся при этой температуре.
Вторичная сушка длится 21 ч, после этого подогрев сублиматора выключается, также выключается вакуумный насос. Давление в сушилке выравнивается и готовый продукт извлекается из камеры.
Главным вопросом в процессе приготовления лиофилизата остаются температурные условия охлаждения и высушивания образцов.
Для сохранения лиофилизата во время сушки применяются криопротекторы и липротекто-ры. Они играют важную роль в защите образцов за счет вытеснения воды [45].
Оптимальным криопротектором считается полиэтиленгликоль, обладающий кристаллическими свойствами. Но в зависимости от условий охлаждения образцов и связи с другими вспомогательными веществами (сахарозой) структура ПЭГ может оказаться кристаллической либо бо- лее аморфной. Эти моменты влияют на стабильность и сохранность получаемого продукта.
Вспомогательные вещества во время сушки формируют защитный слой и приводят в устойчивое состояние белковые, а также пептидные соединения. Эти вещества необходимы для вытеснения молекул воды и предотвращения кристаллизации раствора при заморозке. Вытесняя воду, защищают их от изменения формы макромолекулы и последующей деградации [46]. Лиопротектор, часто используемый при лиофилизации, это дисахарид, образующий водородные связи с функциональными группами пептидов. Из известных лиопротекторов эффективным является сахароза.
Для определения лучшего способа приготовления компонента были протестированы два способа охлаждения образцов: медленное и быстрое.
Во время медленного охлаждения с последующей заморозкой в образце образуются крупные кристаллы льда. Впоследствии при сушке испарение влаги происходит через крупные поры, оставшиеся после испарения льда.
При быстром охлаждении образцов с последующей заморозкой появляются маленькие поры, и лиофилизация образца происходит медленнее.
Для лучшего сохранения продукта необходимо нахождение криопротектора в кристаллическом состоянии. Тогда происходит образование защитной оболочки, называемое стеклованием.
Чтобы предотвратить «коллапс», первую сушку проводили при температуре на 2 градуса ниже температуры кристаллизации, которая составляет –5 °C.
Поскольку чистая жидкость из яйцевода не подошла для лиофилизации, потребовалось комплексное использование криопротектора и лиопротектора, наиболее оптимальными из которых оказались ПЭГ и сахароза.
В процессе исследований были определены наиболее благоприятные отношения лиопротек-тора к криопротектору: 20/80, 70/30, 80/20 и 90/10. Такие пропорции позволяют сохранить аморфную структуру вспомогательных веществ, образуют стекловидный слой и защитную оболочку.
Добавление полиэтиленгликоля поддерживает структуру лиофилизированного продукта и дополнительно защищает его от внешних воздействий при сублимационной сушке (рис. 4).

А Б
Рис. 4 . Образец лиофилизированного продукта: А – без «коллапса»; Б – с «коллапсом» Sample of a lyophilized product: A – without “collapse”; B – with “collapse”
Кроме того, взаимодействие с гидрофильными группами вспомогательных веществ приводило к дополнительной термодинамической стабилизации во время вторичной сушки. К этим соотношениям лиопротектора к криопротектору (20/80, 70/30, 80/20 и 90/10) рекомендуем использовать быстрый метод заморозки, он обеспечит сохранность аморфной структуры вспомогательных веществ.
Внедрение компонента в питательные среды. За основу для эксперимента была выбрана среда ТСМ 199 с добавлением в нее 10 % фетальной бычей сыворотки (FBS) для обеспечения клеток дополнительными биологически активными молекулами, такими как гормоны липиды и минералы, также в состав питательной среды добавляли фолликулостимулирующий гормон (ФСГ супер) – в условиях инкубато- ра он имитирует условия в фаллопиевых трубах, создавая эмбриону максимально возможные благоприятные условия in vitro. Дополнительно в состав среды добавляли 50 мг/мл гентамицина для минимизирования риска роста микробов в чашках Петри и последний компонент, который находился в основной среде для культивирования эмбрионов, это 3 мг/мл витамина В12. Он регулирует обменные процессы в клетке, участвует в делении клеток, снижает уровень стресса у клеток [47]. Полученные яйцеклетки для эксперимента помещались в питательную среду и покрывались минеральным маслом таким образом, чтобы вся капля с содержанием среды и яйцеклетками, а в последующем эмбрионами, были полностью покрыты минеральным маслом (рис. 5).

Рис. 5. Капли питательной среды, покрытые минеральным маслом Drops of nutrient medium coated with mineral oil
Биологические растворы требуют буферизации, чтобы рН оставался в узком диапазоне (7,2–7,4), совместимом с жизнеспособностью клеток. Изменения рН происходят в основном за счет накопления побочных продуктов метаболизма, таких как молочная кислота [22].
Применение минерального масла позволило увеличить время нахождения питательной среды вне инкубатора, при этом не влияя на находящиеся в этой среде клетки.
Ежедневно производилась частичная замена питательной среды на свежую, для того чтобы у яйцеклеток/эмбрионов была постоянная среда с содержанием всех необходимых веществ для роста и деления.
Исследование подходящей концентрации компонента для добавления в питательные среды. Мы протестировали питательную среду, разработанную таким образом, чтобы она напоминала среду, в которой первоначально растет эмбрион крупного рогатого скота. Добавка для культивирования эмбрионов представляет со- бой компонент питательной среды на основе биологических жидкостей репродуктивного тракта самок крупного рогатого скота, которая содержит химический состав углеводов и аминокислот, обнаруженных в жидкостях яйцевода крупного рогатого скота и маточной жидкости. Мы проверили эффективность этой последовательной системы для поддержания начального развития и получения бластоцист по сравнению с обычными средами без добавления разрабатываемого компонента. С этой целью эмбрионы были получены и культивированы in vitro в нескольких опытных группах. Схема опыта представлена в таблице 1.
Для опыта были сформированы одна контрольная группа и пять опытных групп. В каждой группе находилось по 30 яйцеклеток, полученных из яичников, отобранных на мясокомбинате во время убоя животных. Яичники отбирались от здоровых животных, не подверженных заболеваниям. Животные поступали на убой в связи с полученными механическими травмами.
Таблица 1
|
Группа |
Состав питательной среды для культивирования эмбрионов КРС |
Состав питательной среды для подготовки спермы быка к оплодотворению |
Кол-во вводимого компонента жидкости яйцеводов, мг/мл |
Кол-во вводимого компонента маточной жидкости, мг/мл |
|
1 |
2 |
3 |
4 |
5 |
|
Контрольная |
ТСМ199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицин + 3 мг/мл В 12 |
Градиент плотности: Percool – 45 и 90 % Источник белка для промывки: bo-semenprep |
– |
– |
|
Опытная 1 |
ТСМ199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицин + 3 мг/мл В 12 + 0,5 мг/мл жидкость яйцевода (OF) |
Градиент плотности: Percool – 45 и 90 % Источник белка для промывки: 1 мг/мл маточной жидкости (UF) |
0,5 |
1 |
|
Опытная 2 |
ТСМ199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицин + 3 мг/мл В 12 + 1 мг/мл жидкость яйцевода (OF) |
Градиент плотности: Percool – 45 и 90 % Источник белка для промывки: 2 мг/мл маточной жидкости (UF) |
1 |
2 |
|
Опытная 3 |
ТСМ199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицин + 3 мг/мл В 12 + 2 мг/мл жидкость яйцевода (OF) |
Градиент плотности: Percool – 45 и 90 % Источник белка для промывки: 5 мг/мл маточной жидкости (UF) |
2 |
5 |
Окончание табл. 1
|
1 |
2 |
3 |
4 |
5 |
|
Опытная 4 |
ТСМ199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицин + 3 мг/мл В 12 + 5 мг/мл жидкость яйцевода (OF) |
Градиент плотности: Percool – 45 и 90 % Источник белка для промывки: 10 мг/мл маточной жидкости (UF) |
5 |
10 |
|
Опытная 5 |
ТСМ199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицин + 3 мг/мл В 12 + 10 мг/мл жидкость яйцевода (OF) |
Градиент плотности: Percool – 45 и 90 % Источник белка для промывки: 15 мг/мл маточной жидкости (UF) |
10 |
15 |
Схема опыта
The scheme of experience
Яйцеклетки проходили этап дозревания, далее были распределены по группам. Все яйцеклетки были идентичны друг другу, с высокой балльной оценкой, проведенной после дозревания. Яйцеклетки, набравшие недостаточно баллов, после оценивания к опыту не допускались.
Согласно схеме опыта проводилась дальнейшая подготовка спермопродукции для опло- дотворения яйцеклеток. Далее яйцеклетки оплодотворяли и культивировали согласно схеме нашего опыта.
По окончании работы с яйцеклетками был проведен обсчет полученных данных. Результаты проведенного опыта представлены в таблице 2.
Таблица 2
|
Группа |
Количество яйцеклеток, заложенных на цикл, шт. |
Образование нормального второго полярного тельца, шт. |
Образование ранних бластоцист, шт. |
Образование экспандирован-ной бластоцисты, шт. |
Процент выхода качественных эмбрионов, % |
|
Контрольная |
30 |
20 |
15 |
10 |
33,3 |
|
Опытная 1 |
30 |
23 |
20 |
20 |
66,6 |
|
Опытная 2 |
30 |
25 |
22 |
21 |
70,0 |
|
Опытная 3 |
30 |
28 |
26 |
25 |
83,3 |
|
Опытная 4 |
30 |
28 |
27 |
24 |
80,0 |
|
Опытная 5 |
30 |
27 |
25 |
25 |
83,3 |
Результаты опыта 1
Experience results 1
Анализируя полученные данные, мы пришли к выводу, что добавление в питательную среду компонента на основе биологических жидкостей репродуктивного тракта крупного рогатого скота, подготовленного при помощи лиофилизации с добавлением вспомогательных веществ, таких как полиэтиленгликоль и сахароза, показало отличный результат. Опытные группы 3, 4 и 5 имели самые высокие показатели выхода качественных эмбрионов: 25 шт. (83,3 %), 24 шт. (80,0 %) и 25 шт. (83,3 %). На основании этого было принято решение для дальнейшего использования взять за основу дозировку, представленную в опыте 3, а именно – добавление 2 мг/мл жидкости яйцеводов для культивирования эмбрионов и 5 мг/мл маточной жидкости при чтобы уменьшить затраты компонента и не потерять эффективность его введения в питательные среды. У этой группы наименьшее введение компонента в питательную среду и наибольший выход качественных эмбрионов. Большая концентрация компонента в питательных средах не несет никакого смысла, потому что качество оплодотворения и выхода бластоцист остаются на том же уровне, что и в опытной группе 3.
Для полноты эксперимента было проведено дополнительное исследование опытных групп, показавших хороший результат. В опыте 2 было принято решение увеличить число исследуемых яйцеклеток до 50 шт. Результаты опыта представлены в таблице 3.
подготовке спермы к оплодотворению, для того
Таблица 3
|
Группа |
Количество яйцеклеток, заложенных на цикл, шт. |
Образование нормального второго полярного тельца, шт. |
Образование ранних бластоцист, шт. |
Образование экспандирован-ной бластоцисты, шт. |
Процент выхода качественных эмбрионов, % |
|
Контрольная |
50 |
37 |
26 |
17 |
34,0 |
|
Опытная 3 |
50 |
47 |
45 |
42 |
84,0 |
|
Опытная 4 |
50 |
48 |
44 |
40 |
80,0 |
|
Опытная 5 |
50 |
47 |
42 |
41 |
82,0 |
Результаты опыта 2
Results of experiment 2
Основываясь на данных, полученных в опыте 2, подтвержден ранее полученный результат. Опытная группа 3 с добавлением 2 мг/мл жидкости яйцеводов для культивирования эмбрионов и 5 мг/мл маточной жидкости при подготовке спермы к оплодотворению показала наилучший результат – 42 экспандированные бластоцисты, готовые для пересадки реципиенту, что составляет 84 % от заложенных яйцеклеток на цикл.
Исследование лабораторного образца на эмбрионах с добавлением компонента в питательные среды. Мы протестировали компоненты питательной среды, разработанные на основе биологических жидкостей репродуктивного тракта таким образом, чтобы она напоминала среду, в которой первоначально растет эмбрион. Добавка для культивирования эмбрионов представляет собой леофилизат репродуктивных жидкостей крупного рогатого скота, который имеет в химическом составе углеводы и аминокислоты, содержащиеся в жидкостях яйцевода и маточной жидкости.
В результате исследований проведена модернизация технологии in vitro maturation (IVM) (дозревание ооцитов в лабораторных условиях) с определением наиболее эффективных характеристик экзогенных факторов при дозревании, включая использование различных отечественных и импортных ростовых факторов. Также для улучшения качества и увеличения количества эмбрионов, пригодных для криоконсервации и/или для подсадки реципиентам, были проведены экспериментальные исследования по улучшению состава среды для культивирования эмбрионов.
Исследование проводилось на 100 яйцеклетках от здоровых коров. Материал разделили на две равные группы. В контрольной группе 50 яйцеклеток культивировали в стандартной среде (TCM 199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицина + 3 мг/мл В12) до стадии экспанди-рованной бластоцисты при 38,5 °C и 6 % CO2. Обработку спермы проводили стандартным методом (градиент Percoll). В опытной группе (50 яйцеклеток) условия культивирования были идентичны, но в питательную среду добавляли 2 мг/мл жидкости яйцеводов, а при подготовке спермы использовали маточную жидкость в качестве источника белка.
После созревания яйцеклетки помещали в питательную среду под минеральным маслом. Оплодотворение проводили замороженной спермой быка, размороженной при 37 °С в течение 30 с и обработанной центрифугированием в градиенте Percoll (45 и 90 %). В контрольной группе для промывки спермы использовали коммерческий препарат (bo-semenprep, IVF BIOSCIENCE), в опытной – маточную жидкость (UF) коров. Схема опыта представлена в таблице 4.
После экстракорпорального оплодотворения яйцеклеток предполагаемые зиготы переносились в среду для культивирования и дважды промывались для удаления лишних сперматозоидов с целью минимизации токсического влияния на зиготы, среды помещались в увлажненную атмосферу с содержанием 6,0 % CO 2 , при 38,8 °C, питательная среда в каплях частично обновлялась (через 48 ч), из капли удаляли 45 мкл использованной среды и вносили равный объем (45 мкл) свежей питательной среды.
Таблица 4
|
Группа |
Количество яйцеклеток, шт. |
Состав питательной среды |
Оплодотворение |
|
Контрольная группа |
50 |
ТСМ199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицин + 3 мг/мл – В 12 |
Градиент плотности: Percool – 45 и 90 %. Источник белка для промывки: bo-semenprep |
|
Опытная группа |
50 |
ТСМ199 + 10 % FBS + ФСГ супер + 50 мг/мл гентамицин + 3 мг/мл – В 12 + 2 мг/мл жидкость яйцевода (OF) |
Градиент плотности: Percool – 45 и 90 %. Источник белка для промывки: маточная жидкость (UF) |
Схема лабораторного опыта
The scheme of laboratory experience
В момент частичной замены среды оценивали скорость дробления клеток, сравнивая текущее состояние с исходным, зафиксированным до замены среды. Дополнительно определяли время начала дробления зигот после осемене- ния ооцитов. На 7-й день регистрировали выход, качество и стадию развития бластоцисты. Далее регистрировали общее количество полученных эмбрионов от клеток, заложенных на цикл. Результаты представлены в таблице 5.
Таблица 5
|
Показатель |
Контрольная группа |
Опытная группа |
Разница, % |
|
Количество яйцеклеток, заложенных на цикл, шт. |
50 |
50 |
– |
|
Степень дозревания яйцеклеток, шт. |
42 |
49 |
16,6 |
|
Образование нормального второго полярного тельца, шт. |
32 |
40 |
25,0 |
|
Образование ранних бластоцист, шт. |
20 |
35 |
75,0 |
|
Образование экспандированной бластоцисты, шт. |
12 |
32 |
166,6 |
|
Процент выхода качественных эмбрионов, % |
24 |
64 |
40 |
Выход качественных эмбрионов на 7-й день in vitro
High-quality embryos are released the 7th in vitro
Проанализировав данные, представленные в таблице 5, пришли к выводу, что добавление жидкости яйцевода (OF) во время дозревания яйцеклеток и культивирования оплодотворенных зигот, а также использование маточной жидкости (UF) во время подготовки спермы к оплодотворению показали положительный эффект на конечный выход качественных эмбрионов, пригодных для пересадки реципиентам. В контрольной группе выход качественных эмбрионов составил 12 шт. (24 %). В опытной группе показатель намного выше и составляет 32 эмбриона (64 %).
Для проведения оценки качества эмбрионов была составлена таблица с критериями, необходимыми для оценивания. Оценку качества эмбрионов проводили по признакам, выраженных в баллах, согласно таблице 6.
Качественные признаки эмбрионов переводили в баллы для проведения статистической обработки данных по качественным признакам методом U-критерия Манна – Уитни.
Таблица 6
|
Показатель |
Критерий оценки |
|
Степень дозревания яйцеклеток |
0 – отсутствие дозревания (кумулюсный слой не отходит от яйцеклетки). 1 – неполное дозревание (пространство между клетками кумулюсного слоя небольшое, кумулюсный слой недостаточно распушился). 2 – полное дозревание (кумулюсный слой полностью распушился) |
|
Оплодотворение яйцеклеток |
0 – отсутствие второго полярного тельца.
|
|
Скорость образования морул |
0 – 7–8-й день (после оплодотворения). 1 – 5–6-й день (после оплодотворения). 2 – 3–4-й день (после оплодотворения) |
|
Образование ранних бластоцист |
0 – неравномерное развитие бластомеров, мутность внутреннего пространства бластоцисты, поврежденная зона пеллюцида.
|
|
Образование экспандированной бластоцисты |
0 – бластоциста не меняется, остается на стадии развития ранней бластоцисты.
|
|
Витрификация эмбрионов |
0 – сильный разрыв зоны пеллюцида, разрушения бластомеров, сжатие бластополости.
|
|
Девитрификация эмбрионов |
0 – разрыв зоны пеллюцида, бластомеры разного размера, восстановление объема эмбриона не происходит, продолжение развития эмбриона не происходит.
|
Критерии оценки качества эмбрионов крупного рогатого скота, балл
Criteria for assessing the quality of bovine embryos, score
Результаты оценки качества эмбрионов Для полноты исследования была проведена крупного рогатого скота при применении компо- статистическая обработка данных по критерию нента питательной среды на основе биологи- t-Стьюдента, результаты представлены в таб-ческих жидкостей репродуктивного тракта самок лице 8.
крупного рогатого скота приведены в таблице 7.
Таблица 7
Результаты оценки качества эмбрионов крупного рогатого скота при применении компонента питательной среды на основе биологических жидкостей репродуктивного тракта самок крупного рогатого скота (n = 100)
The results of assessing the quality of cattle embryos when using a nutrient medium component based on biological fluids of the reproductive tract of female cattle (n = 100)
|
Показатель |
Группа |
Разница, % |
|
|
Контрольная |
Опытная |
||
|
Степень дозревания яйцеклеток |
74 |
91 |
22,9 |
|
Оплодотворение яйцеклеток |
57 |
72 |
26,3 |
|
Скорость образования морул |
43 |
68 |
58,1 |
|
Образование ранних бластоцист |
38 |
94 |
147,3 |
|
Образование экспандированной бластоцисты |
22 |
62 |
181,8 |
|
Витрификация эмбрионов |
22 |
62 |
181,8 |
|
Девитрификация эмбрионов |
21 |
61 |
190,4 |
|
U эмп. |
– |
5* |
– |
Примечание: * - достоверность при (р < 0,05): U-критерий Манна - Уитни равен 5; критическое значение U-критерия Манна – Уитни при заданной численности сравниваемых групп составляет 8; 5 ≤ 8, следовательно различия уровня признака в сравниваемых группах статистически значимы (р < 0,05).
Таблица 8
Результаты оценки качества эмбрионов крупного рогатого скота по критерию t-Стьюдента, балл
The results of the evaluation of the quality of bovine embryos according to the t-Student criterion, score
|
Признаки, выявляемые в процессе опыта |
Группа |
|
|
Контрольная (n = 50) |
Опытная (n = 50) |
|
|
Степень дозревания яйцеклеток |
74 |
91 |
|
Средняя степень дозревания яйцеклеток |
1,48 ± 0,11 |
1,82 ± 0,06* |
|
Оплодотворение яйцеклеток |
57 |
72 |
|
Среднее оплодотворение яйцеклеток |
1,14 ± 0,13 |
1,44 ± 0,11 |
|
Скорость образования морул |
43 |
68 |
|
Средняя скорость образования морул |
0,86 ± 0,13 |
1,36 ± 0,12** |
|
Образование ранних бластоцист |
38 |
94 |
|
Среднее образование ранних бластоцист |
0,76 ± 0,17 |
1,90 ± 0,19*** |
|
Образование экспандированной бластоцисты |
22 |
62 |
|
Среднее образование экспандированной бластоцисты |
0,24 ± 0,09 |
1,24 ± 0,13*** |
|
Витрификация эмбрионов |
22 |
62 |
|
Средняя витрификация эмбрионов |
0,24 ± 0,09 |
1,24 ± 0,13*** |
|
Девитрификация эмбрионов |
21 |
61 |
|
Средняя девитрификация эмбрионов |
0,42 ± 0,11 |
1,22 ± 0,14*** |
Примечание : * – р < 0,1; ** – р < 0,01; *** – р < 0,001.
Анализ изучения оценки качества эмбрионов показал, что достоверные различия выявлены по следующим изучаемым показателям: средняя степень дозревания яйцеклеток, где разница составила 22,97 %, или 0,34 балла (р < 0,01); средняя скорость образования морул, где разница составила 58,13 %, или 0,5 балла (р < 0,01); среднее образование ранних бластоцист, где разница составила 150 %, или 1,14 балла (р < 0,001); среднее образование экспандиро-ванных бластоцист, разница составила 416,66 %, или 1 балл (р < 0,001); средняя витрификация эмбрионов, разница составила 416,66 %, или 1 балл (р < 0,001); средняя девитрификация эмбрионов, разница составила 190,47 %, или 0,8 балла (р < 0,001).
Основываясь на этих данных, можно с уверенностью сказать, что добавление компонента, полученного из биологических жидкостей репродуктивного тракта самок крупного рогатого скота, благоприятно влияет на рост и развитие эмбрионов, начиная с первого этапа получения эмбрионов in vitrо – закладки на дозревание ас-пирированых яйцеклеток.
Заключение. Существующие методы отбора проб люминальных жидкостей в репродуктивном тракте не позволяют извлекать жидкость, свободную от клеток, требующую немедленного центрифугирования после отбора проб. Отбор проб OLF и ULF путем промывки следует ограничивать обстоятельствами. Текущие методы in situ , доступные для OLF крупного рогатого скота, требуют хирургических вмешательств, и необходима разработка неинвазивных методов:
-
1. Проведено исследование способов отбора биологических жидкостей у крупного рогатого скота. Изучена научная литература русских и зарубежных авторов. Выявлены методы отбора проб. В эксперименте участвовало 10 голов крупного рогатого скота, было использовано следующее оборудование: аспирационный насос (системы OPU КРС), катетер Фолея, цен-трифуга-вортекс СМ-50M, транспортировочный инкубатор с поддержанием постоянной температуры. В результате определены способы, наиболее подходящие под выполнение работы. А именно – забор маточной жидкости при жизни животного методом аспирации и забор жидкости яйцеводов в течении 10 мин после убоя животного.
-
2. Разработан наиболее оптимальный способ отбора биологических жидкостей. Для отбора маточной жидкости был подобран и доработан метод отбора проб при помощи трансвагинального устройства Фолея, а именно – удлинение устройства для более глубокого проникновения и отбора более концентрированной жидкости. Усовершенствованное устройство позволило отобрать от одного донора на 3 мл раствора больше, чем оригинальное устройство. В конечном итоге увеличился объем получаемого компонента от опытной группы на 30 мл.
-
3. Проведено исследование реактивов для лиофилизации жидкостей и увеличения срока хранения продукта. Для эксперимента были
-
4. Усовершенствованные составы питательных сред привели к повышению способности поддерживать эмбрион млекопитающего в культуре на протяжении всего предимплантационно-го периода и периода до прикрепления. Аминокислоты и специфические макромолекулы были определены как ключевые компоненты среды, тогда как временная динамика была признана важной характеристикой среды. Кроме того, были выявлены другие лабораторные факторы, которые непосредственно влияют на развитие и жизнеспособность эмбриона. К таким факторам относятся использование пониженного содержания кислорода, соответствующая система инкубации и надлежащая предварительная проверка всех контактных принадлежностей. При наличии строгих систем контроля качества можно получать показатели развития эмбрионов in vitro с использованием новых составов питательных сред при сохранении высокого уровня жизнеспособности эмбрионов.
-
5. Опытные группы 3, 4 и 5 имели самые высокие показатели выхода качественных эбрио-нов: 25 шт. (83,3 %), 24 шт. (80,0 %) и 25 шт. (83,3 %). На основании этого было принято решение: для дальнейшего использования взять за основу дозировку, представленную в опыте 3, а именно добавление 2 мг/мл жидкости яйцеводов для культивирования эмбрионов и 5 мг/мл маточной жидкости при подготовке спермы к оплодотворению, для того чтобы уменьшить затраты компонента и не потерять эффективность его введения в питательные среды. У этой группы наименьшее введение компонента в питательную среду и наибольший выход качественных эмбрионов. Большая концентрация компонента в питательных средах не несет никакого смысла, потому что качество оплодотворения и выхода бластоцист остается на том же уровне, что и в опытной группе 3.
-
6. Проанализировав полученные данные, был сделан вывод, что добавление жидкости яйцевода (OF) во время дозревания яйцеклеток и культивирования оплодотворенных зигот, а также использование маточной жидкости (UF) во время подготовки спермы к оплодотворению показали положительный эффект на конечный выход качественных эмбрионов, пригодных для пересадки реципиентам. В контрольной группе выход качественных эмбрионов составил 12 шт. (24 %). В опытной группе показатель намного выше и составляет 32 эмбриона (64 %).
сформированы группы изучаемого образца и разделены между собой. Часть образцов была лиофилизирована без добавления вспомогательных веществ, а часть с добавлением. В результате эксперимента образцы без добавления вспомогательных веществ выкипали при лиофилизации, а вследствие этого происходило разрушение белка, находящегося в биологических жидкостях. В качестве вспомогательных веществ были отобраны полиэтиленгликоль и сахароза. Эти вещества необходимы для вытеснения молекул воды и предотвращения кристаллизации раствора при заморозке.
Анализ изучения оценки качества эмбрионов показал, что достоверные различия выявлены по следующим изучаемым показателям: средняя степень дозревания яйцеклеток, где разница составила 22,97 %, или 0,34 балла (р < 0,01);
средняя скорость образования морул, где разница составила 58,13 %, или 0,5 балла (р < 0,01); среднее образование ранних бластоцист, где разница составила 150 %, или 1,14 балла (р < 0,001); среднее образование экспандированных бластоцист, разница составила 416,66 %, или 1 балл (р < 0,001); средняя витрификация эмбрионов, разница составила 416,66 %, или 1 балл (р < 0,001); средняя девитрификация эмбрионов, разница составила 190,47 %, или 0,8 балла (р < 0,001).
Конфликты интересов. Авторы заявляют об отсутствии конфликта интересов. Финансирующие организации не принимали участия в разработке исследования, в сборе, анализе или интерпретации данных; в написании рукописи или в решении опубликовать результаты.


