Разработка метода выявления Anaplasma marginale с использованием ПЦР в реальном времени
Автор: Ковальчук С.Н., Косовский Г.Ю., Архипов А.В., Глазко Т.Т., Глазко В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная микробиология, микробиомы
Статья в выпуске: 6 т.50, 2015 года.
Бесплатный доступ
Риккетсия Anaplasma marginale - возбудитель анаплазмоза крупного рогатого скота. Заболевание протекает с признаками анемии, лихорадки и потерей веса, вызывает аборты и снижение удойности у коров и во многих случаях приводит к гибели зараженных животных. A. marginale переносится клещами и кровососущими насекомыми. Анаплазмоз обычно диагностируется при микроскопическом исследовании мазков крови, окрашенных по Романовскому красителем Гимза, но этот метод ненадежен, если животное находится на ранних стадиях инфицирования. Широко используются серологические методы диагностики, однако они не позволяют дифференцировать А. marginale от других видов анаплазм. Подход, основанный на применении полимеразной цепной реакции (ПЦР) в реальном времени, сочетает высокую специфичность анализа и возможность количественной оценки числа копий ДНК патогена в образце. Цель выполненного нами исследования - разработать метод дифференцированного выявления A. marginale в крови крупного рогатого скота с помощью ПЦР в реальном времени. В качестве мишени для амплификации был выбран однокопийный ген msp4. Msp4 - иммунодоминантный белок наружной мембраны всех известных на сегодняшний день риккетсий рода Anaplasma. Праймеры на основе гена msp4 для филогенетического анализа А. marginale ранее были предложены J. de la Fuente с соавт. (2001), однако они не видоспецифичны. В результате анализа нуклеотидных последовательностей гена msp4 разных изолятов A. marginale и близкородственных видов анаплазм, включая A. ovis, выявили характерные для A. marginale участки, на основе которых были разработаны видоспецифичные праймеры и флуоресцентно меченный зонд (MSP4-F 5′-CA-TGAGTCACGAAGTGGCT-3′ и MSP4-R 5′-GGCACACT-CACATCAATC-3′, MSP4-probe 5′-(Cy5)-AAGGGGGAGTAATGGGAGGTAGCT-3′) для амплификации и детекции фрагмента гена msp4 A. marginale длиной 177 п.н. методом ПЦР в реальном времени. Анализ амплифицированных нуклеотидных последовательностей показал, что они имеют 99-100 % идентичности с фрагментом гена msp4 у разных изолятов A. marginale. При определении аналитической чувствительности ПЦР была сконструирована плазмида pGEM -msp4 с фрагментом гена msp4 длиной 177 п.н. и получены образцы, содержащие 10 0-10 7 копий msp4. Показано, что чувствительность метода позволяет выявлять от 10 2 копий гена msp4 А. marginale в анализируемом объеме образца ДНК. Для испытания аналитической специфичности праймеров и зонда использовались образцы ДНК овец, зараженных риккетсиями A. ovis, а также ДНК коров, которые по результатам секвенирования содержали ДНК бактерий Sanguibacter keddieii, Propionibacterium acnes и Pseudomonas aeruginosa. При этом роста флуоресценции, характерного для материала от зараженных A. marginale животных, и каких-либо продуктов ПЦР при электрофоретическом разделении не наблюдали. Таким образом, специфичность метода позволяет надежно дифференцировать A. marginale и A. ovis. Разработанный способ выявления A. marginale на основе амплификации и детекции фрагмента гена msp4 с помощью ПЦР в реальном времени отличается от существующих аналогов высокой специфичностью, быстротой, а также возможностью количественной оценки бактериальной нагрузки. Метод может быть использован для оперативного дифференциального обнаружения и количественного определения А. marginale в образцах крови инфицированного крупного рогатого скота с целью подтверждения диагноза и при проведении эпидемиологического мониторинга анаплазмоза.
Ген msp4, крупный рогатый скот, диагностика, пцр в реальном времени
Короткий адрес: https://sciup.org/142134847
IDR: 142134847 | УДК: 636.2:619:579.881.31:577.21:579.083.1 | DOI: 10.15389/agrobiology.2015.6.825rus
Текст научной статьи Разработка метода выявления Anaplasma marginale с использованием ПЦР в реальном времени
Анаплазмоз крупного рогатого скота (КРС) — трансмиссивное инфекционное заболевание, вызываемое риккетсиями рода Anaplasma (отряд Riсkettsiales, семейство Anaplasmatacеa). Анаплазмоз КРС широко распространен во всем мире и приводит к значительным экономическим потерям вследствие уменьшения мясомолочной продуктивности скота, ущерба от недополучения молодняка и гибели животных. Возбудитель анаплазмоза КРС — риккетсия вида Anaplasma marginale, облигатный внутриклеточный паразит, поражающий эритроциты. Встречается также коинфекция КРС анаплазмами вида A. ovis (1). Источником возбудителя анаплазмоза служат инфицированные животные, переносчиками — около 20 видов клещей, а также кровососущие насекомые (2, 3). Кроме того, возможна механическая передача возбудителей от зараженных животных к здоровым через нестерильные инструменты при проведении зоотехнических мероприятий.
Анаплазмоз КРС, вызванный A. marginale , зафиксирован во многих тропических и субстропических странах, по всей территории США и Канады, а также в некоторых странах Европы, главным образом средиземноморских (4, 5). Это заболевание регистрируют на Украине, в Белоруссии, Молдавии, Казахстане, государствах Средней Азии и Закавказья. Согласно ветеринарной отчетности в РФ, по анаплазмозу неблагополучны субъекты Центрального, Северо-Западного и Приволжского федеральных округов (6).
В настоящее время для диагностики анаплазмоза применяют микроскопические и серологические методы, однако их чувствительность и специфичность недостаточно высоки. Результаты микроскопических исследований мазков крови ненадежны, особенно на ранних стадиях инфицирования и в случаях заболеваний, сопровождающихся тяжелой формой анемии (7, 8). Серологические методы, основанные на использовании антител к антигенам возбудителя анаплазмоза, имеют недостаточно высокую чувствительность и не позволяют дифференцировать А. marginale от других видов анаплазм (9-11). Преимущество ПЦР-диагностики заключается в высокой чувствительности и специфичности — она позволяет обнаружить возбудителя на самых ранних стадиях заболевания, в том числе в латентную фазу, и надежно дифференцировать анаплазмоз от ряда сходных по клиническим проявлениям патологий. Согласно рекомендациям Всемирной организации здравоохранения животных (OIE, the World Organization for Animal Health) ПЦР-диагностику A. marginale следует применять перед каждым перемещением животного на новое место и для подтверждения диагноза. Описаны разные методы ПЦР для детекции A. marginale (12-22), однако ни один из них не прошел полную валидацию.
Цель представленного исследования — разработка метода выявления Anaplasma marginale в крови крупного рогатого скота на основе ПЦР в реальном времени.
Методика. Для подбора праймеров использовали имеющиеся в базе данных GenBank последовательности гена msp4 разных изолятов A. marginale, а также A. centrale, A. ovis и A. phagocytophilum. Консервативные участки msp4, которые могут послужить праймерами и зондом, выявляли, пользуясь ресурсом сервера СlustalW2 , открытый доступ). Видоспецифичность праймеров и зонда оценивали, применяя алгоритм BLASTN .
Анализируемые образцы ДНК выделяли из цельной крови естественно заразившихся животных — КРС с инфекцией A. marginale , а также Sanguibacter keddieii , Propionibacterium acnes и Pseudomonas aeruginosa , и овец, инфицированных A. ovis. Для этого использовали набор Sorb-M («Синтол», Россия) согласно рекомендациям производителя.
Реакцию амплификации проводили в режиме реального времени в смеси, содержащей 10 мкл реактива для ПЦР LightCycler® 480 Probes Master («Roche», Швейцария); праймер MSP4-F 5 ′ -CATGAGTCACGA-AGTGGCT-3 ′ (0,5 мкМ), праймер MSP4-R 5 ′ -GGCACACTCACATCA-826
ATC-3 ′ (0,5 мкМ); флуоресцентно меченный зонд MSP4-probe 5 ′ -(Cy5)-AAGGGGGAGTAATGGGAGGTAGCT-3 ′ (0,1 мкМ); 3 мкл ДНК; общий объем реакционной смеси — 20 мкл. ПЦР выполняли на приборе LightCycler 96 («Roche», Швейцария) при следующих условиях: начальная денатурация в течение 2 мин при 95 ° С; 45 циклов — 15 с при 95 ° С, 15 с при 58 ° С, 15 с при 72 ° С. Сигнал флуореcценции снимали по каналу Cy5. Результаты ПЦР оценивали также методом электрофореза в 2 % агарозном геле.
Полученный в ПЦР фрагмент гена msp4 длиной 177 п.н. очищали с помощью набора GeneJET PCR Purification Kit («Life Technologies», США), лигировали в вектор pGEM-T («Promega», США) и клонировали в клетках Escherichia coli DH5. Для выявления колоний трансформантов, содержащих плазмиду pGEM- msp4 , проводили ПЦР с использованием пары стандартных праймеров для секвенирования M13 («Сибэнзим», Россия) с последующим анализом продуктов амплификации методом электрофореза в 2 % агарозном геле.
Целевые колонии инкубировали в течение ночи при 37 ° С в 2 мл жидкой среды LB, содержащей ампициллин в концентрации 100 мкг/мл. Для очистки плазмидной ДНК использовали набор GeneJET Miniprep Kit («Thermo Fisher Scientific», США). Концентрацию плазмидной ДНК определяли с помощью набора PicoGreen® dsDNA Assay Kit («Thermo Fisher Scientific», США) на флуориметре QuantiFluor-ST («Promega», США). Секвенирование полученных плазмид pGEM- msp4 проводили методом Сэнгера с использованием набора ABI Prism Big Dye Terminator 3.1 Cycle Sequencing Kit («Applied Biosystems», США) и генетического анализатора Applied Biosystems 3130 («Life Technologies», США). Для определения аналитической чувствительности ПЦР была выполнена серия 10-кратных разведений плазмиды pGEM -msp4 и получены образцы, содержащие 100-107 копий гена msp4 . Определение аналитической чувствительности ПЦР проводилось в трех повторностях.
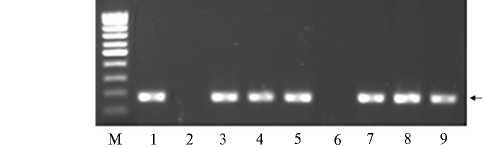
Рис. 1. Электрофоретическое разделение ДНК, полученной в результате ПЦР с использованием оригинальных праймеров (MSP4-F и MSP4-R) и ДНК, выделенной из крови инфицированных (1, 3-5, 7-9) и не инфицированных Ana-plasma marginale (2, 6) коров: М — маркер размера фрагментов ДНК (100-1000 п.н., «Диа-лат Лтд.», Россия). Стрелкой отмечен фрагмент размером 177 п.н.
Результаты. В представленном исследовании были разработаны праймеры и зонд для амплификации и детекции фрагмента гена msp4 (major surface protein 4) А. marginale методом ПЦР в реальном времени. Msp4 — имму-нодоминантный белок наружной мембраны всех известных на сегодняшний день риккетсий рода Ana-plasma (5, 23). Согласно результатам полногеномного секвенирования, у А. marginale msp4 представлен одной копией (24). Праймеры на основе гена msp4 для филогенетического анализа А. marginale ранее были предложены J. de la Fuente с соавт. (13), однако они не видоспецифичны для этой анаплазмы, так как имеют 100 % идентичность с соответствующими участками гена msp4 анаплазмы A. ovis, вследствие чего их нельзя использовать для дифференцирования двух этих патогенов. Также были предложены праймеры на основе msp4 для дифференциального выявления А. marginale и A. ovis методом классической ПЦР с идентификацией продуктов амплификации посредством электрофореза в агарозном геле (17). Преимущество метода ПЦР в реальном времени перед классической
ПЦР заключается в том, что регистрация накопления ДНК происходит непосредственно в процессе ПЦР, то есть детекция результатов как дополнительный этап анализа отсутствует. Это значительно сокращает время исследования, а сочетание праймеров и видоспецифичного флуоресцентно меченного зонда повышает надежность правильной идентификации патогена.
Подобранные праймеры MSP4-F и MSP4-R были использованы для проведения ПЦР, в которой матрицей служила ДНК коров, инфицированных A. marginale , что подтвердили результаты проведенного нами ранее секвенирования фрагментов генома КРС (25), а также ПЦР с праймерами AmargMSP4Fw 5 ′ -CTGAAGGGGGAGTAATGGG-3 ′ и AmargMSP4Rev 5 ′ -GGTAATAGCTGCCAGAGATTCC-3 ′ к msp4 у A. marginale , предложенными A. Torina с соавт. (17). В результате ПЦР с разработанными нами праймерами MSP4-F и MSP4-R (рис. 1) были получены и секвенированы фрагменты ДНК длиной 177 п.н.
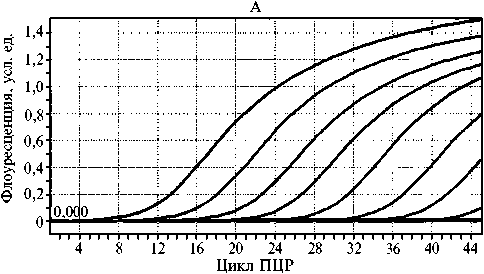
Рис. 2. Кривые изменения флуоресценции при ПЦР в реальном времени для последовательных 10-кратных разведений плазмиды pGEM- msp4 (А) и оценка порога чувствительности (зависимость между необходимым числом циклов ПЦР и исходным числом копий гена msp4 в реакционной смеси) (Б) . LightCycler 96 («Roche», Швейцария; сигнал флуореcценции снимали по каналу Cy5).
были использованы для ПЦР в реальном
Анализ нуклеотидных последовательностей ампликонов показал, что они имеют 99-100 % идентичности с фрагментом гена msp4 у разных изо-лятов A. marginale. Эти же праймеры MSP4-F и MSP4-R и зонд MSP4-pro- be
времени. Во всех образцах
ДНК инфицированных коров наблюдалось экспоненциальное нарастание флуоресценции.
Для испытания специфичности праймеров MSP4-F и MSP4-R и зонда MSP4-probe использовались образцы ДНК овец, зараженных риккетсиями A. ovis , что было установлено в результате ПЦР с праймерами AovisMSP4Fw 5 ′ -TGAAGGGAGCGGGGTCATGGG-3 ′ и AovisMSP4Rev
5 ′ -GAGTAATTGCAGCCAGGGACTCT-3 ′ к гену msp4 A . ovis (17), а также образцы ДНК коров, которые по результатам секвенирования (25) содержали ДНК бактерий Sanguibacter keddieii , Propionibacterium acnes и Pseudomonas aeruginosa. При ПЦР-анализе этих образцов ДНК в режиме реального времени не наблюдали роста флуоресценции, характерного для материала от зараженных A. marginale животных, а при электрофоретическом разделении какие-либо продукты ПЦР отсутствовали, что свидетельствует о видоспецифичности праймеров и зонда.
При определении аналитической чувствительности ПЦР была сконструирована плазмида pGEM-msp4 с фрагментом гена msp4 длиной 177 п.н. (стандарт) и в результате серии последовательных 10-кратных разбавлений стандарта получены образцы, содержащие 100-107 копий фрагмента гена msp4. Результаты ПЦР с этими образцами стандартов в качестве матрицы и разработанными нами праймерами и зондом показали, что чувствительность метода позволяет выявлять в исследуемом объеме образца 102 копий гена msp4 и более (рис. 2), то есть, учитывая однокопийность этого гена (24), от 100 молекул ДНК A. marginale.
Следует отметить, что разработанный нами метод выявления A. marginale отличается от существующих аналогов (13, 17) высокой специфичностью, быстротой анализа, а также возможностью количественной оценки бактериальной нагрузки.
Таким образом, нами разработана пара праймеров и зонд к гену msp4 для дифференциального выявления риккетсий вида Anaplasma marginale в крови крупного рогатого скота методом ПЦР в реальном времени. Чувствительность метода позволяет выявлять от 102 копий гена msp4 А. marginale в анализируемом объеме образца ДНК, а специфичность достаточна для того, чтобы надежно дифференцировать A . marginale и A . ovis , то есть предложенный метод (в отличие от описанных в литературе) высокоспецифичен. Более того, он дает возможность количественно оценивать бактериальную нагрузку, при этом процедура требует меньшего времени. Поэтому его можно использовать в случае необходимости оперативного дифференциального обнаружения и количественного определения А. marginale в образцах крови инфицированного крупного рогатого скота с целью подтверждения диагноза и при проведении эпидемиологического мониторинга анаплазмоза.
Список литературы Разработка метода выявления Anaplasma marginale с использованием ПЦР в реальном времени
- Kocan K.M., de la Fuente J., Blouin E.F., Coetzee J.F., Ewing S.A. The natural history of Anaplasma marginale. Vet. Parasitol., 2010, 167: 95-107 ( ) DOI: 10.1016/j.vetpar.2009.09.012
- Kocan K.M., de la Fuente J., Blouin E.F., Garcia-Garcia J.C. Anaplasma marginale (Rickettsiales: Anaplasmataceae): recent advances in defining host-pathogen adaptations of a tick-borne rickettsia. Parasitology, 2004, 129: 285-300 ( ) DOI: 10.1017/S0031182003004700
- Scoles G.A., Broce A.B., Lysyk T.J., Palmer G.H. Relative efficiency of biological transmission of Anaplasma marginale (Rickettsiales: Anaplasmataceae) by Dermacentor andersoni (Acari: Ixodidae) compared with mechanical transmission by Stomoxys calcitrans (Diptera: Muscidae). J. Med. Entomol., 2005, 42: 668-675 ( ) DOI: 10.1093/jmedent/42.4.668
- Guglielmone A.A. Epidemiology of babesiosis and anaplasmosis in South and Central America. Vet. Parasitol., 1995, 57: 109-119.
- de la Fuente J., Lew A., Lutz H., Meli M.L., Hofmann-Lehmann R., Shkap V., Molad T. Genetic diversity of Anaplasma species major surface proteins and implications for anaplasmosis serodiagnosis and vaccine development. Anim. Health Res., 2005, 6: 75-89 ( ) DOI: 10.1079/AHR2005104
- Гулюкин М.И., Заблоцкий В.Т., Белименко В.В. Мониторинг эпизоотической ситуации по протозойным кровепаразитарным болезням домашних животных в Российской Федерации (2007-2012). Российский ветеринарный журнал СХЖ, 2013, 2: 36-40.
- Noaman V., Shayan P. Comparison of Microscopy and PCR-RFLP for detection of Anaplasma marginale in carrier cattle. Iran. J. Microbiol., 2010, 2(2): 89-94.
- Potgieter F.T., Stoltsz W.H. Anaplasmosis. In: Infectious diseases of livestock with special reference to Southern Africa/J.A.W. Coetzer, G.R. Thompson, R.C. Tustin (eds.). Oxford University Press, Cape Town, South Africa, 1994.
- Dreher U.M., Fuente J., Hofmann-Lehmann R., Meli M.L., Pusterla N., Kocan K.M., Woldehiwet Z., Braun U., Regula G., Staerk K.D., Lutz H. Serologic crossreactivity between Anaplasma marginale and Anaplasma phagocytophilum. Clin. Diagn. Lab. Immunol., 2005, 12: 1177-1183 ( ) DOI: 10.1128/CDLI.12.10.1177-1183.2005
- Al-Adhami B., Scandrett W.B., Lovanov V.A., Gajadhar A.A. Serological cross reactivity between Anaplasma marginale and Ehrlichia species in naturally and experimentally infected cattle. J. Vet. Diagn. Invest., 2011, 23: 1181-1188 ( ) DOI: 10.1177/1040638711425593
- Strik N.I., Alleman A.R., Barbet A.F., Sorenson H.L., Wamsley H.L., Gaschen F.P., Luckschander N., Wong S., Chu F., Foley J.E., Bjoersdorff A., Stuen S., Knowles D.P. Characterization of Anaplasma phagocytophilum major surface protein 5 and the extent of its cross-reactivity with A. marginale. Clin. Vaccine Immunol., 2007, 14: 262-268 ( ) DOI: 10.1128/CVI.00320-06
- Torioni de Echaide S., Knowles D.P., McGuire T., Palmer G.H., Suarez C.E., McElwain T.F. Detection of cattle naturally infected with Anaplasma marginale in a region of endemicity by nested PCR and a competitive Enzyme-Linked Immunosorbent Assay using recombinant major surface protein 5. J. Clin. Microbiol., 1998, 36: 777-782.
- de la Fuente J., Van Den Bussche R.A., Kocan K.M. Molecular phylogeny and biogeography of North American isolates of Anaplasma marginale (Rickettsiaceae: Ehrlichieae). Vet. Parasitol., 2001, 97: 65-76 ( ) DOI: 10.1016/S0304-4017(01)00378-8
- Carelli G., Decaro N., Lorusso A., Elia G., Lorusso E., Mari V., Ceci L., Buonavoglia C. Detection and quantification of Anaplasma marginale DNA in blood samples of cattle by real-time PCR. Vet. Microbiol., 2007, 124: 107-114 ( ) DOI: 10.1016/j.vetmic.2007.03.022
- Fyumagwa R.D., Simmler P., Meli M.L., Hoare R., Hofmann-Lehmann R., Lutz H. Prevalence of Anaplasma marginale in different tick species from Ngorongoro Crater, Tanzania. Vet. Parasitol., 2009, 161(1-2): 154-157 ( ) DOI: 10.1016/j.vetpar.2008.12.018
- Picoloto G., Lima R.F., Olegário L.A.O., Carvalho C.M.E., Lacerda A.C.R., Tomás W.M., Borges P.A.L., Pellegrin A.O., Madruga C.R. Real-time polymerase chain reaction to diagnose Anaplasma marginale in cattle and deer (Ozotoceros bezoarticus leucogaster) of the Brazilian Pantanal. Brazilian Journal of Veterinary Parasitology, 2010, 19(3): 186-188 ( ) DOI: 10.1590/S1984-29612010000300012
- Torina A., Agnone A., Blanda V., Alongi A., D'Agostino R., Caracappa S., Marino A.M., Di Marco V., de la Fuente J. Development and validation of two PCR tests for the detection of and differentiation between Anaplasma ovis and Anaplasma marginale. Ticks and Tick-borne Diseases, 2012, 3(5-6): 283-287 ( ) DOI: 10.1016/j.ttbdis.2012.10.033
- Reinbold J.B., Coetzee J.F., Sirigireddy K.R., Ganta R.R. Detection of Anaplasma marginale and A. phagocytophilum in bovine peripheral blood samples by duplex real-time reverse transcriptase PCR assay. J. Clin. Microbiol., 2010, 48(7): 2424-2432 ( ) DOI: 10.1128/JCM.02405-09
- Molad T., Mazuz M.L., Fleiderovitz L., Fish L., Savitsky I., Krigel Y., Leibovitz B., Molloy J., Jongejan F., Shkap V. Molecular and serological detection of A. centrale-and A. marginale-infected cattle grazing within an endemic area. Vet. Microbiol., 2006, 113: 55-62 ( ) DOI: 10.1016/j.vetmic.2005.10.026
- Bilgiç H.B., Karagenç T., Simuunza M., Shiels B., Tait A., Eren H., Weir W. Development of multiplex PCR assay for simultaneous detection of Theileria annulata, Babesia bovis and Anaplasma marginale incattle. Exp. Parasitol., 2013, 133(2): 222-229 ( ) DOI: 10.1016/j.exppara.2012.11.005
- Lew A.E., Bock R.E., Minchin C.M., Masaka S. A msp1alpha polymerase chain reaction assay for specific detection and differentiation of Anaplasma marginale isolates. Vet. Microbiol., 2002, 86: 325-333 ( ) DOI: 10.1016/S0378-1135(02)00017-2
- Ybañez A.P., Sivakumar T., Ybañez R.H.D., Ratilla J.C., Perez Z.O., Gabotero S.R., Hakimi H., Kawazu S., Matsumoto K., Yokoyama N., Inokuma H. First molecular characterization of Anaplasma marginale in cattle and Rhipicephalus (Boophilus) microplus ticks in Cebu, Philippines. J. Vet. Med. Sci., 2013, 75: 27-36 ( ) DOI: 10.1292/jvms.12-0268
- Vidotto M.C., McGuire T.C., McElwain T.F., Palmer G.H., Knowles D.P. Jr. Intermolecular relationships of major surface proteins of Anaplasma marginale. Infect. Immunol., 1994, 62(7): 2940-2946.
- Brayton K.A., Kappmeyer L.S., Herndon D.R., Dark M.J., Tibbals D.L., Palmer G.H., McGuire T.C., Knowles D.P. Jr. Complete genome sequencing of Ana-plasma marginale reveals that the surface is skewed to two superfamilies of outer membrane proteins. PNAS USA, 2005, 102(3): 844-849 ( ) DOI: 10.1073/pnas.0406656102
- Глазко В.И., Косовский Г.Ю., Ковальчук С.Н., Архипов А.В., Петрова И.О., Дедович Г.О., Глазко Т.Т. Инвертированный повтор микросателлита (AGC)6G фланкирует районы ДНК с участками гомологии к ретротранспозонам в геноме крупного рогатого скота. Инновационные технологии в медицине, 2014, 2(03): 63-79.


