Разработка методов длительного хранения культур Corynebacterium pseudotuberculosis
Автор: Заболотных М.В., Якушкин И.В.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринарные науки
Статья в выпуске: 4 (24), 2016 года.
Бесплатный доступ
Казеозный лимфаденит овец широко распространен в хозяйствах Западной Сибири. Поражается до 24,0% поголовья мериносовых и кроссбредных овец [1]. В зонах сильного и значительного поражения возбудитель чаще циркулирует в R- и I-формах, а в зонах слабого и умеренного преобладают S-формы. Возбудитель казеозного лимфаденита (псевдотуберкулеза овец) - С. pseudotuberculosis - грамположительная, полиморфная, неподвижная, аэробная бактерия размером 0,5-3,1 мкм в длину и 0,5-0,9 мкм в ширину, не образующая спор и капсул [2; 3]. Коринебактерии сохраняют свою жизнеспособность при лиофильном высушивании в течение 15 лет, а свои первоначальные свойства в течение 12 лет. На скорость отмирания клеток коринебактерий как в процессе лиофилизации, так и при хранении оказывают влияние следующие факторы: высокий вакуум (30,7%), низкая температура (13,9%), защитная среда (10,8%), остаточная влажность (10,6%) и сроки хранения (28,6%) [2; 4]. Испытанный способ сохранения штаммов коринебактерий применяется в изготовлении специфических биологических препаратов для профилактики и борьбы с казеозным лимфаденитом овец, а высушенные штаммы, депонированные в ВГНКИ ветеринарных препаратов (г. Москва) могут служить эталоном для научно-исследовательских и учебных целей. Постоянные посевы и пересевы культур для изучения их свойств и поддержания биологической активности приводили к гибели некоторых штаммов и изменению их фенотипических свойств. Хранение культур в 0,25%-ном полужидком агаре под слоем вазелинового масла при температуре 4°С оказался ненадежным, поскольку не позволял сохранять культуры в R-форме более 12 месяцев. В то время, как S-формы могли храниться и более длительное время (19 месяцев). Проведенные исследования позволили выбрать оптимальные режимы лиофилизации, подобрать криозащитные среды и сохранить лиофильно-высушенные культуры в течение 20 лет (срок наблюдения), а также депонировать C. рseudotuberculosis в ВГНКИ ветпрепаратов (г. Москва). При хранении (12 лет) два штамма R-формы потеряли гликолитическую и каталазную активность и приобрели фенотипические признаки S-формы.
Казеозный лимфаденит, коринебактерия, овцы, лиофилизация
Короткий адрес: https://sciup.org/142199276
IDR: 142199276 | УДК: 619:576.8
Текст научной статьи Разработка методов длительного хранения культур Corynebacterium pseudotuberculosis
Постоянные посевы и пересевы культур для изучения их свойств и поддержания биологической активности приводят к гибели некоторых штаммов и изменению их фенотипических свойств. Традиционный способ хранения культур в 0,25%-ном полужидком агаре под слоем вазелинового масла при температуре 4 ° С оказался ненадежным, поскольку не позволял сохранять культуры в R-форме более 12 месяцев. В то время, как S-формы могут храниться и более длительное время (19 месяцев). С учетом этого факта целью исследования стала разработка метода лиофильного высушивания выделенных культур C. рseudotuberculosis с подбором оптимальных режимов лиофилизации, криозащитных сред и установлением срока хранения лиофильно-высушенных культур.
Объекты и методы
Для лиофилизации были подобраны штаммы 74, 70 R-формы, 50 S-формы и 37 I-формы C. рseudotuberculosis. Суспензии культур разливали по 2 мл во флаконы емкостью 10 мл, предварительно определяли колониеобразующие единицы (КОЕ/мл), затем замораживали до температуры -45°С, не допуская снижения ее более 20°С в минуту. Следующим этапом этого исследования было определение жизнеспособности ко-ринебактерий при воздействии различных факторов в процессе лиофилизации. Для
разрешения этой задачи замороженный материал помещали в сублимационную камеру ТГ-50М и высушивали в течение 30 ч при температуре сублиматора 22–26°С, конденсатора –45…–60°С и при вакууме 100 мкм с последующим контролем жизнеспособности. После проведения лиофилизации все 16 серий были исследованы по органолептическим показателям, на растворимость, остаточную влажность, колониеобразующую способность.
Результаты исследований
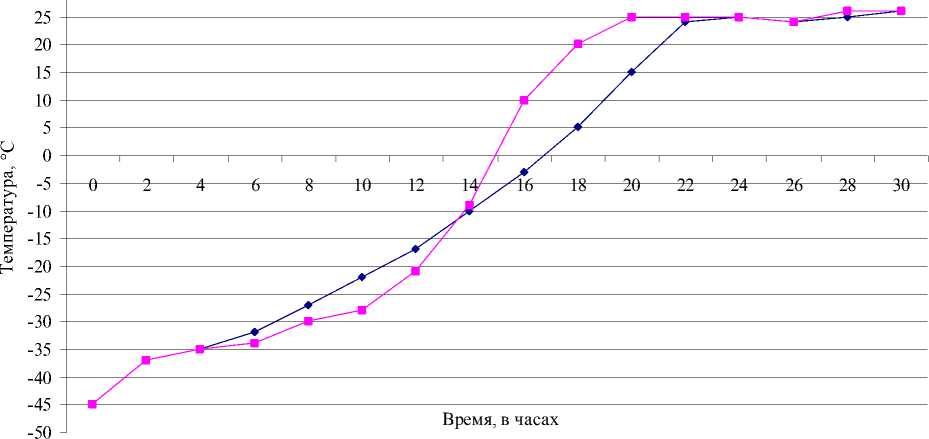
Постоянная минусовая температура в биопродукте установилась через 22 мин и достигла -45°C к 64-й минуте замораживания (рис. 1).
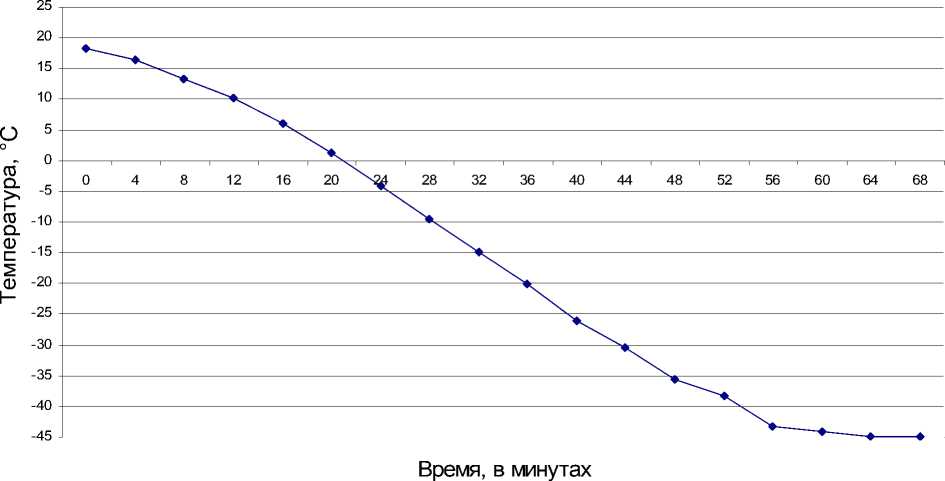
Рис. 1. Динамика температурного режима замораживания коринебактерий
Для контроля жизнеспособности культур во время замораживания отбирали по 3 флакона из каждой серии. В результате было установлено, что испытуемые корине-бактерии в процессе замораживания выживали в 86,1% случаев. Последующее хранение при температуре –40°С в течение 12 часов приводило к незначительному отмиранию клеток, которое составляло 9,5%. Штаммы 74, 70 R-форм лучше переносили замораживание и последующее хранение. Штаммы 50 S-формы и 37 I-формы были менее устойчивы к воздействию холода. Так, достоверного уменьшения КОЕ у штамма 74, 70 R-формы не наблюдали. Штамм 37 I-формы, замороженный в сорбитно-желатиновой среде, уменьшил КОЕ на 78,9 (28,3%) (р < 0,001), штамм 50 S-формы, замороженный в молочно-глюкозной среде на 57,1 млн/мл (15,4%) (р < 0,05). Аналогичное снижение КОЕ произошло у этого же штамма на сывороточно-глюкозной среде на 40,7 млн/мл (9,3%) (р < 0,05). При хранении всех испытуемых штаммов коринебакте-рий при температуре –40°С в течение 12 часов КОЕ снижались. Достоверное уменьшение КОЕ штамма 50 S-формы проходило во всех криозащитных средах. Штамм 37 I-формы имел меньше КОЕ в трех защитных средах: в сывороточно-желатиновой на 107,1 (р < 0,001), молочно-глюкозной на 56,7 (р < 0,05) и сывороточно-глюкозной на 61,7 млн/мл (р < 0,05). Таким образом, полученные данные позволяют заключить, что возбудитель казеозного лимфаденита, помещенный в защитные среды, выживает при
быстром замораживании (1 час) до температуры –45°С и последующем хранении его при температуре –40°С в течение 12 часов. Кроме того, замечено, что отмирание клеток е
жима сушки опытных серий в защитных средах изображены графически (рис. 2, 3).
ЖСС МГС
Рис. 2. Динамика температурного режима при лиофилизации коринебактерий в желатино-сахарозной (ЖСС) и молочно-глюкозной (МГС) защитных средах
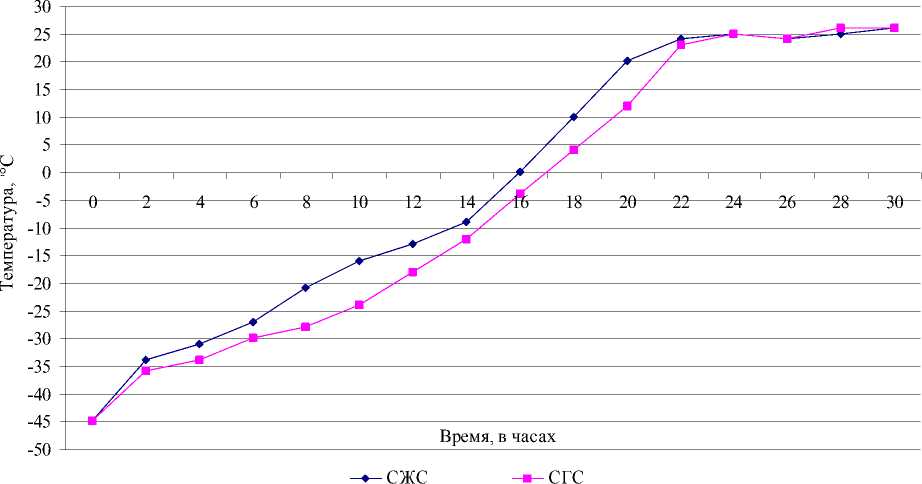
Рис. 3. Динамика температурного режима при лиофилизации коринебактерий в сорбитно-желатиновой (СЖС) и сывороточно-глюкозной (СГС) защитных средах
По результатам лиофилизации культур при выбранном режиме в различных крио-защитных средах видно, что высушивание материала в молочно-глюкозной среде происходило быстрее, чем в желатино-сахарозной, сорбитно-желатиновой и сывороточноглюкозной (рис. 2). После 22 часов сублимационного высушивания температура установилась 25°С, что указывало на готовность этих серий. Остальные серии были высушены через 24 часа. При достижении одинаковой температуры (24–26°С) во всех сериях их досушивали в течение 6 часов, закрывали пробками и этикировали. После проведения лиофилизации все 16 серий были исследованы по органолептическим показателям, на растворимость, остаточную влажность, колониеобразующую способность. Результаты этих исследований отражены в табл. 1.
Таблица 1
Некоторые качественные показатели высушенных серотипов, n = 3
|
№ штамма |
Защитная среда |
До лиофилизации, КОЕ млн/мл |
После лиофилицации, КОЕ млн/мл |
P < |
Остаточная влажность, % |
P < |
Растворимость, с |
|
37 I |
СЖС* |
278,7 ± 2,6 |
165,3 ± 29,5 |
0,05 |
0,55 ± 0,12 |
– |
48 ± 11,2 |
|
МГС |
251,7 ± 13,2 |
152,7 ± 5,2 |
0,01 |
4,73 ± 0,41 |
0,001 |
66 ± 8,5 |
|
|
ЖСС |
242,0 ± 23,1 |
138,3 ± 45,2 |
0,1 |
2,95 ± 0,36 |
0,01 |
45 ± 6,4 |
|
|
СГС |
269,7 ± 20,5 |
201,3 ± 20,2 |
0,1 |
4,18 ± 0,24 |
0,001 |
73 ± 14,2 |
|
|
50 S |
СЖС |
368,3 ± 20,7 |
217,0 ± 9,1 |
0,01 |
0,55 ± 0,12 |
– |
48 ± 11,2 |
|
МГС |
370,7 ± 24,6 |
257,7 ± 16,9 |
0,05 |
4,73 ± 0,41 |
0,001 |
66 ± 8,5 |
|
|
ЖСС |
416,0 ± 29,5 |
314,0 ± 23,1 |
– |
2,95 ± 0,36 |
0,01 |
45 ± 6,4 |
|
|
СГС |
438,3 ± 13,3 |
342,7 ± 8,5 |
0,01 |
4,18 ± 0,24 |
0,001 |
73 ± 14,2 |
|
|
70 R |
СЖС |
367,0 ± 48,0 |
255,0 ± 2,6 |
– |
0,55 ± 0,12 |
– |
48 ± 11,2 |
|
МГС |
337,7 ± 62,3 |
217,7 ± 8,4 |
– |
4,73 ± 0,41 |
0,001 |
66 ± 8,5 |
|
|
ЖСС |
363,3 ± 32,3 |
251,7 ± 23,5 |
0,05 |
2,95 ± 0,36 |
0,01 |
45 ± 6,4 |
|
|
СГС |
366,0 ± 51,4 |
261,0 ± 6,7 |
– |
4,18 ± 0,24 |
0,001 |
73 ± 14,2 |
|
|
74 R |
СЖС |
297,0 ± 32,1 |
195,3 ± 14,7 |
0,05 |
0,55 ± 0,12 |
– |
48 ± 11,2 |
|
МГС |
323,3 ± 22,2 |
238,0 ± 18,9 |
0,05 |
4,73 ± 0,41 |
0,001 |
66 ± 8,5 |
|
|
ЖСС |
269,7 ± 44,3 |
224,3 ± 4,7 |
– |
2,95 ± 0,36 |
0,01 |
45 ± 6,4 |
|
|
СГС |
293,0 ± 47,6 |
232,3 ± 10,7 |
– |
4,18 ± 0,24 |
0,001 |
73 ± 14,2 |
* СЖС – сорбитно-желатиновая среда; МГС – молочно-глюкозная среда; ЖСС – желатино-саха-розная среда; СГС – сывороточно-глюкозная среда.
Серии с сывороточно-глюкозной средой имели характерный желтоватый цвет, хорошо сформированную плотную по структуре таблетку. Растворимость таблеток составляла от 45 ± 6,4 до 7,3 ± 14,2 секунд и зависела от защитной среды. Очень быстро растворялась таблетка с желатино-сахарозной и сорбитно-желатиновой защитными средами, с молочно-глюкозной и сывороточно-глюкозной – медленнее. Колониеобразующая способность коринебактерий после лиофилизации составила 251,3 ± 46,3 млн/мл, что соответствует 69,3% выживших бактерий в процессе сублимации.
В высушенных при одинаковом режиме сублимации сериях остаточная влажность препарата была различной и зависела от защитной среды. Так, для сорбитно-желатиновой среды она составила 0,55%; молочно-глюкозной – 4,73%; желатино-сахарозной – 2,95% и сывороточно-глюкозной – 4,18% (табл. 1).
Результаты контроля жизнеспособности лиофильно-высушенных коринебактерий показали, что на протяжении 15 лет (срок наблюдения) все штаммы сохраняли способность роста на питательных средах. По мере увеличения сроков хранения, количество колониеобразующих единиц (КОЕ) уменьшалось (рис. 4).
%, КОЕ
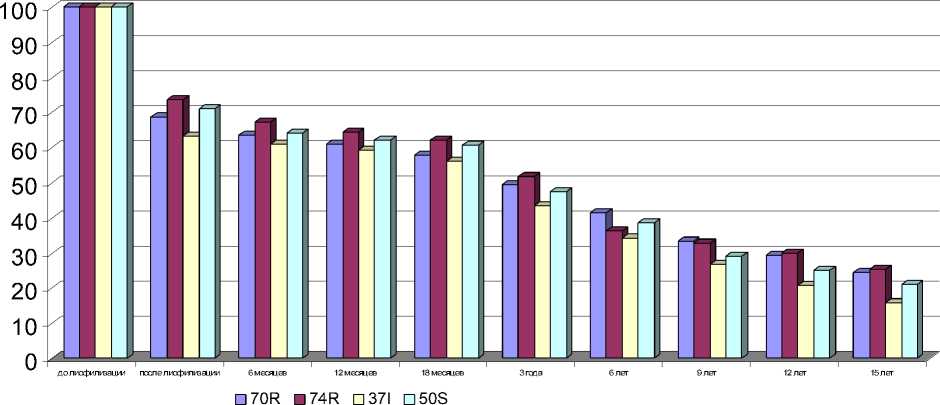
Рис. 4. Контроль жизнеспособности лиофильно-высушенных штаммов коринебактерий в течение 15 лет
Анализ процента гибели клеток показал, что лиофильное высушивание в высоком вакууме в течение 36 часов приводит к 26,5-36,9%-ному отмиранию коринебактерий. При этом более устойчивым оказался штамм 74 R-формы. При хранении лиофильно-высушенных штаммов при 4-6°С и 18-20°С до 18 месяцев было незначительное уменьшение числа жизнеспособных коринебактерий. В период от 18 месяцев до 3 лет происходило быстрое отмирание числа жизнеспособных клеток от 8,4 до 12,8% (р < 0,01-0,001). При последующем хранении, в период от 3 до 6 лет, отмирание числа клеток было на прежнем уровне и составляло от 8,1 до 15,3%. При этом наибольшее отмирание клеток было у штамма 74 R-формы. В последующие сроки хранения жизнеспособность коринебактерий относительно их количества до лиофилизации медленно уменьшалась с 6 до 9 лет (3,4-9,4%); с 9 до 12 лет (4,1-12,5%); с 12 до 15 лет (4,0-5,0%) (табл. 2).
По окончании срока наблюдения (15 лет) у штаммов 74, 70 R-формы, 50 S-формы и 37 I-формы оставалось жизнеспособных клеток соответственно 15,8; 21,0; 24,3 и 25,4%. При температуре хранения 4-6°С коринебактерии сохранялись лучше по сравнению с таковыми, хранившимися при комнатных температурах (18–20°С) (табл. 3, 4) на протяжении всего срока наблюдения. Такая закономерность наблюдалась у всех высушенных серий и не зависела от состава защитной среды.
Штаммы коринебактерий, высушенные в одинаковой среде, но хранившиеся длительное время (15 лет) при разных температурных условиях , имели существенные и достоверные (р < 0,05) отличия в КОЕ (табл. 4). Так, у штамма 37 I-формы, высушенного в сывороточно-желатиновой среде, при 4-6°С на конец наблюдения оставалось 13,0 ± 3,1 (4,6%) живых микробных тел, а при температуре хранения 18-20°С
10,0 ± 2,9 млн/мл (3,5%). Этот же штамм, высушенный в желатино-сахарозной среде, имел 61,0 ± 6,9 (25,2%) жизнеспособных клеток при температуре хранения 4–6°С и 40,5 ± 6,3 млн/мл (6,7%) при 18–20°С.
Таблица 2
Контроль жизнеспособности культур C. pseudotuberculosis (4–6°С), КОЕ млн/мл, n = 3
|
Штамм |
Защитная среда |
До лиофилизации |
3 года хранения |
P < |
6 лет хранения |
P < |
9 лет хранения |
P < |
|
37 I |
СЖС |
278,7 ± 2,6 |
90,7 ± 5,9 |
0,001 |
72,0 ± 10,1 |
0,001 |
38,0 ± 6,9 |
0,001 |
|
МГС |
251,7 ± 13,2 |
103,5 ± 4,9 |
0,001 |
87,0 ± 7,1 |
0,001 |
79,5 ± 4,5 |
0,001 |
|
|
ЖСС |
242,0 ± 23,1 |
134,0 ± 9,5 |
0,01 |
111,0 ± 7,7 |
0,01 |
94,0 ± 5,8 |
0,001 |
|
|
СГС |
269,7 ± 20,5 |
151,5 ± 20,9 |
0,01 |
114,0 ± 7,3 |
0,001 |
89,5 ± 9,7 |
0,001 |
|
|
50 S |
СЖС |
368,3 ± 20,7 |
146,0 ± 7,8 |
0,001 |
107,5 ± 6,2 |
0,001 |
89,5 ± 5,1 |
0,001 |
|
МГС |
370,7 ± 14,6 |
168,0 ± 14,4 |
0,001 |
133,0 ± 8,6 |
0,001 |
93 ± 5,9 |
0,001 |
|
|
ЖСС |
416,0 ± 29,5 |
240,5 ± 20,8 |
0,01 |
208,5 ± 19,1 |
0,01 |
166,5 ± 14,9 |
0,01 |
|
|
СГС |
438,3 ± 13,3 |
247,0 ± 6,5 |
0,001 |
206,5 ± 12,3 |
0,001 |
150,0 ± 10,2 |
0,001 |
|
|
70 R |
СЖС |
367,7 ± 48,0 |
164,5 ± 4,6 |
0,01 |
125,0 ± 12,6 |
0,01 |
116,5 ± 7,8 |
0,01 |
|
МГС |
337,7 ± 62,3 |
168,0 ± 8,0 |
0,05 |
148,5 ± 10,8 |
0,05 |
121,0 ± 7,3 |
0,05 |
|
|
ЖСС |
363,3 ± 32,3 |
172,0 ± 2,8 |
0,01 |
141,5 ± 10,6 |
0,001 |
96,5 ± 8,4 |
0,001 |
|
|
СГС |
366,0 ± 51,4 |
224,0 ± 17,7 |
0,05 |
208,0 ± 15,3 |
0,05 |
188,5 ± 21,5 |
0,01 |
|
|
74 R |
СЖС |
297,0 ± 32,1 |
136,0 ± 8,9 |
0,001 |
112,0 ± 6,3 |
0,001 |
93,0 ± 7,7 |
0,001 |
|
МГС |
323,3 ± 22,2 |
167,0 ± 5,9 |
0,001 |
126,0 ± 5,7 |
0,001 |
113,5 ± 8,1 |
0,001 |
|
|
ЖСС |
296,7 ± 44,3 |
164,5 ± 6,9 |
0,1 |
136,0 ± 10,9 |
0,05 |
104,0 ± 9,4 |
0,05 |
|
|
СГС |
293,0 ± 47,6 |
163,0 ± 4,5 |
0,05 |
121,5 ± 10,5 |
0,05 |
94,0 ± 7,2 |
0,01 |
Таблица 3
Влияние лиофилизации и продолжительности хранения на выживаемость культур C. pseudotuberculosis (при 18–20°С), КОЕ млн/мл, n = 3
|
Штамм |
Защитная среда |
До лиофилизации |
После лиофилизации |
P < |
Через 6 месяцев |
P < |
Через 12 месяцев |
P< |
Через 18 месяцев |
P < |
|
37 I |
СЖС |
278,7 ± 2,6 |
165,3 ± 29,5 |
0,05 |
144,0 ± 16,6 |
0,01 |
144,7 ± 5,7 |
0,001 |
102,0 ± 1,7 |
0,001 |
|
МГС |
251,7 ± 13,2 |
152,7 ± 5,2 |
0,01 |
135,0 ± 10,8 |
0,01 |
125,3 ± 3,2 |
0,001 |
121,3 ± 10,4 |
0,01 |
|
|
ЖСС |
242,0 ± 23,1 |
138,3 ± 45,2 |
0,05 |
157,0 ± 7,2 |
0,05 |
154,7 ± 7,1 |
0,05 |
152,7 ± 5,8 |
0,05 |
|
|
СГС |
269,7 ± 20,5 |
201,3 ± 20,2 |
– |
184,7 ± 12,5 |
0,05 |
178,0 ± 11,9 |
0,05 |
175,7 ± 9,6 |
0,05 |
|
|
50 S |
СЖС |
368,3 ± 20,7 |
217,0 ± 9,1 |
0,01 |
186,0 ± 11,1 |
0,01 |
176,3 ± 12,9 |
0,01 |
166,0 ± 5,6 |
0,001 |
|
МГС |
370,7 ± 24,6 |
257,7 ± 16,9 |
0,01 |
204,7 ± 21,4 |
0,01 |
196,6 ± 8,1 |
0,01 |
181,7 ± 5,2 |
0,001 |
|
|
ЖСС |
416,0 ± 29,5 |
314,0 ± 23,1 |
0,05 |
288,7 ± 17,1 |
0,05 |
276,0 ± 14,0 |
0,05 |
270,0 ± 11,7 |
0,01 |
|
|
СГС |
438,3 ± 13,3 |
342,7 ± 8,5 |
0,01 |
312,7 ± 7,2 |
0,01 |
306,3 ± 12,7 |
0,01 |
303,0 ± 7,5 |
0,001 |
|
|
70 R |
СЖС |
367,7 ± 48,0 |
255,0 ± 2,6 |
– |
224,3 ± 5,8 |
0,05 |
211,0 ± 11,0 |
0,05 |
197,3 ± 13,4 |
0,05 |
|
МГС |
337,7 ± 62,3 |
217,7 ± 8,4 |
– |
204,3 ± 19,6 |
– |
197,0 ± 13,7 |
189,3 ± 14,4 |
|||
|
ЖСС |
363,3 ± 32,3 |
251,7 ± 23,5 |
0,05 |
194,3 ± 20,7 |
0,01 |
200,7 ± 8,5 |
0,01 |
192,0 ± 4,6 |
0,01 |
|
|
СГС |
366,0 ± 51,4 |
261,0 ± 6,7 |
– |
257,3 ± 12,5 |
– |
250,7 ± 4,9 |
242,0 ± 16,6 |
|||
|
74 R |
СЖС |
297,0 ± 32,1 |
195,3 ± 14,7 |
0,05 |
179,3 ± 4,8 |
0,05 |
159,3 ± 4,7 |
0,05 |
154,7 ± 14,9 |
0,05 |
|
МГС |
323,3 ± 22,2 |
238,0 ± 18,9 |
– |
214,3 ± 22,4 |
0,05 |
205,3 ± 24,7 |
0,05 |
197,7 ± 12,3 |
0,01 |
|
|
ЖСС |
296,7 ± 44,3 |
224,0 ± 4,7 |
– |
201,7 ± 9,7 |
– |
192,7 ± 17,3 |
189,3 ± 5,0 |
|||
|
СГС |
293,0 ± 47,6 |
232,3 ±10,7 |
– |
203,0 ± 16,8 |
– |
199,9 ± 9,1 |
– |
195,7 ± 8,8 |
– |
Таблица 4
Контроль жизнеспособности культур C. Pseudotuberculosis (при 18–20°С), КОЕ млн/мл, n = 3
|
Штамм |
Защитная среда |
До лиофилизации |
3 года хранения |
P < |
6 лет хранения |
P < |
9 лет хранения |
P < |
|
37 I |
СЖС |
278,7 ± 2,6 |
75,5 ± 5,1 |
0,001 |
49,0 ± 4,4 |
0,001 |
27,5 ± 4,6 |
0,001 |
|
МГС |
251,7 ± 13,2 |
96,0 ± 10,5 |
0,001 |
86,0 ± 8,7 |
0,001 |
62,0 ± 6,4 |
0,001 |
|
|
ЖСС |
242,0 ± 23,1 |
110,5 ± 6,3 |
0,01 |
85,5 ± 7,5 |
0,001 |
70,5 ± 4,0 |
0,001 |
|
|
СГС |
269,7 ± 20,5 |
142,5 ± 8,1 |
0,01 |
109,7 ± 6,3 |
0,001 |
93,5 ± 9,0 |
0,001 |
|
|
50 S |
СЖС |
368,3 ± 20,7 |
124,5 ± 4,7 |
0,001 |
99,5 ± 6,1 |
0,001 |
78,0 ± 4,9 |
0,001 |
|
МГС |
370,7 ± 24,6 |
133,0 ± 7,4 |
0,001 |
98,5 ± 6,9 |
0,001 |
70,0 ± 7,8 |
0,001 |
|
|
ЖСС |
416,0 ± 29,5 |
211,5 ± 12,9 |
0,01 |
194,0 ± 17,1 |
0,01 |
161,5 ± 6,7 |
0,001 |
|
|
СГС |
438,3 ± 13,3 |
238,5 ± 11,7 |
0,001 |
181,5 ± 12,1 |
0,001 |
120,5 ± 13,2 |
0,001 |
|
|
70 R |
СЖС |
367,7 ± 48,0 |
185,0 ± 7,5 |
0,01 |
139,0 ± 10,6 |
0,01 |
109,0 ± 6,2 |
0,01 |
|
МГС |
337,7 ± 62,3 |
146,0 ± 10,1 |
0,05 |
110,5 ± 12,8 |
0,05 |
88,5 ± 10,8 |
0,01 |
|
|
ЖСС |
363,3 ± 32,3 |
144,0 ± 8,8 |
0,01 |
118,0 ± 11,8 |
0,001 |
70,0 ± 5,4 |
0,001 |
|
|
СГС |
366,0 ± 51,4 |
218,0 ± 9,5 |
0,05 |
200,2 ± 6,2 |
0,05 |
167,2 ± 14,4 |
0,01 |
|
|
74 R |
СЖС |
297,0 ± 32,1 |
128,5 ± 7,9 |
0,001 |
87,0 ± 5,9 |
0,001 |
71,0 ± 7,8 |
0,001 |
|
МГС |
323,3 ± 22,2 |
166,5 ± 7,3 |
0,001 |
138,5 ± 12,8 |
0,001 |
114,5 ± 6,8 |
0,001 |
|
|
ЖСС |
296,7 ± 44,3 |
146,5 ± 6,8 |
0,05 |
12,5 ± 7,8 |
0,05 |
96,0 ± 3,9 |
0,01 |
|
|
СГС |
293,0 ± 47,6 |
177,0 ± 8,8 |
– |
145,5 ± 12,3 |
0,05 |
111,0 ± 8,5 |
0,01 |
Аналогичные исследования, проведенные по окончании срока наблюдения (15 лет), показали, что все четыре штамма, высушенные в сорбитно-желатиновой, два (50 S и 74 R) – в желатино-сахарозной и два (37 I и 50 S) – в сывороточно-глюкозной средах, потеряли свои вирулентные свойства (табл. 2). Микроскопическими и бактериологическими методами установлено: уменьшение длины микробных клеток на 0,12 у штамма 70 R и на 0,16 мкм у штамма 74 R, а также отсутствие гликолитической и каталазной активности у штаммов 37 I- и 70 R-форм. При росте на кровяном агаре наблюдали полное отсутствие гемолитической активности всех штаммов. На мясопептонном агаре штамм 70 R-формы перешел в S-форму и слабо рос. Штаммы 37 I и 70 R потеряли способность ферментировать глюкозу и галактозу. Полученные данные свидетельствуют о том, что сывороточно-глюкозная среда является оптимальной для высушивания ко-ринебактерий, так как обладает рядом свойств, способствующих сохранению биологической активности С. pseudotuberculosis в процессе сублимации: обеспечивает распределение и оптимальный баланс влаги между биоматериалом и внешней средой; является хорошим структурирующим материалом при образовании плотной таблетки сухого препарата; ингибирует гидролитичесие ферменты в биоматериале и обладает антиокис-лительной активностью.
Выводы
Подводя итоги данного исследования, можно заключить, что коринебактерии сохраняют свою жизнеспособность при лиофильном высушивании в течение 15 лет, при этом сохраняя в течение 12 лет свои первоначальные свойства. На скорость отмирания клеток коринебактерий как в процессе лиофилизации, так и при хранении оказывают следующие факторы: высокий вакуум (30,7%), низкая температура (13,9%), защитная среда (10,8%), остаточная влажность (10,6%) и сроки хранения (28,6%). Испытанный способ сохранения штаммов коринебактерий применяется в изготовлении специфиче- ских биологических препаратов для профилактики и борьбы с казеозным лимфаденитом овец, а высушенные штаммы, депонированные в ВГНКИ ветеринарных препаратов (г. Москва), могут служить эталоном для научно-исследовательских и учебных целей. Проведенные исследования позволили выбрать оптимальные режимы лиофилизации, подобрать криозащитные среды и сохранить лиофильно-высушенные культуры в течение 20 лет (срок наблюдения).
Лиофильно-высушенные культуры коринебактерий позволяли проводить планомерную работу по изучению их свойств. При хранении (12 лет) два штамма R-формы потеряли гликолитическую и каталазную активность и приобрели фенотипические признаки S-формы. Этот переход из одной формы в другую, как нам представляется, происходит в результате значительного расходования глико- и полифосфатов цитоплазмы, являющихся энергетическим депо коринебактерий, а также средством включения адаптационных механизмов клеточных структур к выживанию в трофически бедной среде.
Испытанный способ лиофилизации коринебактерий применяется в настоящее время при изготовлении специфических биологических препаратов для профилактики борьбы с казеозным лимфаденитом овец.
M.V. Zabolotnykh, I.V. Yakushkin
Development of methods of long-term storage of cultures Corynebacterium pseudotuberculosis
Caseous lymphadenitis of sheep is widespread in Western Siberia farms. Among Merino and crossbred sheep affected to 24,0% of the population. In the zones of strong and significant lesions often circulated in the exciter R- and I-forms, as in zones of weak and moderate S-forms predominate. The causative agent of caseous lymphadenitis (pseudotuberculosis sheep) – C. pseudotuberculosis – Gram-positive, polymorphic, fixed, aerobic bacterium size 0,5–3,1 mm in length and 0,5–0,9 microns in width, do not form spores and capsules. Corynebac-terium remain viable during freeze-drying for 15 years, while maintaining over 12 years of their original properties. At the speed of the withering away of Corynebacterium cells in the process of freeze-drying, and church-nenii the following factors: the high vacuum of 30,7%, the low temperature of 13,9%, 10,8% protection Wednesday, the residual moisture of 10,6% and terms 28,6%. A proven way to save us Corynebacterium strains used in the manufacture of specific biological products for the prevention and control of caseous lymphadenitis of sheep and dried strains deposited in VGNKI veterinary drugs (Moscow) can serve as a benchmark for research and educational purposes. Permanent crops and crops subcultures to study their properties and maintain biological activity led to the deaths of some strains and phenotypic changes in their properties. Storage cultures in semisolid agar 0,25% vaseline oil layer under at +4? C proved unreliable because they do not allow to maintain the culture in the form of R- more than 12 months. While S-forms is stored and can longer time (19 months). The research allowed to choose the optimal modes liofi-tion, choose the cryoprotective medium to preserve and freeze-dried cultures for 20 years (time of observation), and deposit in C. rseudotuberculosis VGNKI vet drugs Moscow. During storage (12 years), two strains R – lost form glycolytic and catalase activity and acquired phenotypic traits S-forms.
Список литературы Разработка методов длительного хранения культур Corynebacterium pseudotuberculosis
- Заболотных А.В. Устойчивость возбудителя казеозного лимфаденита к физико-химическим и биологическим факторам: дис. … канд. вет. наук/А.В. Заболотных. -Омск, 1993. -184 с.
- Колычев Н.М. Казеозный лимфаденит овец и биологические свойства возбудителя/Н.М. Колычев, М.В. Заболотных//Эпизоотология, диагностика, лечение и профилактика инфекционных и инвазионных болезней животных: сб. науч. тр./ОмСХИ. -Омск, 1991. -С. 4-9.
- Колычев Н.М. Ветеринарная микробиология и иммунология/Н.М. Колычев, Р.Г. Госманов. -Омск: Изд-во ОмГАУ, 1996. -238 с.
- Колычев Н.М. Казеозный лимфаденит (псевдотуберкулез) овец/Н.М. Колычев, И.Г. Трофимов. -Омск, 1993. -214 с.


