Разработка методов непрямой лазерной реваскуляризации миокарда у больных ИБС
Автор: Шипулин В.М., Гордов Е.П., Андреев С.Л., Коровин Н.В., Суходоло И.В., Козлов Б.Н., Павлюкова Е.Н., Макогон М.М., Карпов Р.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Опыт регионов
Статья в выпуске: 4 т.22, 2007 года.
Бесплатный доступ
В работе обсуждаются и обобщаются результаты работы томских ученых в области применения лазеров в кардиохирургии как в ходе экспериментальных исследований на животных, так и в клинической практике. Рассматривается применение различных типов лазеров (таких, как СО2 (100Вт), Nd-YAG (10Вт) и полупроводникового лазера (10 Вт) для непрямой лазерной реваскуляризации миокарда, как альтернативного хирургического метода лечения у больных ишемической болезнью сердца. В эксперименте установлено, что наилучшим в применении в связи с минимальным повреждающим действием на миокард, сравнительно эффективным неоангиогенезом, отсутствием необходимости в синхронизации при работе с ЭКГ и малыми габаритами является полупроводниковый лазер. Приводятся данные эффективности клинического применения полупроводникового лазера в отделении сердечно-сосудистой хирургии ГУ НИИ кардиологии ТНЦ СО РАМН в разные сроки от проведения операции. Отмечен значительный положительный клинический эффект.
Лазерная реваскуляризация миокарда, ишемическая болезнь сердца, неоангиогенез, полупроводниковый лазер
Короткий адрес: https://sciup.org/14918788
IDR: 14918788 | УДК: 616.127-089.844:615.849.19
Текст научной статьи Разработка методов непрямой лазерной реваскуляризации миокарда у больных ИБС
РАЗРАБОТКА МЕТОДОВ НЕПРЯМОЙ ЛАЗЕРНОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА У БОЛЬНЫХ ИБС
ГУ НИИ кардиологии Томского научного центра СО РАМН;
-
* Институт мониторинга климатических и экологических систем СО РАН;
-
* * ГОУ ВПО Сибирский государственный медицинский университет;
-
* ** Институт оптики атмосферы СО РАН, г. Томск
В течение последнего десятилетия в отделении сердечно-сосудистой хирургии ГУ НИИ кардиологии Томского научного центра СО РАМН идет активная разработка и внедрение лазерной реваскуляризации миокарда – методики, применяющейся у больных ИБС с нешунтабельными коронарными артериями и неэффективностью консервативных методов лечения. Данная проблема объединила специалистов из раз- личных научных учреждений нашего города: ГУ Научно-исследовательский институт кардиологии ТНЦ СО РАМН, Институт мониторинга климатических и экологических систем СО РАН, ГОУ ВПО Сибирский государственный медицинский университет, Институт оптики атмосферы СО РАН.
В мире вопрос об альтернативном способе реваскуляризации миокарда встал достаточно остро в связи с широким распространением аортокоронарного шунтирования (АКШ). Выяснилось, что у значительного количества пациентов – кандидатов на АКШ, невозможно выполнение данного оперативного вмешательства. Доля таких больных, по данным ведущих кардиохирургических центров, составляет до 13% обследованных пациентов [1]. Выходом в таком случае является применение альтернативных методов реваскуляризации, одним из которых является лазерная реваскуляризация миокарда (ЛРМ). Суть операции заключается в создании лазерных каналов в целевой области стенки левого желудочка. В настоящий момент выделяют несколько механизмов эффективности данной процедуры. По современным представлениям эффективность данного метода обусловлена денервацией миокарда, поступлением оксигенированной крови в миокард непосредственно из полости левого желудочка через трансмиокардиальные каналы и образованием вокруг каналов микрососудистой сети, благодаря выбросу биологически активных веществ во время лазерного воздействия [2, 3]. Последний эффект считается ведущим.
Изучение возможностей улучшения кровоснабжения ишемизированного миокарда непосредственно из полости левого желудочка было начато еще в 30-е гг. ХХ века. Но на новый уровень эти исследования вышли с появлением и внедрением в медицину лазерной техники. Основными историческими этапами в данной области кардиохирургии можно считать следующие:
– 1969 г.: Z. Naprstek и R. Rockwell (США) исследуют воздействие лазерного излучения на миокард в эксперименте;
– 1983 г.: Mirhoseini выполнил первую операцию трансмиокардиальной лазерной реваскуляризации (в сочетании с АКШ). Операция была выполнена в Милуоки (шт. Висконсин, США) в медицинском центре Св. Луки;
– 1984 г.: в России первые операции по трансмиокардиальной лазерной реваскуляризации миокарда были проведены хирургами Ю.Ю. Бредикисом и О.Н. Скобелкиным;
– 90-е гг. ХХ в. – в мире проводится серия исследований по эффективности применения лазеров для реваскуляризации миокарда и начинается внедрение метода в широкую клиническую практику [4].
Были определены следующие показания к новому методу: 1) выраженная клиника стенокардии, рефрактерная к обычной антиангинальной терапии; 2) невозможность выполнения АКШ, либо транс-люминарной баллонной ангиопластики в связи с диффузным поражением коронарных артерий (КА), поражением дистального русла или наличием мелких, нешунтабельных КА; 3) обязательное наличие в области операции жизнеспособного миокарда [1].
Во всех крупных кардиохирургических центрах начинается освоение новой методики, в том числе и в отделении сердечно-сосудистой хирургии. Но зачастую результаты из различных медицинских центров были противоречивы, а использование различных лазерных установок с варьируемыми в значительных пределах настройками еще более запутывало ситуацию по выбору наиболее оптимального применения новой методики. В конце 90-х гг. в мире самым распространенным аппаратом для ЛРМ являлся СО2-лазер, но по ряду характеристик (стоимость, сложность в эксплуатации, аритмогенное действие) он, зачастую, не устраивал кардиохирургов. В ГУ НИИ кардиологии ТНЦ СО РАМН и Институте оптики атмосферы СО РАН в 1997-2000 гг. проведена совместная работа по изучению ЛРМ. В Научно-исследовательском институте оптики атмосферы СО РАН была разработана твердотельная лазерная система на основе импульсного Nd-YAG лазера. Со следующими параметрами: длина волны = 1,06mkm; средняя мощность = 10Вт; частота следования импульсов – 50 Гц; длительность импульса – 10 нс. Также применялся непрерывный CO2 лазер с длиной волны = 10,6 mkm; мощностью = 100 Вт. Разработан объединением «Топаз» (г. Томск; рис. 1).
Исследование проходило в 2 этапа. Первым этапом выполнялось изучение воздействия лазерного излу-

Рис. 1. Твердотельная лазерная система на основе импульсного Nd-YAG лазера чения на участки передней стенки левого желудочка сердца людей, умерших от различных причин в возрасте от 35 до 75 лет, в течение первых суток после смерти (в количестве 100 фрагментов). Второй этап выполнялся на миокарде 24 экспериментальных животных (собаки, хронический эксперимент) с выведением из опыта в различные сроки (через 1, 2, 7, 14 суток и 1 и 3 месяца после операции).
Эксперименты, проведенные на трупных участках миокарда передней стенки левого желудочка с целью изучения отличий воздействия разных типов лазеров, показали, что излучение СО2-лазера позволяет формировать каналы в миокарде, глубина и зона повреждения тканей вокруг которых прямо зависимы от энергетических параметров излучения (длительности импульса). Излучение Nd-YAG лазера позволяет формировать каналы, глубина и зона повреждения тканей вокруг которых независимы от энергетических параметров излучения (суммарной энергии, количества импульсов в серии, числа серий). Глубина каналов прямо зависит от условий фокусировки лазерного излучения. В то же время низкомощный Nd-YAG-лазер формирует в миокарде каналы глубиной 3-5 мм, при этом ширина зоны некроза окружающей канал ткани миокарда составляет 0,09 ± 0,025 мм, что значительно меньше аналогичных показателей излучения СО2-лазера, которые составляют 0,489 ± 0,02 мм (различия между значениями достоверны при доверительной вероятности р<0,01. Статистическая обработка результатов выполнена с применением критерия Ван-ДерВардена для непарных выборок). В результате опытов in vitro подобраны режимы генерации лазерного излучения (энергия, мощность, длительность импульса, условия фокусировки), обеспечивающие образование слепо заканчивающихся каналов различной конфигурации [5].
Экспериментальные вмешательства на лабораторных животных осуществлялись посредством переднебоковой торакотомии. В бессосудистой зоне передней стенки и верхушки левого желудочка сердца экспериментального животного проделывались 15-30 лазерных каналов до 1 мм в диаметре на 1/2 толщины 77
миокарда ЭКГ - синхронизированного импульса лазерного излучения при помощи полуавтоматической система управления установки. Установлено, что воздействие лазерного излучения как СО2, так и Nd-YAG лазеров на миокард in vivo вызывает фазовые изменения в сердечной мышце, укладывающиеся в картину воспаления на ранних сроках после лазерной реваскуляризации (до 3 недель) и активного васкулогенеза в отдаленные сроки после операции (1-3 месяца), что должно послужить значительному улучшению перфузии облученного участка миокарда [6, 7].
Параллельно в 2000-2001 гг. с целью усиления эффективности непрямого эффекта реваскуляризации разработана методика проведения сочетанной операции ЛРМ и оментокардиопексии (ОКП) в эксперименте. Сравнение проводилось с изолированным применением данных процедур. Выполнялось

Рис. 2. Полупроводниковый непрерывный лазер «Лазон 10-П» (НТО «ИРЭ-Полюс» (г. Фрязино, Московской области)
выделение малого сальника и окутывание им сердца стью 25 Вт для выполнения ЛРМ с положительным после выполнения ЛРМ с выведением животных из эксперимента в различные сроки. В результате было обнаружено, что разработанный метод комплексной непрямой реваскуляризации миокарда, включающий ЛРМ и ОКП, менее эффективен и более травматичен, чем изолированное лазерное воздействие, хотя и превышает по эффективности оментокардиопексию. В связи с этим дальнейшее исследование данного метода не проводилось [8].
В процессе исследований был выявлен ряд недостатков, присущий обоим типам лазеров. Так, СО2-лазер вызывает чрезмерное повреждение ткани, окружающей область воздействия, проявляющееся широкой зоной некроза кардиомиоцитов (до 2 мм), вакуолизацией ядер и «оглушенностью» клеток на большом протяжении от лазерного канала. При этом применение СО2-лазера в импульсном режиме – наиболее эффективном для процедуры ЛРМ, требует обязательной синхронизации с ЭКГ, что необходимо с целью профилактики жизнеугрожающих нарушений ритма во время операции. Nd-YAG-лазер может применяться с гибкой фиброволоконной оптикой, позволяющей достигать любой зоны сердца. Низкая энергия и короткая длительность импульса обеспечивает минимальные термические повреждения, но для перфорации стенки миокарда требуется несколько импульсов, эффектом [9].
В 2001 г. на базе НИИК ТНЦ СО РАМН начато изучение эффективности отечественного полупро-
-
водникового лазера для проведения лазерной рева скуляризации миокарда. Использовался полупрово
-
дниковый непрерывный лазер «Лазон 10-П» (НТО «ИРЭ-Полюс» (г. Фрязино, Московской области) с мощностью 10 Вт и длиной волны 970 нм (рис. 2.).
Стоит отметить, что именно эта длина волны рабочего излучения приходится на локальные максимумы поглощения биоткани, определяемые поглощением в воде и оксигемоглобине. Вследствие этого режущий эффект мало зависит от вида биоткани и близок к
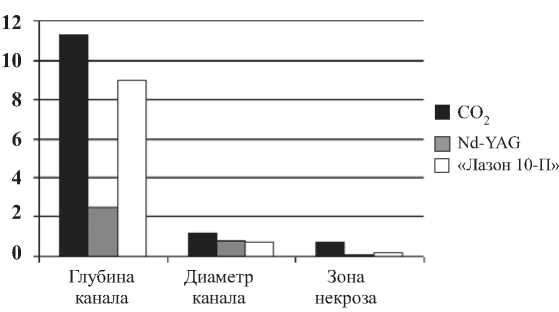
Рис. 3. Параметры каналов после лазерной реваскуляризации (мкм)
лазерный канал имеет неправильную форму, что затрудняет задание глубины лазерных насечек, а риск возникновения аритмий при этом выше, чем у СО2-лазера. Кроме всего прочего данные установки обладают большими габаритами и сложны в эксплуатации. В то же время в конце 90-х гг. в хирургии появился большой интерес к новому типу лазеров – малогабаритным низкоэнергетическим полупроводниковым лазерам. В России в 2001 г. С.В. Евдокимов и соавт. опубликовали результаты использования диодного лазера с
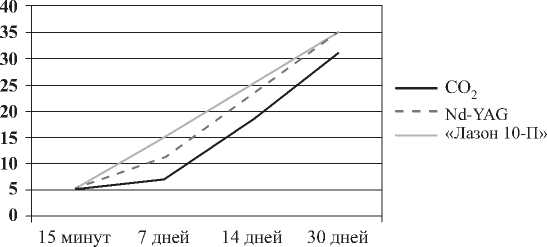
Рис. 4. Количество капилляров в 1 мм2 поверхности миокарда
длиной волны 805 нм. «LTO-30000» с мощно-
действию излучения с длинами волн 810 нм (лазерные диоды) и 1060 нм (АИГ:Nd) с большей в 2-2,5 раза мощностью. Кроме этого, снижается риск повреждения лазерным излучением окружающих тканей и органов [10]. Экспериментальная ЛРМ при помощи полупроводникового лазера была выполнена на 11 беспородных собаках с выведением из эксперимента в различные сроки после операции. Результаты сопоставлялись с ранее полученными данными воздействия Nd-YAG и углекислотного лазеров. По итогам исследований были сделаны выводы, что под воздействием лазерного излучения, независимо от типа применяемой установки, в ткани миокарда протекают сходные морфологические процессы, приводящие к неоваскулогенезу (рис. 3.).
Установлено, что минимальным повреждающим действием на миокард обладает излучение от твердотельного Nd-YAG лазера, а максимальным – от газового СО2-лазера; в то же время, глубина канала у полупроводникового лазера сопоставима с СО2-лазером, а по повреждающему действию с Nd-YAG лазером (рис. 4).
Наиболее удобным в применении в связи с малыми габаритами и кратковременной подготовкой к работе оказался полупроводниковый лазер «Лазон-10П». Также он не нуждается в синхронизации с ЭКГ и является наиболее безопасным относительно аритмо-генного эффекта [11].
В связи с рассмотренными результатами было решено произвести углубленное экспериментальное изучение эффектов ЛРМ, выполненной полупроводниковым лазером. Объектом исследования явился миокард левого желудочка 12 беспородных собак массой 10-15 кг, взятый через 25 часов, 2 недели и 3 месяца (по 4-й точке на каждый срок) после ТМЛР ишемизированного миокарда под общей анестезией в условиях хронического эксперимента. Лазерную реваскуляризацию проводили через 1 месяц после моделирования экспериментального кардиосклероза. Группами сравнения стали: миокард собак с экспериментальным кардиосклерозом и миокард интактных животных без воздействия лазера (по 4 собаки в каждой группе). Создавалась модель постинфарктного кардиосклероза у лабораторных животных с помощью лигирования диагональных ветвей передней межжелудочковой артерии, через месяц выполнялась операция ЛРМ с последующим выведением собак из эксперимента через 1 сутки, 2 недели и 3 месяца после операции. Препараты изучались с помощью световой микроскопии, подсчитывался удельный объем сосудов миокарда и трофический индекс. Через 25 часов после ЛРМ в ишемизированном миокарде отмечались венозное полнокровие, стаз эритроцитов в капиллярах и мелких артериолах, образование гемосидерина и присутствие сидерофагов в просвете лазерных каналов. Кроме того, наблюдали интерстициальный отек, релаксацию миофибрилл кардиомиоцитов, прилежащих к лазерному каналу. Через 2 недели после ЛРМ в ишемизированном миокарде наблюдали образование новых сосудов, в т.ч. в зоне грануляционной ткани на месте предшествующих микроинфарктов. Спустя 3 месяца после ЛРМ в ишемизированном миокарде отмечали увеличение плотности распределения сосудов в единице объема ткани (рис. 5.). Через 2 недели после ЛРМ в ишемизированном миокарде отмечали незначительный рост удельного объема сосудов, в то время как через 3 месяца этот показатель превышал контрольное значение в 1,9 раза. Трофический индекс, наиболее полно отражающий состояние трофики миокарда и вычисляемый отношением удельного объема капилляров к удельному объему кардиомиоцитов, возрастал в меньшей степени и своего максимального значения достигал через 3 месяца, что превысило начальный показатель в 1,2 раза [12].
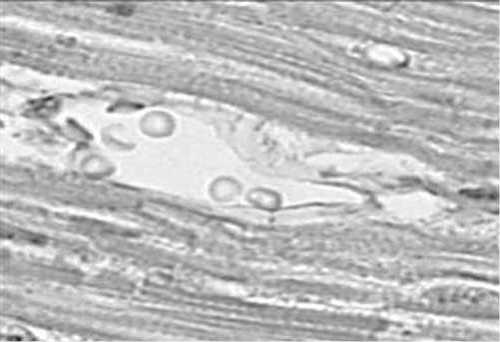
Рис. 5. Новообразованные тонкостенные сосуды через 3 мес после ЛРМ
Таким образом, серия экспериментальных работ показала, что полупроводниковый лазер эффективен для проведения непрямой реваскуляризации миокарда, а статистически подтвержденное увеличение количества неососудов в единице объема облученного участка миокарда должно послужить улучшению перфузии в месте воздействия лазерного излучения. В связи с этим полупроводниковый лазер российского производства был рекомендован для применения в клинике сердечно-сосудистой хирургии.
В начале 2003 г. начался отбор пациентов-кандидатов на выполнение лазерной реваскуляризации миокарда. Всем пациентам проводились общеклинические исследования и специальная программа обследования, включающая коронаровентрикулографию, однофотонную эмиссионную компьютерную томографию с 199таллием с оценкой перфузии сердечной мышцы, ЭхоКГ исследование, в том числе тканевое допплеровское изображение миокарда. ЭхоКГ анализ выполнен на ультразвуковой системе VIVID7 (expert) и на ECHOPAC PC (версия 1.0Х), включая режимы TVI, Strain, Strain rate до и через 2 недели после оперативного лечения. Стресс-ЭхоКГ (включая тканевое допплеровское изображение) с добутамином выполнено всем пациентом до операции для выявле-
Таблица
Динамика уровня тропонина I при ЛРМ и коронарном шунтировании в зависимости от степени повреждения миокарда
|
Этап исследования |
1-я группа |
2-я группа |
3-я группа |
|
До операции (I) |
0,04 (0,02; 0,09) |
0,05 (0,05; 0,19) |
0,07 (0,05; 0,18) |
|
Завершение операции (II) |
0,17 (0,08; 0,27) |
1,77 (0,22; 1,25)* |
6,57 (0,24; 1,25)* |
|
4 часа после операции (III) |
0,42 (0,36; 0,27) |
3,56 (1,41; 3,1)* |
11,66 (1,48; 3,6)* |
|
8 часов после операции (IV) |
0,66 (0,42; 1,2) |
5,16 (1,58; 3,21)* |
14,06 (2,1; 4,1)* |
|
12 часов после операции (V) |
0,84 (0,35; 0,97) |
3,06 (2,15; 4,1)* |
16,60 (1,56; 3,6)* |
|
24 часа после операции (VI) |
0,50 (0,25; 0,90) |
2,08 (1,2; 2,9)* |
12,83 (1,2; 2,91)* |
|
48 часов после операции (VII) |
0,29 (0,16; 0,52) |
0,95 (0,49; 1,4) |
10,95(0,44; 1,46)* |
|
7-е сутки после операции (VIII) |
0,06 (0,04; 0,13) |
0,07 (0,16; 0,2) |
6,48 (0,14; 0,2)* |
Примечание: * - p < 0,05 при сравнении обсуждаемых групп. Статистическая обработка выполнена с применением критерия Манна-Уитни.
ния сегментов гибернированного миокарда. В марте 2003 г. в отделении сердечно-сосудистой хирургии выполнена первая операция лазерной реваскуляризации миокарда.
На сегоднящний день в ОССХ выполнено 29 операций лазерной реваскуляризации миокарда (таблица). Клиническая характеристика пациентов представлена в таблице: 2 – в сочетании с резекцией аневризмы ЛЖ, 4 – изолированные операции ЛРМ, 23 – в сочетании с аортокоронарным шунтированием. Средний возраст пациентов составил: 51,82±5,79 лет (25 мужчин и 4 женщины), эффективная фракция выброса – 45,2±11,4 %, зоны гипоперфузии, не входящие в бассейн шунтируемых артерий, по данным ЭхоКГ и сцинтиграфии располагались преимущественно по задней и боковой стенках левого желудочка. В зоне гибернирующего миокарда левого желудочка сердца проделывались 30-60 лазерных каналов с использованием полупроводникового лазера с длиной волны 970 нм и мощностью 10 Вт, разработанного НТО «ИРЭ-Полюс» (г. Фрязино). Каналы создавались непосредственно световодом в рабочем состоянии лазера на глубину, заданную хирургом путем дозированного выдвигания конца световода из специального держателя. Глубина каналов составляла около 8 мм.
При анализе результатов у всех пациентов, подвергнутых процедуре ЛРМ, обнаружено повышение толерантности к физической нагрузке (с 31,0±3,4 Вт до 56,2±2,5 Вт), исчезновение или уменьшение приступов стенокардии. При сравнении ультразвуковых кривых Tissue Tracking от боковой стенки левого желудочка, где производилось лазерное воздействие, до и через 6 месяцев после операции лазерной реваскуляризации, выявлено увеличение амплитуды движения преимущественно верхушечных с 3,7±0,34 мм – до операции до 5,0±0,22 мм – после операции и средних сегментов боковой стенки ЛЖ с 0,2±0,04 мм – до операции до 4,0±0,34 мм – после операции. Амплитуда движения базальных сегментов боковой стенки ЛЖ значимо не изменилась. Динамика перфузии миокарда по данным однофотонной эмиссионной компьютерной томографии с 199таллием показала уменьшение преходящего дефекта перфузии с 15,2% до 7%. Величина стабильных дефектов перфузии не изменялась [13, 14].
Одновременно с оценкой эффективности процедуры проводилась оценка степени повреждения миокарда при выполнении непрямой лазерной реваскуляризации. Проанализировано 24 операции ЛРМ: в том числе 1 – в сочетании с резекцией аневризмы левого желудочка (ЛЖ) и АКШ, 3 – изолированные операции ТЛРМ, 20 – в сочетании с АКШ. В плазме крови больных определяли уровень кардиоспецифичного фермента миокардиального повреждения тропонин I (ТнI) по методике МНИИ медицинской экологии (Москва) и ООО «Хема-Медика» набором реактивов фирмы «Biocon» (Германия) на этапах: перед началом операции, сразу после реваскуляризации миокарда, через 4, 8, 12, 24, 48 часов и на 7-е сутки после операции. Перед операцией исходный уровень ТнI у обсуждаемых больных был близок к нулю. Анализ полученных данных позволил распределить всех пациентов на три группы по степени и обратимости периоперационного повреждения миокарда при ревакуляризирующих операциях. Первую группу сформировали 18 (75%) пациентов, из них трем больным были выполнены изолированные операции ТЛРМ и 15 человек перенесли лазерную реваскуляризацию в сочетании с АКШ. После операции у них не было выявлено значимого повышения биохимических маркеров повреждения миокарда. К 2 группе были отнесены 4 (16,7%) пациента, у которых в раннем послеоперационном периоде отмечались обратимые кратковременные ишемические изменения миокарда. Из них трем больным ТМЛР дополняло АКШ и у одного пациента сочеталась с резекцией аневризмы ЛЖ. Третью группу составили 2 (8,3%) пациента. У обоих пациентов ТМЛР сочеталась с АКШ. Критерием, по которому выделена эта группа, стал зарегистрированный периоперационный ИМ и значимое и стабильное повышение тропонина I в крови (таблица).
Но стоит учитывать, что частота развития перио-перационного инфаркта миокарда при коронарном шунтировании в условиях ИК составляет, по данным разных авторов от 1,6 до 8,2% [15, 16], что практически совпадает с полученными данными касательно 3-й группы. Подобные же цифры частоты ИМ отмечаются большинством исследователей и после сочетанных операций – АКШ и ЛРМ [17]. Были сделаны выводы, что выполнение ЛРМ с использованием полупроводникового лазера с длиной волны 970 нм и мощностью 10 Вт оказывает несущественное влияние на степень периоперационного повреждения миокарда как изолированно, так и в сочетании с АКШ [18].
Таким образом, проведенные многолетние исследования позволили определить оптимальный тип лазера для выполнения лазерной реваскуляризации миокарда – полупроводниковый низкоэнергетический лазер. Несомненным достоинством полупроводникового лазера являются его небольшие размеры, удобство в эксплуатации и малая стоимость по сравнению с аналогами, при относительно низком повреждении окружающих тканей и высоким уровнем индуцированного ангиогенеза в миокарде. Экспериментальные исследования доказали, что после ЛРМ в окружающей лазерные каналы зоне миокарда запускается процесс асептического воспаления, что в свою очередь приводит к активному неоваскулогенезу уже через 1-3 месяца после операции непрямой лазерной реваскуляризации. А статистически подтвержденное увеличение количества неососудов в единице объема облученного участка миокарда должно послужить улучшению перфузии в месте воздействия лазерного излучения. В связи с этим полупроводниковый лазер российского производства был рекомендован для применения в клинике сердечно-сосудистой хирургии. Использование полупроводникового лазера в отделении сердечнососудистой хирургии показало его эффективность для непрямой реваскуляризации сердечной мышцы у больных с диффузным и дистальным атеросклерозом КА как при изолированном применении, так и в сочетании с АКШ. В то же время данная процедура относительно безопасна для больного и обладает минимальным повреждающим действием на миокард.
В настоящее время операция ЛРМ активно применяется в отделении сердечно-сосудистой хирургии НИИК ТНЦ СО РАМН, позволяя расширить спектр оказываемого кардиохирургического лечения, в том числе помочь тем больным, которым ранее в нем было отказано. Выполняется работа по оценке отдаленных результатов операции.Полупроводниковый непрерывный лазер «Лазон 10-П», прошедший клиническую апробацию на базе ОССХ НИИК ТНЦ СО РАМН, используется не только в г. Томске, но и в ряде других кардиохирургических центров РФ.
Список литературы Разработка методов непрямой лазерной реваскуляризации миокарда у больных ИБС
- Бокерия Л.А., Беришвили И.И., Бузиашвили Ю.И.,Сигаева И.Ю. Трансмиокардиальная лазерная реваскуляризация. М.: Издательство НЦССХ им. А.Н. Бакулева РАМН, 2001.
- Horvath K, Cohn L, Cooley D, Crew J, Frazier O, Griffith B, Kadipasaoglu K, Lansing A, Mannting F, March R, Mirhoseini M, Smith C. Transmyocardial laser revascularization: results of a multicenter trial with transmyocardial laser revascularization used as sole therapy for end-stage coronary artery disease. J Thorac Cardiovasc Surg 1997;113(4):645-653.
- Krabatsch T, Schaper F, Leder C, Tulsner J, Thalmann U,Hetzer R. Histological findings after transmyocardial laser revascularization. J Card Surg 1996;11(5):326-331.
- Mueller, Xavier M. Lasers for Ischemic Heart Disease.//Spinger-Verlag Berlin Heidelberg, 2001.
- Н.В. Коровин, В.М. Шипулин, Е.П. Гордов, И.В. Суходоло, М.Е. Левицкий, Н.С. Родичева, С.Р. Будков Воздействие лазерного излучения на стенку сердца in vitro//Третья ежегодная сессия Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева с Всероссийской конференцией молодых ученых: Тезисы докладов и сообщений. -Москва, 1999 г. -С. 181.
- Н.В. Коровин, И.В. Суходоло, А.В. Богачев -Прокофьев Морфологические результаты трансмиокардиальной лазерной реваскуляризации в эксперименте//Четвертая ежегодная сессия Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева с Всероссийской конференцией молодых ученых: Тезисы докладов и сообщений. -Москва, 2000 г. -С. 173.
- Korovin N.V., Krivoshekov Е.V., Kuryak А.N., Bogacheov-Prokofev А.V., Makogon М.М., Sukhodolo I.V., Shipulin V.М.,Gordov E.P. Myocardial laser revascularization under experiment//8th International Congress of the European Medical Laser Association (EMLA), «Laser-2001», May 23-26, 2001 г. -Moscow, 2001 г. -P. 121-122.
- Коровин Н.В., Куряк А.Н., Богачев-Прокофьев А.В., Макогон М.М., Суходоло И.В., Шипулин В.М., Гордов Е.П. Лазерная комплексная непрямая реваскуляризация миокарда в эксперименте//Материалы Региональной научно-практической конференции, посвященной 50-летию Новокузнецкого ГИДУВа в Кузбассе, 26-27 апреля 2001 г. -Новокузнецк, 2001 г. -С. 58-59.
- Евдокимов С.В., Евдокимов В.П., Головнева Е.С., Лапа А.В. Клинические результаты трансмиокардиальной лазерной реваскуляризации миокарда с применением Nd:YAG и диодного лазеров// Лазер-Информ. - 2001. - вып. 3.- С. 101-102.
- Гапонцев В.П. Минаев В.П., Пантелеев А.М., Пинский Ю.А., Самарцев И.Э. Портативный лазерный скальпель-коагулятор «Лазон-10П»/Бюллетень физиологии и патологии дыхания, ДВНЦ физиологии и патологии дыхания, г.Благовещенск, Вып. 10.-2001 г. -С. 71-72.
- Гордов Е.П., Макогон М.М., Шипулин В.М., Коровин Н.В., Суходоло И.В. Лазерные технологии в лечении ИБС//II объединенная научная сессия СО РАН и СО РАМН «Новые технологии в медицине» 18-19 июня 2002г.: Сб. тезисов. -Новосибирск, 2002. -С. 33-34.
- Шипулин В.М., Суходоло И.В., Коровин Н.В. Применение полупроводникового лазера «Лазон 10-П» для непрямой реваскуляризации миокарда//Восьмой всероссийский съезд сердечно-сосудистых хирургов 18-22 ноября 2002 г.: Сб. тезисов. -Москва, 2002. -С. 80.
- Шипулин В.М., Коровин Н.В., Павлюкова Е.Н., Андреев С.Л. Результаты непрямой реваскуляризации миокарда полупроводниковым лазером совместно с аортокоронарным шунтированием.//Девятая ежегодная сессия Научного центра сердечно-сосудистой хирургииим. А.Н. Бакулева РАМН с Всероссийской конференцией молодых ученых 15-17 мая 2005г.: Сборник тезисов,-Москва, 2005. -С. 40.
- Шипулин В.М., Коровин Н.В., Павлюкова Е.Н., Суходоло И.В., Андреев С.Л. Первый опыт клинического применения полупроводникового лазера с длиной волны излучения 0,97 мкм для непрямой реваскуляризации миокарда.//Лазерная медицина.-2005. -Т.9, Вып. 3. -С. 55-57.
- Dalrymple-Hay M.J., Alzetani A., Aboel-nazar S. et al. Cardiac surgery in the elderly//Eur. J. Cardiothorac. Surg. -1999. -Vol. 15, № 1. -P. 61-66.
- Lotto A.A., Caputo M., Ascione R. et al.Evaluation of myocardial metabolism and function during beating heart coronary surgery//Eur. J. of Cardio-thoracic Surg. -1999. -Vol. 16, Suppl. 1. -P. 112-116.
- Бокерия Л.А., Беришвили И.И., Сигаев И.Ю. и др. Отдаленные результаты сочетанных операций аортокоронарного шунтирования и трансмиокардиальной лазерной реваскуляризации./Бюллетень НЦССХ им.А.Н. Бакулева РАМН. Альтернативные методы реваскуляризации миокарда. -том 5. № 4. -2004 г. -С. 76-92.
- Козлов Б.Н., Шипулин В.М., Коровин Н.В., Андреев Д.Б.*, Андреев С.Л., Павлюкова Е.Н. «Оценка клинической эффективности и степени повреждения миокарда при трансмиокардиальной лазерной реваскуляризации у больных ИБС».//«Патология кровообращения и кардиохирургия». Новосибирск, № 2, 2006.


