Разработка пептида, устойчивого к протеолизу, с последующим синтезом плазмиды, кодирующей его последовательность для экспрессии в биообъекте
Автор: Тихонов С.Л., Тихонова Н.В., Валиева Ш.С., Шихалев С.В.
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 4 т.12, 2024 года.
Бесплатный доступ
Проведены исследования по конструированию биоактивной устойчивой к протеолизу пептидной последовательности белка CDF-11 с последующим синтезом плазмиды, кодирующей его экспрессию в E.coli. Прогнозирование биологической активности, устойчивости к протеолизу и биодоступности пептидной последовательности проводили на платформе ADMET. Синтез плазмид пептидной последовательности нового рекомбинантного белка осуществляли в Российской биотехнологической компании «Евроген» (г. Москва) методом циклической сборки из олигонуклеотидов. Молекулярно-массовое распределение пептидной последовательности оценивали масс-спектрометрическим методом. Идентификацию пептида осуществляли методом MALDI-TOF MS Ultraflex. Проведена циклизация пептидной последовательности белка GDF-11 LQIIYGKIPR путем введения и сшивания трех остатков цистеина. В результате получена новая последовательность LQСIIYСGKIСPR. Прогнозируемые значения показателей биодоступности и клинического применения нового пептида свидетельствуют об эффективности предложенной его модификации и возможности перорального применения. Для экспрессии рекомбинантного белка с повышенной стабильностью к протеолизу и биодоступностью, содержащего последовательность циклического пептида, получена и синтезирована плазмида, определена последовательность аминокислот в ней. Дальнейшие исследования будут направлены на экспрессию модифицированного белка GDF 11 mut в E.coli.
Пептидная последовательность, протеолиз, биодоступность, циклическая сборка, плазмиды, экспрессия
Короткий адрес: https://sciup.org/147245949
IDR: 147245949 | УДК: 606:579.255 | DOI: 10.14529/food240408
Текст научной статьи Разработка пептида, устойчивого к протеолизу, с последующим синтезом плазмиды, кодирующей его последовательность для экспрессии в биообъекте
В качестве функциональных ингредиентов пищевых продуктов в основном используются биологически активные вещества (БАВ) с молекулярной массой более 5000 Да, в частности, белки и полипептиды. Короткие и олигопептиды находятся в диапазоне молекулярных масс от 500–5000 Да и имеют много преимуществ перед другими БАВ и пептидами, в частности, более простая структура (линейная), способность взаимодействовать с малоизученными мишенями, недорогой синтез, пониженная иммуногенность и улучшенное проникновение в ткани. На фармацевтическом рынке США, Европы и Японии пред- ставлено более 100 пептидных препаратов, используемых для лечения ряда заболеваний. В основном это пептидные препараты для инъекций, но следует отметить, что наиболее удобным методом применения БАВ является пероральный, поскольку позволяет потребителю принимать его самостоятельно.
Одним из современных направлений в пищевой промышленности является создание обогащенных продуктов, в том числе функционального и специализированного назначения с использованием в рецептуре пищевых пептидов. Вопросам разработки обогащенных мясопродуктов биологически активными веществами посвящены исследования авторов
Для повышения эффективности применения пероральных пептидов необходимо предотвратить их ферментативный гидролиз, что возможно путем циклизации пептидных связей тремя способами: от начала пептида к концу, от начала или конца пептида к боковой цепи, от боковой цепи к боковой цепи. Последний носит название «сшивание». Этот способ позволяет зафиксировать вторичную структуру пептида и усилить его биологические свойства. Существуют две подгруппы пептидных сшивающих средств (СС): однокомпонентные (1C) и двухкомпонентные (2C). В однокомпонентном пептидном сшивании (1C-СС) имеется внутримолекулярная связь между боковыми цепями аминокислот и может допускаться циклизация в зависимости от вторичной структуры. Циклизация вторичной структуры позволяет стабилизировать линейные пептиды [8, 9], уменьшая потерю энтропии при связывании с мишенью. Дисульфидная связь является наиболее распространенным типом циклизации. Богатые дисульфидами пептиды, такие как циконотид, используются в клинических целях [10]. Высокую эффективность применения показал сшитый пептид ALRN-5281, который используется для лечения дефицита гормона роста [11].
Общая концепция 2C-CC заключается в сшивании трех остатков цистеина с трехфункциональным линкером с образованием устойчивой конструкции пептида [12].
Также для решения проблемы быстрого выведения пептидов необходимо увеличить общий суммарный заряд пептидной последовательности. Пептиды, которые приобретают суммарный низкий положительный заряд, как правило, имеют более длительный период полураспада по сравнению с пептидами с суммарным отрицательным зарядом [13].
Пептидные последовательности определяют биологические свойства белков. Одним из необходимых белков для организма человека является белок GDF-11- фактор роста. Он синтезируется во многих органах и тканях человека и способен предотвращать процессы старения [14, 15]. В исследованиях на лабораторных мышах доказано, что введение в рацион белка GDF-11 животным предупреждает гипертрофию сердца и фиброз. Эффективность применения белка зависит от дозировки, способа введения (пероральный, инъекция и др.), при этом высокие дозы не токсичны [16].
Целью исследований является конструирование биоактивной устойчивой к протеолизу пептидной последовательности белка CDF-11 с последующим синтезом плазмиды, кодирующей его экспрессию в E.coli .
Следует отметить, что использование генно-модифицированных пищевых продуктов запрещено Федеральным законом от 3 июля 2016 г. № 358-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации в части совершенствования государственного регулирования в области генно-инженерной деятельности», но научные исследования в области биотехнологии рекомбинантых белков и пептидов разрешены и приветствуются.
Объекты и методы исследований
В качестве объектов исследований использованы:
-
– белок CDF-11, частью которого являются пептидная последовательность LQIIYGKIPR;
-
– новый пептид LQСIIYСGKIСPR с циклизацией по способу двухкомпонентного пептидного сшивания;
– кодирующая плазмида синтез нового пептида LQСIIYСGKIСPR с условным названием pET-25b(+)_GDF-11_mut.
Белок CDF-11 имеет трехмерную структуру, которая определяет его биологическую активность. На рис. 1 представлена трехмерная структура белка CDF-11 .
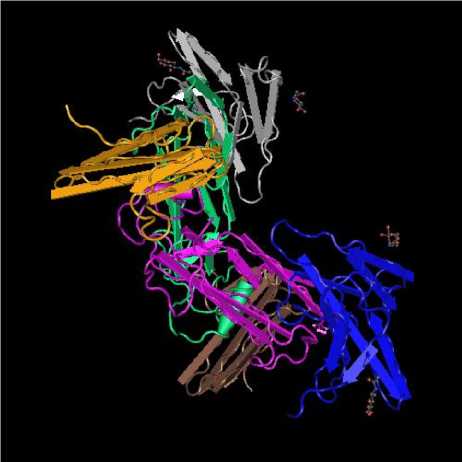
Рис. 1. Трехмерная структура белка CDF-11
10220#gene-expression)
Для изучения биоактивности и биодоступности новой пептидной последовательности белка GDF-1 предварительно ее преобразовали в строку программы SMILES
(Simplified Molecular Input Line Entry System) tools/convert-peptide-to-smiles-string) с помощью инструмента PepSMI.
Прогнозирование биологической активности, устойчивости к протеолизу и биодоступности пептидной последовательности проводили на платформе ADMET .
Синтез плазмид пептидной последовательности LQСIIYСGKIСPR нового рекомби- нантного белка осуществляли в Российской биотехнологической компании «Евроген» (г. Москва) методом циклической сборки из олигонуклеотидов (PCA, рolymerase cycling assembly). Сначала были синтезированы олигонуклеотиды, комплементарные либо одной, либо другой цепи гена, перекрывающиеся участками в 20–30 пар оснований. Затем с помощью ДНК-полимеразы были достроены цепи с заполнением промежутков между олигонуклеотидами. На последнем этапе сконструированный ген амплифицировался путем стандартной ПЦР. Последовательности, кодирующие белок GDF-11mut, после амплификации обрабатывали эндонуклеазами рестрикции BamHI и XhoI и клонировали в вектор pET-25b(+) по сайтам узнавания этих ферментов. Клоны были отсеквенированы методом Сэнгера.
Молекулярно-массовое распределение пептидной последовательности оценивали масс-спектрометрическим методом [17]. Идентификацию пептидной последовательности осуществляли методом MALDI-TOF MS Ultraflex (Bruker, Германия) [18].
Результаты исследований
Проведена циклизация пептидной последовательности белка GDF-11 LQIIYGKIPR путем введения и сшивания трех остатков цистеина, так как белок имеет трехмерную структуру и не является линейным. Полученная последовательность LQСIIYСGKIСPR позволяет создать устойчивую конструкцию всего белка, который можно в дальнейшем рассматривать как перспективный пищевой ингредиент при условии доказательства безопасности применения.
Кроме того, циклизация пептида позволяет повысить проницаемость им клеток, снизить общий почечный клиренс, что увеличивает период полувыведения пептида из системы кровообращения [8, 9].
Пептид может определяться как «лекарственно подобное вещество», если он удовлетворяет критериям правила Липински. Это правило включает несколько фундаментальных критериев: молекулярная масса (< 500 Да), количество доноров с Н-связью ≤ 5, акцепторов с Н-связью ≤ 10 и log P < 5. Молекулы, удовлетворяющие этим требованиям, будут биодоступны при приеме внутрь [19], но встречаются пептиды, характеристики которых не соответствуют правилу Липински, но они эффективны при пероральном приме- нении. Для приема внутрь пептидам необходимо иметь молекулярную массу до 1200 Да и быть в диапазоне по показателю log P от 5 до 8 ед. Доступные пероральные пептиды содержат в 5 раз больше доноров и акцепторов Н-связей [19].
Проведено прогнозирование показателей новой пептидной последовательности LQСIIYСGKIСPR на соответствие правил Липински и другим критериям биодоступности. Результаты представлены в таблице.
Предварительно пептид был преобразован в строку SMILES (Simplified Molecular Input Line Entry System), т. е. проведена ком- пьютерная сборка пептида в виде строки текста, однозначно описывающей каждый атом и связь в молекуле способом, доступным машинной обработке. Получен следующий ре-зNу[лCь@та@т: ]([H])(CC(C)C)C(=O)N[C@@]([H])(C CC(=O)N)C(=O)N[C@@]([H])([C@]([H])(CC) C)C(=O)N[C@@]([H])([C@]([H])(CC)C)C(=O) N[C@@]([H])(Cc1ccc(O)cc1)C(=O)NCC(=O)N [C@@]([H])(CCCCN)C(=O)N[C@@]([H])([C @]([H])(CC)C)C(=O)N1[C@@]([H])(CCC1)C (=O)N[C@@]([H])(CCCNC(=N)N)C(=O)O, который был использован для создания 2D-модели пептида, представленной на рис. 2.
NH
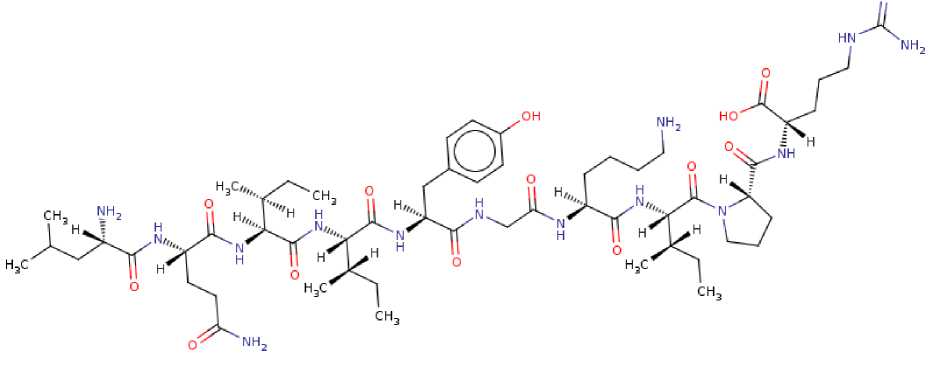
Рис. 2. 2D-модель новой пептидной последовательности LQСIIYСGKIСPR
Прогнозирование показателей новой пептидной последовательности LQСIIYСGKIСPR
|
Показатель |
Прогнозируемое значение |
Рекомендуемое значение |
|
Молекулярная масса, Да |
1199,74 |
До 1200 Да |
|
logP, моль/л |
5,63 |
5–8 |
|
logD7.4, логарифмических моль /л |
1,01 |
Менее 3 |
|
Количество доноров акцепторов nHD, ед. |
20,0 |
Более 16 |
|
pka (кислота), ед. |
6,17 |
Ниже базового 6,862 |
|
Fu,% |
95,312 |
Более 20 |
|
PPB, % |
8,152 |
Менее 90 |
|
CL плазма, мл/мин/кг |
2,03 |
0–5: отлично; 5–15: средний; > 15: плохо |
|
T1 /2, ч |
4,286 |
Средний период полувыведения от 4 до 8 |
|
VDss, л/кг |
0,237 |
0 до 20 |
|
Fsp3, ед. |
0,684 |
Более 0,42 |
|
MCE-18, ед. |
104,833 |
Более 45 |
Результаты исследования характеристик пептидной последовательности свидетельствуют о том, что она устойчива к протеолизу и соответствует рекомендуемым показателям для пероральных пептидов, представленных в работе [19], и правилу Липински. Так, молекулярная масса составляет до 1200 кДа, показатель logP, отражающий липофильность и возможность пептида растворяться, на уровне 5,63 при рекомендуемом значении от 5 до 8 моль/л [20]. Одним из важных показателей биодоступности пероральных пептидов является logD7.4, отражающий баланс между липофильностью и гидрофильностью. По нему оценивают возможность пептида проникать в клетку, т. е. достигать клеток-мишеней. В исследуемом пептиде logD7,4 на уровне 1,01 логарифмических моль/л при оптимальном значении менее 3.
Количество доноров акцепторов позволят судить о возможности пептида проникать через стенки кишечника и всасываться в кровь. Оптимальное значение для пептидов с возможностью перорального применения более 16,0 в исследуемом пептиде составляет 20 ед.
При pka ниже базового пептид характеризуется высокой всасываемостью. Базовое значение этого показателя у исследуемого пептида составляет 6,862 ед. Установлено, что pka (кислота) пептида составляет 6,17 ед., что ниже базового.
Показатель Fu отражает возможность пептида находиться в несвязанном состоянии в крови и проникать в клетки-мишени. Значение показателя более 20 % свидетельствует о его стабильности в кровотоке и доступности клеткам. У исследуемого пептида Fu равен 95,312 %, что согласуется со значением PPB (уровень связывания с белками плазмы). Вещества со значением PPB менее 90 % характеризуются высокой эффективностью клинического применения. У исследуемого пептида PPB составляет 8,152 %.
Пептид относится к веществам со средним периодом выведения и с необходимым плазменным клиренсом. Показатель VDss пептида имеет оптимальное значение, что отражает наряду с плазменным клиренсом его устойчивость к действию протеолитических ферментов, доступности организму и эффективности действия. Показатель Fsp3 показывает эффективность клинического применения на основании хорошей растворимости. Значение Fsp3 исследуемого пептида соответствует оптимальному. По показателю MCE-18 судят в целом о биологической активности пептидов. Значение более 45 является оптимальным. У исследуемого пептида – на уровне 104,833 ед.
Таким образом, циклический пептид LQСIIYСGKIСPR соответствует правилу Липински для пероральных пептидов, устойчив к протеолизу в жкт и ферментам крови, является биодоступным и эффективным. Следова-
Рис. 3. Хроматограмма праймера плазмиды pET-25b(+)_GDF-11_mut, кодирующая экспрессию пептида LQСIIYСGKIСPR в E.coli
тельно, целесообразно рассмотреть возможность его биологического синтеза в живом организме для последующего выделения и использования.
Проведены исследования по созданию плазмиды, кодирующей пептид
LQСIIYСGKIСPR с возможностью ее встраивания в биологический объект E. Coli и с последующей экспрессии исследуемого пептида.
Полученная плазмида получила условное название pET-25b(+)_GDF-11_mut. Хроматограмма праймера плазмиды, кодирующая экспрессию пептида LQСIIYСGKIСPR в E.coli , представлена на рис. 3.
Хроматограмма имеет следующую последовательность аминокислот:
AACAATCAGCTTCTTTCGGGCTTTGTTAG CAGCCGGATCTCAGTGGTGGTGGTGGTGG TGCTCGACATCCTCGGGGTCTTCCGGGGC GAGTTCTGGCTGGCTAGCCCGTTTGATCT CGAGACTACATCCGCATCGATCAACCACC ATACGTGGGATCTTACCATAAATAATCTG AAGTTTAGGATTAAAGTACAGCATGTTAA TGGGCGACATCTTGGTAGGTGTGCAGCAC GGGCCCGCATGGCTACAGCGCGGATTGG
CATGTACTAAATGGGTGTGCGGATATTTC TGACCAAACATGTACTCGCAGTTGCCAGA GCAATAGTTTGCTTTGTAACGGCGCGGAG CAATGATCCAATCCCAGCCGAACGCTTCG AAATCGACCGTCAGCGGATAACGA.
Выводы
В результате исследований проведена циклизация части пептидной последовательности белка GDF 11. Получена новая последовательность аминокислот LQСIIYСGKIСPR путем введения и сшивания трех остатков цистеина для образования устойчивой к протеолизу в жкт и крови конструкции пептида. Прогнозируемые значения показателей биодоступности и клинического применения пептида свидетельствуют об эффективности предложенной циклизации пептида и возможности перорального применения. Для экспрессии рекомбинантного белка с повышенной стабильностью к протеолизу и биодоступностью, содержащего последовательность циклического пептида, получена и синтезирована плазмида, определена последовательность аминокислот в ней. Дальнейшие исследования будут направлены на экспрессию белка GDF 11 mut E.coli.
Список литературы Разработка пептида, устойчивого к протеолизу, с последующим синтезом плазмиды, кодирующей его последовательность для экспрессии в биообъекте
- Мясной паштет для геродиетического питания при активном образе жизни / Е.А. Миф-тахутдинова, С.Л. Тихонов, Н.В. Тихонова [и др.] // Ползуновский вестник. 2020. № 2. С. 70-74.
- Miftahutdinova E.A., Tikhonov S.L., Tikhonova N.V. Development of lithium-containing feed additive and its use for fortification of chicken broilers meat and by-products // Theory and Practice of Meat Processing. 2020. Vol. 5, No. 1. P. 27-31. DOI: 10.21323/2414-438X-2020-5-1-27-31
- Permyakova L., Sergeeva I., Ryabokoneva L., Atuchin V., Li Y. Peptides of yeast Saccharo-myces cerevisiae activated by the malt sprout extract: Preparation, identification and bioactivity // Food Bioscience. 2024. V. 61, 104867. DOI: 10.1016/j.fbio.2024.104867
- Sergeeva I., Permyakova L., Markov A. et al. Peptides of yeast Saccharomyces cerevisiae activated by the aquatic extract of Atriplex sibirica L. // ACS Food Science & Technology. 2024. V. 4(1). P. 173-189. DOI: 10.1021/acsfoodscitech.3c00455
- Drucker DJ. Advances in oral peptide therapeutics // Nat Rev Drug Discov. 2020, 19(4):277-289. DOI: 10.1038/s41573-019-0053-0
- Bucheit J.D., Pamulapati L.G., Carter N. et al. Oral Semaglutide: A Review of the First Oral Glucagon-Like Peptide 1 Receptor Agonist // Diabetes Technol Ther. 2020. V. 22(1). P. 10-18. DOI: 10.1089/dia.2019.018
- Di L. Strategic approaches to optimizing peptide ADME properties // AAPS J. 2015. V. 17(1). P. 134-143. DOI: 10.1208/s12248-014-9687-3
- Wu F., John P., Gelfanov V. Synthesis of Four-Disulfide Insulin Analogs via Sequential Disulfide Bond Formation // The Journal of Organic Chemistry. 2017. V. 82(7). P. 3506-3512. DOI: 10.1021/acs.joc.6b03078
- Muttenthaler M., King G.F., Adams D.J., Alewood P.F. Trends in peptide drug discovery // Nat Rev Drug Discov. 2021. V. 20(4). P. 309-325. DOI: 10.1038/s41573-020-00135-8
- Liu X.Y., Ji X., Heinis C., Waser J. Peptide-Hypervalent Iodine Reagent Chimeras: Enabling Peptide Functionalization and Macrocyclization // Angew Chem Int Ed Engl. 2023. 14;62(33):e202306036. DOI: 10.1002/anie.202306036
- Keppler J.K., Heyse A., Scheidler E. et al. Towards recombinantly produced milk proteins: physicochemical and emulsifying properties of engineered whey protein betalactoglobulin variants // Food Hydrocoll. 2021. 110:106132. DOI: 10.1016/j.foodhyd.2020.106132
- Peptide and small molecule inhibitors of HECT-type ubiquitin ligases // Proc Natl Acad Sci USA. 2014 Nov 25;111(47): 16736-41. DOI: 10.1073/pnas.1412152111.
- Huang J. Protein and Peptide Studies in Kidney Disease: Prediction, Diagnosis and Treatment // Protein Pept Lett. 2018. V. 25(6). P. 512-513. DOI: 10.2174/092986652506180810154427
- Tomohiro K., Richard T. Lee, GDF-11 as a Potential Cardiac Pro-Angiogenic Factor* // JACC: Basic to Translational Science. 2023. V. 8, Iss. 6. P. 636-637. DOI: 10.1016/j.jacbts.2023.04.003
- Lian J., Walker R.G., D'Amico A. et al. Functional substitutions of amino acids that differ between GDF11 and GDF8 impact skeletal development and skeletal muscle // Life Sci Alliance. 2023;6:e202201662. DOI: 10.26508/lsa.202201662
- Harper S.C., Johnson J., Borghetti G. et al. GDF11 decreases pressure overload-induced hypertrophy, but can cause severe cachexia and premature death // Circ Res. 2018;123:1220-1231. DOI: 10.1161/CIRCRESAHA.118.312955
- Hubler S.L., Craciun G. Periodic patterns in distributions of peptide masses // Biosystems. 2012. V. 109(2). P. 179-185. DOI: 10.1016/j.biosystems.2012.04.008
- Webster J., Oxley D. Protein identification by MALDI-TOF mass spectrometry // Methods mol. biol (Clifton, N.J.). 2012. V. 800. P. 227-240. DOI: 10.1007/978-1-61779-349-3_15
- Santos G.B., Ganesan A., & Emery F.S. Oral Administration of Peptide-Based Drugs: Beyond Lipinski's Rule // Chem Med Chem. 2016. V. 11(20). P. 2245-2251. DOI: 10.1002/cmdc.201600288
- Broccatelli F., Aliagas I., Zheng H. Why Decreasing Lipophilicity Alone Is Often Not a Reliable Strategy for Extending IV Half-life // ACS Med Chem Lett. 2018. No. 19. P. 522-527. DOI: 10.1021/acsmedchemlett.8b00047


