Разработка пищевого ингредиента для производства ферментированных напитков
Автор: Волкова Г.С., Толокнова А.А., Куксова Е.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Пищевые технологии
Статья в выпуске: 10, 2025 года.
Бесплатный доступ
Цель исследования – разработать состав пищевого ингредиента на основе консорциума штаммов молочнокислых бактерий и бифидобактерий для производства ферментированных напитков. Исследование проведено в лаборатории биотехнологии органических кислот, пищевых и кормовых добавок ВНИИПБТ. Объекты исследования – штаммы молочнокислых бактерий из коллекции института: L. delbrueckii ssp. bulgaricus Д16, L. plantarum 578/25, L. helveticus 842(D)2, L. lactis subsp. lactis М12, St. thermophilus В92 и бифидобактерии B.longum Б2, а также закваска для специализированной молочной продукции (PILEGE, Франция) в качестве сравнения. Исследование проводили на гидролизате разбавленной творожной сыворотки с 7 % концентрата сывороточного белка. Контроль процессов ферментации осуществляли по следующим показателям: содержание сухих веществ, титруемая кислотность, накопление биомассы бактерий оценивали измерением оптической плотности. Подобран состав консорциума на основе технологических свойств штаммов и соотношения молочнокислых бактерий и бифидобактерий 2 : 1, разработаны технологические режимы с достижением титра клеток на 15 ч роста: пробиотические лактобактерии – 64,5·108 КОЕ/см3, молочнокислые бактерии – 15·109 КОЕ/см3, бифидобактерии – 6,8·109 КОЕ/см3. Бактериальную массу выделяли на центрифуге ОПН16 при 10 000 об/мин (4 °C) в течение 15 мин, концентрирование осуществляли через полисульфонамидную мембрану УПМ20 при 20 °С. Полученный концентрат замораживали и лиофильно высушивали. Титр микроорганизмов определяли при рассеве на селективные агаризованные среды. В составе пищевого ингредиента содержится лиофилизат бактерий с титром 59,9·109 КОЕ/г, пищевые волокна в виде пребиотика инулина, а также сахарозаменители эритрит и сукралоза. Полученный комплексный пищевой ингредиент может быть рекомендован как компонент БАД к пище или для производства обогащенных пищевых продуктов в качестве источника бифидобактерий, пробиотических молочнокислых бактерий и пребиотиков. Для создания основы ферментированного напитка использовали пищевой ингредиент в качестве источника пробиотиков с получением на соевой сыворотке на 24 ч роста накопление биомассы 1,4·107 КОЕ/см3.
Пищевой ингредиент, молочнокислые бактерии, пробиотик, пребиотик, биосовместимость, ассоциация бактерий
Короткий адрес: https://sciup.org/140312653
IDR: 140312653 | УДК: 663.15 | DOI: 10.36718/1819-4036-2025-10-248-259
Текст научной статьи Разработка пищевого ингредиента для производства ферментированных напитков
Введение. Разработка технологий получения продуктов питания с пробиотическими свойствами на основе отечественных штаммов, учитывая санкционную политику, является актуальной задачей. С учетом изменения структуры пищевого рациона человека существуют определенные риски формирования алиментарно-зависимых заболеваний, связанных как с нарушением принципов оптимального питания, так и с качеством и безопасностью пищевой продукции.
При использовании микроорганизмов для создания новых пищевых ингредиентов для пищевой промышленности необходимы полная идентификация используемых штаммов и под- твержденные биологические свойства [1], что регламентируется нормативными документами. При этом определяющее значение имеет метаболический профиль штамма, который является специфичным и определяет эффективность пищевого ингредиента [2]. Штаммы бактерий в составе консорциумов могут проявлять различные биосинтетические и технологические свойства в зависимости от уровня их биологической совместимости [3]. Поэтому применение комплексного подхода к созданию пищевых ингредиентов позволит получить новый рецептурный компонент для создания специализированных пищевых продуктов, таких как ферментированные напитки, содержащие пробиотические микроорганизмы.
В последние годы возрос спрос на функциональные продукты, содержащие синбиотики, что стимулировало их включение в другие пищевые матрицы, помимо молочных, для удовлетворения растущего спроса потребителей на новые вкусы. Фрукты, злаки и соевые бобы были предложены в качестве новых матриц, поддерживающих доставку синбиотиков в организм человека.
Анализ опубликованных данных показывает, что при разработке пищевых ингредиентов син-биотиков используются штаммы с доказанными пробиотическими свойствами в комбинации с олигосахаридами [4–7], а также с включением в состав витаминов и аминокислот [8, 9]. В соответствии с современными представлениями о синбиотиках каждый его компонент по отдельности должен обладать терапевтическим эффектом, а доза каждого из них должна быть адекватной для независимого достижения этого эффекта [10]. Следует отметить, что положительное влияние пробиотиков и пребиотиков на здоровье в значительной степени зависит от их соответствующих комбинаций и формы внесения [11].
Развитие нутримикробиомики определило научный подход к коррекции дисбиотических нарушений желудочно-кишечного тракта человека с помощью пищевых ингредиентов синбио-тиков на основе консорциумов бифидо- и молочнокислых бактерий в сочетании с пребиоти-ками и биологически активными веществами, что является предметом исследования и научного анализа. В ряде исследований показано, что использование синбиотиков значительно снижает риск развития сердечно-сосудистых заболеваний, распространенность метаболического синдрома и маркеры резистентности к инсулину у пожилых пациентов [1, 7, 8].
Для повышения эффективности пищевых ингредиентов синбиотиков и обеспечения стабильности и жизнеспособности входящих в их состав штаммов могут быть применены различные стратегии, такие как микрокапсулирование или лиофилизация с применением защитной среды-протектора. Необходимы дальнейшие исследования по разработке соответствующих технологий, матриц носителей, способствующих выживанию бактериальных клеток в условиях желудочно-кишечного тракта, а также подбору пробиотических штаммов [12, 13]. Лиофилиза- ция пробиотических бактерий представляет собой подход, который может быть применен в ряде продуктов питания для достижения широкого спектра функциональных особенностей.
Всемирная организация здравоохранения рекомендует уменьшить потребление сахара до 10 % от общей потребляемой энергии как среди взрослых людей, так и среди детей. Среди подсластителей есть соединения, которые имеют сладкий вкус и не содержат калорий, или такие, сладость которых настолько интенсивна, что их можно использовать в очень низких концентрациях, поэтому их влияние на общую калорийность продукта незначительно. Сахароспирты-полиолы, относящиеся к углеводам, являются как натуральными заменителями сахара, так и пищевыми ингредиентами. Они становятся все более и более популярными среди потребителей, в основном из-за более низкой калорийности и гликемического индекса. Сахарные спирты часто комбинируют в составе пищевых ингредиентов с другими подсластителями для усиления сладости пищевых продуктов.
Таким образом, при создании пищевого ингредиента синбиотика для пищевой промышленности необходима разработка эффективной формулы, включающей биомассу консорциума пробиотических бактерий с высоким титром, а также комплекс пребиотиков, обеспечивающих синбиотические свойства и комбинацию подсластителей в качестве альтернативы сахару, что является весьма актуальной темой, касающейся вопроса о сохранении здоровья человека.
Цель исследования - обосновать состав комплексного пищевого ингредиента синбиоти-ческого действия, в состав которого входит лиофилизат биомассы консорциума молочнокислых и бифидобактерий, созданного на основе штаммов из коллекции ВНИИПБТ.
Задачи : выбор штаммов пробиотиков на основе биологических характеристик; создание консорциума штаммов на основе биосовместимости; изучение технологических свойств на жидкой питательной среде; лиофилизация биомассы с оценкой титра клеток; составление рецептуры пищевого ингредиента; сбраживание соевой сыворотки консорциумом бактерий, входящих в состав пищевого ингредиента.
Объекты и методы. Объектами исследования являлись штаммы молочнокислых бактерий L. bulgaricus Д-16, L. plantarum 578/25, L. helve-ticus 842(D)-2, L. lactis subsp. lactis М-12, St. ther- mophilus В-92, бифидобактерии B. longum Б-2 из коллекции ВНИИПБТ (моделируемый консорциум) и закваска для специализированной молочной продукции (LACTIBIANE® REFERENCE, пр-во PILEGE, Франция), в состав которой входят штаммы L. bulgaricus LA 308, L. plantarum LA 301, L. helveticus LA 102, L. lactis LA 103, St. thermophilus LA 104 и B. longum LA 101 (контрольный консорциум).
Восстановление и активирование штаммов-продуцентов исследуемых культур молочнокислых бактерий и бифидобактерий проводили путем переноса культур из ампул или скошенных плотных агаровых сред в пробирки с селективными жидкими питательными средами для молочнокислых и бифидобактерий, затем проводили выращивание в термостате при оптимальных температурах и рН, указанных в паспортах изучаемых штаммов-продуцентов, затем делали последующие пересевы. Далее проводили адаптацию штаммов со стандартных синтетических питательных сред на среду с неосвет-ленной творожной сывороткой с внесением дополнительных источников питания минерального и органического происхождения в качестве ростостимулирующих факторов.
Использовали жидкую питательную среду MRS для пересева молочнокислых бактерий, гидролизатно-молочную среду для бифидобактерий, среду Lee и М-17 для лактококков и стрептококков.
В качестве питательной среды для консорциума использовали творожную сыворотку (содержание сухих веществ 6 %, рН 5,3) с добавлением концентрата сывороточного белка в количестве 7 % к объему после гидролиза β-галак-тозидазой (пр-во Индия) 0,1 % в течение 2 ч при 50 °С. Далее проводили гидролиз 1 % Alcalase, 2 % Flavorzyme в течение 3 ч при 55 °С, добав- ляли минеральные соли KH2PO4 – 0,1 %, MnSO4 4H2O – 0,05 %, MgSO4 7H2O – 0,02 %, Na3C6H5O7 2H2O – 0,03 %, L-цистеин – 0,05 г, твин-80 – 1,0 г, рН среды – 7,0. Количество посевного материала 5 %, ферментацию проводили при 37 °С в течение 24 ч в условиях термостата.
Контроль ферментации осуществляли по содержанию сухих веществ, титруемой кислотности и микроскопированию с использованием микроскопа Nikon ECLIPSE Ci-S/Ci-L. Накопление биомассы бактерий оценивали измерением оптической плотности (ОП) при 620 нм на спектрофотометре СФ-2000, количество клеток определяли по калибровочной кривой.
После центрифугирования биомассы при 10 000 об/мин и 4 °C в течение 15 минут клетки концентрировали, подвергали криоконсервации и лиофилизации. Подсчет жизнеспособных микроорганизмов (КОЕ) осуществляли на агаризо-ванных селективных средах (MRS агар для лактобактерий и агар для бифидобактерий) с помощью автоматизированного счетчика колоний Scan 500 (Interscience, Франция).
Для основы ферментированного напитка в качестве питательной среды использовали соевую сыворотку, полученную при производстве соевого сыра тофу (с. в. 10 %, пр-во ООО «ПК ПИТЭКО»).
Статистическую обработку данных проводили с использованием программы Statistica 6.0 методом однофакторного дисперсионного анализа при уровне значимости 0,05.
Результаты и их обсуждение. На селективных жидких питательных средах при оптимальных для каждого штамма моделируемого консорциума температуре и рН определяли максимальный титр жизнеспособных клеток и выход кислоты от использованного субстрата на 48 ч роста. Результаты представлены в таблице 1.
Таблица 1
Технологические показатели штаммов Technological parameters of strains
|
Штамм |
Выход молочной кислоты, % |
Титр клеток, КОЕ/см3 |
|
L. bulgaricus Д-16 |
87,5 |
6,1·108 |
|
L. plantarum 578/25 |
88,0 |
8,5·108 |
|
L. helveticus 842(D)-2 |
85,5 |
5,7·108 |
|
L. lactis subsp. lactis М-12 |
83,5 |
1,2·109 |
|
St. thermophilus В-92 |
85,3 |
0,5·109 |
|
B. longum Б-2 |
56,6 |
1,0·109 |
Согласно полученным экспериментальным данным штаммы молочнокислых бактерий моделируемого консорциума накапливают молочную кислоту с выходом 83–88 % и биомассу.
Для подтверждения эффективности моделируемого консорциума проводили оценку роста отдельных штаммов для бифидобактерий и молочнокислых бактерий в сравнении со штаммами, входящими в состав контрольного консор- циума. Рост контролировали визуально по изменению оптической плотности культуральной жидкости питательной среды, по изменению показателя титруемой кислотности культуральных жидкостей микроскопией культуральной жидкости. Результаты культивирования штаммов бифидобактерий на гидролизатно-молочной среде представлены на рисунке 1.
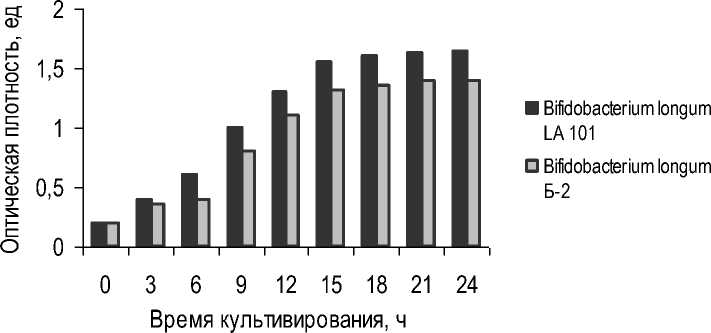
Рис. 1. Динамика изменения оптической плотности штаммов бифидобактерий, Входящих в состав моделируемого консорциума (B. longum Б-2) и контрольного консорциума (B. longum LA 101)
Dynamics of changes in optical density of Bifidobacterium strains included in the modelled consortium (B. longum B-2) and control consortium (B. longum LA 101)
При сравнении штамма Bifidobacterium lon-gum Б-2 и штамма Bifidobacterium longum LA 101 было выявлено, что величина оптической плотности культуральной жидкости на 24 ч роста штамма B. longum LA 101 превышает показа- тель штамма B. longum Б-2, что свидетельствует о большем накоплении биомассы.
В дальнейших исследованиях изучали влияние количества посевного материала на накопление биомассы штаммами бифидобактерий. Результаты представлены в таблице 2.
Таблица 2
|
Доза инокулята, % ( Bifidobacterium longum Б-2 и Bifidobacterium longum LA 101) |
Титр жизнеспособных клеток, КОЕ/см3 |
|||
|
Продолжительность культивирования, ч |
||||
|
6 |
12 |
18 |
24 |
|
|
3 |
5·107 |
3,2·108 |
9·108 |
0,3·109 |
|
5 |
8·107 |
5,8·108 |
9,4·108 |
0,8·109 |
|
7 |
1·108 |
7,4·108 |
9,8·108 |
1,3·109 |
Влияние количества посевного материала на рост бифидобактерий
Effect of inoculum quantity on the growth of bifidobacteria
Из данных таблицы 2 видно, что количество посевного материала значимо влияет на накопление биомассы бифидобактерий на конец культивирования. Для дальнейших исследований выбрано количество посевного материала 5 %, так как при этом титр х клеток к 24 ч куль- тивирования составляет 0,8·109 КОЕ/см3, что свидетельствует о высокой активности штаммов бифидобактерий. Повышение дозы инокулята до 7 % с экономической точки зрения невыгодно.
В продолжение экспериментальных исследований изучали рост и развитие молочнокислых бактерий (МКБ), входящих в состав моделируемого и контрольного консорциума. Штам- мы молочнокислых бактерий культивировали совместно на жидкой питательной среде MRS в соотношении 1:1:1:1. Результаты представлены на рисунке 2.
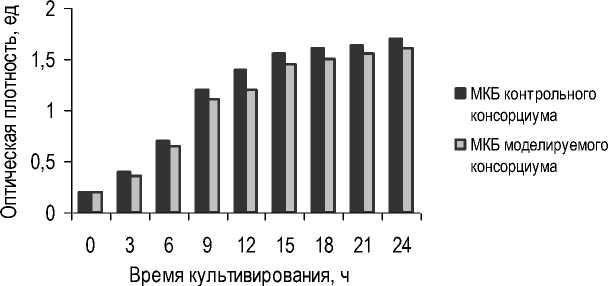
Рис. 2. Динамика изменения оптической плотности штаммов молочнокислых бактерий, входящих в состав моделируемого и контрольного консорциума
Dynamics of changes in optical density of lactic acid bacteria strains included in the modelled and control consortia
Отмечено, что штаммы молочнокислых бактерий моделируемого консорциума практически повторяют динамику роста молочнокислых бактерий контрольного консорциума, а также обеспечивают высокую плотность популяции с сохранением соотношения штаммов, что свидетельствует о возможности использования штаммов молочнокислых бактерий в составе моделируемого консорциума для накопления биомассы при совместном культивировании для
На следующем этапе исследований изучали рост консорциумов молочнокислых и бифидобактерий, обращая внимание на соотношение стабильности соотношения штаммов в процессе ферментации при внесении 5 % посевного материала от объема питательной среды MRS с внесением ростостимулирующих добавок для бифидобактерий (L-цистеина и твина-80). Результаты представлены в таблице 3.
производства пищевого ингредиента.
Таблица 3
Выход органических кислот от используемого субстрата при росте консорциумов бактерий на жидкой среде MRS, %
Yield of organic acids from used substrate during growth of bacterial consortia on MRS liquid medium, %
|
Состав консорциума |
Выход молочной кислоты от субстрата, % |
|
Моделируемый: L. delbrueckii ssp. bulgaricus Д-16, L. plantarum 578/25, L. helveticus 842(D)-2, L. lactis subsp. lactis М-12, St. thermophilus В-92, B. longum Б-2 |
89,7 |
|
Контрольный: L. helveticus LA 102, L. bulgaricus LA 308, L. plantarum LA 301, L. lactis LA 103, St. thermophilus LA 104, B. longum LA 101 |
90,0 |
Представленные в таблице 3 данные показывают, что по выходу молочной кислоты – а значит, и по технологическим свойствам – моделируемый консорциум практически не уступает показателям консорциума сравнения.
Далее изучали динамику кислотообразова-ния моделируемого и контрольного консорциу- ма на гидролизате творожной сыворотки. Молочнокислые бактерии засевали после 6 ч культивирования штаммов бифидобактерий в соотношении 2:1 при рН 5,6–5,9. Результаты изучения динамики титруемой кислотности культуральной жидкости приведены на рисунке 3.
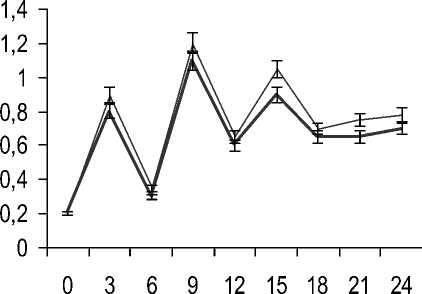
^^^^м Моделируемый консорциум
Контрольный консорциум
Время ферментации, ч
Рис. 3. Динамика титруемой кислотности в процессе роста моделируемого и контрольного консорциума бифидобактерий и молочнокислых бактерий Dynamics of titratable acidity during growth of modelled and control consortium of bifidobacteria and lactic acid bacteria
Анализ изменения титруемой кислотности в процессе роста каждого консорциума свидетельствует об активном кислотообразовании в первые часы ферментации, фаза адаптации практически отсутствует, при этом моделируемый консорциум по технологическим признакам практически повторяет показатели контрольного консорциума. Добавление в питательные среды ростостимулирующих факторов интенсифицировало прирост биомассы, что говорит об отсутствии конкуренции за углеводный субстрат для роста штаммов-продуцентов, являющихся классическими симбионтами и фактором мутуализма молочнокислых и бифидобактерий. Симбиотические отношения, наблюдаемые между этими микроорганизмами, основаны на снабжении ими друг друга необходимыми для роста и развития веществами.
Титр клеток моделируемого консорциума достигает максимума на 15 ч роста и составил 8,5·108 КОЕ/см3. Это время ферментации соответствует концу экспоненциальной фазы роста и началу стационарной фазы роста консорциума.
Микроскопия культуральной жидкости (рис. 4) показала, что соотношение штаммов сохранено, отсутствует явление конкуренции молочнокислых бактерий и бифидобактерий за источники углеводов, что подтверждает симбиотические взаимодействия штаммов в смешанной культуре.
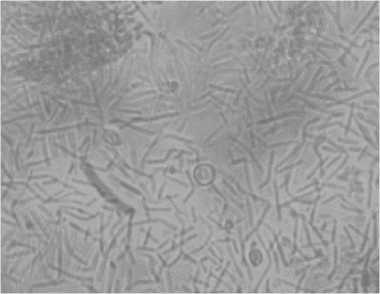
Рис. 4. Микроскопия культуральной жидкости моделируемого консорциума после 15 ч роста на гидролизате творожной сыворотки
Microscopy of culture fluid of a simulated consortium after 15 hours of growth on curd whey hydrolysate
Отсутствуют морфологические изменения клеток, таких как инволюционные и шаровидные формы клеток бифидобактерий, наличие как одиночных клеток с четким контуром, так и длинных цепочек молочнокислых бактерий. Результаты эксперимента показали, что модели- руемый консорциум молочнокислых и бифидобактерий является перспективным и сопоставимым с зарубежным аналогом.
После концентрирования биомассы до 6,0·1010 КОЕ/см3 концентрат смешивали с защитной средой (рисовый мальтодекстрин, 5 % желатоза, 1 % цитрата натрия, 0,1 % витами- на С) в соотношении 1:1, после чего замораживали в морозильной камере при –55 °С и лио-фильно высушивали. После досушивания лиофилизат смешивали с пищевыми волокнами и подсластителем. Внешний вид лиофилизата приведен на рисунке 5, А, титр клеток в лиофилизате биомассы – в таблице 4.

А
Рис. 5. Лиофилизат биомассы консорциума бифидобактерий и молочнокислых бактерий (А) и посев для подсчета титра живых клеток молочнокислых бактерий в лиофилизате (Б) Bifidobacterium bifidobacterium and lactic acid bacteria consortium biomass lyophilisate (A) and sowing for counting the titre of live cells of lactic acid bacteria in the lyophilisate (Б)

Б
Таблица 4
Количество живых клеток молочнокислых и бифидобактерий в лиофилизате биомассы Number of live cells of lactic acid and bifidobacteria biomass lyophilisate
|
Бактерии |
Титр штаммов-продуцентов, КОЕ/г |
|
Пробиотические лактобактерии: |
10,9·109 |
|
Молочнокислые бактерии |
19,5·109 |
|
Бифидобактерии: Bifidobacterium longum Б-2 |
16,9·109 |
|
Итого: |
59,9·109 |
Титр штаммов-продуцентов полученного лиофилизата биомассы был сравнен с титром концентратов с криопротекторными средами перед лиофильным высушиванием, и процент потерь жизнеспособных клеток составил от 20 до 25 %, что не превышает 30 % потерь в стандартных технологиях получения пищевых добавок на стадии лиофилизации.
Основываясь на проведенном исследовании, можно утверждать, что предложенные технологические параметры применимы в процессе создания пищевого ингредиента – синбиотика. Данный продукт, созданный на базе моделируемого консорциума, по количеству активных клеток не уступает зарубежным аналогам.
Далее полученные лиофилизаты могут быть направлены на стадию смешивания и фасовки.
В результате систематизации данных литературы и с учетом анализа отечественного рынка выпускаемых комплексных пищевых ингредиен-тов-синбиотиков был сделан расчет количества каждого компонента в составе рецептуры, в качестве пребиотика выбран инулин, для придания сладкого вкуса – эритрит и сукралоза. Рецептура комплексного пищевого ингредиента синбиотического действия содержит лиофилизат биомассы молочнокислых и бифидобактерий 1 г/10 г добавки, эритрит (Е968) – 6,992 г/10 г добавки, инулин – 2 г/10 г добавки, сукралоза (Е955) – 0,008 г/10 г добавки. Расчет сделан на основе адекватных уровней суточного потребления (АУП) биологически активных веществ, а также требований ТР ТС 029/2012.
Далее была рассчитана пищевая и энергетическая ценность в соответствии с требованиями ТР ТС 022/2011 (прил. 4, 5): пищевая ценность в 100 г, г: белки – 5; жиры – 0; углеводы – 6,6, в т. ч. инулин – 1,6 г, эритрит – 70,0 г. Энергетическая ценность, ккал/100 г продукта – 82,0 ккал.
Сделан расчет количества биологически активных компонентов добавки при суточном потреблении 10 г пищевого ингредиента (суточная порция) (табл. 5).
Таблица 5
Содержание биологически активных компонентов в пищевом ингредиенте-синбиотике Content of biologically active components in the food ingredient-synbiotic
|
Компонент |
КОЕ/г |
АУП |
|
Бифидобактерии |
7,7·109 |
5·108 – 5·1010 |
|
Пробиотические молочнокислые бактерии |
10,8·108 |
5·107 – 5·109 |
|
Молочнокислые бактерии |
3,2·109 |
5∙107– 5∙109 |
|
Биологически активные вещества |
Количество, г в 10 г |
% от АУП |
|
Инулин |
2,0 |
80 |
Таким образом, полученный пищевой ингредиент по своему составу может являться биологически активной добавкой к пище и использоваться в качестве ингредиента специализированных пищевых продуктов, источника бифидобактерий, пробиотических молочнокислых бактерий и пребиотиков.
Для создания основы ферментированного напитка проведено сбраживание соевой сыворотки консорциумом бактерий, входящих в сос- тав пищевого ингредиента. Ферментацию проводили при 37 °С в течение суток, засев сыворотки – в количестве 0,1 г/100 см3 с изучением накопления биомассы. Контролем служила соевая сыворотка, ферментированная лиофилизированной культурой L. plantarum 578/25 в таком же количестве. Экспериментальные данные по динамике накопления биомассы на соевой сыворотке представлены на рисунке 6.
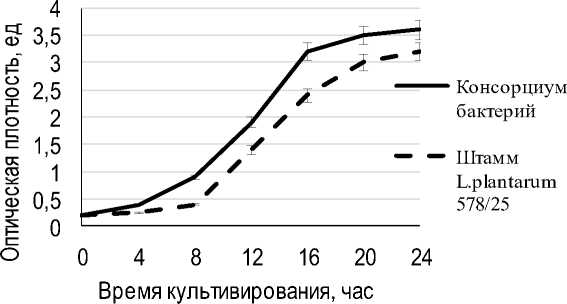
Рис. 6. Динамика накопления биомассы при сбраживании соевой сыворотки Dynamics of biomass accumulation during soya whey digestion
Результаты брожения соевой сыворотки показывают, что штаммы, входящие в состав созданного пищевого ингредиента, обеспечивают высокую активность консорциума. На 24 ч роста консорциума на соевой сыворотке суммарный титр пробиотических культур составляет 1,4·107КОЕ/см3.
Представленные экспериментальные данные являются продолжением исследований авторов по получению консорциумов молочнокислых бактерий для производства пищевых ингредиентов с пробиотическими свойствами [2, 14], а также по изучению биосинтетических свойств штаммов молочнокислых бактерий для
Пищевые технологии производства ферментированных пищевых продуктов.
В настоящее время сохраняется тренд на повышение биосинтетических свойств консорциумов пробиотических бактерий, идентификацию и определение биологических свойств биологически активных веществ молочнокислых бактерий, что подтверждают ряд авторов [3–5, 9, 10, 15, 16], считая данное направление актуальным в области микробиологии и пищевой биотехнологии.
В опубликованных статьях [2, 4, 10, 12, 15, 16] отмечено, что сохраняется актуальность в поиске эффективных отечественных консорциумов штаммов пробиотических бактерий, при этом необходимо учитывать не только технологические свойства, но и характер межштаммовых взаимодействий в смешанной культуре и подтверждать пробиотические характеристики штаммов известными методами. В данном исследовании используемые штаммы молочнокислых бактерий и бифидобактерий составляют консорциум, который характеризуется стабильностью состава при пересевах и сохраняет его в процессе применения. Планируется продолжение исследований функциональных свойств пищевого ингредиента в составе ферментированного продукта в клинических условиях. Титр пробиотических микроорганизмов в сухом лиофилизате пищевого ингредиента является достаточно высоким и сопоставим с опубликованными данными [4, 6,10,12,15]. Состав моделируемого кон- сорциума и технологические показатели накопления биомассы являются оригинальными.
Консорциум молочнокислых бактерий и бифидобактерий, используемый в работе, ранее не использовался в составе пищевых ингредиентов. По показателю титра клеток в сравнении с аналогами [3, 5] пищевой ингредиент – синбиотик имеет биотехнологический потенциал использования в технологии ферментированных напитков, обогащенных пробиотическими микроорганизмами [16, 17], и для производства обогащенных продуктов питания.
Заключение. Разработанный пищевой ингредиент содержит биомассу молочнокислых бактерий и бифидобактерий с высоким титром, имеет низкую калорийность, содержит пребиотики.
Моделируемый консорциум, включающий в себя конкурентноспособные отечественные штаммы бифидо- и молочнокислых бактерий, не уступает по характеристикам контрольному консорциуму производства Франции. Поэтому применение отечественных стартовых культур при создании нового пищевого ингредиента – син-биотика поможет предложить пищевой отрасли альтернативу импортным аналогам.
Разработанный комплексный пищевой ингредиент может использоваться при сбраживании соевой сыворотки, получаемой при производстве сыра тофу, в качестве источника молочнокислых бактерий с получением основы ферментированного напитка.


