Разработка продуцента комплексного ферментного препарата для переработки крахмалсодержащих отходов с фильтр-прессов при производстве хлебопекарных дрожжей
Автор: С.С. Перкин, Г.П. Шуваева, Е.М. Мотина, Д.А. Черенков, С.Ф. Яковлева, О.C. Корнеева
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 3 (89), 2021 года.
Бесплатный доступ
Недостаточное использование передовых технологий с более эффективной переработкой сырья приводит к большому количеству производственных отходов при производстве хлебопекарных прессованных дрожжей. К отходам производства дрожжевой промышленности относятся: осадок после осветления мелассы (шлам), обездрожженная бражка, промывные воды и дрожжи в виде отхода на фильтр-прессах. Выход дрожжей в виде отхода на фильтр-прессах, которые могут использоваться на кормовые цели, составляет порядка 1,5 % к массе получаемых дрожжей, а основной компонент отходов – крахмал. Для его переработки авторами проведен скрининг микроорганизмов – продуцентов и выбран генетически компетентный штамм, способный к синтезу целевых ферментов (глюкоамилазы, ?-амилазы, пуллуланазы) - Rhisopus tritici t1 (Rh. oryzae t1) с активностью, энзимов, соответственно, 100,0; 8,4 и 20,0 ФЕ/мл. Разработаны условия жидкофазного культивирования продуцента, обеспечивающие максимальный биосинтез целевых ферментов и получение комплексного ферментного препарата для переработки крахмалсодержащих отходов с фильтр-прессов при производстве хлебопекарных дрожжей. Отмечено, что лучшим источником углерода для продуцента Rhisopus tritici t1 являются крахмал, декстрин и мальтоза. Рациональный состав среды, обеспечивающий максимальные величины синтезируемых ферментов, включает, %:крахмал – 16, азотнокислый калий – 0,8, кукурузный экстракт – 0,85. Активности ферментов – глюкоамилазы, альфа-амилазы и пуллуланазы – увеличились к 96-120 часам культивирования, соответственно, на (%): 18,0; 19,0 и 50,0.
Ферментный препарат, дрожжи, глюкоамилаза, а-амилаза, пуллуланаза
Короткий адрес: https://sciup.org/140259869
IDR: 140259869 | УДК: 670 | DOI: 10.20914/2310-1202-2021-3-106-114
Текст научной статьи Разработка продуцента комплексного ферментного препарата для переработки крахмалсодержащих отходов с фильтр-прессов при производстве хлебопекарных дрожжей
Современное отечественное производство хлебопекарных дрожжей обеспечивает потребности российского рынка на 90%.
Несмотря на технологические модернизации, которые провели большинство российских заводов, техническое состояние отрасли остается на относительно невысоком уровне [1]. Ввиду недостаточного финансирования, практически не используются передовые технологии, связанные с энергосбережением, с более эффективным использованием сырья, и, прежде всего, с рациональным использованием производственных отходов. Рост цен на основное сырьё, тепловые и энергетические, транспортные ресурсы, делает невозможным сокращение себестоимости продукта для дрожжевых заводов, отнимая, тем самым, у предприятия возможность увеличить прибыль, обеспечить техническую модернизацию и социальное развитие.
К отходам производства дрожжевой промышленности относятся: осадок после осветления мелассы (шлам), обездрожженная бражка, промывные воды и дрожжи в виде отхода на фильтр-прессах.
Выход дрожжей в виде отхода на фильтрпрессах, которые могут использоваться на кормовые цели, составляет порядка 1,5% к массе получаемых дрожжей. Химический состав крахмалсодержащего отхода на фильтрпрессах достаточно разнообразен (таблица 1).
Таблица 1.
Химический состав крахмалсодержащего отхода
Table 1.
Chemical composition of starch-containing waste
|
Вещество | Material |
Содержание, % Content, % |
|
Жиры | Fat |
0,34 |
|
Белки | Protein |
6,90 |
|
Углеводы (крахмал) Carbohydrates (starch) |
83,10 |
|
Вода | Water |
6,52 |
|
Зола | Ash |
3,14 |
Как видно из данных, приведенных в таблица 1, основной компонент отходов – крахмал. Крахмал – главный резервный полисахарид растений. Как известно, его полисахаридная фракция состоит из 2-х компонентов: амилозы и амилопектина. Амилоза легко растворяется в теплой воде, образуя истинные растворы, которые неустойчивы и способны к самопроизвольному выпадению в осадок в виде кристаллов. Молекулярная масса колеблется в пределах 50–150 тыс. Каждая молекула содержит от 300 до 500 остатков молекулы глюкозы (рисунок 1).
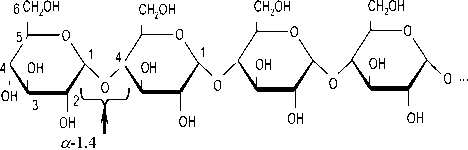
Рисунок 1. Структурная формула молекулы амилозы
Figure 1. Structural formula of amylose molecule
Амилопектин (рисунок 2) в отличие от амилозы трудно растворим в горячей воде. В раствор он переходит при температуре 120 ° С, образуя стойкие, но вязкие растворы. Молекулярная масса колеблется в пределах от 100 000 до 1 000 000.
CH OH CH OH
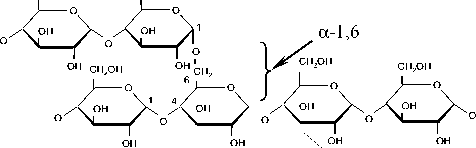
Рисунок 2. Структурная формула молекулы амилопектина
Figure 2. Structural formula of amylopectin molecule
В пищевой промышленности и природе крахмал подвергают интенсивным ферментативным превращениям. Основной реакцией при этом превращении является гидролиз крахмала амилазами. Продуцентами этих ферментов могут быть растения, животные и бактерии. Амилазы в растениях содержатся в семенах хлебных культур, у животных – в слюне и поджелудочной железе. Их синтезируют многие бактерии рода Bacillus , микромицеты родов Aspergillus, Rhizopus . Активные амилазы содержатся в солоде. По способу действия амилазы делятся на а -амилазу, р -амилазу, глюкоамилазу, пуллуланазу.
а -Амилаза - декстринирующий фермент, превращающий молекулу крахмала в ее осколки. Она интенсивно разжижает крахмальный клейстер, действуя на глубинные а -1,4 -гликозидные связи без определенного порядка При этом образуются декстрины и небольшое количество мальтозы.
в -Амилаза - осахаривающий фермент, гидролизует в крахмале каждую вторую а -1,4 - гликозидную связь, начиная с нередуцирующего конца полисахаридной цепи. Продуктами реакции являются мальтоза небольшое количество высокомолекулярных декстринов, называемых р -амило-декстринами.
Глюкоамилаза в отличие от α - и β -амилаз расщепляет в молекуле крахмала α -1,4- и α -1,6 – гликозидные связи, осуществляя полный гидролиз крахмала до глюкозы. α -Амилаза и β -амилаза гидролизуют крахмал на 95%, 5% – остаточные конечные декстрины, которые содержат все α -1,6 – гликозидные связи.
Большинство разновидностей крахмала, важных в промышленном отношении, содержит 80% амилопектина, который лишь частично расщепляется в ходе ферментативного гидролиза. Под действием α –амилаз из него образуются производные декстринов, которые далее уже гидролизоваться не могут. Так как по точкам ветвления гидролиз под действием глюкоамилазы идет медленно, используют α –1,6 – глюкозидазы, из них в промышленном масштабе – пуллуланазу.
Пуллуланаза (пуллулан-6-глюкано-гид-ролаза, К.Ф. 3.2.1.41) гидролизует α-1,6 – гликозидные связи в пуллулане, гликогене, амилопектине и предельных декстринах, образующихся при действии на амилопектин α-и β-амилаз. Гидролиз происходит по эндо-типу, основной продукт расщепления пуллулана – мальтотриоза. При добавлении его в комплексе с α- и β-амилазами крахмал полностью гидролизуется.
Все ферменты имеют различные физикохимические свойства. α -Амилаза неустойчива к активной кислотности среды, но термоустойчива; β -амилаза кислотоустойчива, но термолабильна; глюкоамилаза обладает высокой термической и кислотной устойчивостью. Пул-луланаза отличается высокой термостабильностью: после нагревания при 100° С в течение 10 мин остается около 80% активности.
Существенное влияние на гидролиз крахмала оказывает концентрация Н – ионов.
В связи с вышеизложенным, цель настоящего исследования состояла в разработке генетически компетентного штамма, способного к синтезу целевых ферментов для гидролиза крахмалсодержащих отходов с фильтр-прессов при дрожжевом производстве.
Материалы и методы
Основным объектом исследований служила чистая культура Rhisopus tritici t1 (Rh. oryzae t1), депонированная в коллекцию чистых культур кафедры биохимии и биотехнологии ВГУИТ (Воронеж).
Лиофилизированная культура Rhisopus tritici t1 хранилась в запаянных ампулах при температуре 4 – 5 °С.
Оживление лиофилизированной культуры продуцента проводилось согласно МУ 2.1.4.1057–01 [2]: оттянутый конец ампулы с лиофилизированной культурой нагревают над пламенем горелки. Влажным концом стерильного ватного тампона прикоснуться к нагретой части, в результате чего появляются трещины. Конец ампулы накрываются трехслойной марлевой салфеткой, смоченной этиловым спиртом с массовой долей 70%, хорошо отжатой и обламывается пинцетом.
После вскрытия ампула остается накрытой той же салфеткой в течение 1 – 2 мин. Затем салфетка осторожно снимается и вместе с остатками стекла погружается в дезраствор. В ампулу вносится ≈ 0,5 мл питательного бульона для регидратации. Содержимое ампулы перемешивается, переносится стерильной пастеровской пипеткой или шприцем вносили в центр застывшей среды, равномерно распределяя в чашке (предварительно сусло-агар с массовой долей 2% расплавляли на водяной бане, охлаждали до 48 – 50 °С и разливали в чашки Петри, чтобы дно чашки было покрыто полностью).
После засева чашки переворачивали вверх дном и инкубировали в течение 4 – 6 суток в термостате при температуре (35 ± 1) °С. Выросшие колонии просматривали сначала невооруженным глазом, затем под микроскопом. Колонию извлекали стерильной петлей и переносили в заранее подготовленную чашку Петри с сусло-агаром (СА), распределяя культуру зигзагообразными штрихами по всей поверхности чашки. По истечении 4–6 суток дрожжи переносили на скосы с сусло-агаром.
В исследованиях использовали чистую культуру микромицета, выделенную методом Коха [3].
Глубинное культивирование продуцентов проводили в качалочных колбах емкостью 750 см3, содержащих по 200 см3 питательной среды, в течение 120 ч при температуре 34 – 36 °С.
Для выращивания использовали модифицированную питательную среду (г/л): глюкоза – 2; дрожжевой экстракт – 1; CaCO 3 – 0,4; MgSO 4 – 0,1; KH 2 PO 4 – 0,2; мочевина – 0,1; соевая мука – 0,5; крахмал – 6; вода – остальное.
Среды стерилизовали в течение 40 минут при 0,8 МПа, охлаждали до 30 °С и засевали водной суспензией продуцента.
Влияние компонентов углеводного и азотного питания на биосинтез ферментов исследовали на питательной среде при замене источников углерода и азота испытуемым веществом в таком количестве, чтобы их содержание во всех опытах было одинаковым (0,1% по азоту).
Различные значения величины рН среды устанавливали добавлением 1 моль НСl или NаОН.
Состав питательной среды и условия культивирования варьировали в зависимости от задач и условий эксперимента. Состав рациональной питательной среды был уточнен с помощью методов математического планирования эксперимента.
Активности глюкоамилазы, α-амилазы, пуллуланазы определяли общепринятыми методами [4].
Микроскопирование культур проводили с помощью светового микроскопа МБИ-3.
Величину рН определяли на потенциометре рН – 150 МА.
Эксперименты проводились в трех повторностях; погрешность измерений опытов не превышала установленную стандартом или используемой методикой. При необходимости, в экспериментах присутствовали контрольные опыты. Достоверность результатов исследований определяли с использованием метода вариационной статистики. Обсуждались достоверные результаты с различиями по уровню значимости q ≤0,05. Графическая обработка данных производилась в программе Microsoft Excel 2007.
Результаты и обсуждение
Для переработки крахмалсодержащего сырья был подобран штамм-продуцент, обладающий способностью к синтезу гликозидаз, наиболее полно гидролизующих крахмал: глюкоамилазы, α-амилазы и пуллуланазы.
Исходя из анализа научных и научно-технических источников литературы, с этой целью перспективно использовать мицелиальные грибы. Микромицеты имеют большой потенциал в области микробного синтеза, проявляя способность трансформировать различные природные полимеры под действием синтезируемых ими ферментов. В отличие от других микроорганизмов они содержат значительно меньше нуклеи-
веществ в биопродукты.
В эксперименте исследовали чистые культуры, хранящиеся в музее чистых культур кафедры биохимии и биотехнологии ВГУИТ, и полученные из Всероссийской коллекции промышленных микроорганизмов ФГУП Гос-НИИ Генетики.
Проведен скрининг 23 штаммов микро-мицетов различных таксономических групп. Лиофилизированные культуры оживляли и выделяли моноколонии (ЧК). Выделение ЧК грибов проводили чашечным методом на твердых ага-ризованных средах с использованием метода серийных разведений [3]. Посев на чашки Петри производили из суспензий с разведением 10 – 103. Чашки с посевами инкубировали в термостате при температуре 34–36 °С, так как этот температурный режим способствует выделению представителей группы термотолерантных микромицетов, применение которых в биотехнологиях имеет несомненное преимущество.
Микроорганизмы выращивали глубинным способом, используя среду Чапека, г: NaNO 3 – 3, KH 2 PO 4 – 1, MgSO 4 x7H 2 O – 0.5, KCl – 0,5, FeSO 4 x7H2O – 0,01, сахароза – 30, дистиллированная вода – 1000 мл. Большинство ферментов являются экстрацеллюларными продуктами и выделяются в окружающую клетки жидкую среду, при этом обычно в мицелии трехсуточной культуры остается не более 10 – 15% ферментов. Исходя из этого, активности синтезируемых ферментов определяли в фильтрате культуральной жидкости после отделения биомассы. Результаты скрининга представлены в таблице 2.
Таблица 2.
Биосинтез ферментов – гликозидаз микромицетами
Table 2.
Biosynthesis of enzymes – glycosidases by micromycetes
|
Название продуцента Name of the producer |
Активность, ед/мл Activity, u/ml |
||
|
глюкоамилазы glucoamylases |
α-амилазы α-amylases |
глюкоамилазы glucoamylases |
|
|
1 |
2 |
3 |
4 |
|
Aspergillus niger F-2092 |
55,0 |
4,5 |
18,0 |
|
Aspergillus niger F-1119 |
18,4 |
1,5 |
19,0 |
|
Aspergillus niger F-2259 |
27,2 |
1,8 |
16,0 |
|
Aspergillus awamori F-808 |
118,2 |
5,2 |
10,0 |
|
Aspergillus awamori F-2250 |
120,2 |
9,4 |
12,0 |
|
Aspergillus awamori ВУД Т-2 |
110,0 |
4,5 |
16,0 |
Продолжение таблицы 2 | Continuation of table 2
|
1 |
2 |
3 |
4 |
|
Rhizopus oryzae F-495 |
35,2 |
4,8 |
9,0 |
|
Rhizopus oryzae F-497 |
30,0 |
4,1 |
6,0 |
|
Rhizopus oryzae F-596 |
5,4 |
0,5 |
10,0 |
|
Rhizopus oryzae F-593 |
15,0 |
1,8 |
7,0 |
|
Rhizopus oryzae F-605 |
10,3 |
1,2 |
6,0 |
|
Rhizopus microsporus var. chinensis F-1361 |
30,2 |
4,5 |
3,0 |
|
Rhizopus microsporus var. chinensis F-1062 |
50,4 |
6,9 |
8,0 |
|
Rhizopus microsporus var. chinensis F-1218 |
45,0 |
5,4 |
4,0 |
|
Rhizopus microsporus var. chinensis F-595 |
25,2 |
1,4 |
3.0 |
|
Rhizopus microsporus var. chinensis F-610 |
107,0 |
4,6 |
5.0 |
|
Rhizopus oryzae F-1217 |
62,2 |
9,4 |
17.0 |
|
Rhisopus tritici t1 (Rh. oryzae t1) |
100,0 |
8,4 |
20,0 |
|
Trichoderma harzianum BKM F-4099D |
95,2 |
5,7 |
5,0 |
|
Trichoderma harzianum 18 ВИЗР |
39,0 |
4,0 |
3,0 |
|
Trichoderma reesei |
25,7 |
2,1 |
8,6 |
|
Rhizopus stolonifer |
59,8 |
5,9 |
6,0 |
|
Rhizopus nigricans |
62,9 |
3,7 |
5,0 |
|
Rhisopus pygmaeus p1 |
110,0 |
6,3 |
4,6 |
Биосинтез гликозидаз может быть ре-
Анализируя изменения аминокислотного
прессирован или индуцирован различными аминокислотами. Влияние аминокислот на биосинтез ферментов Rh. oryzae t1 исследовалось на среде Чапека с массовой долей крахмала 6% и NH 4 NO 3 , куда вносилась аминокислота в количестве 0,2% по азоту. На фоне этой среды активность пуллуланазы была максимальной при внесении в среду Глю, Асп, γ-Ами, Лиз, Орн, Вал, Ала. При внесении в среду Тир, Нор активность фермента была в 6–9 раз ниже, чем в контроле.
Внесение Глю в среду в момент засева и в первые часы культивирования стимулирует синтез фермента, внесение ее после 24–36 часов культивирования (в период активного синтеза пуллуланазы) не дает эффекта. При отсутствии Глю в первые часы роста микроорганизма сдвигает максимум накопления фермента к 60 часам. Количество биомассы не зависит от времени внесения Глю. На фоне среды с компонентным составом,%: крахмал – 2,0, БВК – 1,0, KCl – 0,6, MgSO 4 - 0,05, (NH 4 ) 2 HPO 4 – 0,7 в качестве источников аминного азота использовались различные аминокислоты (0,2% по азоту). Активный синтез наблюдался в среде с Про, Глю. Количество биомассы снижалось вдвое. Это указывает на отсутствие корреляции между ростом и биосинтетической активностью.
На среде с Тре и Асп, продуцент синтезирует пуллуланазы с низкой активностью, при этом активно развивается и накапливается максимум биомассы. На максимальную активность пуллуланазы оказывает влияние вносимая в среду доза аминокислоты, так, для Глю – 0,005–0,010%, Орн – 0,005%.
пула штамма в сравнении с этим показателем при росте на варианте среды без внесения аминокислот, можно отметить общую закономерность: повышение содержания в клетках Глю, Ами, Ала, Лиз, Сер, Тре, Цис. Кроме того, в их мицелии обнаруживаются гидрофобные аминокислоты: Вал, Изо, Лей, Три, Фен.
Влияние вносимых в питательную среду углеводов на биосинтез пуллуланазы распределяется в следующий убывающий ряд: крахмал – декстрин – мальтоза – сахароза – маннит – рафиноза – лактоза – рамноза – фруктоза – сорбит – арабиноза – инозит – глюкоза – галактоза – дульцит. Следует отметить, что глюкоза репрессировала синтез пуллуланазы на 70%. Катаболитная репрессия пуллуланазы наблюдается на средах с арабинозой, инозитом, галактозой и дульцитом.
Одна из задач, которую следовало решить в рамках достижения поставленной цели, была разработка условий культивирования продуцента, наиболее приближенным к оптимальным.
Оптимизацию условий культивирования проводили в три этапа.
-
1. Были выбраны управляемые факторы, существенно влияющие на синтез пуллуланазы. Применительно к грибам в качестве таких факторов чаще всего используются: продолжительность выращивания, влажность и состав питательной среды, температура выращивания. В литературе отсутствуют количественные оценки влияния указанных факторов на биосинтез фермента при глубинном культивировании проду-цета Rhisopus tritici t1 (Rh. oryzae t1), поэтому было проведено последовательное
определение частных оптимумов по каждому значимому фактору, поочередно варьируя отдельный фактор на фоне постоянства остальных.
В эксперименте установлено, что максимальный биосинтез ферментов, в том числе пуллуланазы, наблюдался при выращивании в продуцента течение 96–120 часов при температуре (35 + 1) °C
В качестве основных факторов, влияющих на рост микромицета, были выбраны: концентрация крахмала,% (x1), концентрация азотнокислого калия,% (x2), концентрация кукурузного экстракта,% (x3). Критериями оценки влияния различных факторов на процесс биосинтеза амилаз служили активности глюкоамилазы и пуллуланазы. Для исследования применяли полный факторный эксперимент с использованием центрального композиционного рототабельного униформпланирования.
В результате обработки данных получены уравнения регрессии, адекватно описывающие процесс биосинтеза амилаз:
у 1 = 120,6 +3,65x 1 +2,75x 2 – 1,72x 3 – 2,8x2 1 – 1,9х2 2 – 1,9х2 3
y 2 = 6,6 – 0,59х 1 + 1,95х 2 – 0,18х 3 – 0,41х 1 х 2 – 0,89х2 1 – 0,19х2 2 – 0,29х2 3
Определение оптимальных составов питательной среды проводили методом “Ридж-анализ”. При наложении оптимальных составов питательных сред при биосинтезе амилаз, рациональной средой является,%:
– крахмал – 16,
– азотнокислый калий – 0,8,
– кукурузный экстракт – 0,85.
При таких значениях параметров активность амилаз достигала максимальных величин.
Динамика роста микроорганизма и биосинтеза им ферментов представлена на рисунках 3–6.
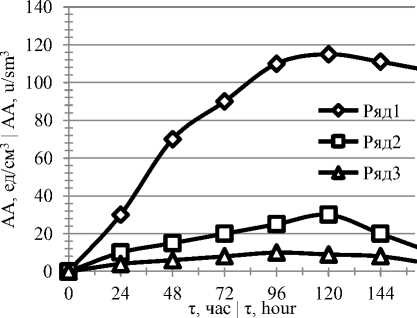
Рисунок 3. Влияние времени культивирования на биосинтез ферментов (1 – глюкоамилаза, 2 – α-амилаза, 3 – пуллуланаза)
Figure 3. Cultivation time effect on biosynthesis of enzymes (1 – glucoamylase, 2 – α-amylase, 3 – pullulanase)
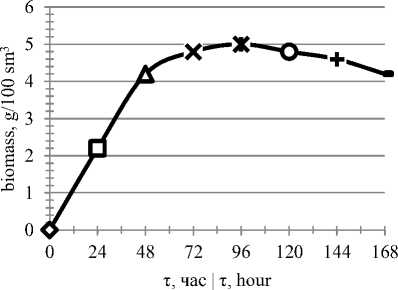
Рисунок 4. Динамика накопления биомассы в зависимости от времени культивирования
Figure 4. Dynamics of biomass amplification in dependence to cultivation time
Из рисунка 4 видно, что при культивировании продуцента на оптимизированной питательной среде активность глюкоамилазы; альфа-амилазы и пуллуланазы увеличилась, соответственно, на (%): 18,0; 19,0 и 50,0.
Из рисунка 5 следует, что развитие микроорганизма характеризуется непродол-жи-тельной лаг-фазой (до 24 часов), затем наступает экспоненциальная фаза роста, в которой интенсивно потребляются питательные вещества среды и увеличивается биомасса продуцента. К 96 часам рост прекращается, максимально снижается содержание редуцирующих веществ в среде.
Активный синтез ферментов заканчивается к 96 – 120 часам культивирования.
Характер кривой роста соответствовал изменению активной кислотности (рН) культуральной жидкости (рисунок 5) и изменению количества редуцирующих веществ питательной среды в зависимости от времени культивирования (рисунок 6).
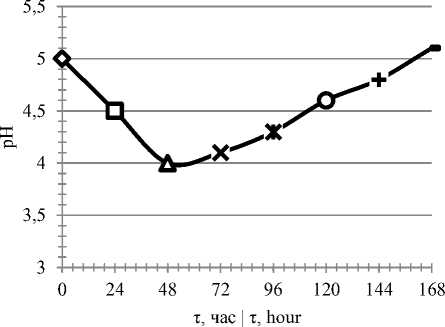
Рисунок 5. Изменение рН культурной жидкости в зависимости от времени культивирования
Figure 5. рН culture liquid change in dependence to cultivation time
Максимальный рост и накопление биомассы продуцентом наблюдается к 48 – 96 часам культивирования. Биосинтез целевых ферментов – к 96–120 часам.
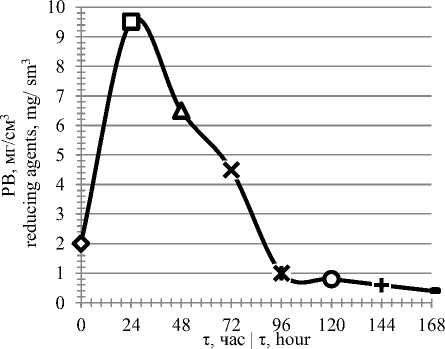
Рисунок 6. Изменение количества редуцирующих веществ питательной среды в зависимости от времени культивирования
Figure 6. Amount change of reducing agents in the medium in dependence to cultivation time
-
1. На основании анализа научной и научнотехнической литературы по разрабатываемой проблеме и результатам собственных исследований проведен скрининг микроорганизмов – продуцентов и выбран генетически компетентный штамм, способный к синтезу целевых ферментов – Rhisopus tritici t1 (Rh. oryzae t1) с нативной активностью синтезируемых ферментов, (ФЕ/мл): глюкоамилазы, α-амилазы и пуллуланазы, соответственно, 100,0; 8,4 и 20,0.
-
2. Разработаны условия жидкофазного культивированиτя, часпродуцента, обеспечивающие максимальный биосинтез целевых ферментов и получение комплексного ферментного препарата для переработки крахмалсодержащих отходов с фильтр-прессов при производстве хлебопекарных дрожжей:
– анализируя изменения аминокислотного пула при росте штамма, установлено влияние вносимых в питательную среду углеводов на биосинтез пуллуланазы. Отмечено, что к лучшим источникам углерода можно отнести крахмал, дектрин и мальтозу. Глюкоза репрессировала синтез пуллуланазы на 70%. Катаболитная репрессия пуллуланазы наблюдалась на средах с арабинозой, инозитом, галактозой и дульцитом;
– рациональным составом среды, обеспечивающим максимальные величины синтезируемых ферментов, является,%, крахмал – 16, азотнокислый калий – 0,8, кукурузный экстракт – 0,85. Активности ферментов – глюкоамилазы; альфа-амилазы и пуллуланазы – увеличились, соответственно, на (%): 18,0; 19,0 и 50,0;
– изучение динамики роста микромицета на разработанной среде, включая анализ изменения рН и содержания редуцирующих веществ в культуральной жидкости, показало, что максимальный рост и накопление биомассы продуцентом наблюдается к 48 – 96 часам культивирования, биосинтез целевых ферментов – к 96–120 часам.
Список литературы Разработка продуцента комплексного ферментного препарата для переработки крахмалсодержащих отходов с фильтр-прессов при производстве хлебопекарных дрожжей
- Гаврилова А.Ю. Исследование параметров культивирования сухих хлебопекарных дрожжей из отходов сахарного производства свекловичной мелассы // Актуальные вопросы современной науки. 2017. С. 138-143.
- Римарева Л.В., Серба Е.М., Соколова Е.Н., Борщева Ю.А. и др. Ферментные препараты и биокаталитические процессы в пищевой промышленности // Вопросы питания. 2017. Т. 86. №. 5.
- Банницына Т.Е., Канарский А.В., Щербаков А.В., Чеботарь В.К. и др. Дрожжи в современной биотехнологии // Вестник Международной академии холода. 2016. №. 1.
- Хатко З.Н., Стойкина А.А. Хлебопекарные дрожжи: характеристика и способы их активации // Новые технологии. 2016. №. 2.
- Панкина И.А., Черникова Д.А. Хлебопекарные дрожжи: характеристика и изучение их физико-химических показателей // Проблемы конкурентоспособности потребительских товаров и продуктов питания. 2019. С. 241-244.
- Джахонгирова Г.З., Саидходжаева М.А., Махмудова Д.Х., Касимова М.А. Ресурсосберегающий способ производства хлебопекарных дрожжей на основе рисовой мучки // Universum: технические науки. 2018. №. 3 (48).
- Ребезов М.Б., Карпова Г.В., Зайнутдинов Р.Р. Анализ технологических моделей производства дрожжей // Вестник Южно-Уральского государственного университета. Серия: Пищевые и биотехнологии. 2014. Т. 2. №. 2.
- Крикунова Л.Н., Дубинина Е.В. Исследовние белкового комплекса возвратных отходов хлебопекарного производства // Технология и товароведение инновационных пищевых продуктов. 2018. №. 6. С. 63-66.
- Луговая Н.П., Требухин И.В. Утилизация отходов дрожжевого производства // Научно-технический прогресс в сельскохозяйственном производстве. 2014. С. 193-196.
- Волкова А.В., Александрова Е.Г. Биоконверсия биотинсодержащего растительного сырья в технологии производства дрожжей // Современные технологии: актуальные вопросы, достижения и инновации. 2020. С. 38-41.
- Benabda O., Kasmi M., Kachouri F., Hamdi M. Valorization of the powdered bread waste hydrolysate as growth medium for baker yeast // Food and Bioproducts Processing. 2018. V. 109. P. 1-8. https://doi.org/10.1016/j.fbp.2018.02.007
- Kefale A., Redi M., Asfaw A. Potential of bioethanol production and optimization test from agricultural waste: the case of wet coffee processing waste (pulp) // Int J Renew Energy Res. 2012. V. 2. №. 3. P. 446-450.
- Haque M.A., Kachrimanidou V., Koutinas A., Lin C.S.K. Valorization of bakery waste for biocolorant and enzyme production by Monascus purpureus // Journal of biotechnology. 2016. V. 231. P. 55-64. https://doi.org/10.1016/j.jbiotec.2016.05.003
- Pleissner D., Lau K.Y., Schneider R., Venus J. et al. Fatty acid feedstock preparation and lactic acid production as integrated processes in mixed restaurant food and bakery wastes treatment // Food Research International. 2015. V. 73. P. 52-61. https://doi.org/10.1016/j.foodres.2014.11.048
- Oprea O.B., Gaceu L. Application of multiple criteria decision making (mcdm) in bakery industry. Study case: wastes and by-products // Bulletin of the Transilvania University of Brasov. Forestry, Wood Industry, Agricultural Food Engineering. Series II. 2016. V. 9. №. 1. P. 89.
- Akmirza I., Turker M., Alp K. Characterization and treatment of yeast production process emissions in a biofilter // Feb-fresenius environmental bulletin. 2018. P. 7099.
- T?rker M. Yeast biotechnology: Diversity and applications // Proceedings of 27th VH Yeast Conference. 2014. P. 1-26.
- El-Zaher F.H.A., El-Din M.S., Fadel M. Perspectives for appropriating distilled yeast to be reused in bakery // International Journal of Academic Research. 2012. V. 4. №. 4. P. 11-16.
- Ro?an C.A., Bei M.F. Evaluation of the fermentative potential of some bakery yeasts // Analele Universit??ii din Oradea, Fascicula: Ecotoxicologie, Zootehnie ?i Tehnologii de Industrie Alimentar?. 2018. V. 17. №. A. P. 65-68.
- Pleissner D., Lam W.C., Han W., Lau K.Y. et al. Fermentative polyhydroxybutyrate production from a novel feedstock derived from bakery waste // BioMed research international. 2014. https://doi.org/10.1155/2014/819474


