Разработка с использованием молекулярной пептидной трансплантации потенциального нейропротекторного биопептида
Автор: Тихонов С.Л., Тихонова Н.В.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 1 (92), 2024 года.
Бесплатный доступ
Целью исследований являлась разработка с использованием метода молекулярной пептидной трансплантации (МПТ) нового пищевого нейропротекторного биопептида на основе анализа литературных источников, баз данных о биофизических свойствах и биологической активности пептидов. В качестве объектов исследований использованы последовательности аминокислотных остатков пептидов с доказанными нейропротекторными свойствами. Прогнозирование биологической активности разработанного биопептида проводили с помощью базы данных Peptide Ranker (http://distilldeep.ucd.ie/PeptideRanker), информацию о каркасах циклических пептидов, устойчивых к протеолизу, получали в базе данных Cybase (http://www.cybase.org.au), идентификацию биопептида осуществляли по базе EROP-Moscow (http://erop.inbi.ras.ru/index.html), оценку биофизических свойств разработанного биопептида проводили с помощью калькулятора свойств пептидов PepCalc (http://pepcalc.com) и базы данных APD 3 (https://aps.unmc.edu/home). Разработан нейропротекторный интерферирующий пептид путем предварительного получения каркаса на основе циклотида с последующей вставкой короткого пептида HFRWPGP в каркас методом МПТ. Разработанный пептид имеет следующую последовательность аминокислотных остатков: PCRRRCHFRWPGPCRGRCP, обладает высокой биологической активностью равной 0,89. Гидрофобность пептида по Уимли - Уайту в целом остатке равна 2,91, следовательно, пептид хорошо растворим в воде. Потенциал связывания с белками (индекс Бомана) высокий и равен 4,3 ккал/моль, что свидетельствует о его способности связываться целевыми рецепторами.
Нейропротекторные свойства, пептиды, аминокислотная последовательность, гидрофобность, молекулярная пептидная трансплантация
Короткий адрес: https://sciup.org/142240224
IDR: 142240224 | УДК: 543.645.6 | DOI: 10.53980/24131997_2024_1_53
Текст научной статьи Разработка с использованием молекулярной пептидной трансплантации потенциального нейропротекторного биопептида
Целью исследований являлась разработка с использованием метода молекулярной пептидной трансплантации (МПТ) нового пищевого нейропротекторного биопептида на основе анализа литературных источников, баз данных о биофизических свойствах и биологической активности пептидов. В качестве объектов исследований использованы последовательности аминокислотных остатков пептидов с доказанными нейропротекторными свойствами. Прогнозирование биологической активности разработанного биопептида проводили с помощью базы данных Peptide Ranker , информацию о каркасах циклических пептидов, устойчивых к протеолизу, получали в базе данных Cybase , идентификацию биопептида осуществляли по базе EROP-Moscow , оценку биофизических свойств разработанного биопептида проводили с помощью калькулятора свойств пептидов PepCalc и базы данных APD 3 . Разработан нейропротекторный интерферирующий пептид путем предварительного получения каркаса на основе циклотида с последующей вставкой короткого пептида HFRWPGP в каркас методом МПТ. Разработанный пептид имеет следующую последовательность аминокислотных остатков: PCRRRCHFRWPGPCRGRCP, обладает высокой биологической активностью равной 0,89. Гидрофобность пептида по Уимли - Уайту в целом остатке равна 2,91, следовательно, пептид хорошо растворим в воде. Потенциал связывания с белками (индекс Бомана) высокий и равен 4,3 ккал/моль, что свидетельствует о его способности связываться целевыми рецепторами.
The present research is focused on design of new nutritional neuroprotective biopeptide, using method of molecular peptide transplantation (MPT) based on analysis of literature sources, databases on biophysical properties and biological activity of peptides. The objects of the research are sequences of amino acid residues of peptides with proven neuroprotective properties. Prediction of biological activity of the developed biopeptide was carried out using the Peptide Ranker database . Information on cyclic peptides frameworks that are resistant to proteolysis was obtained in the Cybase database , biopeptide identification was carried out using the EROP-Moscow database , biophysical properties assessment of the developed biopeptide was carried out using the PepCalc peptide properties calculator and APD 3 databases . A neuro-protective interfering peptide has been developed by preliminary preparation of a cyclotide-based framework followed by insertion of short HFRWPGP peptide into the framework by the MPT method. The developed peptide has the following sequence of amino acid residues: PCRRRCH-FRWPGPCRGRCP, has high biological activity equal to 0.89. The hydrophobicity of the peptide according to Wimley-White in the whole residue is 2.91, therefore, the peptide is well soluble in water. The protein binding potential (Boman index) is high and is 4.3 kcal / mol, indicating its ability to bind to target receptors.
Возросшее количество пациентов в России с болезнями нервной системы (5 346,8 случая на 100 тыс. населения в 2021 г.) [1] свидетельствует о необходимости поиска новых профилактических и терапевтических средств нейропротекторного действия [2]. Особое внимание уделяется нейропротекторным биопептидам, которые блокируют каскад патологических процессов, вызванных ограничением притока крови к тканям мозга, предотвращают повторные нарушения кровоснабжения мозга и осложнений, усугубляющих течение заболевания, и восстанавливают нервную ткань и функции мозга после ишемии. Пептиды представляют собой уникальный класс биологически активных веществ с высокой эффективностью, четкой специфичностью, биосовместимостью, низкой иммуногенностью, отличаются мягким действием и отсутствием побочных эффектов [3, 4]. Высокая эффективность пептидов (галанин, ноцистатин и сектроневрин) при лечении пациентов с нарушением функции мозга были описаны авторами [5, 6].
Авторами [7] разработана биологически активная добавка нейропротекторного действия, в которой в качестве действующего начала использованы 2 пептида со следующими последовательностями: NMVPFPR и ASAFQGIGSTHWVYDGVGNS.
Биопептиды можно получать с помощью ферментолиза пищевого белка [8] или синтезировать в лаборатории [9]. В частности, авторами [10] разработаны и получены синтетические нейропротекторные пептиды R1-Pep (SETQDTMKTGSSTNNNEEEKSR) и PP2A-Pep (FQFTQNQKKEDSKTSTSV).
При создании нейропротекторного препарата для приема внутрь или биологически активной добавки (далее - БАД) к пище необходимо учитывать действие протеолитических ферментов желудочно-кишечного тракта (далее - ЖКТ). Поэтому следует конструировать биопептиды, устойчивые к ферментативному гидролизу с целью сохранения их биодоступности. Обеспечить стабильность биопептида и его целевую доставку к органу-мишени возможно путем применения молекулярной пептидной трансплантации (далее - МПТ) – встраивания целевой аминокислотной последовательности в пептид или белок [11] с устойчивым к фермен-толизу каркасу [12].
Цель исследований - разработка с использованием метода молекулярной пептидной трансплантации нового пищевого нейропротекторного биопептида на основе анализа литературных источников, баз данных о биофизических свойствах и биологической активности пептидов.
Материалы и методы исследования
В качестве объектов исследований использованы последовательности аминокислотных остатков пептидов с доказанными нейропротекторными свойствами. Прогнозирование биологической активности разработанного биопептида проводили с помощью базы данных Peptide Ranker , информацию о каркасах циклических пептидов, устойчивых к протеолизу, получали в базе данных Cybase , идентификацию биопептида осуществляли по базе EROP-Moscow , оценку биофизических свойств разработанного биопептида проводили с помощью калькулятора свойств пептидов PepCalc и базы данных APD 3 .
Результаты исследований и их обсуждение
Пептид будет эффективен в том случае, если будет создан с учетом белок-белкового взаимодействия (ББВ) [13]. Примером такого пептида являются интерферирующие пептиды (далее - ИП), связывающиеся с рецепторами белков, блокируя их взаимодействие [14].
ИП ингибируют взаимодействие рецепторов γ-аминомасляной кислоты типа B (ГАМК B ) с ферментами, участвующими в их фосфорилировании. В физиологических условиях ГАМК В -рецепторы контролируют возбудимость нейронов в головном мозге путем длительного торможения и, таким образом, противодействуют перевозбуждению и гибели нейронов. Однако во время церебральной ишемии эксайтотоксическое состояние быстро подавляет ГАМК В -рецепторы посредством процессов фосфорилирования/дефосфорилирования, опосредованных Ca 2+ /кальмодулинзависимой протеинкиназой II (CaMKII) и протеинфосфатазой 2A (PP2A) [15]. После фосфорилирования ГАМК В -рецепторы подвергаются лизосомальной деградации, а не рециклируются обратно в плазматическую мембрану [16]. ИП проникают в клетки, ингибируют взаимодействие ГАМК В рецепторов с CaMKII, предотвращая его фосфорилирование [16].
ИП могут включать следующие последовательности: EEE, NNN, RRR, TGS, ST, SR, SK, RG, GR, GCF, PPP, CG, SCS, HFRWPGP и др., а также они богаты аргинином (R) [17-25].
В качестве каркаса для МПТ рекомендуется использовать циклотиды – пептиды, содержащие цистеин, и характеризующиеся наличием дисульфидных мостиков, что делает их стабильными к протеолитическому расщеплению [26].
Авторами был разработан нейропротекторный интерферирующий пептид, путем предварительного получения каркаса на основе циклотида с последующей вставкой короткого пептида HFRWPGP в каркас методом МПТ. По данным [27], пептид HFRWPGP обладал нейро-протекторными свойствами. Разработанный пептид имел следующую последовательность аминокислотных остатков: PCRRRCHFRWPGPCRGRCP. В результате тестирования пептида PCRRRCHFRWPGPCRGRCP по серверу для прогнозирования биоактивных пептидов PeptideRanker было установлено, что он обладал высокой биологической активностью, равной 0,89 (рис. 1) (активность выше порогового значения 0,5 свидетельствует о биоактивности).
-
- @ С Л distilldeep,ucd.ie PeptideRanker response
0.898571 PCRRRCHFRWPGPCRGRCP
[ Пептидный агент
Ваш запрос (ID 17099893603322) был обработан
Реакция:
Рисунок 1 – Результаты тестирования пептида PCRRRCHFRWPGPCRGRCP по серверу для прогнозирования биоактивных пептидов PeptideRanker
При поиске пептида по базе данных EROP-Moscow (рис. 2) пептид не был идентифицирован, что свидетельствует о его идентичности.
фп 1пко - химические особенности
-
□ослеловагельаопъ аминокислот pcrrrchfrwpgpcrgrcp влп часть кослиоватгльнопи Сочимняя

Рисунок 2 – Результаты идентификации пептида PCRRRCHFRWPGPCRGRCP по пептидной базе данных EROP-Moscow
В таблице представлена характеристика аминокислотного состава пептида PCRRRCH-FRWPGPCRGRCP.
Таблица
Характеристика аминокислотного состава пептида PCRRRCHFRWPGPCRGRCP
|
Характеристика аминокислот |
Наименование/количество |
|
Гидрофобная аминокислота |
F/1, C/4, W/1 |
|
Отрицательно заряженная аминокислота |
- |
|
Положительно заряженная аминокислота |
R/6, H/1 |
На рисунке 3 представлена характеристика биофизических свойств исследуемого пептида PCRRRCHFRWPGPCRGRCP, которая была получена с помощью калькулятора свойств пептидов PepCalc .
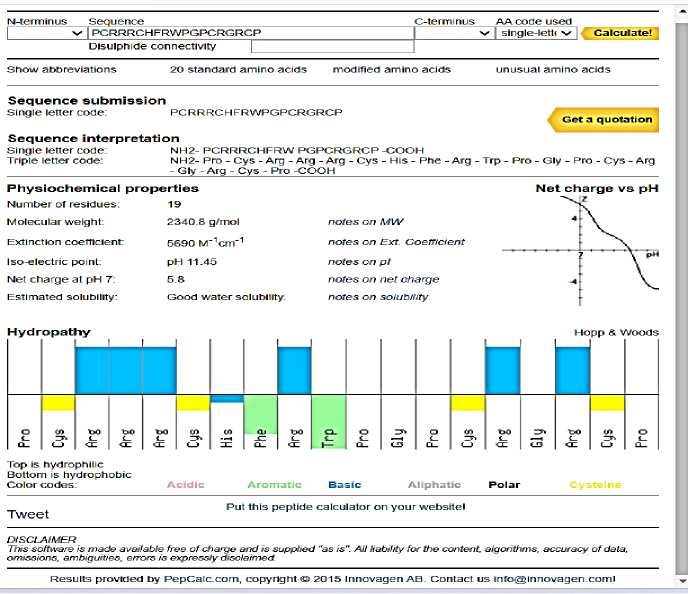
Рисунок 3 – Характеристика биофизических свойств исследуемого пептида PCRRRCH-FRWPGPCRGRCP, полученная с помощью калькулятора свойств пептидов PepCalc
Процентное содержание аминокислот в пептиде было следующее: Phe – 5, Cys – 21, Trp – 5, Gly -11, Pro- 21, His – 5 и Arg -32. Молекулярная масса была равна 2340,826 Да. Последовательность пептида была богата R. По данным [24], нейропротекторные пептиды содержали большое количество аргинина и их последовательность составляла до 27 - 30 аминокислот. В разработанном пептиде было 19 остатков аминокислот, в том числе 6 остатков аргинина.
В исследованиях [28] было установлено, что богатые аргинином пептиды (RRCPPs), способны проникать в клетки, такие как полиаргинин, пенетратин или Tat (48-57) ВИЧ-1, проявляют нейропротекторный эффект на моделях инсульта в нейрональных клетках in vitro. Соответственно, пептид PCRRRCHFRWPGPCRGRCP, возможно, будет обладать нейропротек-торными свойствами и может стать основой для разработки новых нейропротекторных био- логически активных веществ. Однако механизм, лежащий в основе RRCPPs-зависимой нейропротекции, еще предстоит изучить. Известно, что RRCPP характеризуются мультимодальным механизмом действия, включая способность защищать нейроны от эксайтотоксичности глутамата, уменьшать приток внутриклеточного кальция, противодействовать функции рецепторов клеточной поверхности, воздействовать на митохондрии, поглощать токсичные молекулы, снижать окислительный стресс, индуцировать передачу сигналов выживания, стабилизировать белки, ингибировать протеолитические ферменты и уменьшать воспаление. При этом эндоцитоз является более вероятным нейропротекторным механизмом RRCCPs, чем взаимодействие с мембраной или цитоплазматическим рецептором [29].
Способность нейропротекторных пептидов взаимодействовать с мембраной нейрона и последующее проникновение в клетку является ключевым фактором, определяющим их нейропротекторный эффект. Способность пептидов проникать через клеточную мембрану также коррелирует со спиральностью и нейропротекторной способностью. В исследованиях [30] было установлено, что пептиды, содержащие аргинин Tat (49-57)-NH 2 и PTD4, взаимодействуют с липосомами, имитирующими мембрану нейрона, и способны проникать в нейрон.
Белок-белковое, белок-лигандное взаимодействие и способность проникновения в мембрану также зависят от концентрации пептидов, которая находится в прямой корреляции с показателем - молярный коэффициент экстинкции белка. Поэтому для пептидов, доступных только в «молекулярно-биологических» количествах необходимо было рассчитывать молярный коэффициент экстинкции белка, чтобы предположить его возможность связывания с рецепторами и проникновения в мембрану. Было установлено, что коэффициент молярной экстинкции исследуемого пептида PCRRRCHFRWPGPCRGRCP составлял 5800, это свидетельствовала о высоком потенциале связывания с целевыми рецепторами и проникновения в мембрану.
Общее гидрофобное соотношение пептида, определенное APD, составило 32 %, гидрофобность по Уимли - Уайту в целом остатке (т. е. сумма энергии переноса пептида без остатка из воды на поверхность раздела POPC) равна 2,91, следовательно, пептид хорошо растворим в воде. Потенциал связывания с белками (индекс Бомана) высокий и был равен 4,3 ккал/моль, что свидетельствовало о его способности связываться целевыми рецепторами. Следует отметить, что нейропротекторные пептиды характеризовались положительным зарядом и являлись катионными [31, 32]. У пептида PCRRRCHFRWPGPCRGRCP заряд был равен +6,25. высокий положительный заряд нейропротекторных пептидов благоприятствовал взаимодействию электродов, следствием чего являлось их адсорбция на поверхности мембраны. Высокая энергия этих взаимодействий в сочетании со связыванием пептида с внутренней частью мембраны способствовало проникновению нейропротекторного пептида через мембранный барьер. Авторы [33] установили, что пептид Tat, имеющий высокий положительный заряд, проникал через клеточную мембрану. Следует отметить, для конкретного пептида могут быть различные механизмы проникновения в зависимости от условий эксперимента [34]. Этот процесс зависил от многих факторов, таких как присутствие сульфированных протеогликанов или мембранных рецепторов.
Количество остатков цистеина в исследуемом пептиде было равно 4. Предполагается, что они находились в паре и были соединены дисульфидными мостиками, что свидетельствовало об его каркасе, устойчивом к действию пептидаз.
Заключение
Можно предположить, что последние разработки в области биотехнологии по созданию нейропротекторных пищевых пептидов с использованием МПТ в устойчивый пептидный каркас обеспечат их доставку в мозг, что, возможно, сделает прорыв в профилактике и лечении болезней нервной системы. В результате наших исследований разработан новый нейропротек-торный пептид, дана характеристика его биофизических свойств, обуславливающих биологи- ческую активность и обоснован молекулярный механизм нейропротекторного действия (противодействие перевозбуждению и гибели нейронов). Но вместе с тем эффективность разработанного пептида должна быть подтверждена в многочисленных исследованиях in vitro.
Список литературы Разработка с использованием молекулярной пептидной трансплантации потенциального нейропротекторного биопептида
- Котова Е. Г., Кобякова О.С., Александрова Г.А. и др. Заболеваемость всего населения России в 2021 году: статистические материалы. – М.: ЦНИИОИЗ Минздрава России, 2022. – 145 с.
- Fisher M., Savitz S.I. Pharmacological brain cytoprotection in acute ischaemic stroke – Renewed hope in the reperfusion era // Nat. Rev. Neurol. - 2022. – Vol. 18 (4). – P. 193–202. DOI: 10.1038/s41582-021-00605-6/
- Yeo X.Y., Cunliffe G., Ho R.C. et al. Potentials of Neuropeptides as Therapeutic Agents for Neurological Diseases // Biomedicines. - 2022. – Vol. 10 (2). – 343 p. DOI: 10.3390/biomedicines10020343.
- Apostolopoulos V., Bojarska J., Chai T.-T. et al. A Global Review on Short Peptides: Frontiers and Perspectives // Molecules, 2021. – Vol. 26. – 430 p. doi.org/10.3390/molecules26020430.
- Plášek J., Lazárová M., Dodulík J. et al. Secretoneurin as a Novel Biomarker of Cardiovascular Episodes: Are We There Yet? A Narrative Review // J. Clin. Med. - 2022. – Vol. 11 (23). – P. 7191. DOI:10.2174/2211536610666210412154455.
- Russo A.F. Overview of Neuropeptides: Awakening the Senses? // Headache. - 2017. - Vol. 57. – P. 37–46. DOI:10.1111/head.13084.
- Патент RU 2389500 МПК A61K 38/04. Нейропротективная пищевая добавка / Месслер Херберт, Ридль Криста, Шмитцбергер Вольфганг, Шнайт Хайнц. Патентообладатели: ЭБЕВЕ ФАРМА ГЕЗ.М.Б.Х. НФГ.КГ. – Заявка № 2006130961/15, заявл. 26.01.2005; опубл. 20.05.2010.
- Жамсаранова С.Д., Лебедева С.Н., Болхонов Б.А. и др. Ферментативная конверсия пищевого белка и оценка антиоксидантной активности пептидов // Вестник ВСГУТУ. - 2021. – № 4 (83). – С. 5–14. DOI: 10.53980/24131997_2021_4_5.
- Balakrishnan K., Hleihil M., Bhat M.A. et al. A Targeting the interaction of GABAB receptors with CaMKII with an interfering peptide restores receptor expression after cerebral ischemia and inhibits progressive neuronal death in mouse brain cells and slices // Brain Pathol. - 2022. – Vol. 33 (1). – P. e13099. DOI: 10.1111/bpa.13099.
- Jacob B., Vogelaar A., Cadenas E. et al. (2022). Using the cyclotide scaffold for targeting biomolecular interactions in drug development // Molecules. - 2022. –Vol. 27 (19). – P. 6430. doi.org: 10.3390/molecules27196430.
- Wang C.K., Craik D.J. Designing macrocyclic disulfide-rich peptides for biotechnological applications // Nat. Chem. Biol. - 2018. – Vol. 14 (5). – P. 417–427. doi.org 10.1038/s41589-018-0039-y.
- Crook Z.R., Sevilla G.P., Friend D. et al. Mammalian display screening of diverse cystine-dense peptides for difficult to drug targets // Nat. Commun. - 2017. – Vol. 8. – P. 2244. doi.org: 10.1038 /s41467-017-02098-8.
- Stumpf M.P.H., Thorne T., De Silva E. et al. Estimating the size of the human interactome // Proc. Natl. Acad. Sci. USA. - 2008. – Vol. 105. – P. 6959–6964. DOI: 10.1073/pnas.0708078105.
- Ludhiadch A., Sharma R., Muriki A. et.al. Role of Calcium Homeostasis in Ischemic Stroke: A Review. CNS Neurol. Disord. Drug Targets 2021, 21, 52–61 DOI: 10.2174/1871527320666210212141232.
- Zemoura K., Balakrishnan K., Grampp T. et al. Ca2+/Calmodulin-Dependent Protein Kinase II (CaMKII) β-Dependent Phosphorylation of GABAB1 Triggers Lysosomal Degradation of GABAB Receptors via Mind Bomb-2 (MIB2 )-Mediated Lys-63 - Linked Ubiquitination // Mol. Neurobiol. - 2019. – Vol. 56. – P. 1293–1309. DOI: 10.1007/s12035-018-1142-5.
- Zemoura K., Trümpler C., Benke D. Lys-63-linked Ubiquitination of γ-Aminobutyric Acid (GABA), Type B1, at Multiple Sites by the E3 Ligase Mind Bomb-2 Targets GABAB Receptors to Lysosomal Degradation // J. Biol. Chem. - 2016. – Vol. 291. – P. 21682–21693. DOI: 10.1074/jbc.M116.750968.
- Huang L., Li Q., Wen R. et. al. Rhokinase inhibitor prevents acute injury against transient focal cerebral ischemia by enhancing the expression and function of GABA receptors in rats // Eur. J. Pharmacol. - 2017. – Vol. 797. – P. 134–142. doi: 10.1016/j.ejphar.2017.01.021.
- Hleihil M., Balakrishnan K., Benke D. Protein phosphatase 2A regulation of GABA B receptors normalizes ischemia-induced aberrant receptor trafficking and provides neuroprotection // Front. Mol. Neurosci. - 2022. – Vol. 15. – P. 1015906 DOI: 10.3389/fnmol.2022.1015906.
- Hill M.D., Goyal M., Menon B.K. et al. Efficacy and safety of nerinetide for the treatment of acute ischaemic stroke (ESCAPE-NA1): A multicentre, double-blind, randomised controlled trial // Lancet. - 2020. – Vol. 395. - P. 878–887. DOI: 10.1056/NEJMoa2201295.
- Schmidt N., Mishra A., Lai G.H. et al. Arginine-rich cell-penetrating peptides // FEBS Lett. - 2010. – Vol. 584. – P. 1806–1813. DOI: 10.1056/NEJMoa2201295.
- Meloni B.P., Milani D., Edwards A.B. et al. Neuroprotective peptides fused to arginine-rich cell penetrating peptides: Neuroprotective mechanism likely mediated by peptide endocytic properties // Pharmacol. Ther. - 2015. – Vol. 153. – P. 36–54. DOI: 10.1016/j.pharmthera.2015.06.002.
- Chiu L.S., Anderton R.S., Knuckey N.W. et al. The neuroprotective potential of arginine-rich peptides for the acute treatment of traumatic brain injury // Expert Rev. Neurother. - 2016. – Vol. 16. – P. 361–363. DOI: 10.1586/14737175.2016.1150180.
- Meloni B.P., Milani D., Cross J.L. et al. Assessment of the Neuroprotective Effects of Arginine- Rich Protamine Peptides, Poly-Arginine Peptides (R12-Cyclic, R22) and ArginineTryptophan-Containing Peptides Following In Vitro Excitotoxicity and/or Permanent Middle Cerebral Artery Occlusion in Rats // Neuromolecular Med., 2017. – Vol. 19. – P. 271–285. DOI: 10.1007/s11064-021-03251-y.
- Meloni B.P., Mastaglia F.L., Knuckey N.W. Cationic Arginine-Rich Peptides (CARPs): A Novel Class of Neuroprotective Agents With a Multimodal Mechanism of Action // Front. Neurol. - 2020. – Vol. 11. – P. 108. DOI: 10.3389/fneur.2020.00108.
- Meloni B.P., Blacker D.J., Edwards A.B. et al. Impact of poly-arginine peptides R18D and R18 on alteplase and tenecteplase thrombolysis in vitro, and neuroprotective stability to proteolysis // J. Thromb. Thrombolysis. - 2022. – Vol. 54. – P. 172–182. DOI: 10.1007/s11239-022-02642-4.
- Dawson W.M., Rhys G.G., Woolfson D.N. Towards functional de novo designed proteins // Curr. Opin. Chem. Biol. - 2019. – Vol. 52. – P. 102–111. DOI: 10.1016/j.cbpa.2019.06.011.
- Bakaeva Z.V., Surin A.M., Lizunova N.V. et al. Neuroprotective Potential of Peptides HFRWPGP (ACTH6-9PGP), KKRRPGP, and PyrRP in Cultured Cortical Neurons at Glutamate Excitotoxicity // Dokl Biochem Biophys. - 2020. – Vol. 491 (1). – P. 62–66. doi: 10.1134/S1607672920020040.
- Mazuryk J., Puchalska I., Kozi´nski K. et al. PTD4 Peptide Increases Neural Viability in an In Vitro Model of Acute Ischemic Stroke // Int. J. Mol. Sci. - 2021. – Vol. 22. – P. 6086. DOI:10.3390/ijms22116086.
- Marto J.P., Strambo D., Livio F. et al. Drugs Associated with Ischemic Stroke: A Review for Clinicians. Stroke 2021, 52, e646–e659. DOI: 10.1161/STROKEAHA.120.033272.
- Mucha P., Sikorska E., Rekowsk P. et al. Interaction of Arginine-Rich Cell-Penetrating Peptides with an Artificial Neuronal Membrane // Cells. - 2022. – Vol. 11. – P. 1638. - https://doi.org/10.3390/cells11101638.
- Eric Ho., Dania A., Tunable S. Charge Enables the Electrostatic Adsorption-Controlled Release of Neuroprotective Peptides from a Hydrogel–Nanoparticle Drug Delivery System // ACS Appl Mater Interfaces’. - 2023. – Vol. 15 (1). – P. 91–105. doi.org/10.1021/acsami.2c17631.
- Reigado G.R., Adriani P.P., dos Santos J.F. et al. Delivery of superoxide dismutase by TAT and abalone peptides for the protection of skin cells against oxidative stress // Biotechnol. Appl. Biochem. - 2022. – Vol. 69. – P. 2673–2685. DOI: 10.1002/bab.2314.
- Choe S. Free Energy Analyses of Cell-Penetrating Peptides Using the Weighted Ensemble Method // Membranes. - 2021. – Vol. 11. – P. 974. DOI: 10.3390/membranes11120974.
- Liu B.R., Chiou S.-H., Huang Y.-W. et al. Bio-Membrane Internalization Mechanisms of Arginine-Rich Cell-Penetrating Peptides in Various Species // Membranes. - 2022. – Vol. 12. – P. 88. doi.org/10.3390/membranes12010088.


