Разработка системы комплексной оценки мутагенных и канцерогенных эффектов у населения крупного промышленного региона
Бесплатный доступ
Разработка региональных программ профилактики онкологических заболеваний должна базироваться на достоверной информации об особенностях онкологической заболеваемости на отдельных территориях, сведениях о её динамике и трендах, данных о генотоксических эффектах у населения для прогнозирования развития канцерогенной ситуации на отдельных территориях. Для получения подобной информации и корректного сравнения территорий между собой необходим единый стандартизованный подход для проведения подобных оценок. Предлагаются методические рекомендации для проведения комплексного анализа процессов канцерогенеза и мутагенеза у населения крупного промышленного региона.
Онкологическая заболеваемость, хромосомные аберрации, профилактика рака
Короткий адрес: https://sciup.org/148100326
IDR: 148100326 | УДК: 575:224.
Текст научной статьи Разработка системы комплексной оценки мутагенных и канцерогенных эффектов у населения крупного промышленного региона
Эпидемиологические исследования свидетельствуют о повсеместном росте заболеваемости и смертности от злокачественных опухолей. По данным международного агентства по изучению рака к 2020 г. прогнозируется увеличение числа вновь выявленных случаев онкозаболеваний до 16 миллионов человек [5]. На основании большого числа данных было сформулировано представление, согласно которому канцерогенез в значительной мере связан с загрязнением окружающей среды [3]. Поэтому в промышленно развитых районах с высокой антропогенной нагрузкой особую актуальность приобретает разработка региональных противораковых программ. В основе разработки региональных программ профилактики онкологических заболеваний должна лежать достоверная информация об особенностях онкологической заболеваемости на отдельных территориях, сведения о динамике и трендах, данные о генотоксических эффектах у населения для прогнозирования развития ситуации на отдельных территориях. Для получения подобной информации и корректного сравнения территорий между собой необходим единый стандартизованный подход для оценок канцерогенных и мутагенных эффектов у населения.
Важной количественной характеристикой генотоксического воздействия окружающей
среды на организм человека является уровень хромосомных аберраций (ХА) в лимфоцитах крови человека. Предлагается использовать тест на ХА при формировании групп риска онкологических заболеваний [1, 6-8, 10]. Однако остается много неясного относительно механизмов реализации отдаленных эффектов ХА, о степени риска того или иного типа повреждений ДНК для развития заболеваний, о согласованности процессов мутагенеза и канн-церогенеза в популяциях человека. Для выяснения данных вопросов необходим комплексный подход, подразумевающий оценку онкологической заболеваемости (и/или смертности) и учет повреждений ДНК в одной и той же опытной группе, т.е. проведение генетикоэпидемиологических исследований.
Цель работы: разработка системы комплексной оценки процессов мутагенеза и канцерогенеза у населения крупного промышленного региона, которые могут быть использованы в научных, лечебных и санитарных учреждениях.
Материалы и методы. При разработке системы за основу были взяты стандартные методики культивирования клеток крови [9], учета ХА в лимфоцитах крови человека [2], расчета стандартизованных показателей онкозаболеваемости [4], выделения ДНК [11] и ПЦР-анализа полиморфных маркеров в генах, оказывающих влияние на индивидуальную токсико-генетическую чувствительность (генах репарации ДНК, генах ферментов биотрансформации ксенобиотиков, генах контроля клеточного цикла).
План обследования:
-
1. Формулирование цели обследования и его задач.
-
2. Выбор регионов (городов, предприятий, цехов и пр.) для проведения обследования.
-
3. Определение контингента, подлежащего обследованию (вид воздействия).
-
4. Составление рандомизированных выборок численностью большей, чем количество людей, предполагаемых для обследования.
-
5. Анализ онкологической заболеваемости в выбранных группах (населения городов, предприятий, цехов, когорт, групп и пр.).
-
6. Обработка полученных результатов – выявление групп высокого онкориска и
- групп сравнения (население городов, работников предприятий, цехов, когорт, групп и пр.).
-
7. Определение уровня ХА в клетках крови.
-
8. Анализ молекулярных маркеров повышенной токсико-генетической чувствительности. Формирование групп высокого риска формирования хромосомных наруше-ний.
-
9. Анализ всех данных. Выявление коре-ляционных связей.
-
10. Обобщение полученных результатов.
-
11. Разработка групповых и индивидуальных рекомендаций по профилактике злокачественных новообразований.
Таблица. Система комплексных генетико-эпидемиологических исследований
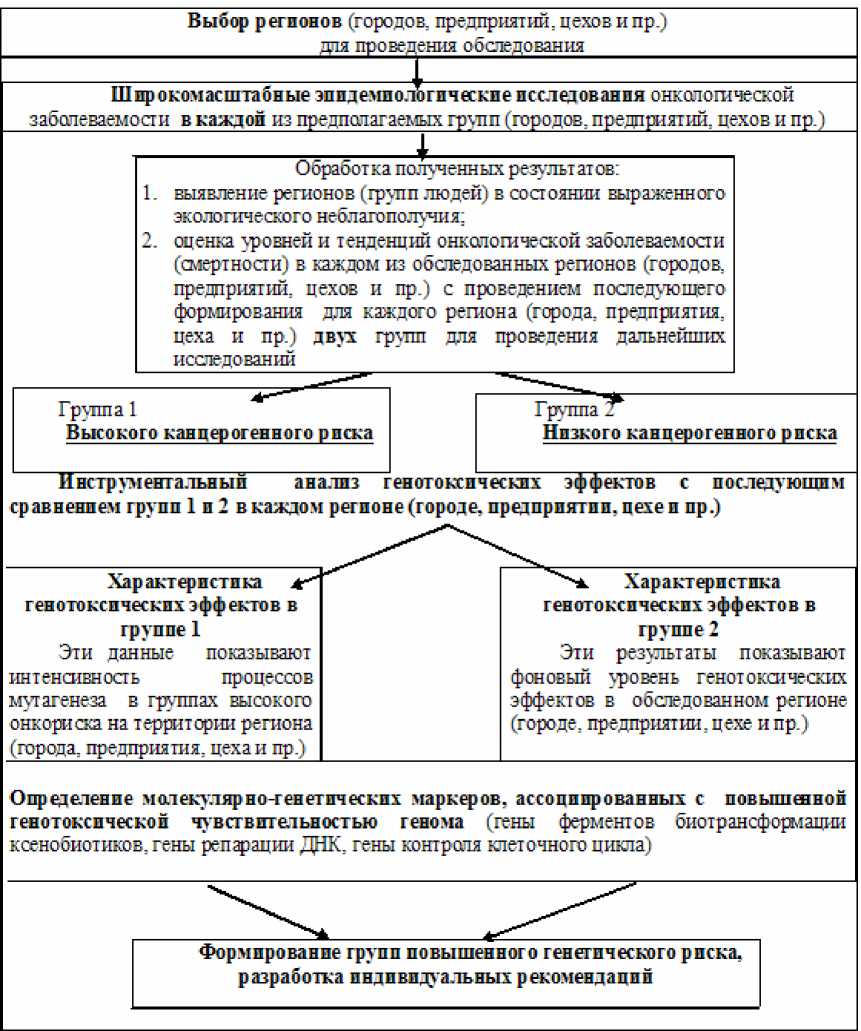
Результаты. Была разработана система оценки интенсивности процессов мутагенеза и канцерогенеза в популяциях человека (таблица), направленная на выявление и оценку генотоксических эффектов в популяциях, формирование групп повышенного генетического риска и прогноз индивидуальной чувствительности генома человека к действию комплекса генотоксических факторов среды.
Данная система базируется на: адекватном выборе регионов (городов, предприятий, цехов и пр.) для проведения обследования (включая экологическую характеристику мест проживания); оценке канцерогенных эффектов воздействия комплекса факторов окружающей среды по данным эпидемиологических исследований онкологической заболеваемости и смертности; корректном формировании групп для проведения обследования, включая оценку адаптивного потенциала организма по данным психологического тестирования); определении показателей хромосомного мутагенеза; оценке индивидуальной чувствительности генома; определении генетических маркеров, ассоциированных с повышенной генотоксической чувствительностью генома.
Обследование должно проводиться в соответствии с нормами профессиональной этики – соблюдением принципов конфиден-иальности получаемой информации, обеспе-ения права человека отказаться от участия в обследовании и информирования испытуемого о результатах и использовании получаемой информации. Работа должна проводиться в отдельном помещении. Во время проведения обследования не допускается присутствие по-торонних. Взятие крови осуществляется только одноразовым оборудованием и проводится профессионалами, имеющими разрешение на проведение всех манипуляций. Перед проведением анализа все анкеты и препараты шифруют и расшифровывают только после получения всего массива данных. Учитывая существование межлабораторной вариабельности в результатах применения стандартных методик, ниже приводится детальное описание процедур исследования канцерогенной ситуации, генотоксических эффектов и анализа молекулярных маркеров.
Оценка онкологической заболеваемости. Расчет стандартизованных показателей заболеваемости проводится прямым методом по общепринятой методике [4]. Для анализа заболеваемости злокачественными новообразованиями используют данные официальных отчетных форм № 7 и № 35 из официальных ежегодных отчетов онкологических диспансеров МЗ РФ. Данные о численности населения по административным территориям (группам населения) могут быть представлены Территориальным органом федеральной службы государственной статистики. За стандарт принимается возрастная структура населения за определенный период времени, а для сравнения с РФ и другими регионами могут быть взяты стандартизованные показатели из статистических сборников «Злокачественные новообразования в России», подготовленные Московским НИОИ им. П.А. Герцена и Российским Центром информационных технологий и эпидемиологических исследований в области онкологии. Расчет направленности и темпа тенденции может быть проведен с применением одного из видов регрессионного анализа – выравнивание по прямой, с помощью уравнения регрессии типа y=A+B*x.
Достоверность различия может быть определена с помощью расчета коэффициента Стьюдента по формуле:
р -Р t = 1 2
m 2 + m | где: Р1 и Р2 - сравниваемые показатели; m1 и m2 – ошибки сравниваемых показателей. При числе наблюдений 30 и более оценка полученного коэффициента - в сравнении с величиной 1,96; при числе наблюдений менее 30 сравнение полученного коэффициента проводится с табличным значением.
Оценка генотоксических эффектов. Материалом для исследования ХА служит цельная периферическая кровь, забранная из локтевой вены в асептических условиях в стерильные вакутейнеры с гепарином или одноразовые шприцы. Культивирование клее-ток крови и подготовка препаратов хромосом проводится по единому стандартному протоколу: 1) питательную смесь готовят из расчета: среда RPMI–1640 (4 мл), сыворотка крупного рогатого скота (1 мл) и 0,1 мл фитогемагглютинина (ПанЭко); 2) смесь помещают в стерильные культуральные флаконы и добавляют 0,5 мл гепаринизированной крови; 3) культуральные флаконы выдерживают при 370С в течение 48 ч, и за 2 часа до фиксации в культуры вводят колхицин (0,5 мкг/мл); 4) после гипотонической обработки и фиксации клеток суспензию раскапывают на охлажденные чистые предметные стекла и высушивают над пламенем спиртовки; 5) препараты окрашивают 1% красителем Гимза (Merk) и анализируют под световым микроскопом.
Учет ХА проводят без кариотипиро-вания. Регистрируют аберрации хpоматидного (одиночные фрагменты, хроматидные обмены) и хромосомного типов: парные фрагменты (включают изохроматидные фрагменты и не включают парные фрагменты, сопровождающие дицентрики и кольцевые хромосомы), дицентрики с парными фрагментами и дицентрики без фрагментов, кольцевые хромосомы (включают центрические кольцевые хромосомы с парными фрагментами и без них, а также ацентрические кольца и интерсте-циальные делеции), симметричные обмены. Пpобелы в анализ не включают. Для каждого индивида анализируют от 100 до 500 метафаз. Уровень ХА определяют путем подсчета частоты метафаз c аберрациями хромосом (в процентах от изученного числа клеток).
Определение молекулярно-генетических маркеров, ассоциированных с повышенной генотоксической чувствительностью генома. Для этого периферическую кровь забирают в вакутейнеры с ЭДТА. ДНК выделяют из лейкоцитов периферической крови стандартным методом фенольно-хлороформной экстракции [11]. Полиморфизмы С163А гена CYP1A2 и 3801Т>С гена CYP1A1 исследуются методом ПЦР-ПДРФ с использованием рест-риктазы Bst2U. Протяженные делеции в генах GSTM1 и GSTT1 анализируют путем амплификации специфических участков исследуемых генов с флуоресцентной детекцией результатов в режиме реального времени (Realtime PCR). Генотипирование полиморфных маркеров: CYP1A1 А2455G, GSTР1 С341T, APE1 Asp148Glu, XRCC1 Arg194Trp, XRCC1 Arg280His, XRCC1 Arg399Gln, hOGG1 Ser326Cys, ADPRT Val762Ala; ATM Asp1853Asn; CHEK2 1100 delC; CHEK2 Ile157Thr ;) проводят с использованием метода аллель-специфической ПЦР (метод «SNP-экспресс», разработчик ООО«Литех»). ПЦР проводится на амплификаторах («ТЕРЦИК» ДНК-Технология, Россия). Амплифицирован-ные фрагменты ДНК разделяют электрофоре-тически в горизонтальном 3% агарозном и в вертикальном 6% полиакриламидном геле. После окончания электрофореза гель окрашивают раствором бромистого этидия и визуализируют в проходящем ультрафиолетовом свете на трансиллюминаторе.
Обсуждение. Предлагаемая схема проведения генетико-эпидемиологического мониторинга и разовых обследований различных популяций людей позволяет:
-
1. Определить границы вариабельности генетических показателей, характеризующих
-
2. Получить корректные сведения об уровне генетических эффектов и проводить адекватное сравнение показателей здоровья жителей территорий с разными уровнями генотоксического воздействия.
-
3. Корректно формировать группы повышенного генетического риска – выявлять людей, для которых наиболее опасны генотоксические нагрузки и кто в первую очередь нуждается в диспансерном наблюдении в медико-генетических консультациях, онкологических диспансерах и в проведении профилактических мероприятий.
-
4. Минимизировать объем исследований, материальных и финансовых затрат, необходимых для заключения об уровне генетических эффектов в изучаемых популяциях.
обследуемую группу населения в условиях вредных производств или экологически неблагоприятных условиях проживания;
Вывод: рекомендуемый подход может быть включен в систему сравнительной оценки канцерогенной ситуации в разных регионах в рамках проведения социально-гигиенического мониторинга. Кроме того, указанная система позволит выделить персонифицированные группы высокого риска развития онкологических заболеваний и разрабатывать индивидуальные программы профилактики рака.
Список литературы Разработка системы комплексной оценки мутагенных и канцерогенных эффектов у населения крупного промышленного региона
- Болтина, И.В. Использование показателя «частота аберраций хромосом» при формировании групп риска относительно онкологических заболеваний//Цитология и генетика. 2007. Т.41, №1. С. 66-74.
- Бочков, Н.П. Хромосомы человека и облучение. -М.: Атомиздат, 1971. 168 с.
- Гичев, Ю.П. Загрязнение окружающей среды и экологическая обусловленность патологии человека. -Новосибирск, 2003. С. 53-57.
- Мерков, А.М. Санитарная статистика/А.М. Мерков, Л.Е. Поляков. -Ленинград: Медицина, 1974. 384 с.
- Чиссов, В.И. Избранные лекции по клинической онкологии/В.И. Чиссов, С.Л. Дарьялова. -М., 2000. 736 с.
- Boffetta, P. Chromosomal aberrations and cancer risk: results of a cohort study from Central Europe/P. Boffetta, O. van der Hel, H. Norppa et al.//Am J Epidemiol. 2007. V. 165. P. 36-43.
- Bonassi, S. Chromosomal aberration frequency in lymphocytes predicts the risk of cancer: results from a pooled cohort study of 22,358 subjects in 11 countries/S. Bonassi, H. Norppa, M. Ceppi et al.//Carcinogenesis. 2008. V. 29. P. 1178-1183.
- Hagmar, L. Epidemiological evaluation of cytogenetic biomarkers as potential surrogateend-points for cancer/L. Hagmar, U. Strömberg, H. Tinnerberg et al.//IARC Sci Publ. 2004. V. 157. P. 207-222.
- Hungerford, P.A. Leukocytes cultured from small inocula of whole blood and the preparation of metaphase chromosomes by treatment with hypotonic KCl//Stain Techn. 1965. V. 40. P. 333-338.
- Norppa, H. Chromosomal aberrations and SCEs as biomarkers of cancer risk/H. Norppa, S. Bonassi, I-L. Hansteen et al.//Mutat Res. 2006. V. 600. P. 37-45.
- Sambrook, J. Molecular cloning: a laboratory manual, 2 ed./J. Sambrook, E. Fritsch, T. Maniatis//Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1989. P. 6.4-6.13.


