Разработка технологии получения липосомальной формы пеуценидина
Автор: Павлов Игорь Артурович
Журнал: Вестник Бурятского государственного университета. Медицина и фармация @vestnik-bsu-medicine-pharmacy
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
В ходе работы были получены липосомы с использованием разных методов: дегидратации - регидратации, гомогенизации и ультразвуковой обработки. Подобран компонентный состав липосомальной оболочки для инкапсуляции пеуценидина. Основным структурным компонентом липосом является фосфатидилхолин. На основе экспериментальных данных выявлено, что оптимальным методом получения липосом является метод ультразвуковой обработки, так как при продолжительном воздействии ультразвука стабильность липосом возрастает прямо пропорционально, но при этом снижается загрузка липосом. Для предотвращения перекисного окисления липидов в качестве антиоксиданта был введен α-токоферола ацетат 30%-ный раствор масляный.
Липосомы, пеуценидин, фосфатидилхолин, дегидратация, регидратация, гомогенизация и ультразвуковая обработка, антиоксидант
Короткий адрес: https://sciup.org/148316758
IDR: 148316758 | УДК: 615.451
Текст научной статьи Разработка технологии получения липосомальной формы пеуценидина
Актуальность
В настоящее время одним из перспективных направлений в увеличении терапевтической эффективности лекарственных препаратов в современной нанобиотехнологии является создание их липосомальныхформ. Липосомы используются как биосовместимые и биодеградируемые наносистемы доставки, оптимизирующие действие лекарств. Известно, что липосомальные препараты снижают токсичность лекарственных средств, защищают их от преждевременной деградации, тем самым пролонгируя время действия лекарства в организме [1–5]. В последнее десятилетие большое внимание стало уделяться лекарственным средствам, выделенным из растительного сырья, так как они лучше переносятся организмом и имеют меньше побочных действий, по сравнению с лекарственными средствами синтетического происхождения [6]. Таким образом, учитывая уникальные свойства липосом как носителей лекарств, актуальным представляется разработка липосом с включением спазмолитического средства пеуценидина [7], что повысит фармако-терапевтическое влияние и снизит его токсичность.
Цель работы
Разработка технологии получения и стандартизация липосоминкапсули-рованных пеуценидином. Для решения поставленной цели было необходимо решить ряд задач:
-
1) подобрать компонентный состав липосомальной оболочки для инкапсуляции пеуценидина;
-
2) на основе экспериментальных данных выбрать оптимальный метод получения липосом;
-
3) разработать физико-химические методы контроля качества полученной липосомальной формы пеуценидина;
-
4) разработать технологическую схему производства липосомальной формы пеуценидина.
Обсуждение результатов
Экспериментальные серии липосом, содержащие пеуценидин, получали по разработанной нами технологической схеме, представленной на рисунке 1. Навеску фосфолипидов, полученных из яичного желтка по стандартной методике [8], не менее 10% (0,2 г) из расчета от содержания их в готовой форме растворяли в 10 мл хлороформа, далее добавляли антиоксидант — масляный раствор α-токоферола в количестве 5% от общего количества липидов. Смесь выдерживали, периодически помешивая до полного растворения липидов. Далее проводили выпаривание хлороформа на роторном испарителе. Образовавшуюся тонкую пленку липидов на стенках колбы продували газообразным азотом или аргоном для предотвращения окисления липидов. Ресуспендирование фофосолипидной пленки смесью этилового спирта и воды в соотношении 1:1. Содержимое встряхивают до полного растворения пленки. Охлаждают смесь в холодильной камере при температуре +4 оС в течение 24–36 часов. В охлажденную смесь вносили предварительно растворенный в 95%-ном этаноле пеуценидин с таким расчетом, чтобы массовая доля его в фосфатной эмульсии составляла 1% [9]. Полученную суспензию обрабатывали на ультразвуковом дезинтеграторе УЗДН-А в течение 1–3 мин с последующим перерывом 3 мин, не давая перегреваться смеси, так как повышение температуры отрицательно сказывается на качестве получаемых липосом [10]. Для стандартизации полученных липосом были подобраны основные параметры, влияющие на качество липосомальных везикул, и предложены следующие методики исследования:
-
1) определение степени включения;
-
2) определение средних размеров липосом.
Было установлено, что при продолжительном воздействии ультразвука стабильность липосом возрастает прямо пропорционально, но при этом снижается загрузка липосом. Опытным путем установлено, что оптимальным временем ультразвуковой обработки составляет 7 мин, при этом степень включения достигает 88,8% (табл. 1) от общего количества растворенного пеуценидина (рис. 2).
Размеры липосом определяли с помощью анализатора ZetaSizerNano ZS. По его данным размеры мультиламиллярных везикул составляли от 600 до 1200 нм (рис. 3), а малых однослойных везикул составляли от 300 до 600 нм наибольшее количество липосом с диаметром 546 нм (рис. 4). Также были получены микрофотографии загруженных липосом с помощью медицинского микровизора проходящего света mVizo-101, увеличением 10х100, до и после воздействия УЗДН.
Таблица 1
Метрологические характеристики определения степени включения липосом после ультразвуковой обработки в течении 7 мин.
|
n |
x |
S2 |
S |
S x |
P |
t(P,f) |
Δ x |
x ±Δ x |
,% |
|
5 |
88,84 |
0,8851 |
0,9407 |
0,4199 |
95 |
2,78 |
2,6151 |
88,84±1,1674 |
1,314 |
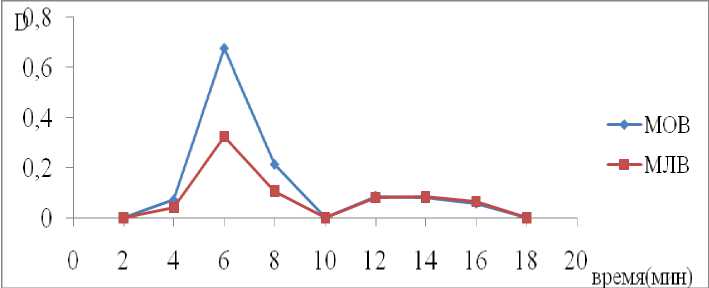
Рис. 2. Зависимость оптической плотности от времени выхода препарата при длине волны 322 нм, после гель-фильтрации. Малые однослойные везикулы (МОВ), Мультиламеллярные везикулы (МЛВ)
Заключение
Таким образом, нами была разработана технологическая схема производства липосом с пеуценидином, диаметр которых составлял от 300 до 600 нм, был подобран компонентный состав липосомальной оболочки для инкапсуляции, установлены оптимальные условия получения липосом. Для стандартизация полученного лекарственного средства было проведено определение степени включения в липосомыпеуценидина, которая составляет 88,8%; проведено качественное определение фосфолипидов, а также качественное и количественное определение пеуценидина.
Список литературы Разработка технологии получения липосомальной формы пеуценидина
- Барышников А. Ю. Наноструктурированные липосомальные системы как средство доставки противоопухолевых препаратов // Вестник РАМН. 2012. №3. С. 23-30.
- Грищенко Н. В., Барышникова М. А., Полозкова А. П. и др. Липосомальные противоопухолевые препараты не используют СВ95-зависимый сигнальный путь апоптоза // Российский биотерапевтический журнал. 2014. Т. 13. № 1. С. 37-42.
- Грищенко Н. В., Альбассит Б., Барышникова М. А. и др. Сравнение цитотоксического действия двух лекарственных форм противоопухолевых препаратов из класса нитрозомочевины // Российский биотерапевтический журнал. 2014. Т. 13. №1. С. 49-54.
- Дмитриева М. В., Оборотова Н. А., Санарова Е. В. и др. Наноструктурированные системы доставки противоопухолевых препаратов // Российский биотерапевтический журнал. 2012. Т. 11. № 4. С. 21-27.
- Фармацевтическая разработка: концепция практические рекомендации. Научно-практическое руководство для фармацевтической отросли / под ред. С. Н. Быковского, И. А. Василенко, Н. Б. Деминой, О. В. Новожилова, А. П. Мешковского, О. Р. Спицкого. М.: Перо, 2015. С. 171.
- Лавренова Г. В. Нет растения, которое не было бы лекарственным [Электронный ресурс] / Г. В. Лавренова, В. К. Лавренов. Донецк: Донеччина, 1997. Режим доступа: http://receptsite.com/LT/LT_statii.files/s009.htm, свободный.
- Тараскин В. В. Фармакогностическое исследование Phlojodicarpussibiricus (Steph. exSpreng.) Koso-Pol. и PhlojodicarpusturczaninoviiSipl.: дис. … канд. фарм. наук. Улан-Удэ, 2011. 148 с.
- Сорокоумова Г. М. Фосфолипиды [методы их выделения, обнаружения и изучения физико-химических свойств липидных дисперсий в воде]: учеб.-метод. пособие / Г. М Сорокоумова, А. А. Селищева, А. П. Каплун. М., 2000. 100 с.
- Владимирский М. А. Экспериментальное изучение липосомального препарата стрептомицина при туберкулезе / М. А. Владимирский, Г. А. Ладыгина, Р. М. Петюшенко, Н. С. Грязнова, Ю. О. Сазыкин // Липосомы. Прим. в биол. медицине. М.: Наука, 1985. С. 77-82.
- Павлов И. А. Разработка и стандартизация липосом с 4-триоурендоиминометилпиридиний перхлоратом, полученных на основе природных триацилглицеринов: автореф. дис. … канд. фарм. наук. Улан-Удэ, 2010. 23 с.


