Редкий клинический случай тимомы типа А: клиническая характеристика и результаты стереотаксического облучения множественных метастазов в печени
Автор: Сидибе Н., Измайлов Т.Р.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клинические наблюдения
Статья в выпуске: 1 т.20, 2020 года.
Бесплатный доступ
В статье представлен редкий клинический случай пациентки 72 лет с клиническим диагнозом: Тимома, тип А, метастатическое поражение головного мозга, легких, печени. Частота встречаемости данного заболевания составляет от 0,2 до 1,5% всех злокачественных новообразований. На сегодняшний день существует морфологическая классификация, пересмотренная ВОЗ в 2015 году, которая выделяет подтипы тимомы в зависимости от гистологического строения (А, атипичный А, AB,B1, B2, B3). Данная классификация учитывает форму опухолевых клеток и количество лимфоцитарного компонента. Для стадирования по степени инвазии в окружающие ткани широко используется классификация Масаоки (1981), а также классификация TNM. Тимомы, как правило, представляют собой индолентные опухоли, имеющие относительно благоприятный прогноз. Они редко (3 - 5%) метастазируют за пределы грудной клетки. По данным литературы, подтип А является наиболее благоприятным вариантом тимомы, c благоприятным прогнозом и общей выживаемостью более 15 лет. В данной статье приведен редкий клинический случай гистологически подтвержденной тимомы типа А с агрессивным течением, характеризующимся множественным отдаленным метастазированием, а также описан результат стереотаксического облучения метастазов тимомы в печени.
Тимома типа а, метастазы в печени, стереотоаксическое облучение
Короткий адрес: https://sciup.org/149132122
IDR: 149132122
Текст научной статьи Редкий клинический случай тимомы типа А: клиническая характеристика и результаты стереотаксического облучения множественных метастазов в печени
Тимома – это новообразование вилочковой железы, которое происходит из ее собственной эпителиальной ткани. Опухоль возникает у взрослых в возрасте от 40 до
70 лет, крайне редко встречается в детском и подростковом возрастах [7]. Этиология тимом до сих пор остается неизвестной. По данным литературы, алкоголь, табакокурение и ионизирующее излучение не являются факторами риска для развития новообразования в данной локализации [7]. Отмечается высокий уровень заболеваемости тимомой среди афроамериканцев, а также азиатов и жителей тихоокеанских островов, что может говорить о наличии влияния генетической компоненты на развитие данного заболевания [7]. На протяжении многих лет были представлены различные классификации тимом, которые не были универсальными, и постоянно изменялись. В конечном счете, была разработана классификация ВОЗ, пересмотренная в 2015 году [2]. Эта классификация разделяет тимому на подтипы A, атипичный А, AB, B1, B2 и B3 в дополнение к более редким вариантам, таким как микронодулярная тимома, метапластическая тимома или склерозирующая тимома
(Табл. 1).
Таблица 1. Классификация тимом, пересмотренная ВОЗ в 2015 году
|
Подтип тимомы |
Обязательные критерии |
Дополнительные критерии |
|
Тип А |
Преобладание доброкачественных, веретенообразных эпителиальных клеток, незначительное количество или отсутствие незрелых (Tdt+) T клеток во всей опухоли |
Полигональные эпителиальные клетки, CD20+ эпителиальные клетки |
|
Атипичный тип А |
Сходные критерии с типом А + комедо-некроз, повышенная митотическая активность (> 4/2 мм2), сгущение ядер |
Полигональные эпителиальные клетки, CD20+ эпителиальные клетки |
|
Тип AB |
Преобладание доброкачественных, веретенообразных эпителиальных клеток, изобилие незрелых (Tdt+) T клеток фокально и во всей опухоли |
Полигональные эпителиальные клетки, CD20+ эпителиальные клетки |
|
Тип B1 |
Тимусоподобная архитектура и цитология: обилие незрелых Т клеток, ареалы медуллярных островков, немногочисленные полигональные или дендрические эпителиальные клетки без сколонности к скоплению (< 3 соприкасающихся эпителиальных клеток) |
Тельца Гассаля, периваскулярные пространства |
|
Тип В2 |
Повышенное число одиночных или без склонности к скоплению полигональных или дендрических эпителиальных клеток, смешанные с большим количеством незрелых Т-клеток |
Медуллярные островки, тельца Гассаля, периваскулярные пространства |
|
Тип В3 |
Слой полигональных атипичных эпителиальных клеток; отсутствие или небольшое количество межклеточных мостиков, немногочисленность или отсутствие смешанных Tdt+ клеток |
Тельца Гассаля, периваскулярные прострнаства |
|
MNT |
Узелки или веретенообразные /овальные эпителиальные клетки, |
Лимфоидные фолликулы, |
|
окруженные лимфоидной стромой |
моноклональные В- клетки и/или плазматические клетки (реже) |
|
|
Метапластическая тимома |
Бифазная опухоль, состоящая из солидных ареалов эпителиальных клеток в окружении доброкачественных веретенообразных клеток; отсутствие незрелых Т клеток |
Плеоморфизм эпитеалиальных клеток; актин, кератин, или EMA-позитивных клеток |
|
Редкие формы тимом |
- |
- |
Для стадирования и определения прогнозов также широко используется классификация Масаоки, целью которой является оценка распространенности опухолевого процесса, целостности капсулы, наличия микро-макроскопической инвазии в окружающие структуры, лимфогенного либо гематогенного метастатического распространения. Местная инвазия в органы плевральной полости оценивается по очередности поражения анатомических барьеров – поражение капсулы опухоли, медиастинальной плевры, клетчатки средостения определяет I – II стадию [6]. При III стадии отмечается инвазия опухоли в перикард, легкое, магистральные сосуды средостения. IV стадия разделяется на IVa – диссеминация по плевре или перикарду и IVb – наличие отдаленных лимфогенных, гематогенных метастазов (Табл. 2). Согласно рекомендациям ВОЗ 2015 г., рекомендована оценка иммуногистохимических признаков в качестве критериев для диагностики тимом.
Примерами являются различия между тимомами типа A и AB по количеству и количеству незрелых TdT+ T-клеток (Терминальные дезоксинуклкотидилтрансфераза-положительные клетки) [2].
Таблица 2. Соотношение стадирования по Masaoka-Koga с TNM-классификацией
|
Стадия I |
TNM T 1 N 0 M 0 |
Описание Макроскопически и микроскопически полностью инкапсулированная опухоль без инвазии в окружающие ткани |
|
IIa |
T 2 N 0 M 0 |
Минимально инвазивное распространение – капсула инфильтрирована на всю толщину, что выявляется последующим микроскопическим исследованием |
|
IIb |
T 2 N 0 M 0 |
Макроскопическая инвазия тимуса в окружающую жировую ткань, медиастинальную плевру или перикард |
|
III |
T 3-4 N 0 M 0 |
Макроскопическое прорастание в соседние органы |
|
IIIa |
(перикард, легкое, диафрагмальный или блуждающий |
|
|
IIIb |
нерв); инвазия в крупный сосуд |
|
|
IVa |
T 1-4 N 1-2 M 0 |
Метастазы в плевру или перикард; микроскопически подтвержденные узелки отдельно от первичной опухоли, связанные с висцеральной или париетальной плеврой, на перикарде или эпикардиальной поверхности |
|
IVb |
T 1-4 N 0-2 M 1 |
Лимфогенное или гематогенное метастазирование. Любое поражение лимфоузлов (переднего средостения, грудной клетки, шейных узлов, любые другие экстраторакальные узлы). Отдаленные метастазы (экстраторакальные), или узлы в легочной паренхиме (не |
|
плевральные имплантаты) |
Клиническое наблюдение
Пациент К., женщина 72 лет, обратилась в Российский научный центр Рентгенорадиологии в ноябре 2019 г. с жалобами на слабость и утомляемость. Анамнез заболевания: со слов пациента и согласно представленной медицинской документации, в 2005 г. выполнено хирургическое лечение в виде удаления медуллярной веретеноклеточной мелкоклеточной тимомы переднего средостения. В 2009 г. отмечено прогрессирование заболевания, в виде появления множественных метастатических очагов в легких. В ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ» выполнена биопсия легких. Заключение гистологического исследования: иммуноморфологические признаки опухоли соответствуют тимоме тип А. В 2015 г. выявлено дальнейшее прогрессирование – метастатическое поражение головного мозга, в связи с чем, было проведен курс радиохирургического лечения на Гамманоже на область метастаза в головном мозге (10.05.2016 г.), после проведено 6 курсов ПХТ по схеме ЕР в ноябре 2016 и в сентябре 2017.
Анализы крови (2017 г.): серотонин – 92,1 нг/мл.; хромогранин А – 138,7 нг/мл. Выполнена пункция костного мозга в 2017 г.: в костном мозге морфологическая картина характеризует парциальную красноклеточную аплазию вторичного генеза (ПККА), возможно иммуноопосредованную, в анамнезе тимома. Консультирована гематологом: ПККА без хромосомных аномалий, зависимая от трансфузий эритроцитарной массы ежемесячно.
С целью подтверждения диагноза, был выполнен повторный пересмотр в РОНЦ им. Блохина: опухоль в стенке бронха имеет гистологическое строение тимомы, тип А. С целью определения лекарственной чувствительности опухоли проведено ИГХ исследование с АТ к рецепторам соматостатина. В клетках опухоли полностью отсутствует мембранная экспрессия SSTR2A, SSTR-5. Экспрессия рецепторов видна в эндотелии сосудов (положительный контроль). Заключение: Морфологическая картина метастатического поражения легкого соответствует диагнозу тимомы, тип А. ИГХ статус рецепторов соматостатина 2А и 5 типов в опухоли – негативный.
В связи со стенозом верхних дыхательных путей, в ноябре 2019 г. выполнена эндоскопическая реканализация бронхов. В 2019 г. выявлено дальнейшее прогрессирование заболевания: продолженный рост метастазов в головном мозге, а также появление метастазов в печени. Был выполнен повторный курс радиохирургии на область метастазов в головном мозге на аппарате Гамма-нож (март 2019 г.), затем проведено 4 курса химиотерапии 1 раз в 21 день по схеме антиметаболитами группы аналогов пиримидина (гемцитабин 800 мг внутривенно капельно в 1 день + капецитабин 1650 мг/м2 внутрь в день 1 – 14 дни). При контрольном обследовании после ХТ отмечена положительная динамика в виде уменьшения метастатических очагов в печени и легких. Проведены 5 и 6 курсы химиотерапии антиметаболитаом группы аналогов пиримидина по схеме (Гемцитабин 800 мг 1, 8 день).
После химиотерапии, при МРТ печени в ноябре 2019 г.: на серии МР-томограмм органов брюшной полости и забрюшинного пространства до и после внутривенного контрастного усиления в структуре печени в правой доле выявлены множественные очаги вторичного поражения (> 10). Наибольший очаг визуализируется в нижних отделах S6 размером 4,1 × 4,2 см с прорастанием капсулы, без четкой границы с латеральным контуром правой почки на протяжении около 1,5 см. Контур почки деформирован, вероятно, за счет опухолевой инвазии в S4 очаг (размер 3 см). В левой доле единичный очаг в S2 по передней поверхности размером 1,1 см. Портальная вена до 10 мм, правая средняя и левая печеночные артерии не изменены. Данных за наличие увеличенных лимфатических узлов, свободной жидкости, костнодеструктивных изменений не выявлено. Заключение: МР-картина множественного вторичного поражения печени, очаг в S6 с признаками экстраорганной инвазии.
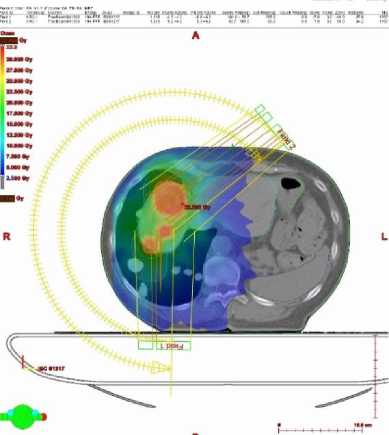
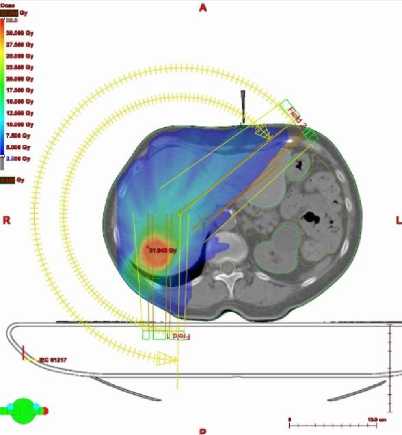
В ноябре 2019 г. госпитализирована в дневной радиотерапевтический стационар РНЦРР, где с 14 ноября 2019 г. по 19 ноября 2019 г. проведен курс дистанционной конформной лучевой терапии с использованием MLC и портальной визуализации на медицинском линейном ускорителе электронов Varian TrueBeam в режиме VMAT на очаги метастатического поражения печени S7-S8 и зону субклинического распространения с РОД 10 Гр за 3 фракции до СОД 30 Гр (Рис.1). Лечение проводилось на фоне гепатопротекторной терапии (гептрал 400 мг/сутки внутривенно №10, карсил 70 мг x 3 раза в сутки №10). Курс дистанционной лучевой терапии проводился c применением методики RapidArc на линейном ускорителе Varian Truebeam, которая позволила избежать превышения толерантных доз на органы риска (Рис. 2.)
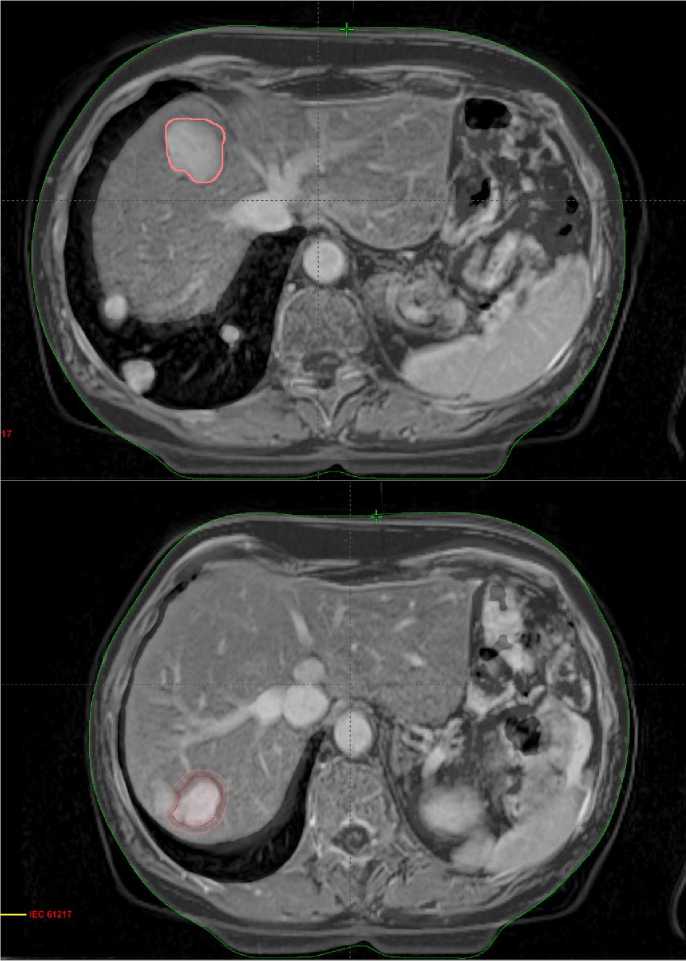
Рисунок 1. Очаги метастатического поражения печени S7-S8.
External Beam Planning
External Beam Plannng 10.0 42 RMCRR, Moscow
Structure ______________ Structure Stilus ____________ Coverage [W%J Volume ________ Mln Dose Max Oose Mean Dote Modal Dose Median Dose StdDev
|
PTV1 |
Approved |
100 0/ 100 0 |
30 6 cm’ |
224Gy |
32 5 Gy |
299Gy |
30 6 Gy |
30 3Gy |
1.5 Gy |
|
PTV3 |
Approved |
100 0/ 1001 |
210cm* |
2$0Gy |
32 3 Gy |
302 Gy |
30 6Gy |
3O3Gy |
09 Gy |
|
GTV3 |
Approved |
100 0/ 1001 |
102 cm* |
29 0 Gy |
32 1 Gy |
30.4 Gy |
30.6 Gy |
30.4 Gy |
0.6 Gy |
|
SPLEEN |
Approved |
100 0/1000 |
1968 cm1 |
01Gy |
36Gy |
05Gy |
OlGy |
OOGy |
07 Gy |
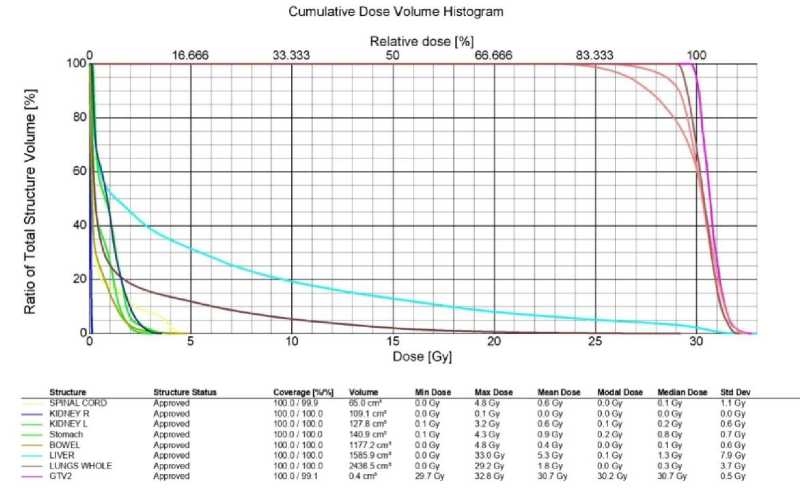
Рисунок 2. План стереотаксической лучевой терапии с гистограммой «доза-объем».
Из гистограммы и изодозных распределений видно, что план облучения удовлетворяет критерию равномерности и достижению необходимого значения по дозам в очагах, а также существенно минимизирует дозовые нагрузки на критические структуры [1].
Спустя 3,5 месяца после стереотаксического облучения метастазов печени, было проведено контрольное дообследование с целью оценки выполненного лечения. На серии МР-томограмм органов брюшной полости и забрюшинного пространства до и после внутривенного контрастного усиления в структуре печени, в правой доле определяются множественные очаги вторичного поражения (> 10). В сравнении с данными от 01.11.19 г. отмечается увеличение всех очагов в среднем на 0,2 - 0,5 см, наибольший очаг визуализируется в нижних отделах S6 размером 4,7 х 5 см (ранее 4,1 х 4, 2 см) с прорастанием капсулы, без четкой границы с латеральным контуром правой почки на протяжении около 1,5 см. Контур почки деформирован, вероятно, за счет опухолевой инвазии. В S4 наблюдается очаг 3 см. Отмечается появление нескольких новых очагов в правой доле размером 0,2 - 0,4 см. В левой доле единичный очаг в S2 по передней поверхности размером 0,5 см (ранее 0,1 см).
Несмотря на выраженную отрицательную динамику, очаги метастазирования, на которые проводилась стереотаксическая лучевая терапия, почти полностью регрессировали по сравнению с данными МР-картины от 01.11.2019 г. (Рис. 3).
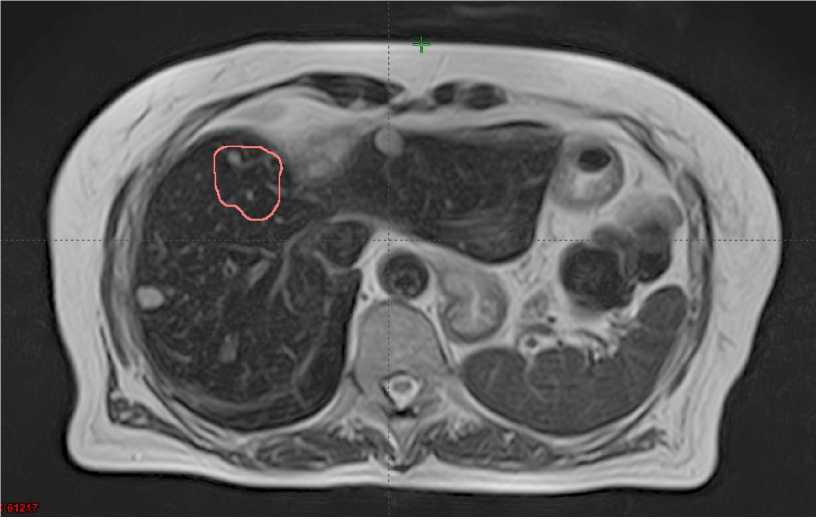
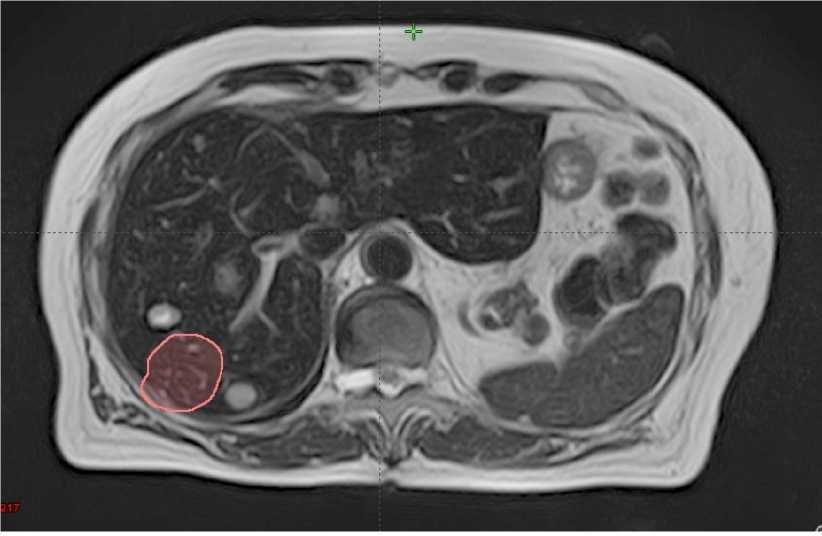
Рисунок 3. Сравнение облученных метастатических очагов через 3 месяца после проведения лучевой терапии (объем облученных очагов наложен на МР-срезы от 21.02.2020 г.).
Обсуждение
Согласно литературным данным, новообразования тимуса встречаются крайне редко, составляя менее 1% всех злокачественных опухолей [8]. Метастазирование обычно ограничиваются плеврой, перикардом или диафрагмой, тогда как отдаленные метастазы встречаются довольно редко. В 2017 году Grajkowska W. и соавторами был описан случай тимомы подтипа А с метастазами в легких и головного мозга у пациентки 66 лет через 10 лет после хирургического удаления первичной опухоли тимуса [4]. Пациентке была проведена лобэктомия с целью удаления метастатических очагов в легких, после было выполнено удаление метастаза в головном мозге. Послеоперационный период протекал без осложнений, однако через 15 дней после нейрохирургического вмешательства у пациентки развилась двусторонняя пневмония. Впоследствии данное состояние осложнилось эпилептическим статусом, и пациентка умерла через 25 дней, несмотря на оказание специализированной медицинской помощи [4].
Заключение
Тимома – это редкая опухоль, возникающая из эпителия тимуса; она является наиболее распространенной солидной первичной опухолью средостения, и на ее долю приходится 20% новообразований органов грудной клетки [5]. Схема ВОЗ определяет тимому подтипа А как эпителиальную неоплазию, лишенную отчетливой дольчатости и состоящую из веретенообразных или овальных опухолевых эпителиальных клеток, почти не имеющих лимфоцитарных инфильтратов. Они классифицируются как доброкачественные опухоли, при этом показатель 5 – 10 летней общей выживаемости составляет 100% [3]. Однако недавние исследования показывают, что доброкачественность данного заболевания не однозначна. Дальнейшее детальное изучение биологии тимомы, несомненно, позволит разработать более эффективные методы лечения, направленные на повышение общей выживаемости, улучшение качества жизни и снижение нежелательных последствий лечения. В заключение, хочется отметить, что внегрудное рецидивирование тимомы встречается очень редко и может произойти спустя годы после хирургического удаления первичной опухоли, поэтому, несмотря на радикальное лечение новообразования, для всех этих больных необходимо обязательное динамическое наблюдение в течение всей жизни.
Список литературы Редкий клинический случай тимомы типа А: клиническая характеристика и результаты стереотаксического облучения множественных метастазов в печени
- Измайлов Т.Р., Смыслов А.Ю., Амелина Н.С. Подготовка и реализация планов облучения пациента, проходившего лечение в ФГБУ "РНЦРР" с использованием метода стереотаксиса. Вестник "Российского научного центра рентгенорадиологии". 2017. № 3. http://vestnik.rncrr.ru/vestnik/v17/docs/izmailov.pdf (Дата обращения: 20.03.2020 г.).
- den Bakker M.A., Roden A. C., Marx A., Marino M. Histologic Classification of Thymoma: A Practical Guide for Routine Cases. J Thorac Oncol. 2014. V. 9. (9 Suppl. 2). P. S125-S130.
- Engles E.A. Epidemiology of thymoma and associated malignancies. J Thorac Oncol. 2010. V. 5 (10 Suppl. 4). S260-2655.
- Grajkowska W., Matyja E., Kunicki J., et al. AB thymoma with atypical type A component with delayed multiple lung and brain metastases. J Thorac Dis. 2017. V. 9. No. 9. E808-E814.
- Kelly R.J., Petrini I., Rajan A., et al. Thymic malignancies: from clinical management to targeted therapies. J Clin Oncol. 2011. V. 29. No. 36. P. 4820-4827.
- Masaoka A. Staging System of Thymoma. J Thorac Oncol. 2010. V. 5. (10 Suppl. 4). P. S304-S312.
- NCCN Guidelines Version 1.2020. Thymomas and Thymic Carcinomas. https://www.nccn.org/professionals/physician_gls/pdf/thymic.pdf.
- Passuello N., Pozza G., Blandamura S., et al. Thymoma metastatic to liver and pancreas: case report and review of the literature. J Int Med Res. 2017. V. 45. No. 2. P. 868- 874.


