Регенерация перирубцовой зоны миокарда при комбинированной реваскуляризации (лазер плюс клетки) на модели хронической ишемической болезни сердца
Автор: Ларионов Петр Михайлович, Чернявский Александр Михайлович, Бондарь Владимир Юрьевич, Бочарова Антонина Владимировна, Субботин Дмитрий Викторович, Сергеевичев Давид Сергеевич, Новрузов Руслан Байрамович, Караськов Александр Михайлович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Новые научные разработки и технологии
Статья в выпуске: 3 т.13, 2009 года.
Бесплатный доступ
На постинфарктной модели хронической ишемии у собак в трехмесячный срок проведена комбинированная реваскуляризация лазер + клетки перирубцовой зоны. Использовались мононуклеарные клетки костного мозга с конечной концентрацией 5х106, имплантированные в лазерные каналы. Через месяц после реваскуляризации миокарда перирубцовой зоны увеличение на 124±4,7/ммл плотности артериол по сравнению с 95±0,4/ммл в контрольной группе ((P<0,05) и плотности капилляров 2938±68,8 /ммл по сравнению с 2144±93,6/ммл в контрольной группе (P<0,05).Кариометрический анализ показал увеличение плотности ядер кардиоцитов на тестовую площадь в зонах васкуляризации на 29,7±1,32 по сравнению с 22,0±1,52 в контрольной группе. контрольной группе (Р<0,05) двукратное увеличение на 972,3±98,2 суммы площадей ядер кардиоцитов на тестовую площадь по сравнению с 465,6±37,1 в контрольной группе (Р<0,05), а также увеличение на 32,6±0,64 | мкл в размере ядер, исходя из их средней площади, по сравнению с 21,0±0,38 мкл в контрольной группе (Р<0,05).Сочетанная реваскуляризация усиливает микроциркуляцию перирубцовой области миокарда и восстанавливает регенерацию кардиоцитов.
Реваскуляризация миокарда, микроциркуляция, регенерация, кардиомиоцит
Короткий адрес: https://sciup.org/142233511
IDR: 142233511 | УДК: 616.127-005.8:612.014.481
Текст научной статьи Регенерация перирубцовой зоны миокарда при комбинированной реваскуляризации (лазер плюс клетки) на модели хронической ишемической болезни сердца
На сегодняшний день, остается неясной возможность регенерации миокарда «взрослого сердца» вообще и в условиях улучшения микроциркуляторного русла. Сейчас считается, что кардиомиоциты (КМЦ) сердца человека после года от момента рождения не способны к гиперпластической регенерации, возможна только внутриклеточная регенерация. Более того, рядом авторов было показано, что число кардиомиоцитов в течение жизни не меняется [6, 11].
Однако ряд экспериментальных исследований последних лет и клинических наблюдений в области трансплантологии позволил предположить несколько гипотез клеточного обновления миокарда: регенерация миокарда может происходить за счет пролиферации резидентных (эндогенных) стволовых клеток миокарда при его повреждении; показана возможность трансдифференцировки клеток костномозгового происхождения в кардиоциты [5, 12, 14, 15].
Цель нашей работы - анализ репаративных процессов кардиоцитов перирубцовой зоны в условиях изменения микроциркуляции после комбинированного воздействия - лазерной реваскуляризации и имплантацией в лазерные каналы мононуклеарной фракции клеток костного мозга (МНФ ККМ).
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на 14 беспородных собаках массой от 11 до 14 кг. Всем животным выполнялась моделирование острого инфаркта миокарда, спустя 3 месяца, 9 животным проводилась комбинированная реваскуляризация миокарда перирубцовой области. В 8-12 лазерных каналов имплантировались аутологичные клетки МНФ КМ. Суммарное количество имплантируемых клеток 5 х 106. Детальное описание методики реваскуляризации и клеточного процессинга представлены в следующих публикациях [1,2, 4]. Для профилактики эктопической оссификации был обязательным этап сепарации МНФ ККМ на пластике 30 мин [2, микроциркуляция, регенерация, кардиомиоцит.
-
3] . Через месяц после комбинированной реваскуляризации животные выводились из эксперимента. Пять животных с постинфарктным рубцом были использованы в качестве контроля время экспозиции ишемии 3 месяца.
Для морфологической оценки использованы фрагменты миокарда левых желудочков миокарда перирубцовой области.
Плотность артериол оценивалась по позитивной реакции на выявление щелочной фосфатазы ЩФ. Среда для демонстрации ЩФ - 25 мг нафтола AS-BI фосфата растворяли в 0,5 мл №,№-диме-тилформамида, затем добавляли 50 мл 0,1 М трис-HCl буфера pH 9,2. Реакцию оценивали визуально, только на поперечных срезах сосудов.
Для оценки микроциркуляторного русла срезы окрашивались изолектином GS-IB 4 меченным флюорофором AlexaFluor 594 (Invitrogen Lot. 404250) (рис. 1) в концентрации 1:100 на 0,1 МФСБ с использованием Multi-Shaker PSU-20 на протяжении 11 ч при комнатной температуре. При подсчете капилляров миокарда учитывались волокна миокарда с поперечным профилем, которые включались в анализируемые площади при их выделении. Для анализа изображений использовали программноаппаратный комплекс на базе микроскопа Axioskop FL-40 c камерой AxioCam MRc, Carl Zeiss, программный пакет AxioVision 3.1, его программные модули ручных измерений и для получения изображений модуль MultiChannel, объектив Plan-Neofluar х 40 с конечным увеличением 460 крат, блоками фильтров (filter set 00 BR 530-585, FT 600, LP615 и filter set 09 BR 450-490, FT 510, LP515 Carl Zeiss).
Проводилась флюоресцентная кардиометрия миокарда (рис. 2). Срезы окрашивались в водном растворе, содержащим 10pG/mL ethidium bromide, 9 мин при комнатной температуре. Анализировались следующие параметры: средняя численная плотность ядер на тестовую площадь (M±m), средняя сумма площадей ядер на тестовую площадь M±m (мкм2), средний процент площади ядер на 100% тестовой площади миокарда (M±m) (%), сред-
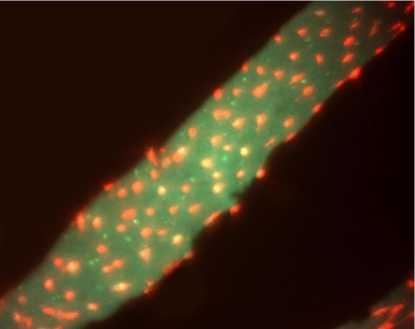
Рис. 1. Флюоресцентная метка Alex-flu на изолектине B4, определяются капилляры миокарда - краснооранжевые. Контрастер-аутофлюоресценция. Объектив х 40.
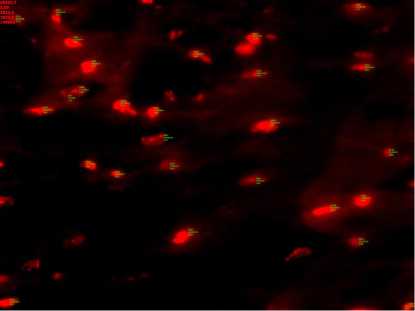
Рис. 2. Окрашивание этидиумом бромидом, на ядрах денситометрические показатели. Объектив х 63.
няя площадь ядра M±m (мкм2), средний «идеальный» диаметр ядра исходя из средней площади миокарда M±m (мкм2). Денситометрический максимум ядер кардиоцитов и денситометрический минимум был одного уровня для изучаемых групп. Аналитическое увеличение 630 крат, тестовая площадь одного изображения 39437 мкм2.
Для получения изображений и их анализа использовался микроскоп M200 c камерой AxioCam HRc, Carl Zeiss, программный пакет AxioVision 4.7, программный модуль автоматических измерений, объектив Neofluarх63, блоком фильтров (filter set 00 BR 530-585, FT 600, LP615).
Статистический анализ результатов, выполнен с помощью программных пакетов Microsoft Excel и OriginPro 7.0. с использованием критериев ANOVA в доверительном интервале P<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Средняя численная плотность артериол миокарда перирубцовой области в экспериментальной группе с реваскуляризацией, составила 124±4,7/мм2 против 95±0,4/мм2 в контроле (P<0,05).
Наши результаты, показывающие увеличение численной плотности артериол в области комбинированной реваскуляризации, близки к результатам полученным авторами при выполнении ТМЛР, так же использовавшим модель хронической ишемии у крупных животных [7, 8].
Средняя численная плотность капилляров миокарда перирубцовой области в экспериментальной группе составила 2938±68,8/мм2 против 2144±93,6/мм2, в контроле ХИБС, (P<0,05). В близком эксперименте, на модели хронической ишемии миокарда у свиней, изучая эффекты имплантации в миокард клеток МНФ КК, через 12 недель после инъекции, нашли увеличение плотности капилляров до 1132±69/мм2, против 903±44/мм2 в контроле, что в процентом выражении показывают увеличение плотности капилляров на 25%, у нас же на 37% [13].
Результаты, представленные в табл. 1, показывают практически двукратное увеличение средней суммы площадей ядер и среднего процента площади ядер кардиоцитов, а также значимое увеличение численной плотности ядер, в группе с воздействием на миокард перирубцовой области «лазер плюс клетки», при сравнении с аналогичными показателями в контроле. Более того, размеры самих ядер при оценке таких параметров как средний «идеальный» диаметр и средняя площадь ядра также увеличиваются в группе с комбинированной реваскуляризацией (табл. 2).
Таблица 1
Средняя сумма площади ядер на тестовую площадь 39437 мкм2, средний процент площади ядер на 100% тестовой площади миокарда, средняя численная плотность ядер на тестовую площадь 39437 мкм2
|
Миокард перирубцовой области |
Средняя сумма площадей ядер на тестовую площадь, 2 мкм |
Средний процент площади ядер на 100% тестовой площади миокарда, (%) |
Средняя численная плотность ядер на тестовую площадь |
|
Контроль ХИБС |
465,6±37,1 |
1,18±0,094 |
22,0±1,52 |
|
Лазер+клетки |
972,3±98,2* |
2,19±0,122* |
29,7±1,32* |
* P<0,05 при сравнении данных контроля с воздействием «лазер плюс клетки» по критериям ANOVA one way
Новые научные разработки и технологии
Таблица 2
Средняя площадь ядра кардиоцита, средний «идеальный» диаметр ядра по предварительным расчетам средней площади ядра
|
Миокард перирубцовой области |
Средняя площадь ядра, 2 мкм |
Средний «идеальный» диаметр ядра, исходя из его средней площади, мкм2 |
|
Контроль ХИБС |
21,0±0,38 |
5,02±0,04 |
|
Лазер+клетки |
32,6±0,64* |
6,04±0,04* |
* P<0,05 при сравнении данных контроля с воздействием «лазер плюс клетки» по критериям ANOVa one way
Привлекательно в проекции наших данных, выглядят результаты, полученные Н. Lim с соавторами [10], которые при использовании модели хронической ишемии у свиней с трехмесячной экспланацией ишемии, обнаружили регионарную потерю ядер кардиоцитов (35%) за счет включения механизмов апоптоза. Эта была первая работа, показавшая связь между хронической регионарной ишемией и ишемической кардиомиопатией.
В этом смысле увеличение размеров самих ядер, в группе с комбинированной реваскуляризацией, прямо говорит об участии антиапоптоти-ческих механизмов клеточной терапии, и включении регенерации кардиоцитов перирубцовой зоны в большей степени за счет паракринных эффектов [9].
Заключая можно с определенной долей уверенности говорить о возможности восстановления функций кардиоцитов в области комбинированного воздействия лазер плюс клетки в условиях восстановления микроциркуляторного русла.
Список литературы Регенерация перирубцовой зоны миокарда при комбинированной реваскуляризации (лазер плюс клетки) на модели хронической ишемической болезни сердца
- Караськов А.М., Kарионов П.М., Чернявский А.М. и др.//Патология кровообращения и кардиохирургия. 2007. № 4. С. 75-81.
- EDN: JJSWMT
- Kарионов П.М., Чернявский А.М., Боярских У.А. и др.//Мед. консульт. 2004. Т. 45, № 4. С. 2-6.
- Kарионов П.М., Сергеевичев Д.С., Чернявский А.М. и др. Бюлл. экспер. биол. и медицины. 2009. Т. 147, № 5. С. 576-583.
- EDN: VRQSCZ
- Чернявский А.М., Kарионов П.М., Фомичев А.В. и др.//Вестник трансплантологии и искусственных органов. 2007. № 6. С. 30-36.
- EDN: KHPFFH
- Beltrami A.P., Urbanek K., Kajstura J. et al.//N. Engl. J. Med. 2001. V. 344. P. 1750-1757.


