Региональный опыт терапии тяжелой бронхиальной астмы препаратом бенрализумаб в Республике Бурятия
Автор: Григорьева Е.В.
Журнал: Вестник Бурятского государственного университета. Медицина и фармация @vestnik-bsu-medicine-pharmacy
Рубрика: Медицина
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Представлен обзор современного метода фармакотерапии тяжелой эозинофильной бронхиальной астмы генно-инженерным иммунобиологическим препаратом бенрализумаб (Фазенра). Показана эффективность и безопасность биологической терапии у 13 пациентов (средний возраст 61,37 + 2,42 года) с эозинофильным фенотипом бронхиальной астмы тяжелого течения в Республике Бурятия на основании оценки клинико-функциональных показателей: выраженность и частота симптомов с оценкой уровня контроля астмы по валидизированным опросникам АСТ и ACQ-5; анамнестическая частота обострений, потребность в системных глюкокортикостероидах; функциональные показатели - пиковая скорость выдоха по данным вентилометрии; эозинофилия периферической крови в динамике. Подтверждено в реальной клинической практике улучшение состояния пациентов с тяжелой бронхиальной астмой в виде уменьшения частоты симптомов, достижения контролируемого течения заболевания (снижение показателя ACQ-5 с 1,92 + 0,23 до 0,73 балла и увеличение показателя АСТ с 15,83 + 2,3 до 22,3 балла), отсутствия обострений за годичный период наблюдения, улучшения показателей функции внешнего дыхания в виде повышения пиковой скорости выдоха с 57,1 + 4,47% до 83,16 + 3,74% от должных величин, отмены системных глюкокортикостероидов, выраженное снижение количества эозинофилов периферической крови до 0 в 98,5% случаев на фоне применения генно-инженерного иммунобиологического препарата бенрализумаб (Фазенра).
Тяжелая бронхиальная астма, эозинофилия крови, контроль астмы, бенрализумаб
Короткий адрес: https://sciup.org/148328049
IDR: 148328049 | УДК: 615.036 | DOI: 10.18101/2306-1995-2023-2-9-18
Текст научной статьи Региональный опыт терапии тяжелой бронхиальной астмы препаратом бенрализумаб в Республике Бурятия
Бронхиальная астма (БА) относится к числу серьезных неинфекционных заболеваний и является проблемой общественного здравоохранения во всех странах независимо от уровня их развития1. В Российской Федерации заболеваемость БА также высока и составляет 1047,7 случая на 100 000 населения1. При этом доля пациентов c тяжелой бронхиальной астмой (ТБА) составляет ориентировочно 15% от всех пациентов с такой патологией (данные исследования НИКА) [1]. Они часто имеют неконтролируемое течение заболевания и нередко внепланово обращаются за медицинской помощью, в том числе неотложной, госпитализируются и составляют группу повышенного риска летального исхода. Именно ТБА нередко является причиной инвалидизации пациентов до 25‒40% в некоторых регионах России [2] и даже смертности2.
Результаты многочисленных исследований последних лет показывают, что в структуре тяжелой неконтролируемой астмы возрастает частота эозинофильного фенотипа воспаления — около 55% пациентов характеризуются уровнем эозинофилов в индуцированной мокроте ≥3% [3]. Подтверждена связь между повышенным уровнем эозинофилов в дыхательных путях и более частыми, тяжелыми обострениями астмы, следовательно, более частым использованием ресурсов здравоохранения [4].
Таким образом, БА и в особенности ее тяжелая форма эозинофильного фенотипа представляет собой важную медико-социальную проблему для системы здравоохранения Российской Федерации. Оптимизация длительной поддерживающей терапии ТБА способна улучшить прогноз в отношении эпидемиологических показателей заболеваемости, смертности, снизить экономическое бремя заболевания, а также улучшить прогноз в отношении бремени симптомов, трудоспособности и качества жизни этих пациентов.
Эффективные стратегии фармакотерапии БА регламентированы международным руководством GINA [1], Международными клиническими рекомендациями «Неконтролируемая и тяжелая астма у подростков и взрослых» 2019 года3, а также Национальными клиническими рекомендациями по диагностике и лечению БА [5], согласно которым пациенты с ТБА получают объем терапии 4‒5 ступени по GINA с использованием максимальных доз стандартных лекарственных препаратов и/или регулярным применением оральных глюкокортикостероидов (ОГКС) [6]. В случае невозможности достижения контроля над заболеванием даже при таком интенсивном лечении рекомендуется одна из опций таргетной терапии генно-ин- женерными иммунобиологическими препаратами (ГИБП), направленной на эозинофильный (T2) тип воспаления, характерный для ТБА, который объединяет в себе факторы адаптивного (Т-хелперы 2-го типа, Th2) и врожденного (врожденные лимфоидные клетки 2-го типа, ILC2) иммунитета. Данные типы клеток продуцируют основные Т2-цитокины: интерлейкин-4 (ИЛ-4), ИЛ-13 и ИЛ-51. В настоящее время в России зарегистрировано 5 иммунобиологических препаратов, относящихся к группе средств фенотипобусловленных методов терапии ТБА: анти-IgE-терапии (IgE –иммуноглобулин E), анти-ИЛ-4/13-терапии и анти-ИЛ-5-тера-пии [5]. В зависимости от анамнеза, клинических особенностей, наличия гиперчувствительности к одному из круглогодичных аллергенов и значений лабораторных маркеров пульмонолог или аллерголог определяет фенотип заболевания (аллергическая БА или неаллергическая, эозинофильная БА) и решает вопрос о назначении больному соответствующего препарата. Следует подчеркнуть, что при выборе препарата специалист учитывает роль ключевого цитокина при эозинофильной БА — ИЛ-5, высвобождаемый Тh2-клетками под действием аллергических стимулов и ILC2 под действием неспецифических раздражителей, включая патогены, поллютанты, табачный дым, механические и термические повреждающие факторы; ИЛ-5 привлекает эозинофилы в зону воспаления, активирует их и увеличивает их выживаемость. В эозинофилах содержатся медиаторы воспаления (эйкозаноиды, лейкотриены, цитокины) и белковые гранулы (эозинофильный катионный белок, эозинофильная пероксидаза, эозинофильный нейротоксин и главный основной белок). Изучение роли ИЛ-5 в патогенезе БА привело к созданию антител к ИЛ-5 как перспективных противоастматических препаратов [7]. В России зарегистрировано 3 препарата, воздействующих на ИЛ-5: реслизумаб и мепо-лизумаб связывают ИЛ-5 в сыворотке крови, в то время так бенрализумаб связывается с IL-5Ra (a-субъединица рецептора к человеческому ИЛ-5). Рецептор к ИЛ-5 находится на поверхности эозинофилов и базофилов и привлекает естественные киллеры, что приводит к быстрой и практически полной деплеции эозинофилов посредством антителозависимой клеточно-опосредованной цитотоксичности (АЗКЦ) активного апоптоза. Таким образом, бенрализумаб посредством АЗКЦ уменьшает эозинофильное воспаление и является одним из наиболее перспективных для лечения эозинофильного фенотипа ТБА [8].
Бенрализумаб представляет собой антиэозинофильное гуманизированное, афукозилированное, моноклональное антитело (IgG1/k), эффективность и безопасность которого была доказана в пяти крупных рандомизированных клинических исследованиях III фазы с участием 2717 пациентов с тяжелой бронхиальной астмой. Эти исследования демонстрируют достоверные и клинически значимые преимущества бенрализумаба в сравнении с плацебо в дополнение к стандартной терапии по следующим клиническим показателям: снижение среднегодовой частоты обострений БА, требующих госпитализации или обращения в отделение неотложной помощи, улучшение функции легких, снижение дозы ОГКС по сравнению с исходной, улучшение качества жизни, успешность использования предварительно заполненных шприцев (ПЗШ) в амбулаторных условиях и на дому 1 [9‒12]. Также лекарственный препарат бенрализумаб продемонстрировал хорошую переносимость. В большинстве случаев наблюдаемые нежелательные явления (НЯ) были легкими или умеренно выраженными, частота НЯ при лечении бе-нрализумабом не превышала их частоту при использовании плацебо. Общая частота НЯ была сопоставимой в группах активной терапии и терапии плацебо (ОР =0,98, 95% ДИ от 0,93 до 1,02, р = 0,34). Статистической неоднородности отмечено не было (I2=0%) [13].
При использовании бенрализумаба в рамках клинических исследований было отмечено снижение частоты обострений, требующих госпитализации или обращений в отделения экстренной помощи на 93% по сравнению с группой плацебо. С учетом доказанного преимущества бенрализумаба по сравнению со стандартной терапией и благоприятного профиля безопасности использование лекарственного препарата бенрализумаб в рутинной клинической практике лечения ТБА будет способствовать снижению экономического бремени заболевания, ассоциированного с обострениями бронхиальной астмы и нежелательными явлениями, возникающими при приеме ОГКС. По сравнению с другими препаратами терапии ТБА омализумабом, дупилумабом, меполизумабом использование лекарственного препарата бенрализумаб в терапии пациентов ТБА позволит в 2‒4 раза сократить число госпитализаций пациентов для проведения лечения (благодаря режиму до-зирования) 2 . Также включение лекарственного препарата бенрализумаб в территориальный перечень лекарственных препаратов может положительно отразиться на показателе доступности и качества медицинской помощи, повысит удовлетворенность населения медицинской помощью. В Российской Федерации лекарственный препарат бенрализумаб показан взрослым пациентам с тяжелой бронхиальной астмой с эозинофильным фенотипом в качестве дополнительной поддерживающей терапии 3 .
Целью проведенного исследования являлась оценка эффективности препарата бенрализумаб (Фазенра) у пациентов с ТБА в Республике Бурятия через год проводимой таргетной терапии ГИБП.
Материалы и методы
Исследование проводилось на базе Городского клинического респираторного центра ГАУЗ «Городская поликлиника № 2» г. Улан-Удэ, где получают терапию
ГИБП пациенты с тяжелыми формами БА со всей Республики Бурятия. До настоящего времени под наблюдением находились 18 человек, получающих терапию бенрализумабом, еще трое готовятся к инициации, проходя дообследование. В соответствии с целью исследования были отобраны 13 пациентов, получивших полные 12 мес. лечения, для оценки основных клинико-функциональных и лабораторных критериев эффективности лечения. Среди обследованных пациентов с ТБА, средний возраст которых составил 61,37 + 2,42 (43‒72) лет, преобладали женщины — 84,6% (рис. 1).
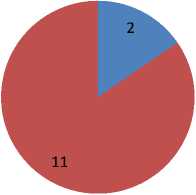
Рис. 1. Гендерный состав обследованных пациентов с ТБА, получавших бенрализумаб в течение года (n=13)
■ МУЖЧИН
■ ЖЕНЩИН
Приведем критерии отбора пациентов на терапию препаратом бенрализумаб :
-
- диагноз БА, установленный более 1 года до включения в наблюдение;
-
- использование высоких доз ингаляционных ГКС (ИГКС) в комбинации с длительно действующими β2 -агонистами и/или ОГКС;
-
- эозинофилия крови (количество эозинофилов ≥ 300 кл/мкл) в анамнезе за последние 12 мес.;
-
- ≥ 2 обострений в течение последнего года.
В исследовании анализировались жалобы, анамнез, проводимая базисная терапия до инициации ГИБТ, наличие/отсутствие обострений и потребность в ОГКС, абсолютные значения содержания эозинофилов в крови (кл/мкл крови), показатели пиковой скорости выдоха (ПСВ) по данным вентилометрии и уровень контроля над БА по результатам ответов на валидизированные опросники Asthma Control Questionnaire (ACQ-5) и астма-контрол тест (АСТ) в сроки до начала терапии и через 12 мес. (1 год) лечения бенрализумабом. В процессе наблюдения все указанные параметры оценивались также через 1 мес. от начала терапии, затем 1 раз в 2 месяца для выявления показаний к отмене препарата или его замене. Бе-нрализумаб назначался в дозе 30 мг подкожно каждые 4 нед. — первые 3 инъекции, затем 30 мг подкожно каждые 8 нед.
Статистическая обработка проводилась с использованием стандартного пакета прикладного статистического анализа Statistica for Windows 7,0.
Результаты
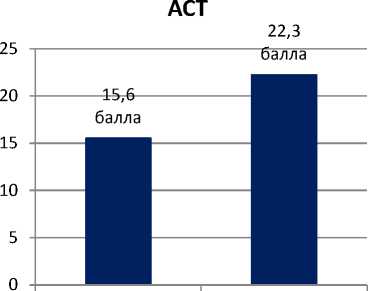
До начала терапии все исследуемые пациенты имели признаки ТБА неконтролируемого течения с исходными показателями тестов контроля астмы по ACQ-5 = 1,92 + 0,23 (0,6‒3,2) балла и АСТ = 15,83 + 2,3 (7‒21) балла, частыми (ежеквартальными) обострениями, требующими приема ОГКС, в том числе у троих пациентов астма характеризовалась стероидозависимым течением. Через год наблюдения на фоне терапии бенрализумабом показатель ACQ-5 снизился до 0,73 балла, показатель АСТ увеличился до 22,3 балла, что соответствовало достижению контроля над астмой (рис. 2).
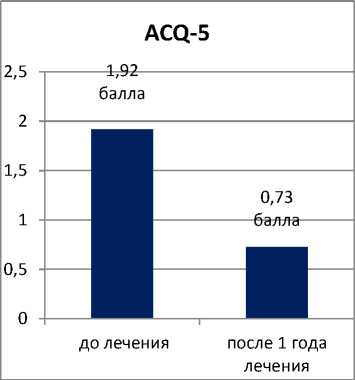
Рис. 2. Динамика показателей уровня контроля астмы по данным валидизированных опросников ACQ-5 и АСТ у пациентов с ТБА, получавших бенрализумаб в течение года (n=13)
до лечения после 1 года лечения
О достижении контроля БА свидетельствует и отсутствие обострений у всех исследуемых пациентов за весь период наблюдения. Кроме того, удалось преодолеть стероидозависимость у всех наблюдаемых пациентов, получающих бенрали-зумаб (n=13).
Функция внешнего дыхания, оцениваемая методом вентилометрии, также претерпела позитивные изменения на фоне лечения у всей группы исследуемых пациентов: ПСВ увеличился на 35,69%: с 57,1 + 4,47% (34‒78) до 83,16 + 3,74% (70‒ 97) от должных величин (рис. 3).
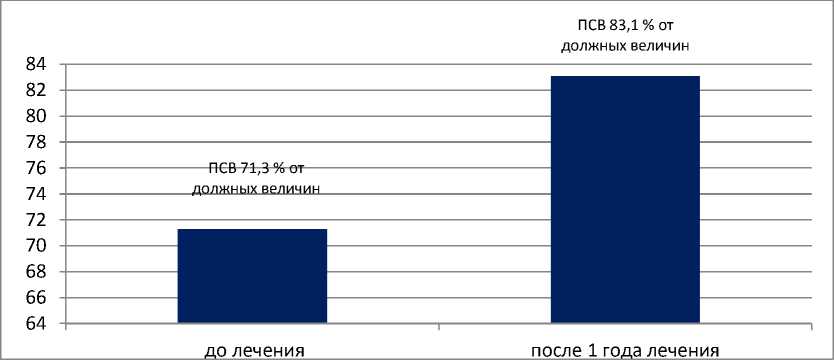
Рис. 3. Динамика степени бронхиальной обструкции по данным ПСВ в % от должных величин у пациентов с ТБА, получавших бенрализумаб в течение года (n=13)
Эффективность проводимой ГИБТ заключалась в значительном снижении уровня эозинофилии периферической крови у всех пациентов с эозинофильным фенотипом ТБА, получающих бенрализумаб, с исходной выраженной эозинофилии крови 1012,33 + 282,3 (400‒2100) клеток /мкл до 57,18 (40‒80) клеток/мкл (рис. 4). Причем уже после первой инъекции препарата относительное количество эознофилов снизилось у всех пациентов до 0‒1% и сохраняется на таком уровне в течение дальнейшего периода наблюдения. Через год использования бенрализу-маба количество эозинофилов крови в исследуемой группе пациентов с эозино-
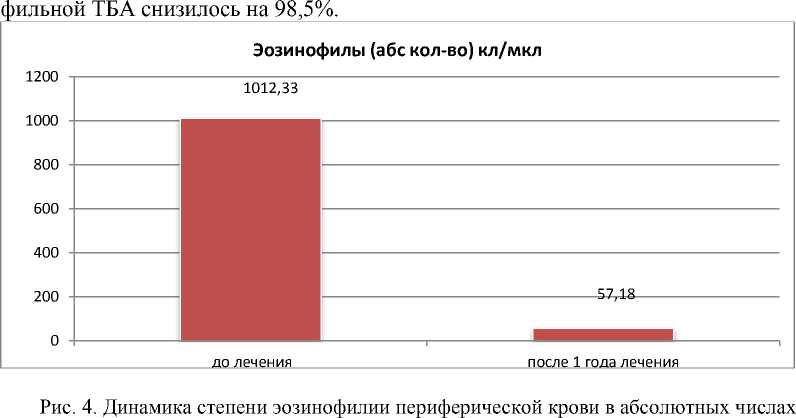
(клеток/мкл) у пациентов с ТБА, получавших бенрализумаб в течение года (n=13)
Надо отметить, что за весь период наблюдения — 1 год терапии препаратом бенрализумаб — ни у одного исследуемого пациента с ТБА не обнаружены нежелательные явления (НЯ).
Заключение
Применение бенрализумаба (Фазенры) в терапии эозинофильного фенотипа ТБА значительно снижает уровень эозинофильного воспаления в дыхательных путях, что опосредовано уменьшением степени эозинофилии периферической крови и приводит к улучшению контроля над БА по результатам тестов АСQ и АСТ, восстановлению проходимости бронхиального дерева, о чем свидетельствует повышение показателя ПСВ до нормы (табл. 1); способствует улучшению течения заболевания за счет предотвращения обострений, в т. ч. тяжелых, с потребностью в приеме ОГКС.
Таблица 1
Сводная таблица динамики клинико-функциональных и лабораторных показателей течения ТБА у пациентов, получавших бенрализумаб в течение года (n=13)
|
АСТ |
ACQ-5 |
ПСВ в % от должных величин |
Эозинофилы (абс. кол-во) кл/мкл |
|
|
До лечения |
15,6 |
1,92 |
71,3 |
1012,33 |
|
Через год лечения препаратом бенрализумаб |
22,3 |
0,73 |
83,1 |
57,18 |
Таким образом, данные, полученные в реальной клинической практике на примере 13 пациентов с эозинофильным фенотипом ТБА, получающих терапию препаратом бенрализумаб (Фазенра) в Республике Бурятия, полностью коррелируют с результатами многочисленных рандомизированных клинических исследований. Высокая эффективность в совокупности с приемлемым профилем безопасности позволяет более широко рассматривать данный лекарственный препарат в арсенале фармакотерапии эозинофильной ТБА.
Список литературы Региональный опыт терапии тяжелой бронхиальной астмы препаратом бенрализумаб в Республике Бурятия
- Архипов В. В., Григорьева Е. В., Гавришина Е. В. Контроль над бронхиальной астмой в России: результаты многоцентрового наблюдательного исследования НИКА // Пульмонология. 2011. № 6. С. 87–93. Текст: непосредственный.
- Социально-экономическое бремя бронхиальной астмы и хронической обструктив- ной болезни легких в Российской Федерации / под редакцией В. В. Омельяновского. Москва, 2009. Текст: непосредственный.
- Schleich F., Brusselle G., Louis R., Vandenplas O., Michils A. et al. Heterogeneity of phenotypes in severe asthmatics. The Belgian Severe Asthma Registry (BSAR). Respiratory Medicine. 2014; 108: 1723‒1732.
- Tran T. N. et al. High blood eosinophil count is associated with more frequent asthma // Ann Allergy Asthma Immunol. 2014. N 113. P. 19‒24.
- Бронхиальная астма: федеральные клинические рекомендации по диагностике и лечению / А. Г. Чучалин, С. Н. Авдеев, З. Р. Айсанов [и др.] // Пульмонология. 2022. № 32(3). С. 393–447. Текст: непосредственный.
- Распространенность, заболеваемость, фенотипы и другие характеристики тяжелой бронхиальной астмы в Российской Федерации / С. Н. Авдеев, Н. М. Ненашева, К. В. Жу- денков [и др.] // Пульмонология. 2018. № 28(3). С. 341‒358. Текст: непосредственный.
- Практические рекомендации по выбору иммунобиологического препарата для лечения тяжелой бронхиальной астмы Т2-эндотипа / Н. М. Ненашева, О. М. Курбачева, С. Н. Авдеев [и др.] // Пульмонология. 2020. № 30(2). С. 227–244. Текст: непосредственный.
- Fitz Gerald J. M., Bleecker E. R., Nair P. et al. Benralizumab, an anti-interleukin-5 recep- tor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosino- philic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial Lancet. 2016. № 388: P. 2128–2141.
- William W. Busse, Eugene R. Bleecker, J. Mark Fitz Gerald et al. Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial // Lancet Respir Med. 2019. N 7. P. 46‒59.
- Ting Liu, Faping Wang, Geng Wang et al. Efficacy and safety of benralizumab in patients with eosinophilic asthma: a meta-analysis of randomized placebo-controlled trials // Frontiers of Medicine. 2018. N 12(3). P. 340‒349.
- Недогода С. В., Саласюк А. С., Барыкина И. Н. Анализ клинико-экономической эффективности применения генно-инженерных биологических препаратов для терапии тяжелой бронхиальной астмы в стационарных условиях. Отчет о научно-исследовательской работе. 2019. Текст: непосредственный.
- Bourdin A. et. al. Matching-Adjusted Indirect Comparison of Benralizumab versus Inter- leukin-5 Inhibitors: Systematic Review // Europ Resp J. 2018. N 52(5). P. 1801‒1393.
- Laren D Tan et al. Benralizumab: a unique IL-5 inhibitor for severe asthma // Journal of Asthma and Allergy. 2016. N 9. P. 71–78.


