Реконструкция пищеводно-кишечного анастомоза у больных после гастрэктомии по поводу рака желудка
Автор: Жерлов Г.К., Кошель А.П., Куртсеитов Н.Э., Карпович А.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (32), 2009 года.
Бесплатный доступ
Представлен анализ результатов формирования эзофагоеюноанастомоза 19 больных с постгастрэктомическим син- дромом после радикального лечения рака желудка. Результаты комплексного обследования показывают, что заживление пищеводно-кишечного анастомоза проходит по типу первичного натяжения у 16 (84,2 %) оперированных больных, а в отдаленном послеоперационном периоде не отмечается признаков стенозирования анастомотического кольца и явлений рефлюкс-эзофагита.
Постгастрэктомический синдром, рефлюкс-эзофагит, реконструкция эзофагоеюноанастомоза
Короткий адрес: https://sciup.org/14055127
IDR: 14055127 | УДК: 616.33-006.6-089.87:616.329/.34-089
Текст научной статьи Реконструкция пищеводно-кишечного анастомоза у больных после гастрэктомии по поводу рака желудка
Одним из радикальных методов, способных улучшить качество жизни таких пациентов и снизить риск развития злокачественной опухоли пищевода, является выполнение реконструктивной операции. Вместе с тем повторная операция с резекцией зоны пищеводно-кишечного анастомоза представляет большую опасность в плане развития несостоятельности вновь сформированного соустья [4]. В этой связи нами разработан и применен на практике способ реконструкции пищеводно-кишечного анастомоза с формированием жома и клапана без вскрытия его просвета [1].
Цель работы – оценить эффективность применения нового способа хирургического лечения рефлюкс-эзофагита у пациентов после гастрэктомии.
Материал и методы
Признаки патологических агастральных симптомов у 12 (63,2 %) пациентов развились в течение первого года, у 7 (36,8 %) – в сроки от 2 до 5 лет после операции. Доминирующими были проявления язвенно-некротического рефлюкс-эзофагита – у 14 (73,7 %) пациентов, флегмонозный эзофагит наблюдался в 3 (15,8 %) случаях. Тяжелый демпинг-синдром в сочетании с катаральным эзофагитом развился у 2 (10,5 %) больных. Окончательный диагноз основывался на данных комплексного обследования, включающего клинические, лабораторные (общеклинические и биохимический анализы крови) и инструментальные (эзофагоеюноскопия, рентгеноскопия и эндоскопическая ультрасонография пищевода) методы исследования.
Для изучения качества жизни пациентов до и после операции использовали модифицированный опросник оценки качества жизни при заболеваниях желудочно-кишечного тракта для хирургических больных (GIQLI) – гастроинтестинальный индекс (ГИ), который был создан специальной международной комиссией и является специфичным для гастроинтестинальной хирургии [2].
Всем пациентам после предоперационной подготовки было выполнено оперативное лечение по разработанной методике, которая заключалась в следующем: из верхнесрединного доступа выполняли ревизию и мобилизацию отводящей и приводящей петли тощей кишки. Приводящую кишку отсекали на 3 см проксимальнее пищеводно-кишечного анастомоза, дистальный конец ее ушивали наглухо, а проксимальный переводили ниже мезоколон. Отводящую петлю тонкой кишки пересекали на 14–16 см дистальнее пищеводно-кишечного анастомоза. Отсепарованную на протяжении 10–12 мм мышечную оболочку пищевода заворачивали кверху и по краю подшивали в состоянии умеренного натяжения к продольному мышечному слою пищевода. На проксимальном конце сформированного трансплантата выкраивали участок серозно-мышечной оболочки размерами 25х30 мм, отсекали и удаляли. При этом большая часть площадки располагалась впереди эзофагоеюноанастомоза (рис. 1). При завязывании швов происходило погружение избытка подслизисто-слизистой основы пищевода и тощей кишки в просвет последней, что
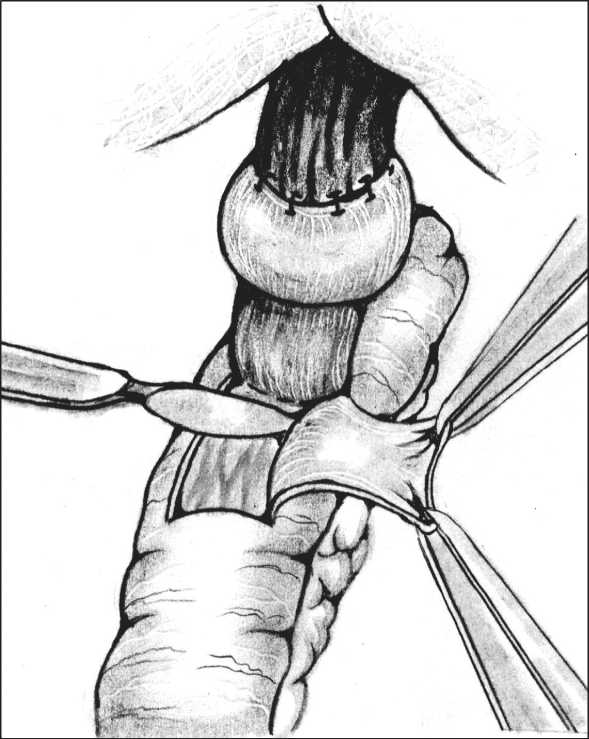
Рис. 1. Этап формирования инвагинационного клапана. Участок серозно-мышечной оболочки впереди эзофагоеюноанастомоза удаляется
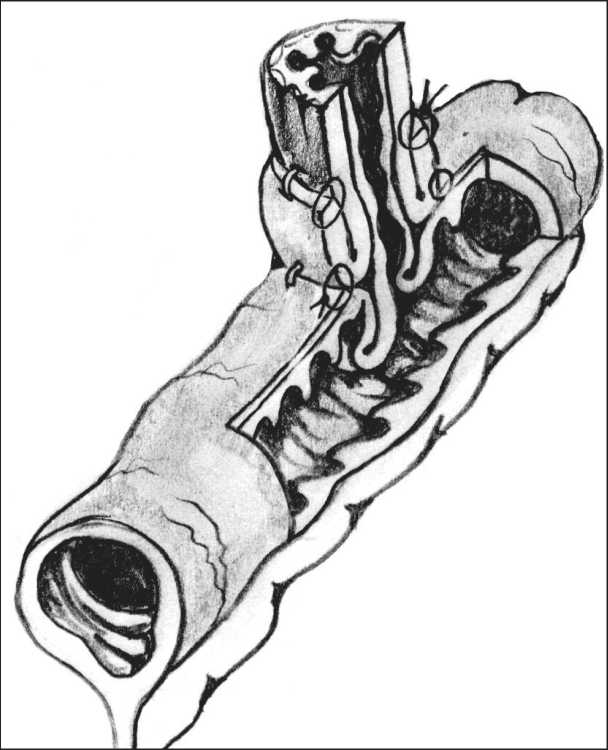
Рис. 2. Схематичный разрез зоны эзофагоеюноанастомоза после реконструкции являлось основой формируемого клапана. На рис. 2 представлен схематический разрез зоны эзофагоеюноанастомоза.
Результаты и обсуждение
До реконструктивной операции по данным эзофагоскопии рефлюкс-эзофагит различной степени выраженности наблюдался у всех пациентов. При этом дистальный рефлюкс-эзофагит I степени в соответствии с классификацией Savary–Miller выявлен у 2 (10,5 %) пациентов, II степени – у 3 (15,8 %), III степени – у 6 (31,6 %), IV степени – у 8 (42,1 %) больных.
Для более объективной оценки явлений эзофагита рутинную эзофагоскопию дополняли эндоскопической ультрасонографией (ЭУС), которая позволяла оценить степень выраженности воспаления на исследуемом участке пищевода, а также органическую и функциональную состоятельность эзофагоэнтероанастомоза. По данным ЭУС у 2 (10,5 %) пациентов воспалительная инфильтрация распространялась только на слизистую оболочку с утолщением его и отёком базальной мембраны, что характерно для катаральной формы рефлюкс-эзофагита. Воспалительная инфильтрация, распространяющаяся на слизистый и подслизистый слои с наличием поверхностного дефекта не глубже базальной мембраны слизистой оболочки, с утолщением слизистого и подслизистого слоёв, наличием гиперэхогенных включений и расширенных сосудов в подслизистом слое, нечётких границ между этими слоями, что соответствует эрозивной форме РЭ, выявлена у 6 (31,6 %) пациентов. У 5 (26,3 %) пациентов по результатам ЭУС выявлены признаки нарушения целостности слизистого и подслизистого слоёв с вовлечением мышечной оболочки в виде гипоэхогенного участка деструкции, в дне которого определялись гиперэхогенные некротические массы, с распространением воспалительной инфильтрации на слизистый, подслизистый, мышечный слои, с нарушением архитектоники мышечного слоя и границ между слоями, что характерно для язвенного РЭ. Рубцово-стенотическая форма РЭ с уменьшением толщины слизистого слоя пищевода, нарушением четкой дифференцировки его стенки по наружному контуру и по слоям с замещением ее структур на гиперэхогенные линейные и точечные включения, гиперэхогенные фрагменты, которые отчетливо визуализировались в мышечном слое, нарушая архитектонику мышечной ткани и межмышечной пластинки, была выявлена у 6 (31,6 %) больных. При сравнительном анализе результатов рутинного эндоскопического исследования при РЭ (классификация Savary–Miller, 1978) и ЭУС пищевода (таблица) была проведена определенная «коррекция» степени тяжести эзофагита.
Таблица
Сравнение результатов эзофагоскопии и эндоскопической ультрасонографии у больных с постгастрэктомическим рефлюкс-эзофагитом
|
Степень РЭ |
Эзофагоскопия (n=19) |
ЭУС (n=19) |
|
I степень |
2 |
2 |
|
II степень |
3 |
6 |
|
III степень |
6 |
5 |
|
IV степень |
8 |
6 |
В соответствии с основными клиническими и эндоскопическими симптомами у обследуемых пациентов при рентгеноскопии пищевода обращали внимание на следующие участки пищеварительной трубки: пищеводно-кишечный анастомоз – его расположение относительно диафрагмы и функция; объем и рельеф слизистой дистальных отделов пищевода; функцию и структуру приводящей и отводящей кишки. Прямой признак недостаточности эзофагоэн-тероанастомоза (рефлюкс бариевой взвеси) выявлен у всех 19 пациентов при обследовании в горизонтальном положении. В большей степени рефлюкс определялся не уровнем расположения пищеводно-кишечного перехода относительно диафрагмы, а степенью расширения дистального отдела пищевода и его недостаточностью. В вертикальном положении этот признак определяется несколько реже – у 14 (73,6) % больных. Однако при нагрузочной пробе Вальсальвы частота энтероэзофагеального рефлюкса приближалась к частоте этого явления в положении Тренделенбурга.
В различные сроки после операции прослежена судьба 18 пациентов (одна больная умерла через 9 мес после реконструктивной операции от метахронного рака прямой кишки).
В раннем послеоперационном периоде (6–10 сут) эндоскопическое исследование было выполнено всем 19 пациентам. Изменения в пищеводе в виде поверхностных эрозий обнаружены у одного больного (5,3 %). В остальных случаях признаков эзофагита не отмечалось, за исключением дистальных отделов, прилежащих к анастомозу, где имела место умеренная гиперемия слизистой оболочки. В зоне эзо-фагоеюноанастомоза наблюдался умеренный отек и гиперемия слизистой. Анастомоз во всех случаях был сомкнут, раскрывался при инсуфля-ции воздухом. Диаметр анастомоза колебался в пределах от 10 до 15 мм (13,5 ± 1,7 мм). Аппарат 11 мм свободно проходил за анастомоз.
При морфологическом исследовании био-птатов зоны пищеводно-кишечного анастомоза в ранние сроки после операции гистологические признаки анастомозита выявили у 6 (31,6 %) больных. Причем воспаление было более выражено в стенке тонкокишечного трансплантата. Слизистая оболочка пищевода в зоне анастомо- за местами истончена, ее толщина в среднем составляла 178,7 ± 15,1 мкм. В подслизистой основе встречались не густые, но достаточно распространенные лейко-лимфоцитарные инфильтраты, расширенные и полнокровные сосуды.
В сроки от 3 до 6 мес по результатам эндоскопического исследования было выявлено, что слизистая оболочка пищевода не изменена, эзофагоеюноанастомоз сомкнут, свободно проходим, при инсуфляции воздухом он раскрывается до 12–14 мм. Инвагинационный клапан был представлен в виде полулунной складки. У одного пациента (5,3 %) на задней полуокружности пищеводно-кишечного анастомоза сохранялся налет фибрина, у остальных обследованных пациентов воспалительных изменений со стороны пищеводно-кишечного анастомоза не отмечено.
При рентгенологическом исследовании в указанные сроки контрастная масса свободно проходит по пищеводу, анастомоз перистальти-рует, раскрывается до 20 мм, пропускает барий в трансплантат порционно. Эвакуация контраста в ДПК наступает через 3–4 мин. Рефлюксов стоя и лежа (в т.ч. в положении Тренделенбурга) в трансплантат и пищевод нет. Через 1 ч в трансплантате следы контрастной массы, основная часть ее в петлях тощей кишки.
В отдаленные сроки после операции (3–5 лет) при эндоскопическом исследовании изменений со стороны слизистой оболочки дистальной части пищевода не было выявлено ни в одном случае. Пищеводно-кишечный анастомоз сомкнут, при инсуфляции воздуха раскрывается до 12–15 мм, в среднем – 14,2 ± 0,7 мм. Проведенное рентгенологическое исследование демонстрирует сохранение органической и функциональной состоятельности эзофагоею-ноанастомоза. Последний при прохождении контрастной массы раскрывается до 20 мм, обеспечивая порционно поступление бария в отводящую кишку. При исследовании пациентов в положении Тренделенбурга рефлюксов в пищевод не выявлено. Полная эвакуация контрастной взвеси из трансплантата происходит в течение 56,4 ± 12,9 мин.
Таким образом, результаты комплексного обследования показывают, что в раннем послео- перационном периоде заживление пищеводнокишечного анастомоза проходит по типу первичного натяжения у 84,2 % оперированных больных, а в отдаленном послеоперационном периоде не отмечается признаков стенозирования анастомотического кольца, и последнее остается эластичным, сохраняя замыкательную функцию. Это обстоятельство обусловлено прецизионной техникой формирования анастомоза. Благодаря наличию жома и клапана в зонах анастомоза последние находятся в сомкнутом состоянии и раскрываются при прохождении перистальтической волны или инсуфляции воздуха. Морфологические исследования, проведенные в разные сроки после операции, свидетельствуют об отсутствии выраженных деструктивных и воспалительных процессов в слизистой оболочке пищевода, что позволяет судить о достаточно высокой эффективности арефлюксных эзофагоеюноанастомозов и подтверждается результатами клинических наблюдений.
При изучении качества жизни до операции средний ГИ для 19 пациентов составил 97,5 ± 3,4 балла (рис. 3). При этом самый низкий ГИ был у пациентов с демпинг-синдромом – 88,3 ± 2,5 балла и рефлюкс-эзофагитом III–IV степени – 92,5 ± 5,3 балла.
В раннем послеоперационном периоде (10–14 сут) отмечается некоторое снижение уровня качества жизни, что, по-видимому, было связано с операционной травмой, сопровождающейся болью, ограничением мобильности, особенно по шкалам № 2 (психическое состояние) и № 3 (физическое состояние). Общий уровень ГИ составил 96,8 ± 6,1 балла.
Через 1,5–3 мес после операции были обследованы 19 пациентов. Характерным для данного периода было повышение уровня качества жизни, особенно у больных с исходным демпинг-синдромом, ГИ составил 107,9 ± 4,6 балла. Самым наглядным повышение качества жизни было у пациентов, оперированных по поводу демпинг-синдрома, у которых ГИ повысился до 103,5 ± 2,4 (до операции – 88,2 ± 2,5 балла).
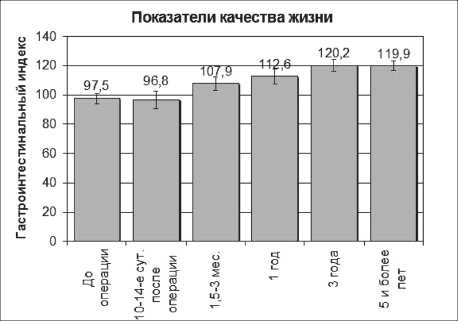
Рис. 3. Динамика ГИ у больных рефлюкс-эзофагитом после реконструктивной операции
В отдаленные сроки в контрольной точке через 1 год после операции общий уровень качества жизни в среднем повысился на 7,5 %, что составило 112,6 ± 5,1 балла. Спустя 3 и 5 лет после реконструктивного оперативного вмешательства эта тенденция сохранялась, соответственно, ГИ в среднем был равен 120,2 ± 4,1 и 119,9 ± 3,2 балла (рис. 3).
Таким образом, предлагаемый способ лечения рефлюкс-эзофагита, основанный на формировании арефлюксного пищеводно-кишечного анастомоза, позволяет достичь высоких функциональных результатов и улучшить клиническое течение заболевания и качество жизни пациентов.


