Рентгеноморфологические особенности консолидации перелома диафиза большеберцовой кости при интрамедуллярном остеосинтезе спицами с покрытием из гидроксиапатита
Автор: Попков Арнольд Васильевич, Попков Дмитрий Арнольдович, Дьячков Константин Александрович, Осипова Елена Владимировна, Тведохлебов Сергей Иванович, Больбасов Евгений Николаевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
Цель. Количественная оценка рентгеноморфологических особенностей сращения перелома диафиза длинных костей в эксперименте. Материалы и методы. В эксперименте на собаках моделировали открытый перелом большеберцовой кости и осуществляли интрамедуллярное введение спиц с покрытием из гидроксиапатита и остеосинтез аппаратом Илизарова. Количественный анализ динамики консолидации перелома осуществляли методами компьютерной томографии и на аппаратно-программном комплексе "ДиаМорф" исследовали оцифрованные изображения рентгенограмм, выполненных в двух стандартных проекциях. Результаты. Консолидация перелома клинически и рентгенологически наступала через 3-4 недели. Через 3 недели после остеосинтеза плотность регенерата в интермедиарной зоне составляет 37 % от плотности кортикалиса контрлатеральной конечности, причем доля высокоминерализованных структур в костномозговом пространстве достоверно (р=0,003) увеличилась более, чем в 5 раз, а в зоне кортикальной пластинки - в 3 раза. Заключение. Результаты исследования свидетельствуют о положительном влиянии интрамедуллярных спиц с покрытием из гидроксиапатита на течение и интенсивность репаративного костеобразования при заживлении перелома и наступлении консолидации в течение месяца. Полученные данные позволяют рекомендовать данный сравнительно малоинвазивный способ оптимизации условий остеорепарации для применения в комплексе с другими методами консервативного и оперативного лечения перелома кости.
Чрескостный остеосинтез, интрамедуллярные спицы, гидроксиапатитовое покрытие, консолидация перелома
Короткий адрес: https://sciup.org/142134601
IDR: 142134601 | УДК: 616.718.55-001.5-089.227.84-003.93-073.7:622.364.1
Текст научной статьи Рентгеноморфологические особенности консолидации перелома диафиза большеберцовой кости при интрамедуллярном остеосинтезе спицами с покрытием из гидроксиапатита
Проблема совершенствования медицинской помощи больным с повреждениями опорно-двигательной системы с каждым годом приобретает всё большее значение в связи с ростом числа пострадавших и увеличением уровня инвалидности от травм у лиц трудоспособного возраста и детей [7].
Среди причин инвалидности от травм доминирующее положение занимают травмы бедра и голени, констатируя тем самым определенную несостоятельность существующих методов лечения и реабилитации пострадавших, которые, к сожалению, не гарантируют положительного исхода. Отечественная травматология в свое время разработала целый ряд эффективных методов чрескостного и внутрикостного остеосинтеза. Однако реальные сроки остеосинтеза продолжают оставаться значительными, а уровень инвалидизации после травм продолжает расти во всех регионах страны, о чем свидетельствуют материалы VIII и IX съездов травматологов-ортопедов России.
Метод чрескостного остеосинтеза стал широко известен в травматологии благодаря работам сотрудников РНЦ «ВТО» им. акад. Г.А. Илизарова (А.А. Девятов, Б.К. Константинов, Н.Н. Смелышев, С.И. Швед, И.И.
Мартель, Ю.М. Сысенко), опубликованным в 1971-2000 гг. Однако в последние годы он применяется в практическом здравоохранении редко, только при тяжелых повреждениях (многооскольчатые переломы, открытые сочетанные повреждения, посттравматические дефекты костей и мягких тканей). Отсутствие должной популярности оригинального отечественного метода лечения переломов объясняют ограниченными возможностями бюджета и штатного расписания муниципальных учреждений здравоохранения – метод Илизарова требует постоянного наблюдения и управления врачом-специалистом не только в стационаре, но и в период амбулаторного лечении. Общий срок лечения переломов длинных костей, например, в Курганской области колеблется от 6 до 9 месяцев [17].
Появление новых технологий, основанных на применении биоактивных интрамедуллярных имплантатов, призвано не только гарантировать положительный результат лечения переломов длинных трубчатых костей, но и сократить сроки остеосинтеза и снизить количество осложнений [1, 9]. Клинические исследования новых технологий, основанных на применении интрамедуллярного напряженного армирования спицами с покрытием гидроксиапатитом (ГА), свидетельствуют о возможности резкого сокращения сроков остеосинтеза при лечении повреждений и заболеваний костно-мышечной системы [9, 12, 14, 20, 21, 24, 25, 26, 27]. Вместе с тем, процесс репаративного остеогенеза при лечении переломов с использованием интрамедуллярного остеосинтеза еще недостаточно изучен современными методами диагностики.
Данная работа проведена с целью количественной оценки рентгеноморфологических особенностей сращения перелома диафиза длинных костей в эксперименте.
МАТЕРИАЛ И МЕТОДЫ
В экспериментах использованы 12 беспородных собак обоего пола в возрасте от 1 года до 5 лет с массой тела 20±2,9 кг. У опытных животных под общим наркозом осуществляли интрамедуллярное армирование правой большеберцовой кости двумя спицами (рис. 1). Были использованы спицы из титанового сплава с биоактивным покрытием из гидроксиапатита толщиной 20-40 мкм и пористостью 2-8 %, полученным методом анодного оксидирования в дуговом режиме [1]. Покрытие представляло собой многоуровневую ультрапористую систему, состоящую из макро- и микропор от 50-100 нм до1-2 мкм в диаметре. Спицы вводили с медиальной и латеральной стороны в области шероховатости гребня большеберцовой кости до уровня дистального метафиза и затем скусывали под основание, мягкие ткани в области раны зашивали наглухо. Затем выполняли остеосинтез аппаратом Илизарова и моделировали открытый перелом костей голени в средней трети диафиза при помощи кортикотомии долотом. Спицы, введенные в костномозговой канал, не извлекали на протяжении всего эксперимента. Демонтаж аппарата Илизарова проводили через месяц фиксации. Рентгенографию в динамике эксперимента осуществляли с помощью рентгеновского аппарата Premium Vet (Sedecal, Испания). Для изучения динамики минерализации в зоне перелома на аппаратно-программном комплексе "ДиаМорф" исследовали оцифрованные изображения рентгенограмм, выполненных в двух стандартных проекциях: до операции, через 7, 14, 21, 28, 42, 56, 70, 90 суток после операции [3]. По одной собаке оставляли под наблюдением до 180 и 365 дней.
Компьютерная томография препаратов берцовых костей от 7 собак, осуществленная после извлечения спиц с напылением, проведена на компьютерных томографах Siemens Somatom AR-HP, GE Lihgt Speed VCT на 21, 28, 35, 42, 90 сутки эксперимента. Технические условия проведения спирального сканирования: программы – Extremity; технические характеристики: а) напряжение 120-135 kV; б) сила тока 100-250 mA; в) толщина среза – slice collimation [mm] 3,0-5,0; г) шаг спирали – pitch = 3,0-5,0; д) алгоритм – Bone standart, High resolution.
Статистическую обработку результатов исследования проводили на персональном компьютере с помощью программы AtteStat (Свидетельство о регистрации программы для ЭВМ № 2002611109, М., 28 июня 2002 г., автор - И.П. Гайдышев), встроенной в Microsoft Excel. На полученных изображениях определяли плотность области интереса в единицах Хаунсфилда.
Уход, оперативные вмешательства и эвтаназию животных осуществляли в соответствии с требованиями приказа МЗ СССР № 755 от 12.08.1977 г. По срокам эксперимента животных разделили на группы: 14, 21, 28, 42, 90 (по два животных), 180 и 360 суток после операции (по одному наблюдению). Достоверность различий между показателями в группах животных оценивали с использованием непараметрического U критерия Манна-Уитни. Различия считали статистически значимыми при р≤0,05.
РЕЗУЛЬТАТЫ
После операции у всех животных на рентгенограммах определяется поперечный перелом в средней трети диафиза большеберцовой кости (рис. 1, а). Края фрагментов имеют неровную поверхность, высота диастаза между ними составляет 0,5-1,0 мм. С 8-10 суток после операции в непосредственной близости от линии перелома появляются признаки периостальной реакции в виде облаковидных теней по краям кости, которые постепенно уплотняются через 3-4 недели опыта. На протяжении всего эксперимента установлено стабильное состояние костных фрагментов, интрамедуллярные спицы также оставались практически неподвижными, их смещения не наблюдали. Формирование нового кортикального слоя кости в месте перелома рентгенологически определяется через месяц после операции, в зоне повреждения отмечается полный контакт и сращение костных фрагментов, интермедиарный регенерат четко выражен (рис. 1, б). В зоне повреждения наблюдается утолщение кости за счет сохраняющихся периостальных наслоений. Для отражения динамики процесса консолидации на оцифрованных изображениях рентгенограмм оконтуривали тени исследуемого участка, включающего диафиз на 0,5 см выше и ниже места перелома, входящие в выделенную зону кортикальную пластинку (КП) и костномозговую полость (КМП); участки фона и мягких тканей на уров- не зоны перелома или предполагаемого места перелома (на изображениях рентгенограмм до операции) и измеряли их среднюю интенсивность (яркость) и площадь. Полученные цифровые данные использовали для расчета средней оптической плотности (СрОП) тени зоны перелома, КП и КМП.

Рис. 1. Рентгенограммы большеберцовой кости собаки: а – перелом в средней трети диафиза, сразу после операции; б – новообразованный кортикальный слой в месте перелома, месяц после операции
При анализе полученных цифровых данных было установлено, что значения СрОП тени исследуемых участков на различных этапах эксперимента находились в диапазоне от 0 до 1,0 усл. ед. Данный диапазон разбивали на 4 интервала, отражающие степень минерализации структур [18]:
-
1) от 0 до 0,2 усл. ед. – неминерализованные;
-
2) от 0,21 до 0,4 усл. ед. – слабоминерализованные;
-
3) от 0,41 до 0,6 усл. ед. – среднеминерализованные;
-
4) от 0,61 до 1,0 усл. ед. – высокоминерализованные.
В площади выделенного участка, которую принимали за 100 %, определяли доли структур, имеющих СрОП, соответствующую определенному интервалу. Изображения рентгенограмм до операции исследовали для контроля.
Через 7 суток после операции СрОП тени зоны перелома была значимо ниже (р=0,04) контрольных значений (рис. 2). Это было связано с уменьшением доли высокоминерализованных структур в КП и, как следствие, со значимым снижением СрОП (р=0,004) ее тени на изображениях рентгенограмм.
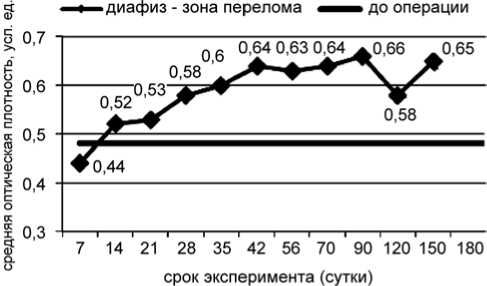
Рис. 2. Динамика СрОП тени кости в зоне перелома
В КМП соотношение структур с различной степенью минерализации к данному сроку существенно не изменялось, поэтому, несмотря на низкие, по сравнению с дооперационными, значения СрОП, существенных различий не выявлено.
К 14 суткам в КМП более чем в 5 раз увеличивалась доля высокоминерализованных структур (р=0,003), в КП – только в 2,8 раза (р=0,10), что приводило к росту показателей СрОП тени КМП (р=0,02), КП (р=0,04), соответственно, и тени зоны перелома (р=0,02) и появлению значимых различий по сравнению с предыдущим сроком наблюдения и их отсутствию по сравнению с контролем (рис. 3).

Рис. 3. Соотношение высокоминерализованных структур в КП и КМП на этапах эксперимента
Увеличение доли высокоминерализованных структур как в КМП, так и в КП, происходило до 42 суток эксперимента, при этом, начиная с 35 суток после операции, показатели СрОП КП, КМП и, следовательно, зоны перелома значимо превышали контрольные значения. До 90 суток доля высокоминерализованных структур в КМП была выше соответствующего показателя в КП, соответственно и СрОП тени КМП на изображениях рентгенограмм была выше СрОП КП.
К 14 суткам эксперимента на поверхности большеберцовой кости вокруг зоны перелома формировались периостальные наслоения, их СрОП составляла 0,27±0,10 усл. ед., при этом 87,95 % их площади были представлены неминерализованными и слабоминерализованными структурами. Площадь периостальных наслоений увеличивалась до 28 суток. К 21 суткам в площади периостальных наслоений уменьшались доли неминерализованных и слабоминерализованных структур, в 2 раза увеличивалась доля среднеминерализованных и определялись высокоминерализованные структуры. Появление высокоминерализованных и увеличение доли среднеминерализованных структур приводило к повышению СрОП периостальных наслоений. Когда СрОП достигала максимальных значений, суммарная доля средне- и высокоминерализованных структур в площади периостальных наслоений составляла 59,61 %. Уменьшение суммарной доли средне- и высокоминерализованных структур и одновременное увеличение суммарной доли неминерализованных и слабоминерализованных структур приводило в дальнейшем к снижению СрОП.
Объектом исследования методом компьютерной томографии (КТ) послужили периостальная и эндостальная зоны на уровне перелома большеберцовой кости, пространство непосредственно между отломками кости (интермедиарная зона), кортикальный слой кости как на стороне повреждения (отступя на 2 см от линии перелома), так и на контрлатеральной конечности (контрольный участок). Плотность костной ткани определяли в единицах Хаунсфилда (НU) и сравнивали с уровнем плотности кортикального слоя кости неповрежденной конечности (таблица).
Во всех случаях при демонтаже аппарата Илизарова наряду с рентгенологическими исследованиями проводили клиническую пробу на консолидацию, которая определила отсутствие какой-либо подвижности между отломками через 2-4 недели после операции, т.е. консолидация в это время наступила (рис. 4).
Плотность кости в интермедиарной зоне в это время достигала 56 % от плотности кортикального слоя здоровой конечности. В дальнейшем плотность кости в этой зоне только увеличивалась и к 180 дням достигала 64 %.
Эндостальная зона на уровне перелома по плотности выросла от 23 % (через 2 недели после операции) до 48 % (через 42 дня). Через 3 месяца эндостальной реакции в зоне перелома не определялось.
В периостальной зоне плотность достигла максимума в первый месяц после перелома (47 %), а затем отмечено закономерное снижение плотности до 28 % к 180 дню эксперимента. Подобная реакция, по-видимому, связана с ранним ремоделированием кости после консолидации перелома.
Для практического здравоохранения представляет определенный интерес отсутствие изменений в плот- значительные колебания плотности кости в этой зоне ности кортикального слоя поврежденной кости. Не- находятся в пределах ошибки измерения.
Таблица
Плотность большеберцовой кости в зоне перелома (ед. HU)
|
Срок эксперимента (сутки) |
Плотность кортикального слоя контралатеральной конечности (ед. HU) |
Периостальная зона |
Эндостальная зона |
Интермедиарное пространство |
Плотность кортикального слоя на 2 см вне перелома |
||||
|
HU |
% |
HU |
% |
HU |
% |
HU |
% |
||
|
21 |
1712±14 |
493,75±111 |
29 |
406±70 |
23 |
638±156 |
37 |
1675±82 |
97 |
|
28 |
1607,14±57,8 |
758±24,7 |
47 |
586,75±98,8 |
36 |
914,5±30,8 |
56 |
1346,25±96,7 |
83 |
|
42 |
1628,75±76,8 |
636,25±42,3 |
39 |
792,25±96,2 |
48 |
863±55,1 |
53 |
1586,25±33,4 |
97 |
|
90 |
2529,75±169,6 |
930,125±109,4 |
37 |
– |
– |
1291±62,4 |
51 |
2405,25±86 |
95 |
|
180 |
2529,75±169,6 |
712,6±89,4 |
28 |
– |
– |
1638,5±102,9 |
64 |
2430,25±60,7 |
96 |

ОБСУЖДЕНИЕ
Рис. 4. Компьютерная томография голени собаки через месяц остеосинтеза (интрамедуллярные спицы удалены): сагиттальная (а) и горизонтальная (б) плоскость сечения
Для травматолога-ортопеда известен факт, когда в процессе лечения пациента с переломами длинных костей методом чрескостного, внутрикостного или накостного остеосинтеза наблюдается нарастание остеопороза поврежденной кости, и минерализация вновь образуемой кости задерживается. Причины этого явления объясняют отсутствием нагрузки на оперированную конечность, разрушением костного мозга и нарушением внутрикостного кровоснабжения, недостаточно стабильным остеосинтезом. Лучшие условия для репаративной регенерации создает чрескостный остеосинтез по Илизарову, но и в этом случае остеопороз имеет место как при лечении перелома, так и при лечении ортопедических заболеваний. Так, при оперативном удлинении конечности долгое время на рентгенограмме сохраняется так называемая «зона роста» дистракционного регенерата, а при переломе кости линия перелома видна на рентгенограмме, и сроки фиксации конечности зачастую значительно и неоправданно затягиваются. Процесс минерализации вновь образованной кости быстрый в начале, потом замедляется. Это объясняется тем, что, когда кость становится минерализованной, скорость диффузии ионов через ткань кости неизбежно снижается. Как результат, вторичные остеоны более высоко минерализованы около их сердечника, где находятся кровеносные каналы, и менее высоко минерализованы на периферии. Работы А.А.Свешникова с использованием радиоизотопов [15,
-
16] подтверждают, что обменные процессы при репаративной регенерации (переломы, удлинения кости) находятся на предельных цифрах в течение месяца, а затем постепенно снижаются параллельно с процессом минерализации и ремоделирования кости. Фактом остается и внезапный прыжок вверх в минерализации при завершении фиксации конечности, когда пациент после удлинения конечности вновь переходит к полной нагрузке на ногу [13]. Эта вариация в минерализации отражается на упругих свойствах кости, как показано наноиндентацией [28]. Делают ли эти механические неоднородности кость прочнее или слабее – до конца неясно. Вероятно, все-таки первое – периметр вторичного остеона, этот «цементный чехол» для остатков кости, которая разрушается, когда ее достигает трещина, затрудняет распространение трещин и поглощает ее [32]. Именно этим можно объяснить причину отсутствия переломов в зоне дистракционного регенерата при наблюдавшихся травмах конечности.
Основным недостатком интрамедуллярного остеосинтеза считается опасность повреждения сосудов и системы кровообращения медуллярного канала, что ослабляет остеогенные и остеоиндуктивные потенции плюрипотентных клеток стромы костного мозга [29, 31]. Вместе с тем, в настоящее время хорошо зарекомендовали себя в клинике и успешно применяются методики создания сквозных каналов в метафизах и диафизах длинных костей конечностей (туннелизация)
для активизации внутрикостного кровообращения, гемопоэза и репаративного остеогенеза [6, 8]. Возможный механизм стимулирующего эффекта введения интрамедуллярных спиц связан и с пролонгированным формированием в костномозговой полости локальных очагов грануляционной ткани, создание которых эндокринными и паракринными путями воздействия обеспечивает увеличение популяции остеопродуцирующих клеток в зоне перелома, стимулирует регенерационный ангиогенез и способствует, тем самым, активизации процесса остеорепарации [5, 19]. Дополнительное покрытие поверхности титановых имплантатов наноструктурированным высокопористым слоем гидроксиапатита обеспечивает высокую биосовместимость с тканевыми структурами регенерата, увеличивает скорость остеоинтеграции и предотвращает образование фибриллярной соединительной ткани и хряща в регенерате [4, 22, 23]. Вокруг спиц образуется зона активного аппозиционного костеобразования и формируется костный футляр со свойствами кондуктора и индуктора остеогенеза, обеспечивающий направленный рост костной ткани, пролонгированную стимуляцию ангиогенеза и репаративного костеобразования. Консолидация перелома осуществляется в ранние сроки по первичному типу без образования хрящевой и со- единительной ткани в костной спайке.
Полученные результаты в рамках данной работы подтверждают, что при интрамедуллярном остеосинтезе спицами с биоактивным покрытием не развивается остеопороз кости, оптическая плотность кортикального слоя диафиза кости сохраняется на уровне контрлатеральной конечности. Это можно использовать в клинической практике для сравнительного количественного анализа степени минерализации полученного костного регенерата [2, 10]. Еще одним важным выводом для клиницистов является тот факт, что для диагностирования консолидации достаточно оптической плотности в интермедиарной зоне на уровне 5060 % от плотности диафиза поврежденной кости. Не нужно ждать, когда плотность регенерата достигнет или превысит плотность прилежащих участков диафиза кости. Плотности регенерата в пределах 50 % в совокупности с плотностью эндостальной кости (30-40 %) и периостальной кости (40-45 %,) при наличии армирования кости интрамедуллярными спицами вполне достаточно, чтобы обеспечить возможность демонтажа аппарата внешней фиксации через месяц после операции. Наши клинические наблюдения показали, что в это время какой-либо подвижности отломков в зоне перелома не отмечается [11].
ЗАКЛЮЧЕНИЕ
Таким образом, результаты исследования свидетельствуют о положительном влиянии интрамедуллярных спиц с покрытием из гидроксиапатита на течение и интенсивность репаративного костеобразования при заживлении перелома и наступлении консолидации в течение месяца. Полученные данные позволяют рекомендовать данный сравнительно малоинвазивный способ оптимизации условий остеорепарации для применения в комплексе с другими методами консервативного и оперативного лечения перелома кости. Количественный анализ процесса репаративной регенерации современными методами (КТ и ДиаМорф) облегчает принятие решения о раннем прекращении остеосинтеза.
Список литературы Рентгеноморфологические особенности консолидации перелома диафиза большеберцовой кости при интрамедуллярном остеосинтезе спицами с покрытием из гидроксиапатита
- Остеоиндуктивные покрытия на основе фосфатов кальция и перспективы их применения при лечении политравм/В.В. Агаджанян, С.Н. Твердохлебов, Е.Н. Больбасов, В.П. Игнатов, Е.В. Шестериков//Политравма. 2011. № 3. С. 5-13.
- Анализ оптической плотности рентгенографического изображения дистракционного костного регенерата бедренной кости при удлинении врожденно укороченного бедра методом билокального дистракционного остеосинтеза/А.В. Попков, С.А. Аборин, Э.А. Гореванов, О.В. Климов//Гений ортопедии. 2003. № 4. С. 21-23.
- ДиаМорф-Cito: Интегрированный пакет прикладных программ анализа изображений: руководство пользователя. Версия 1.1. Книга 2. М., 1995. 179 с.
- Ирьянов Ю.М. Остеопластическая эффективность минерализованного костного матрикса//Морфология. 2013. Том 143, № 1. С. 63-68.
- Ирьянов Ю.М., Ирьянова Т.Ю. Морфологическая характеристика грануляционной ткани, формирующейся в костном мозге при чрескостном остеосинтезе//Морфолог. ведомости. 2010. № 3. С. 48-51.
- Ларионов А. А., Речкин М. Ю., Асонова С.Н. Влияние остеотрепанации длинной трубчатой кости на остеорепарацию и регионарное кровообращение (экспериментальное исследование)//Гений ортопедии. 1999. № 2. С. 80-85.
- Состояние травматолого-ортопедической службы в Российской федерации и методы высоких технологий в диагностике и лечении травматолого-ортопедических больных/С.П. Миронов, В.В. Троценко, Т.М. Андреева, М.М. Попова//Травматология и ортопедия XXI века: сб. тез. докл. VIII съезда травматологов-ортопедов России: в 2-х т. Самара, 2006. Т. 1. С. 95.
- Михайленков Р.В. Стимуляция гемопоэза при острой лучевой травме у животных//Успехи современного естествознания. 2007. № 5. С. 51-54.
- Попков А.В. Управление репаративной регенерацией и гистогенезом тканей -основной путь профилактики неудовлетворительных исходов лечения пациентов ортопедо-травматологического профиля//Ошибки и осложнения в травматологии и ортопедии: материалы Всерос. науч.-практ. конф. с междунар. участием, посвящ. памяти проф. А.Н.Горячева. Омск, 2011. С. 36-37.
- Комплексная рентгено-радионуклидная оценка активности костеобразования при удлинении нижних конечностей: метод. рекомендации/МЗ РСФСР. ВКНЦ "ВТО"; сост.: А. А. Свешников, А. В. Попков. -Курган: , 1991. 26 с.
- Клинический опыт использования интрамедуллярных спиц с биоактивным покрытием в лечении переломов длинных трубчатых костей/А.В. Попков, Д.А. Попков, К.В. Трофимов, А.И. Никифоров, А.А. Исупов//Клин. практика. 2012. № 2. С. 40-47.
- Попков Д.А. Применение интрамедуллярного армирования при удлинении конечности//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 2005. № 2. С. 65-69.
- Попков А.В., Осипенко А.В. Регенерация тканей при удлинении конечностей. М.: ГЭОТАР-Медиа, 2008. 240 с.
- Попков А.В., Попков Д.А. Биоактивные имплантаты в травматологии и ортопедии. Иркутск: НЦРВХ СО РАМН, 2012. 438с.
- Свешников А.А. Радионуклидные методы, применяемые для оценки функционального состояния конечности при чрескостном остеосинтезе//Мед. радиология. 1986. № 8. С. 63-72.
- Свешников А.А., Попков А.В Смотрова Л.А. Рентгеноденситометрические и радиоизотопные исследования репаративного костеобразования при дистракционном остеосинтезе//Ортопедия, травматология и протезирование. 1987. № 5. С. 47-50.
- Серкова Е.В. Медико-социальные аспекты травматизма и пути совершенствования системы оказания медицинской помощи пострадавшим с переломами костей конечностей: автореф. дис… канд. мед. наук. Екатеринбург, 2011. 27 с.
- Компьютерная томография, трехмерная реконструкция и стереологический анализ дистракционного регенерата/В.И. Шевцов, М. М. Щудло, Н. А. Щудло, С. А. Ерофеев, Е. В. Осипова//Гений ортопедии. 1998. № 4. С. 42-51.
- Влияние кальций-фосфатного покрытия спиц на процессы минерализации и активность остеогенеза при чрескостном дистракционном остеосинтезе/В.И. Шевцов, Ю.М. Ирьянов, Н.В. Петровская, Т.Ю. Ирьянова//Морфолог. ведомости. 2008. № 3-4. С. 231-234.
- Calculation of the main parameters of spokes for intramedullary reinforcement of tubular bones/E.V. Burlakov, D.V. Alatov, D.A. Popkov, R.B. Shutov//Med. Tekh. 2008. No 3. P. 26-28.
- Elastic intramedullary nailing as a complement to Ilizarov's method for forearm lengthening: a comparative pediatric prospective study/T. Jager, D. Popkov, P. Lascombes, A. Popkov, P. Journeau//Orthop. Traumatol. Surg. Res. 2012. Vol. 98, No 4. P. 376-382.
- Lin C.M., Yen S.K. Biomimetic growth of apatite on electrolytic TiO2 coating in simulated body fluid//Mater. Sci. Eng. C. 2006. Vol. 26. P. 54-64.
- Liu X., Chu P.K., Ding C. Surface modification of titanium, titanium alloys, and related materials for biomedical applications//Mater. Sci. Eng. 2004. Vol. 47, No 3. P. 490-121.
- Ollier's disease limb lenghtening: should intramedullary nailing be combined with circular external fixation?/D. Popkov, P. Journeau, A. Popkov, T. Haumont, P. Lascombes//Orthop. Traumatol. Surg. Res. 2010. Vol. 96, No 4. P. 348-353.
- Analysis of segmental residual growth after progressive bone lengthening in congenital lower limb deformity/D. Popkov, P. Journeau, A. Popkov, B. Pedeutour, T. Haumont, P. Lascombes//Orthop. Traumatol. Surg. Res. 2012. Vol. 98, No 6. P. 621-628.
- Role of the flexible intramedullary nailing in limb lengthening in children: comparative study based on the series of 294 lenthenings/D. Popkov, P. Lascombes, A. Popkov, P. Journeau, T. Haumont//Eur. Orthop.Traumatol. 2012. No 3. P. 17-24. DOI 10.1007/s12570-012-0090-1.
- Flexible intramedullary nail use in limb lengthening/D. Popkov, A. Popkov, T. Haumont, P. Journeau, P. Lascombes//J. Pediatr. Orthop. 2010. Vol. 30, No 8. P. 910-918.
- Variations in the individual thick lamellar properties within osteons by nanoindentation/J.Y. Rho, P. Zioupos, J.D. Currey, G.M. Pharr//Bone. 1999. Vol. 25, No 3. P. 295-300.
- Ruedi T.P., Murphy W.M. Principles of Fracture Management. Thieme Verlag. 2001. 864 p.
- Cortical bone blood flow in reamed and unreamed locked intramedullary nailing: a fractured tibia model in sheep/E.H. Schemitsch, M.J. Kowalski, M.F. Swiontkowski, D. Senft//J. Orthop. Trauma. 1994. Vol. 8, No 5. P. 373-382.
- Elastic stable intramedullary nailing in Ilizarov bone lengthening/V.I. Shevtsov, A.V. Popkov, D.A. Popkov, S.A. Yerofeev, J. Prévot, P. Lascombes//Rev. Chir. Orthop. Reparatrice Appar. Mot. 2004.Vol. 90, No 5. P. 399-410.
- Yeni Y.N., Norman T.L. Calculation of porosity and osteonal cement line effects on the effective fracture toughness of cortical bone in longitudinal crack growth//J. Biomed. Mater. Res. 2000. Vol. 51, No 3. P. 504-509.


