Ресвератрол: метаболизм, биологические механизмы и возможные побочные эффекты
Автор: Цейликман В.Э., Шатилов В.А., Жуков М.С., Патрикян Г.Н., Хайбулин Т.Л.
Рубрика: Медицина
Статья в выпуске: 3 (31), 2025 года.
Бесплатный доступ
Ресвератрол, природное соединение из класса стильбенов, содержащееся в винограде, ягодах и других растениях, привлекает значительный научный интерес благодаря широкому спектру заявленных полезных свойств, включая антиоксидантную, противовоспалительную, антивозрастную и кардиопротекторную активность. Данный обзор обобщает современные знания о ресвератроле, исследуя его сложную фармакокинетику — характеризующуюся высоким всасыванием, но низкой биодоступностью при пероральном приёме из-за интенсивного пресистемного метаболизма — и его многообразные механизмы действия. Подробно описана активация ключевых сигнальных путей, таких как SIRT1, AMPK, Nrf2 и PGC-1α, которые опосредуют его влияние на митохондриальный биогенез, антиоксидантную защиту и метаболический гомеостаз. Особое внимание уделено ключевой роли микробиоты кишечника в метаболизме ресвератрола до активных производных, таких как дигидроресвератрол и лунуларин, которые вносят существенный вклад в его биологические эффекты и модулируют состояние желудочно-кишечного тракта. Парадоксально, но в обзоре также рассматриваются потенциальные неблагоприятные эффекты соединения, изучается, как его окисление до реакционноспособной хинонной формы может приводить к про-оксидантным эффектам, генотоксичности, нарушению клеточной сигнализации и эндокринным нарушениям. Этот всесторонний анализ подчеркивает двойственную природу ресвератрола, выделяя как его терапевтический потенциал, так и зависящие от дозы риски, которые необходимо учитывать для его будущего применения в питании и медицине.
Ресвератрол, метаболиты, микробиота, метаболические пути, молекулярные механизмы действия, о-хинон
Короткий адрес: https://sciup.org/170211530
IDR: 170211530 | УДК: 616-092.9
Текст научной статьи Ресвератрол: метаболизм, биологические механизмы и возможные побочные эффекты
Введение. Ресвератрол, природный фитоалексин, впервые выделенный в 1940-х годах, представляет собой стильбеноид, синтезируемый растениями в ответ на стрессовые воздействия, такие как грибковая инфекция или ультрафиолетовое облучение. Польза ресвератрола для здоровья впервые была отмечена в начале 1990-х годов с тех пор ресвератролу были приписаны многочисленные фармакологические свойства, включая антиоксидантные, противовоспалительные, противоопухолевые, кардио- и нейропротекторные. Однако его применение затруднено из-за низкой биодоступности нативного соединения. Это связано с интенсивным пресистемным метаболизмом, в ходе которого в энтероцитах и печени образуются конъюгированные производные — глюкурониды и сульфаты. Эти метаболиты, а также новые биологически активные соединения, такие как дигидроресвератрол и лунуларин, образующиеся под действием микробиоты кишечника, во многом опосредуют конечные эффекты ресвератрола. Более того, микробиота не только метаболизирует ресвератрол, но и сама становится мишенью для его действия, что проявляется в улучшении состава микробного сообщества и укреплении кишечного барьера. Механизмы положительного воздействия ресвератрола сложны и включают активацию ключевых клеточных путей: SIRT1, AMPK, Nrf2 и PGC-1α, что ведет к усилению митохондриального биогенеза, антиоксидантной защиты и подавлению воспаления. В то же время, при высоких концентрациях ресвератрол демонстрирует способность окисляться до высокореактивного хинона. Эта форма инициирует каскад негативных эффектов, вклю- чая про-оксидантную активность, ковалентную модификацию белков, митохондриальную дисфункцию, генотоксичность и эндокринные нарушения. Таким образом, ресвератрол представляет собой соединение с выраженным дуализмом действия, где его конечный эффект зависит от множества факторов. Цель данного обзора — интегрировать разрозненные данные о фармакокинетике, механизмах действия, роли микробиоты и потенциальных рисках ресвератрола, чтобы предоставить целостное представление о его потенциале и ограничениях как объекта для нутрицевтического и терапевтического применения.
Адсорбция и метаболизм. Концентрации ресвератрола для обычных пищевых продуктов: арахис, оставшийся от оболочек семян содержит до 0,29 мг / л; в различных розовых винах 0,03-0,14 мг / г; так же он может быть извлечен из красного винограда приблизительно 92-1604 мг / кг; содержание в красных винах колеблется в пределах 0,361–1,972 мг / л; в кожице томатов 19 мг / г; концентрация в пиве колеблется в пределах 1,34–77,0 мг /л; в темный шоколаде 350 мг / кг; молочном шоколаде 100 мг / кг; чае Итадори 68 мг / 100 мл; в белых винах 0-1,089 мг / л; может быть выделен из белого винограда 59-1759 мг / кг и яблок 400 мг / кг свежего веса [1].
Исследование показало наличие ресвератрола в темпе, индонезийском блюде из ферментированных соевых бобов. В ходе исследования из темпе было извлечено 65,15 % ресвератрола, а из оболочки соевых бобов — 55,35 %. Кроме того, исследование показало, что ферментация соевых бобов при производстве темпе, вызванная присутствием типичных ферментирующих бактерий, приводит к повышению уровня транс-ресвератрола [2].
Значительное накопление транс-ресвератрола наблюдалось после обрезки побегов виноградной лозы, при этом максимальное увеличение составило 181 раз на 70-й день. Значительное увеличение содержания транс-ресвератрола в образцах побегов винограда можно объяснить действием структурных генов PAL, C4H, 4CL и STS , которые контролируют выработку транс-ресвератрола. Считается, что транс-форма накапливается до тех пор, пока ткани не высохнут, поскольку живые ткани растений могут воспринимать процесс высыхания во время хранения как сигнал о стрессе, что приводит к выработке ресвератрола [3].
Низкомолекулярные стильбены, такие как ресвератрол, преимущественно транспортируются в толстый кишечник, хотя небольшая часть полифенолов, содержащихся в пище, всасывается в тонком кишечнике. В процессе метаболизма сульфаты, глюкурониды и другие конъюгированные формы ресвератрола выводятся из кишечника с помощью белка-переносчика, устойчивого к раку молочной железы (BCRP). Сообщалось, что они могут попадать в просвет кишечника через белок множественной лекарственной устойчивости 2 (MRP2) на апикальной мембране и проникать в системный кровоток через MRP3 на базолатеральной мембране. Значительная часть принятого внутрь ресвератрола (примерно 70–75 %) подвергается метаболизму в кишечнике и микробиотой кишечника, при этом 25 % выводится без всасывания, и только 1–8 % попадает в кровоток. Неметабо-лизированный ресвератрол трудно обнаружить в плазме крови. По приблизительным оценкам, пиковые концентрации менее 10 нг/мл наблюдались в течение 0,5–2 часов после перорального приема.
Биодоступность ресвератрола значительно снижается при его приеме в пищу, особенно в контексте высокожировой диеты. Натуральные компоненты винограда, в составе которых присутствует ресвератрол, демонстрируют превосходство в усвоении над таблетированными формами, что свидетельствует о роли пищевой матрицы в оптимизации абсорбции [4].
Было обнаружено, что ресвератрол в таблетированной форме значительно дольше сохраняется в организме, что, в свою очередь, приводит к повышению уровня метаболитов [5]. Метаболиты ресвератрола имеют первостепенное значение ввиду того, что отдельные их представители, в частности дигидроресвератрол и лунуларин, проявляют высокую антиоксидантную активность. Важно подчеркнуть тот факт, что дигидроресвератрол, как было доказано, обладает более эффективными антиоксидантными свойствами, чем витамин Е [6].
В пищевых продуктах ресвератрол присутствует в основном в гликозилированной форме, известной как пицеид и полидатин [7]. После попадания в организм ресвератрол проходит через желудочно-кишечный тракт, при этом степень его усвоения составляет около 70 %. В кишечнике ресвератрол связывается с различными питательными веществами, что влияет на его способность к усвоению [8].
Однако свободная форма ресвератрола достигает низкой концентрации в крови, поскольку метаболизируется в основном в печени посредством процессов глюкуронизации и сульфатирования. Сульфат ресвератрола-3 и глюкуронид ресвератрола-3 были обнаружены в различных органах и тканях, таких как печень, жировая ткань и сердце. Кроме того, ресвератрол может метаболизироваться в другие производные, такие как пицеатаннол и дигидроресвератрол. Пицеатаннол образуется в результате гидроксилирования ресвератрола в печени, а дигидроресвератрол — в результате метаболизма кишечными бактериями [9].
Главным сайтом абсорбции ресвератрола при пероральном приеме является тонкий кишечник, в первую очередь, его верхние отделы (двенадцатиперстная и тонкая кишка). Энтероциты становятся главными клетками в этом процессе [10].
Проникновение ресвератрола в энтероциты осуществляется двумя основными путями. Главным образом ресвератрол попадает в энтероциты диффузией, будучи липофильным полифенолом, ресвератрол способен пассивно диффундировать через клеточные мембраны по градиенту концентрации. Этот процесс не требует затрат энергии и является основным путем его поступления в энте-роциты [10].
Существуют данные, указывающие на возможное участие мембранных транспортеров. Предполагается, что некоторые белки семейства ABC (ATP-binding cassette), такие как P-гликопротеин (P-gp/ABCB1), могут взаимодействовать с ресвератролом. Однако их роль двойственна, они могут как облегчать его поступление, так и выбросить его обратно в просвет кишки, что вносит вклад в сложную кинетику его абсорбции [10]. Попав в энтеро-циты, ресвератрол подвергается интенсивному ме- таболизму второй фазы, что ограничивает его биодоступность в организме. В цитозоле энтероцитов сосредоточены высокие концентрации ферментов конъюгации, например УДФ-глюкуронозилтранс-феразы (UGT), в частности UGT1A1 и UGT1A9, катализируют присоединение глюкуроновой кислоты с образованием ресвератрол-3-O-глюкурони-да (R3G) и других изомеров. Так же присутствуют Сульфотрансферазы (SULT), такие как SULT1A1 и SULT1A3, присоединяют сульфатную группу с образованием ресвератрол-сульфатов (например, ресвератрол-3-сульфата) [11].
Образованные в процессе полярные конъюгаты (глюкурониды и сульфаты) далее могут секретироваться обратно в просвет кишечника с помощью транспортеров, таких как MRP2 (ABCC2), расположенных на апикальной мембране. Или же могут транспортироваться через базолатеральную мембрану в портальный кровоток с помощью транспортеров типа MRP3 [10].
Только незначительная часть неизмененного (нативного) ресвератрола, и значительная доля его метаболитов, покидают энтероцит через базолатеральную мембрану и поступают в капилляры кишечника, а затем через воротную вену направляются в печень, где подвергаются дальнейшему метаболизму. Именно данный путь метаболизма является основной причиной чрезвычайно низкой биодоступности свободного ресвератрола (менее 1 %), в то время как в кровотоке преобладают его метаболиты, свободный ресвератрол составляет всего около 0.28 % от общего содержания ресвератрола и его метаболитов в крови [12].
Ресвератрол, обладая высокой степень абсорбции в ЖКТ (70-75%), характеризуется очень низкой биодоступностью в его свободной форме (<1%) из-за интенсивного пресистемного и печеночного метаболизма. Его фармакокинетический профиль отличается быстрой абсорбцией, сверхкоротким периодом полувыведения нативного соединения (8-14 мин) и значительно более длительной циркуляцией его основных метаболитов — глюкуронидов и сульфатов, от 30 минут и до 9 часов. Биотрансформация осуществляется преимущественно в энтероцитах и гепатоцитах с участием ферментов конъюгации UGT и SULT.
После перорального приема ресвератрол характеризуется относительно быстрой абсорбцией. Его пиковая концентрация (максимальная концентрация в системном кровотоке) достигается относительно быстро, в интервале от 0.8 до 1.5 часа после приема. Что указывает на очень эффективное всасывание в верхних отделах желудочно-кишечного тракта [12]. Так же стоить отметить относительно короткий период полувыведения. Фармакокинетика ресвератрола отличается очень быстрой элиминацией нативного вещества, но при этом его метаболиты ещё длительное время продолжают циркулировать в крови.
Свободный (нативный) ресвератрол обладает очень низким периодом полувыведения и составляет от 8 до 14 минут. Что свидетельствует о его интенсивном и быстром метаболизме [12]. Как уже упоминалось ранее метаболиты ресвератрола (сульфаты и глюкурониды) обладают значительно более длительным периодом полувыведения относительно ресвератрола, период полувыведения метаболитов может превышать 9 часов. Несмотря на быструю элиминацию исходного соединения, его производные остаются в системном кровотоке продолжительное время [12].
Исследования показывают, что в пищеварительной системе может усваиваться до 70–75% от принятой дозы ресвератрола. Такой высокий процент абсорбции, не приводит к высокой биодоступности ресвератрола т.к. большая часть всосавшегося ресвератрола незамедлительно подвергается пресистемному метаболизму в энтероцитах. При попадании в кровь, через воротную вену нативный ресвератрол попадает в печень, где подвергается дальнейшему метаболизму, вместе с метаболитами [12].
В результате биотрансформации в организме образуются в основном конъюгированные производные, в то время как концентрация свободного ресвератрола в плазме остаётся крайне мала.
Самими многочисленными производными ресвератрола являются:
Ресвератрол-3-O-глюкуронид (R3G): Основной метаболит, обнаруживается в плазме крови [11].
Ресвератрол-сульфаты (напр., ресвера-трол-3-сульфат): являются другим ключевым классом метаболитов, циркулирующих в системном кровотоке [12; 13].
Пицеатаннол: является продуктом окисления, катализируемого CYP450. Пицеатаннол сам по себе обладает биологической активностью и может вносить вклад в общие фармакологические эффекты.
Взаимодействие с микробиотой. Термин «микробиом человека» используется для обозначения триллионов микроорганизмов, которые обитают внутри нашего организма и на нашей коже. Со временем стало очевидно, что микробиота играет ключевую роль в формировании здоровья человека, влияет на течение болезней и регулирует физиологию хозяина [14].
В кишечнике человека преобладают бактерии двух основных групп: Firmicutes и Bacteroidetes. Также встречаются Proteobacteria и Actinobacteria. То, что мы едим, очень сильно влияет на то, какие бактерии живут в нашем кишечнике, потому что еда служит им пищей – одни бактерии от нее растут лучше, а другие – хуже. Поэтому, когда состав бактерий в кишечнике меняется, меняется и то, какие вещества они производят.
Многие исследования показали, что изменения в составе микробиоты кишечника и соотношении метаболитов связаны с различными заболеваниями, такими как нейродегенеративные заболевания [14], диабет [15], рак [16] и сердечно-сосудистые заболевания [17].
Исследования показали, что некоторые представители микробиоты кишечника, такие как Bac-teroidetes , Actinobacteria , Verrucomicrobia и Cyanobacteria , могут преобразовывать ресвератрол в 3,4′-дигидроксибибензил (лунуларин), в то время как Slackia equolifaciens и Adlercreutzia equolifa-ciens могут вырабатывать дигидроксиресвератрол и лунуларин [18].
Метаболизм ресвератрола в такие соединения как лунуларин и дигидроксиресвератрол имеет так же экспериментальное подтверждение. Группа американских исследователей, обнаружили ди-фицит данных соединений у мышей, получавших антибиотики широкого спектра действия. [19]
Так же, было обнаружено, что кишечные бактерии могут гидролизовать глюкозидную форму ресвератрола, пицеид, с образованием ресвератрола и наоборот [7]. Была открыта способность некоторых бактерий, в частности Bifidobacteria infanti и Lactobacillus acidophilus, синтезировать ресвератрол из пицеида [20; 21].
Ресвератрол и его предшественники могут метаболизироваться микробиотой кишечника с образованием метаболитов ресвератрола. Одним из первых идентифицированных метаболитов, производных ресвератрола, стал дигидроресвератрол, который вырабатывается, например такими микроорганизмами как Slackia equolifaciens и Adlercreutzia equolifaciens. [9] В последующем были выделены 3,4′-дигидрокси-транс-стильбен и 3,4′-дигидроксибибензил (лунуларин) [22]. Кроме того, дополнительные исследования показали, что за выработку пицеида отвечают другие бактерии, такие как Bacillus cereus, B. Infantis и L. Acidophilus [21]. Кишечные бактерии также могут метаболизировать пицеид с образованием дигидропицеида и дигидроресвератрола [23].
Влияние ресвератрола на кишечник и микробиоту. Дисбиоз кишечной микробиоты ассоциирован с этиопатогенезом широкого спектра хронических заболеваний. Исследования, посвященные изучению влияния изменений в составе и функциях микробиоты кишечника на здоровье человека, представляют собой активно развивающуюся область биомедицинских исследований. Экспериментальные модели, позволяющие изучать модуляцию микробиоты и ее влияние на течение заболеваний, являются важным инструментом для получения новых знаний.
Обширные исследования показали, что ресвератрол и его различные метаболиты способны положительно влиять на здоровье кишечника. Исследования на мышах показали, что добавление ресвератрола в рацион усиливает экспрессию белков zonula occludens 1 (ZO-1), zonula occludens 2 (ZO-2), окклюдина, молекулы адгезии плотных контактов A (JAM-A), муциновых белков (MUC 1 и MUC 2) и кателицидинов [24]. Это белки плотных контактов, повышенная экспрессия которых, как известно, благоприятно влияет на барьерную функцию слизистой оболочки.
Добавки с ресвератролом увеличивали высоту ворсинок тощей кишки, тем самым улучшая морфологию кишечника, что было продемонстриро-ванно в исследовании на примере поросят [25].
Экспериментальные данные, полученные в ходе изучения мышей с неалкогольным стеатозом печени, индуцированным рационом с высоким содержанием липидов, продемонстрировали, что ресвератрол вызывал статистически значимое удлинение ворсинчатого аппарата подвздошной кишки [24].
Представленные сведения способствуют оценке воздействия ресвератрола на кишечную морфологию, принимая во внимание фундаментальную роль кишечных ворсинок в процессах нутриент-ной абсорбции и транслокации.
Цю и др. продемонстрировали увеличение количества бактерий рода Roseburia в кишечнике поросят, получавших ресвератрол [25]. Значение данных микроорганизмов заключается в том, что эта бактерия играет ключевую роль в предотвращении патогенных инфекций и уменьшении воспаления в кишечнике.
Ресвератрол уменьшает фиброз печени, вызванный CCl4, подавляя рост Staphylococcus xylosus и Staphylococcus lentus. Staphylococcus был выявлен как преобладающий патоген у пациентов с хроническими заболеваниями печени и часто связан с возникновением муковисцидоза [27]. Способность ресвератрола взаимодействовать с микроорганизмами даёт положительные результаты, выходящие за рамки здоровья кишечника.
Биологическая активность ресвератрола и его метаболитов: механизмы действия и фармакологические свойства. Биологическая роль ресвератрола не ограничена воздействием его нативной формы. Как было приведено ранее, лишь мизерная доля поглощённого ресвератрола остаётся в кровотоке неизменной (не более 1%), в то время как его метаболиты продолжают циркулировать в организме. Из чего стоит сделать вывод, о том, что основную роль в оказании эффекта играет не сам ресвератрол, а его метаболиты.
Экспериментальные данные демонстрируют наличие самостоятельной биологической активности у метаболитов ресвератрола, в частности ресвера-трол-сульфатов. Было установлено, что они обладают антиоксидантной и противовоспалительной активностью, и способны модулировать клеточные сигналы [28].
Также было установлено, что сульфатированные формы метаболитов ресвератрола могут модулировать ферментативную активность, а конкретно обратимо связываться с цитохромом P450, снижая их активность, и потенциально усиливая эффект других лекарственных средств путём снижения их метаболизма, и увеличения времени полувыведения [28]. Так же Генри, К., и Витрак, Х. с коллегами установили, что ресвератрол-сульфаты влияют на активность транспортных белков таких как Р-гликопротеин, снижая их активность, что может приводить к увеличению не только эффекта используемых совместно препаратов, но и привести к повышению цитотоксичности лекарственных средств.
Ресвератрол, верее его метаболиты, оказывают поливалентное действие на ряд ферментов отвечающих за метаболизм экзогенных токсинов, например ингибирование цитохромов P450 (Фаза I метаболизма). Подробный обзорный анализ подтверждает, что нативный ресвератрол является ингибитором ряда изоформ CYP, в частности CY-P1A1, CYP1B1, CYP1A2 и других [11]. Что делает ресвератрол, и его метаболиты (в том числе пицеа-таннол), теоретически применимыми в модуляции фармакокинетики препаратов метаболизируемых цитохромами.
Так же было установлено, что ресвератрол и его метаболиты способны индуцировать ферменты второй фазы метаболизма. Параллельно с ингибированием ферментов первой фазы, ресвератрол способен индуцировать экспрессию и активность ферментов фазы II, таких как глутатион-S-транс-феразы (GST) и UGT. Это приводит к усилению конъюгации и ускоренному выведению потенциально токсичных соединений [11].
Обзор существующих данных позволяет утверждать, что основные метаболиты — ресвера-трол-сульфаты, ресвератрол-глюкурониды и продукт окисления пицеатаннол — не только являются субстратами для этих ферментных систем, но и могут самостоятельно регулировать их активность.
SIRT1. Одним из центральных механизмов действия ресвератрола является активация сиртуина 1 (SIRT1) — NAD ⁺-зависимой деацетилазы класса III. Молекулярный механизм активации SIRT1 ресвератролом был предметом интенсивных исследований и дискуссий. Современные данные показывают, что ресвератрол действует как стабилизатор белково субстратных взаимодействий, особенно для субстратов, содержащих объемные гидрофобные группы в положении 1 относительно ацетилированного лизина [29].
Кристаллографические исследования выявили, что три молекулы ресвератрола могут связываться с Nтерминальным доменом SIRT1, опосредуя взаимодействие между ферментом и субстратом. Ресвератрол не изменяет конформацию самого SIRT1, а создает дополнительные карманы связывания для объемных гидрофобных групп субстра- тов, восстанавливая прочное связывание между SIRT1 и определенными «слабосвязывающимися» субстратами [29].
Активация SIRT1 также возможна через ингибирование ресвератролом ферментов семейства фосфодиэстераз ( PDEs), Ресвератрол активирует сигнальный путь цАМФ/Epac1 за счет ингибирования PDE, что приводит к высвобождению Ca2+, в конечном итоге, к активации пути CamKKβ-AMPK, AMPK увеличивает биогенез и функцию митохондрий за счет увеличения уровня NAD+, что приводит к повышению активности SIRT1 [30; 31].
Ось PGC1α и митохондриальный биогенез. Ресвератрол индуцирует митохондриальный биогенез через активацию оси PGC1α (коактиватор1α рецептора, активируемого пролиферацией пероксисом). PGC1α является ключевым регулятором митохондриального биогенеза и функции, координирующим экспрессию ядерных и митохондриальных генов. SIRT1 деацетилирует PGC1α в ядре, предотвращая его убиквитинирование и деградацию, тем самым поддерживая высокие уровни экспрессии PGC1α в ядре и опосредуя митохондриальный биогенез [32].
Ресвератрол увеличивает экспрессию PGC1α и способствует его ядерной транслокации. Активированный PGC1α затем регулирует экспрессию NRF1 (ядерного респираторного фактора 1) и NRF2 (ядерного респираторного фактора 2), которые в свою очередь активируют TFAM (митохондриальный транскрипционный фактор A. TFAM необходим для репликации и транскрипции митохондриальной ДНК. Недавние исследования показали, что активация PGC1α ресвератролом происходит через PRKAA1 AMPK α1). При нокдауне PRKAA1 эффект ресвератрола на активацию PG-C1α значительно снижается, что указывает на то, что PRKAA1 является ключевым геном, опосредующим активацию PGC 1α ресвератролом [33].
Активация Nrf2 и антиоксидантная защита. Ресвератрол активирует транскрипционный фактор Nrf2 (ядерный фактор, связанный с эритроидным фактором 2) - ключевой регулятор внутриклеточного окислительно восстановительного баланса и антиоксидантной защиты. При окислительном стрессе Nrf2 транслоцируется в ядро и связывается с антиоксидант-респонсивными элементами (ARE) в генах, кодирующих антиоксидантные ферменты, такие как NADPH хинон оксидоредуктаза (NQO1), гемоксигеназа1 (HO1) и супероксиддисмутазы 1 и 2 (SOD1 и SOD2) [34].
Ресвератрол может потенцировать сигнализацию Nrf2 через блокаду Keap1 Kelch подобный ECHассоциированный белок 1), изменение медиаторов Nrf2, его экспрессии и ядерной транслокации. Исследования показали, что ресвератрол увеличивает экспрессию Nrf2 как в общем, так и в ядерном белке дозозависимым образом. Эффект ресвератрола на Nrf2 частично опосредован PI3K/ Akt и ERK1/2 сигнальными путями. Фармакологические ингибиторы PI3K LY294002 и MEK1/2 U0126 ослабляют индуцированную ресвератролом экспрессию HO1 [35; 36; 37].
NFκB сигнальный путь и противовоспалительное действие. Ингибирование NFκB пути ресвератролом тесно связано с активацией AMPK и SIRT1. Исследования показали, что ингибирование AMPKα или SIRT1 значительно снижает эффект ресвератрола на подавление NFκB пути, индуцированного высоким содержанием неэсте-рифицированных жирных кислот. Таким образом, ресвератрол снижает воспалительный ответ и улучшает патологические состояния через активацию пути AMPKα-SIRT1 с последующим ингибированием NFκB [38; 39].
Подавление NFκB приводит к снижению экспрессии множественных провоспалительных генов, включая COX2 (циклооксигеназу2), iNOS (индуцибельную NOсинтазу), TNFα (фактор некроза опухоли альфа), IL1β (интерлейкин1 бета), IL6 (интерлейкин6) и ICAM1 (молекула межклеточной адгезии1). Ресвератрол также уменьшает транслокацию HMGB1 (белка группы высокой подвижности 1) из ядра в цитоплазму, что важно для подавления воспалительного ответа [40; 41].
AMPK. Ресвератрол является мощным активатором AMPактивируемой протеинкиназы (AMPK) ключевого энергетического сенсора клетки. По мимо уже описного пути CamKKβ-AMPK, Активация AMPK происходит преимущественно через LKB1зависимый механизм [42; 43; 44].
Активированная AMPK фосфорилирует множественные нижестоящие мишени, включая аце-тил-КоА-карбоксилазу (ACC), что подтверждается увеличением фосфорилирования ACC после обработки ресвератролом. AMPK ингибирует АТФ-по-требляющие анаболические процессы и стимулирует АТФ-генерирующие катаболические пути для восстановления энергетического баланса клетки. [42,43]. Взаимная активация SIRT1 и AMPK вероятно связана с активацией SIRT1 пути LKB1/ AMPK, что приводит к повышению NAD+ и повы- шению активности SIRT1, образуя петлю обратной положительной связи между SIRT1-AMPK [42], представлен на рисунке 1.
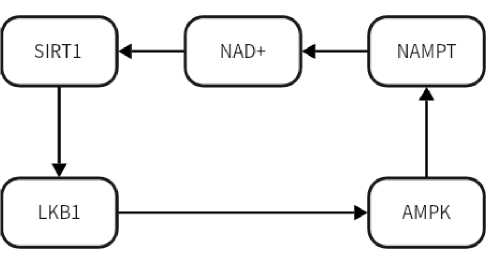
Рис. 1. Положительная обратная связь AMPK-LKB1
Fig. 1. Positive feedback AMPK-LKB1
Активация AMPK приводит к ингибированию mTOR (мишень рапамицина у млекопитающих) и ERK (внеклеточная сигнал-регулируемая киназа) сигнальных путей. Ресвератрол снижает фосфорилирование ERK и его нижестоящей мишени eIF4E (эукариотический фактор инициации трансляции 4E, а также подавляет активность mTOR пути, включая снижение фосфорилирования S6K (киназа рибосомального белка S6 и 4E BP1 (связывающий белок eIF4E 1). Эти изменения приводят к снижению кэп-зависимой трансляции белков и ингибированию клеточного роста [43].
Прямое ингибирование mTOR и индукция аутофагии. Недавние исследования выявили, что ресвератрол может напрямую ингибировать mTOR, связываясь с АТФ-связывающим карманом киназного домена mTOR, т.е. конкурируя с АТФ. In vitro киназные анализы показали, что ингибирование mTOR ресвератролом восстанавливается при добавлении АТФ, что подтверждает АТФ-кон-курентный механизм [45]. Помимо прямого ингибирования mTOR, ресвератрол через активацию AMPK также влияет на mTOR путь, поскольку AMPK прямо фосфорилирует ULK1 по серинам 555 и 317, что активирует аутофагию [45; 46; 47].
Регуляция PI3K/Akt сигнального пути. Ресвератрол оказывает двойственное действие на путь PI3K/Akt в зависимости от клеточного контекста и концентрации. В раковых клетках ресвератрол преимущественно ингибирует путь PI3K/Akt, что приводит к индукции апоптоза и остановке клеточного цикла. Ресвератрол подавляет PI3K/Akt сигнализацию главным образом путем ингибирования двух фосфорилированных субъединиц
PI3K — регуляторного домена p85 и каталитического домена p110, что приводит к каскаду событий, ингибирующих PIP2, PIP3 и PDK1 [48; 49; 50].
Ресвератрол также ингибирует комплекс MTA1/ HDAC1, что приводит к реактивации PTEN (фосфатаза и гомолог тензина) и последующему подавлению пути Akt. PTEN действует как негативный регулятор пути PI3K/Akt, дефосфорилируя PIP3 и превращая его в PIP2. Исследования показали, что обработка ресвератролом или ингибитором PI3K LY294002 очевидно снижала экспрессию p-AKT и AKT, что далее приводило к повышению регуляции p53 и снижению регуляции циклина B1, что приводило к остановке клеточного цикла на стадии G2/M [49].
В контексте защиты от ишемического повреждения ресвератрол может активировать путь PI3K/ Akt. Активация Akt ресвератролом приводит к фосфорилированию и инактивации GSK3β (гли-коген-синтаза-киназа3β), ключевой нижестоящей мишени пути PI3K/Akt. Фосфорилирование GSK3β по серину 9 инактивирует киназу и предотвращает её проапоптотическую активность. Ишемическое повреждение, вызванное окклюзией средней мозговой артерии (MCAO), снижает уровни фосфо-GSK3β, а ресвератрол ослабляет эти снижения. GSK3β индуцирует гибель клеток путем увеличения активности каспазы3 при ишемическом повреждении, поэтому фосфорилирование GSK3β киназой Akt является критическим процессом для ингибирования её проапоптотической активности [48; 50; 51].
Модуляция JAK/STAT сигнального пути. Ресвератрол ингибирует сигнальный путь JAK/STAT Janus киназа/преобразователь сигнала и активатор транскрипции) — важный механизм передачи сигнала в клетках, который тесно связан с клеточным окислительным стрессом, секрецией воспалительных цитокинов и регуляцией иммунного ответа. Связывание лиганда с рецептором индуцирует трансфосфорилирование JAK, активированная JAK вызывает фосфорилирование тирозина связанного рецептора, формируя сайт стыковки для STAT. На этом сайте стыковки JAK фосфорилирует STAT, а затем STAT диссоциирует от рецептора и формирует гомодимеры или гетеродимеры через взаимодействия SH2домен-фосфотирозин [52; 53; 54; 55].
Исследования на модели атеросклероза у крыс показали, что после введения ресвератрола JAK1 и STAT5позитивное окрашивание в артерии крысы было значительно меньше, и наблюдалось определенное снижение уровней мРНК (P 0,033, P 0,027) и белка генов JAK1 и STAT5 P 0,026, P 0,032. Это свидетельствует о том, что ресвератрол может улучшать липидный профиль крови у крыс с атеросклерозом, снижать воспалительный ответ in vivo и ингибировать белки, связанные с сигнальным путем JAK/STAT. In vitro исследования на клетках HT29 показали, что ресвератрол, используемый в концентрации в 20 раз ниже, чем 5аминосалициловая кислота, способен значительно снизить продукцию NO и PGE ₂. Ресвератрол снижает уровни активированного STAT1 в ядре цитокин-стимулированных клеток HT29 более эффективно, чем 5ASA. Клетки предварительно инкубировались с 25 мкМ ресвератрола или 500 мкМ 5ASA, а затем подвергались воздействию комбинации цитокинов в течение 30 минут. Уровни фос-фо-STAT1 по Tyr701 анализировались в ядерных экстрактах методом вестерн блоттинга, и результаты показали значительное снижение в группе ресвератрола по сравнению с группой, стимулированной только цитокинами [52; 53].
Потенциальный вред ресвератрола и его метаболитов. В живых системах окисление ресвератрола может осуществляться несколькими ферментативными путями. Цитохромы P450, особенно CYP1B1, способны метаболизировать ресвератрол в пицеатаннол (3,3’,4’,5-тетрагидрок-си-трансстильбен), который обладает собственным катехольным фрагментом. Этот метаболит может подвергаться дальнейшему окислению с образованием соответствующего о-хинона. Данный процесс может проходить под воздействием изоформ цитохромов P450 - CYP3A4, CYP1A1 и меньшей степени путем гидроксилирование ресвератрол до 3,5,3,4-тетраоксистильбена и его последующем окислении. Микросомальные ферменты печени, содержащие флавопротеины, включая NAD(P)H:хинон оксидоредуктазу NQO2, также могут участвовать в редокс-циклировании ресвератрола, генерируя активные кислородные радикалы в процессе восстановления хинонов до гидрохинонов [58; 59; 73].
Важным является тот факт, что RES-хинон оказался чрезвычайно нестабильным и быстро распадается в олигомерный продукт. Эти олигомеры, демонстрируют про-оксидантную активность, окисляя восстановленный глутатион (GSH) в окисленную форму (GSSG), таким образом «выключая» глутатион из антиоксидантной системы генерируя окислительный стресс [56].
Еще один механизм образования RES-хинона связан с тирозиназой. Образования RES-хинона представляет из себя циклический процесс в первом этапе которого тирозиназа окисляет ресвератрол (группа в положении 4’) в орто-дифенол через реакцию гидроксилирования. При этом к ароматическому ядру добавляется гидроксильная группа и образуется пицеатаннол — дифенольный промежуточный продукт. На втором этапе пицеатаннол подвергается окислению через дифенолазную активность тирозиназы в соответствующий о-хинон, обозначаемый как RES-хинон (4-(3’,5’-дигидрок-си-транс-стиренил)-1,2-бензохинон) [75].
S-глутатионилирование и образование дисульфидных связей с цистеином под действием RES-хинона. Помимо прямого присоединения цистеина, о-хинон ресвератрола может опосредованно модифицировать белки через S-глутатионилирование — процесс, при котором восстановленный глутатион (GSH) ковалентно присоединяется к цистеиновым остаткам белка в результате редокс-реакций. Исследования показали, что RES-хинон индуцирует дисульфидное образование между двумя молекулами цистеина, как это было демонстрировано на рекомбинантной проте-инкиназе G1α (PKG1α), а также, что RES-хинон реактивен по отношению к N-ацетилцистеину, формируя диадъюнкты и триадъюнкты. Образование триадъюнкта является редким явлением для о-хи-нонов и указывает на высокую реактивность RES-хинона [56; 57; 60; 63].
Мишени RES-хинона среди белковых регуляторов апоптоза и АФК. Критической особенностью механизма действия о-хинона ресвератрола является его способность модифицировать специфические регуляторные белки через образование дисульфидных мостиков и ковалентных аддуктов. Keap1 содержит два высокореактивных цистеиновых остатка в своём домене, богатым тиолом. RES-хинон может алкилировать эти остатки приводя к конформационным изменениям Keap1, предотвращающим убиквитирование и деградацию Nrf2. Это может активировать антиоксидантный ответ на низких дозах, но при высоких концентрациях о-хинона избыточное алкилирование Keap1 приводит к патологической активации или инактивации этого пути вызывая ингибирование синтеза и концентрации ферментов, например, NQO1, GPX, TXNRD1, SRXN1 и TXN1 играющих основную роль в снижении активных форм кислорода и их продуктов в щитовидной железе [61; 62; 72].
I-каппа-B-киназа (IKK) и компоненты NF-κB сигнального пути также являются потенциальными мишенями для о-хинона. S-нитрозилирование IKKβ и прямая модификация его цистеиновых остатков могут подавлять или усиливать активацию NF-κB в зависимости от локализации и типа модификации, что может нарушить эндогенное регулирование воспаления, приводя к патологической дерегуляции иммунитета [61].
Генерация АФК под действием RES –хино-на. RES-хинон является мощным генератором активных форм кислорода через ряд механизмов. Во-первых, редокс-циклирование семихинона приводит к прямому восстановлению молекулярного кислорода в суперокисид (- O₂⁻). Во-вторых, о-хинон может взаимодействовать с цитохромом P450, который в процессе детоксикации генерируют дополнительные АФК. В-третьих, взаимодействие о-хинона с NOX может усилить высвобождение суперокисида [61; 64; 65].
Также RES-хинон приводит к истощению митохондриального GSH и инактивации MnSOD, что вызывает образование пероксинитрита (ONOO⁻) [67; 68].
Влияние RES-хинона на митохондриальные структуры. О-хинон и ресвератрол могут прямым образом взаимодействовать с компонентами дыхательной цепи. Исследования показали, что при низких концентрациях ресвератрол активирует комплекс I, связываясь с NADH дегидрогеназным модулем, что приводит к повышению активности NADH окисления. Однако при высоких концентрациях ресвератрол ингибирует комплекс I, при этом запуская открытие пор перемен проницаемости (mPTP) [66].
Сам о-хинон может действовать как альтернативный акцептор электронов, обходя комплекс III и напрямую передавая электроны цитохрому c. Таким образом разрывая окислительное фосфорилирование, снижая синтеза ATP и повышая утечку электронов с образованием суперокисида. В клетках со сниженной антиоксидантной защитой данный эффект может привести к перекисному окислению липидов [66].
Генотоксичность и повреждение ДНК при действии RES-хинона и ресвератрола. При высоких концентрациях ресвератрол может действовать как про-оксидант, индуцируя массивное повреждение ДНК через прямое воздействие активных кислородных видов и косвенное воздействие через нарушение репарационных механизмов.
Наиболее опасным повреждением являются двухцепочечные разрывы. [61; 69].
Ресвератрол и его о-хинонный метаболит способны ингибировать рибонуклеотидредуктазу. Это приводит к глобальному снижению доступности дезоксирибонуклеотидов и торможению S-фазы клеточного цикла. Одновременно, про-оксидантная активность о-хинона нарушает несколько путей репарации ДНК, включая базовую эксцизионную репарацию (BER) и нуклеотидную эксцизионную репарацию (NER) [61].
Было продемонстрировано, что ресвератрол может действовать как яд для топоизомеразы II, что приводит к неконтролируемым разрывам ДНК. При лечении раковых клеток ресвератром наблюдается активация р53-зависимого апоптоза [61; 70].
В лейкемических клеточных линиях (MOLT-4) лечение ресвератролом в дозе 100 микромолярных приводит к ярко выраженной фрагментации хромосомной ДНК, по средствам активации апопто-тических каспаз, особенно каспазы-3 и каспазы-9, и деградации ДНК нуклеазами. При этом в клетках солидных опухолей (MCF-7, HepG2) ресвератрол индуцирует ранний апоптоз без фрагментации ДНК [70].
Негативные эффекты о-хинона на эндокринную систему. Ресвератрол и его метаболиты проявляют выраженное антитиреоидное действие. Так при низких концентрациях подавляется экспрессия генов, ответственных за синтез гормонов щитовидной железы. К ним относятся натриевый/йо-дидный симпортер, тиреопероксидаза, тиреоглобулин, а также ядерные транскрипционные факторы TTF-1, TTF-2 и Pax8 [71].
При микромолярных концентрациях ресвератрол подавляет биосинтез стероидных гормонов снижая приток холестерина в митохондрии. Более того, было продемонстрировано, что ресвератрол подавляет каталитическую активность CYP17A1, фермента, необходимого для синтеза андрогенов и кортизола, в клетках карциномы надпочечников человека [72].
Заключение. Проведенный анализ демонстрирует, что ресвератрол является соединением с выраженным дуализмом действия, где его конечный эффект критически зависит от дозы и метаболического контекста.
С одной стороны, ресвератрол проявляет многогранный благоприятный потенциал. Его способность активировать ключевые сигнальные пути SIRT1, AMPK, Nrf2 и PGC-1α лежит в ос- нове усиления митохондриального биогенеза, антиоксидантной защиты и подавления воспаления через ингибирование NF-κB. Важнейшую роль в реализации этих эффектов играет микробиота кишечника, которая трансформирует ресвератрол в биологически активные метаболиты, такие как дигидроресвератрол и лунуларин, одновременно улучшая состав микробного сообщества и укрепляя кишечный барьер.
С другой стороны, применение ресвератрола ограничивается его сложной фармакокинетикой: высокой абсорбцией, но крайне низкой биодоступностью нативной формы из-за интенсивного пресистемного метаболизма в глюкурониды и сульфаты. Более того, при высоких концентра- циях ресвератрол проявляет про-оксидантные свойства. Окисляясь до высокореактивного RES-хинона, он инициирует каскад токсических эффектов: генерацию АФК, истощение глутатиона, ковалентную модификацию белков (Keap1, IKK), митохондриальную дисфункцию, генотоксичность и эндокринные нарушения.
Таким образом, перспективы дальнейшего изучения и применения ресвератрола лежат в поиске путей преодоления его низкой биодоступности, углубленном исследовании роли микробиоты и ее метаболитов, а также в точном определении безопасных и эффективных дозировок, учитывающих его дозозависимый двуликий характер.


