Результаты клинической апробации нового способа дистракции стволов плечевого сплетения после нейрорафии
Автор: Богов мЛ. А. А., Ахтямов И. Ф., Данилов В. И., Старостина И. Г., Ханнанова И. Г., Богов А. А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 1 т.13, 2023 года.
Бесплатный доступ
В работе описаны результаты клинической апробации аппарата для дозированной тракции стволов плечевого сплетения. Показано, что при наличии диастаза протяженностью 5 см возможно сопоставить фрагменты нерва и провести нейрорафию без натяжения за счёт приведения плеча к голове и вывести плечо в физиологическое положение через полтора месяца после реконструктивной операции.
Травма плечевого сплетения, аппарат для дозированной тракции, регенерация
Короткий адрес: https://sciup.org/143179803
IDR: 143179803 | УДК: 616.711-001.5-007.24 | DOI: 10.20340/vmi-rvz.2023.1.CASE.2
Текст научной статьи Результаты клинической апробации нового способа дистракции стволов плечевого сплетения после нейрорафии
Хирургическое лечение повреждений стволов плечевого сплетения является наиболее сложным в микрохирургической практике и требует технически сложных, многоэтапных вмешательств. Функциональный исход операции и качество восстановления пациента после травмы во многом зависит от точности восстановления анатомических структур нервных стволов. Стратегия оперативного вмешательства на плечевом сплетении зависит от типа и вида травмы, локализации, степени тяжести, а также от срока давности травматического повреждения [1]. При нарушении целостности стволов плечевого сплетения достичь наилучшего функционального результата удаётся при помощи нейрорафии конец в конец. Однако выполнить прямой шов удаётся не всегда. Зачастую между повреждёнными концами нерва формируется диастаз, не позволяющий сопоставить проксимальный и дистальный фрагменты нерва без натяжения. Выполнение шва нерва с натяжением является грубым нарушением микрохирургической техники, приводящим к серьёзным неудовлетворительным результатам [2]. Для восполнения дефекта нерва наиболее распространённой стратегией в клинической практике является аутотрансплантация, которая заключается в использовании донорского фрагмента от другого нерва пациента [3]. В этом случае аутологичный нервный трансплантат функционирует как иммуногенно инертный каркас, способствующий регенерации аксонов [4]. Эта стратегия имеет ряд ограничений, таких как необходимость дополнительного оперативного вмешательства для забора донорского фрагмента нерва, вероятность отторжения из-за низкой жизнеспособности пересаживаемой ткани, несоответствие сечений пучков, к тому же две линии шва создают дополнительное препятствие для роста аксонов [5]. По этим причинам поиск и разработка методов, позволяющих осуществить нейрорафию рассечённых стволов плечевого сплетения при наличии диастаза, представляется актуальной. В статье представлен клинический случай применения аппарата для дистракции стволов плечевого сплетения после нейрорафии при наличии посттравматического диастаза между концами нерва протяжённостью 5,5 см. Описаны методы диагностики, лечения и исходы.
Материалы и методы
Исследование было поведено в два этапа. Первый этап включал разработку аппарата для дозированной тракции стволов плечевого сплетения после нейрорафии (Патент РФ на изобретение «Устройство для лечения повреждённых стволов плечевого сплетения» № 2772539 от 23.05.2022 г.). На втором этапе на базе ГАУЗ «Республиканская клиническая больница» МЗ РТ (ГАУЗ РКБ МЗ РТ) в отделении травматологии № 2 (микрохирургии) проводили клиническую апробацию разработанного устройства.
Клинический случай
Пациент П., 35 лет, поступил в отделение микрохирургии ГАУЗ РКБ МЗ РТ с диагнозом «повреждение правого плечевого сплетения». На догоспитальном этапе на основании клиниконеврологического обследования пациента провели сбор анамнеза с выявлением причин травмы, даты получения и механизма травмы, срока поступления в лечебное учреждение, пола, возраста и сопутствующих заболеваний. Это позволило оценить соматический и неврологический статус, степень выраженности проявлений травмы, установить предварительный диагноз с выявлением предполагаемого уровня поражения. Оценивали клинические проявления повреждения в виде нарушений двигательных функций и чувствительности.
Было установлено, что травма была получена за 5 месяцев до поступления в стационар в результате дорожно-транспортного происшествия. Пациенту была выполнена рентгенограмма плеча в прямой проекции и изготовлено индивидуальное устройство для лечения повреждённых стволов плечевого сплетения. По форме и размерам головы пациента из полиэтилена низкой плотности был изготовлен шлем, а по форме и размерам плевого сустава – фиксирующее кольцо из педилина. За 12 часов до операции на плечевом сплетении пациенту была проведена липосакция с целью забора жировой ткани и выделения клеток стромально-васкулярной фракции (СВФ-ЖТ).
Доступ к повреждённому первичному нервному стволу был осуществлён под эндотрахеаль-ным наркозом. После иссечения рубцовоизмененной ткани дефект нерва составил 5 см, что не позволило осуществить сшивание концов нерва между собой без натяжения. Чтобы избе- жать использования аутонервного трансплантата, положение верхней конечности было изменено. Для этого приблизили надплечье к шейному отделу позвоночника так, чтобы концы нервного ствола удалось сшить с использованием микрохирургической техники. Во время оперативного лечения провели ревизию зоны повреждения нервного ствола, мобилизировали проксимальный и дистальный концы повреждённого нерва, обеспечили приведение плеча к голове, и выполнили микрохирургическую эпипериневральную нейрорафию. По завершению вмешательств на стволах плечевого сплетения для улучшения результатов реконструктивной операции пациенту провели аутотрансплантацию ранее выделенных клеток СВФ-ЖТ в количестве 7–10 млн. Клетки вводили шприцом с инсулиновой иглой эндоневрально в зону поражения и параневрально. Зону трансплантации покрыли тонким слоем фибринового клея Tissucol-Kit (Baxter AG, Австрия).
Конечность в приведённом положении фиксировали в устройстве. После окончания операции пациенту с целью сохранения достигнутого положения нервных окончаний на сегменте конечности с опорой в подмышечной впадине закрепили фиксирующее кольцо и надели на голову шлем. Операцию завершили ушиванием операционной раны.
Спустя четыре недели после операции пациент самостоятельно, по заранее определенному режиму, параллельно по двум резьбовым штангам производил дозированный поворот гаек, расположенных на концах резьбовых штанг, перемещая фиксирующее кольцо в дистальном направлении, до полного выведения конечности в физиологическое положение. Темп разгибания выдерживался в режиме 1 мм в сутки, что соответствовало полному обороту гайки (рис. 1).
Дефект верхнего первичного ствола после иссечения рубцовой ткани
Шов верхнего первичного ствола – устранение дефекта при помощи аппарата для дистракции стволов плечевого сплетения
Рисунок 2. Схема шва плечевого сплетения с установкой аппарата для дистракции стволов плечевого сплетения
Figure 2. Scheme of the suture of the brachial plexus with the installation of a device for distraction of the trunks of the brachial plexus
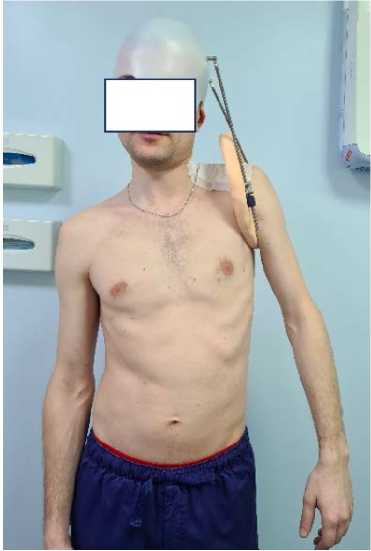
Рисунок 1. Пациент П. после нейрорафии стволов плечевого сплетения и установки устройства для дистракции нервов
Figure 1. Patient P. after brachial plexus neurorhaphy and installation of a nerve distraction device
Двигательная функция. Оценку восстановления двигательной функции проводили при поступлении в отделение и на разных сроках после операций. Для исследования утраты и восстановления двигательной функции поражённых мышц применяли классификацию Санкт-Петербургского научно-исследовательского нейрохирургического института им. проф. А.Л. Поленова, где М0 – отсутствие сокращений (паралич), М1 – едва заметные сокращения, М2 – отчётливые сокращения без движений в суставах, М3 – слабые движения в суставах (полезная степень восстановления), М4 – движения с преодолением некоторого сопротивления, М5 – нормальная сила.
Электронейромиографическое исследование. Методом стимуляционной электронейромиографии регистрировали амплитудновременные характеристики моторных ответов с исследуемых мышц в ответ на стимуляцию из искомых точек поражения структур плечевого сплетения. Количество двигательных единиц (КДЕ) определяли путём вычисления соотношения амплитуд максимального и минимального М-ответа для каждой мышцы на повреждённой и интактной конечности. Также определялась скорость распространения возбуждения по стволам и длинным ветвям плечевого сплетения. Данные, полученные на интактной конечности, использовали в качестве контроля.
Для регистрации моторных ответов использовали электромиограф «Нейрософт МВП-4» (Нейрософт, Россия). Отводящие поверхностные электроды, активный электрод устанавливали на мышцу, референтный отводящий электрод на костный выступ или сухожильную часть. Стимуляция нервов проводили вилочковым электродом в наиболее доступной точке. При этом электрод располагали таким образом, что катод находился более дистально. Стимуляцию выполняли прямоугольным импульсом длительностью 0,1–0,5 мс. Силу тока измеряли в миллиамперах и изменяли с установленным шагом в 1 мА. Для получения достоверного М-ответа при непрямой стимуляции нерва силу стимула постепенно наращивали до регистрации максимального и стойкого ответа.
Результаты
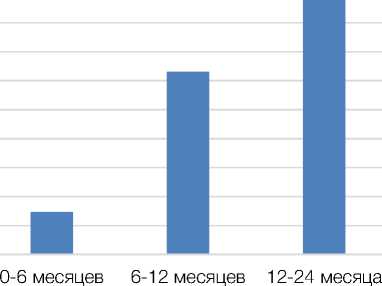
Посттравматическое восстановление пациента проходило без осложнений. Оперированная конечность была выведена в физиологическое положение спустя 1,5 месяца после операции. На сроке до 6 месяцев после операции были зафиксированы слабые движения в суставах и восстановление поверхностной болевой и тактильной чувствительности во всей автономной зоне, что соответствовало функциональному результату М3–S3. На сроке 9,5 месяцев получено восстановление функции отведения плеча и сгибание предплечья в локтевом суставе с функциональным результатом М5–S4 (рис. 3). В течение 24 месяцев функциональный результат оставался стабильным. В ходе проведения электромиографиче-ского исследования на сроках 0–6 месяцев, 6–12 месяцев и 12–24 месяца после нейрорафии и установки аппарата для дозированной дистракции стволов плечевого сплетения с применением клеток СВФ-ЖТ было зафиксировано увеличение КДЕ. Так, за вторые 6 месяцев после операции КДЕ увеличилось на 48,3 %, а за год прибавка составила 24,7 % (рис. 4).
Обсуждение
Несмотря на существенный прогресс в хирургии повреждений плечевого сплетения, обусловленный развитием науки и внедрением микрохирургической техники, позволившим значительно обогатить арсенал оперативных вмешательств, не всегда удаётся добиться успешного исхода лечения пациентов. Для повышения эффективности хирургического лечения повреждений плечевого сплетения необходимо создание условий для усиления естественных процессов посттравматической регенерации восстанавливаемого нервного ствола, однако проблема регенерации периферического нерва остаётся одной из сложно решаемых. Для достижения этой цели перспективным представляется разработка методов, позволяющих осуществить сопоставление рассечённых фрагментов нерва без вставки и применение стимуляторов регенерации.
Главная цель любого подхода к стимуляции регенерации повреждённых периферических нервов – создать наиболее благоприятную среду для регенерации аксонов в течение длительного периода времени. В современном контексте восстановление нервов больше не рассматривается как вопрос исключительно микрохирургической реконструкции [6].
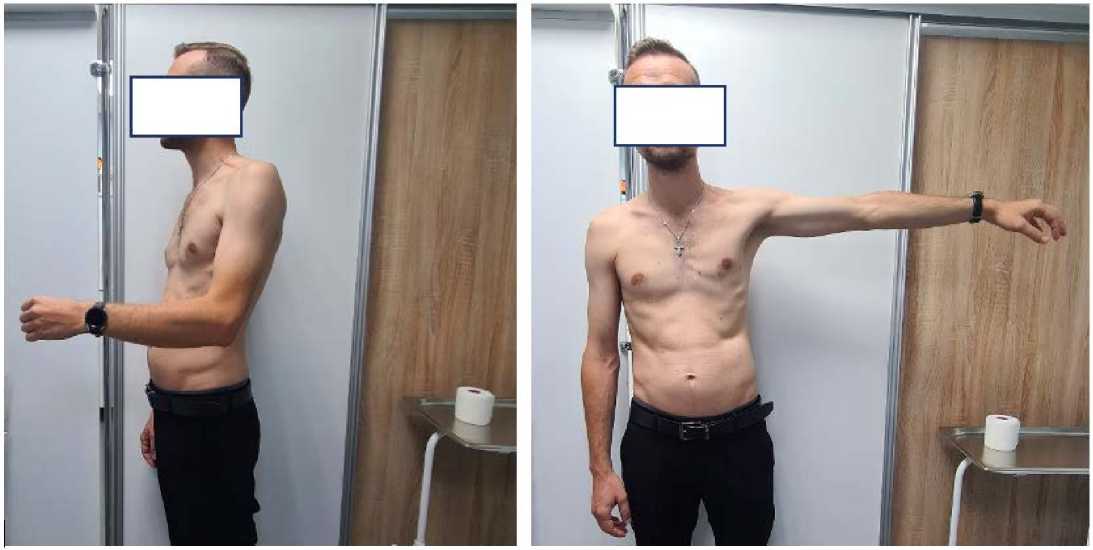
Рисунок 3. Функциональный результат на сроке 9 месяцев после нейрорафии стволов плечевого сплетения с аутотрансплантацией СВФ-ЖТ и дистракцией нервов с использованием аппарата для дистракции нервов
Figure 3. Functional outcome at 9 months after neurorhaphy of the brachial plexus trunks with SVF-AT autotransplantation and nerve distraction using a nerve distraction apparatus
со
ш
Сроки обследования после нейрорафии
-
■ Нейрорафия Аппарат_СВФ-ЖТ
Рисунок 4. Результаты электромиографического исследования пациента П. на сроках 0–6, 6–12 и 12–24 месяцев после нейрорафии стволов плечевого сплетения с аутотрансплантацией СВФ-ЖТ и дистракцией нервов с использованием аппарата для дистракции нервов
Figure 4. Results of an electromyographic study of patient P. at 0–6, 6–12, and 12–24 months after neurorhaphy of the brachial plexus trunks with SVF-AT autotransplantation and nerve distraction using a nerve distraction apparatus
Для этого активно развивающегося направления всё чаще используется термин «тканевая инженерия», поскольку он отражает поиск междисциплинарных и комплексных стратегий лечения, направленных на поддержание выживания нейронов, стимуляцию роста аксонов и восстановление утраченных функций [7].
Учитывая, что самым эффективным методом лечения является прямой шов для сокращения диастаза между концами нерва, в работе был исследован способ приведения конечности с помощью разработанного устройства для восстановления повреждённых стволов плечевого сплетения, позволяющего снизить травматичность оперативного вмешательства за счёт неинвазивного замещения дефекта нерва, при сокращении сроков лечения. На сроке 9,5 месяцев получено восстановление функции отведения плеча и сгибание предплечья в локтевом суставе с функциональным результатом М5–S4. Полученные эффекты несомненно были достигнуты за счёт нейрорафии последующей дозированной дистракцией стволов плечевого сплетения, исключающих дополнительную травматизацию.
Выводы
При всестороннем исследовании эффектов дозированной тракции стволов плечевого сплетения было зафиксировано достоверное увеличение количества двигательных единиц, что даёт нам основание заключить, что данный хирургический подход можно рассматривать как возможную альтернативу аутонервной пластике нерва при протяжённых диастазах между концами нерва, а также метода неинвазивной стабилизации конечности на этапе осуществления дозированной тракции.
Список литературы Результаты клинической апробации нового способа дистракции стволов плечевого сплетения после нейрорафии
- Raza C., Riaz H.A., Anjum R., Shakeel N.U.A. Repair strategies for injured peripheral nerve: Review. Life Sci. 2020;243:117308. PMID: 31954163,.
- PMID: 31954163
- Bahm J., Esser T., Sellhaus B., El-kazzi W., Schuind F. Tension in Peripheral Nerve Suture. In V. Vanaclocha, & N. Saiz-Sapena (Eds.), Treatment of Brachial Plexus Injuries. IntechOpen.2018.
- Li Y., Ma Z., Ren Y., Lu D., Li T., Li W. et al. Tissue Engineering Strategies for Peripheral Nerve Regeneration. Front Neurol. 2021;12:768267. PMID: 34867754,.
- PMID: 34867754
- Hussain G., Wang J., Rasul A., Anwar H., Qasim M., Zafar S. et al. Current Status of Therapeutic Approaches against Peripheral Nerve Injuries: A Detailed Story from Injury to Recovery. Int. J. Biol. Sci. 2020;16:116-134. PMID: 31892850,.
- Vijayavenkataraman S. Nerve guide conduits for peripheral nerve injury repair: A review on design, materials and fabrication methods. Acta Biomater. 2020;106:54-69. PMID: 32044456,.
- Rebowe R., Rogers A., Yang X., Kundu S., Smith T., Li Z. Nerve Repair with Nerve Conduits: Problems, Solutions, and Future Directions. J Hand Microsurg. 2018;10:61-65. PMID: 30154617,.
- Kobayashi E., Haga J. Translational microsurgery. A new platform for transplantation research. Acta Cir Bras. 2016;31:212-217. PMID: 27050793,.


