Результаты получения и трасплантации IVEP эмбрионов у овец (Ovis aries)
Автор: Сингина Г.Н., Луканина В.А., Шедова Е.Н., Чинаров Р.Ю., Гладырь Е.А., Цындрина Е.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вспомогательные репродуктивные технологии
Статья в выпуске: 6 т.58, 2023 года.
Бесплатный доступ
Необходимость развития технологии получения эмбрионов in vitro (in vitro embryo production, IVEP) у овец обусловлена ее использованием в исследованиях по разведению и сохранению ценных животных, а также созданию новых генотипов методом геномного редактирования. В представленной работе впервые для отечественной практики сообщается о получении in vitro у овец полноценных эмбрионов и рождении живого потомства после их трансплантации животным-реципиентам. Цель исследования заключалась в разработке основных этапов технологии IVEP у вида Ovis aries и оценке ее эффективности в условиях in vitro и in vivo. Источником половых клеток самок служили яичники половозрелых ярок и овцематок разной породной принадлежности и возраста, полученные после убоя (post mortem). Видимые фолликулы рассекали и выделяли ооцит-кумулюсные комплексы (ОКК) ( n = 1028). Отобранные по качеству ОКК ( n = 620) культивировали группами по 25-35 шт. в течение 24 ч в 500 мкл среды ТС-199, дополненной 10 % фетальной бычьей сыворотки, 10 мкг/мл фолликулостимулирующего и 10 мкг/мл лютеинизирующего гормонов, 10 нг/мл эпидермального фактора роста. Часть созревших яйцеклеток ( n = 96) использовали для цитологического анализа степени ядерного созревания, оставшуюся часть ( n = 524) переносили в среду BO-IVF («IVF Bioscience», Великобритания) для экстракорпорального оплодотворения. Гранулы замороженной спермы барана породы катадин размораживали и обрабатывали методом swim-up с использованием среды Sperm-TALP (G.N. Singina, 2019). Созревшие ооциты овец культивировали совместно со сперматозоидами в среде BO-IVF в течение 15-16 ч, после чего их переносили в среду эмбрионального развития BO-IVС («IVF Bioscience», Великобритания). Через 2 сут инкубации оценивали раздробившиеся эмбрионы, часть из них трансплантировали животным-реципиентам, на 7-е сут определяли число эмбрионов, развившихся до стадии бластоцисты. Двухсуточные эмбрионы пересаживали синхронным по половому циклу яркам романовской породы ( n = 6) эндохирургически (В.А. Луканина с соавт., 2023) методом двухпортовой лапароскопии под местной анестезией. Через 35-42 сут с момента трансплантации эмбрионов овец-реципиентов исследовали на суягность и затем вели наблюдение за развитием у них плодов вплоть до рождения живого потомства. По результатам цитологического анализа доля ядерного созревания ооцитов составила 77,1 % (74 из 96). Из 524 созревших и оплодотворенных ооцитов 316 клеток (60,3 %) преодолели первое деление дробления. Животным-реципиентам пересадили 92 раздробившихся эмбриона. Из 224 оставшихся и продолживших развитие in vitro ранних эмбрионов 34,8 % достигли стадии бластоцисты. По данным ультразвуковой диагностики, доля суягных животных после трансплантации эмбрионов шести реципиентам составила 50 % (3 из 6), 33,3 % пересадок (2 из 6) завершились рождением живого потомства. Таким образом, представленные результаты свидетельствуют об эффективности применяемой IVEP технологии: получаемые с ее использованием эмбрионы полноценны и способны развиваться до жизнеспособного потомства. Есть все основания полагать, что предложенная технология получения эмбрионов in vitro и их трансплантации животным-реципиентам может быть применена на практике в работах по воспроизводству и геномному редактированию у овец.
Ovis arie, домашняя овца, ооциты, in vitro созревание, in vitro оплодотворение, эмбрионы, ivep, трансплантация
Короткий адрес: https://sciup.org/142240680
IDR: 142240680 | УДК: 636.3:591.391.1:57.085.23 | DOI: 10.15389/agrobiology.2023.6.1088rus
Текст научной статьи Результаты получения и трасплантации IVEP эмбрионов у овец (Ovis aries)
Развитие и практическое применение вспомогательной репродуктивной технологии, предполагающей использование созревших и оплодотворенных in vitro женских половых клеток (ооцитов) домашних животных для получения эмбрионов вне организма с их последующей трансплантацией реципиентам, позволяет решить задачи, связанные с сохранением и тиражированием ценных генотипов, а также созданием новых генотипов методом геномного редактирования (1, 2). Согласно статистике, число эмбрионов, получаемых in vitro (in vitro embryo production, IVEP) от сельскохозяйственных животных, в мире ежегодно возрастает (3). Лидером остается крупный рогатый скот (КРС), у которого доля таких эмбрионов от общего
∗ Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ.
числа производимых составляет около 50 %, при этом существенная их часть предназначена для коммерческого использования (4).
У мелких жвачных животных, в частности у овец, IVEP пока имеет ограниченное коммерческое применение по сравнению с КРС, хотя интерес к IVEP технологии тоже постоянно растет (5). У овец такой подход рассматривается как альтернатива технологии производство эмбрионов методом множественной овуляции и трансплантации (MOET), применимость которой в программах разведения сдерживается высокой стоимостью процедуры и непредсказуемостью результата (1, 5) в силу зависимости MOET от репродуктивного статуса животного-донора (6), значительной вариабельности суперовуляторного ответа на гормональную стимуляцию (7), результативности осеменения (8), ранней лютеиновой регрессия (6), кроме того, как извлечение, так и трансплантация эмбрионов требуют хирургического вмешательства (5, 6). Также серьезным импульсом служит возросший в последние годы интерес к получению модифицированных животных в связи с появлением простой и эффективной системы редактирования генома на основе CRISPR/Cas9 (9, 10). Использование последней чаще всего предполагает ее введение в цитоплазму оплодотворенных in vitro ооцитов (11, 12). И наконец, у овцы как сельскохозяйственного животного существует легкий и доступный способ получения ооцитов из яичников post mortem. Это расширяет возможности использования IVEP в качестве модели для исследований в репродуктивной биологии, в том числе совершенствования вспомогательных репродуктивных технологий, которые применяются для решения некоторых проблем фертильности у человека и для сохранения исчезающих видов животных (13).
IVEP включает нескольких основных этапов: извлечение женских половых клеток (post mortem или от живых доноров) из фолликулов яичников, культивирование выделенных ооцитов с целью их созревания in vitro (in vitro maturation, IVM), экстракорпоральное оплодотворение (in vitro fertilization, IVF) созревших ооцитов с использованием свежего или замороженного семени, а также культивирование IVF-яйцеклеток для получения эмбрионов разных стадий развития (ранних или бластоцист) (13). Первый факт получения IVEP эмбрионов овец зарегистрирован в Кембридже (Великобритания) в 1986 году (14). В дальнейшем благодаря работам ученых из разных стран отдельные этапы IVEP были усовершенствованы и, как свидетельствует ряд обзоров (2, 5, 13), это позволило существенно повысить первоначальные показатели эффективности метода, но все-таки они (за редким исключением) уступают таковым у КРС (2, 5). Следовательно, существует необходимость в продолжении подобных экспериментов. Общая результативность IVEP по числу образовавшихся эмбрионов и их развитию до стадии бластоцисты колеблется соответственно от 18 до 89 % и от 7 до 79 % со значительными различиями между опытами и в зависимости от применяемых протоколов, происхождения используемых половых клеток, а также возраста, физиологического статуса и генетического фона животных — доноров репродуктивного материала (2, 5, 1 3).
В отечественной практике необходимость в развитии технологии IVEP у овец стоит особенно остро. Нами не найдено ни одной работы, в которой бы содержалась информация о получении жизнеспособных эмбрионов из ооцитов овец, созревших и оплодотворенных вне организма.
В представленной нами работе впервые сообщается о получении у овец полноценных IVEP эмбрионов, после трансплантации которых родилось живое потомство.
Цель нашего исследования состояла в разработке технологии IVEP у овец и оценке ее эффективности в условиях in vitro и in vivo.
Методика . Во всех экспериментах, кроме специально указанных случаев, использовались реагенты фирмы «Sigma-Aldrich» (США).
Получение IVEP эмбрионов . Яичники половозрелых ярок и овцематок разной породной принадлежности и возраста отбирали на мясокомбинате после убоя животных и доставляли в лабораторию в течение 24 ч, где освобождали от лишних тканей и многократно отмывали в физиологическом растворе, содержащем 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина (OOO «БиоФармГарант», Россия). Чтобы выделить ооцит-кумулюсные комплексы (ОКК), яичники поочередно помещали в чашку Петри (OOO «Биомедикал», Россия) диаметром 100 мм со средой ТС-199, содержащей 2 % фетальной бычьей сыворотки (ФБС), 10 мкг/мл гепарина и 50 мкг/мл гентамицина (ТС-199М) и фиксировали с помощью хирургического пинцета. Затем выполняли рассечение стенок видимых фолликулов яичников лезвием, зажатым в хирургическом пинцете, или скальпелем. После препарирования партии из 5-7 яичников чашку Петри помещали на предметный столик стереомикроскопа SMZ («Nikon», Япония) и проводили отбор ОКК, перенося их в свежую среду ТС-199М. После завершения аналогичной обработки для всех доставленных в лабораторию яичников общий пул собранных ОКК промывали еще 3 раза. Во время последнего промывания проводили селекцию ОКК, пригодных для дальнейшего культивирования, отбирая ооциты c гомогенной цитоплазмой, окруженные не менее чем одним слоем кумулюсных клеток (КК) (15).
Чтобы отобранные по качеству ОКК созрели in vitro, их культивировали в среде ТС-199, содержащей HEPES (25 мМ), Na-пируват (0,5 мМ), фолликулостимулирующий и лютеоинизирующий гормоны (по 10 мкг/мл), эпидермальный фактор роста (10 нг/мл) («Thermo Fisher Scientific», США), а также ФБС (10 %) и гентамицин (50 мкг/мл). Культивирование проводили в 4-луночных планшетах (OOO «Биомедикал», Россия) группами по 25-35 ОКК в каплях среды объемом 500 мкл. Через 24 ч in vitro созревания (in vitro maturation, IVM) часть ОКК использовали для цитологического анализа степени ядерного созревания (16), оставшуюся часть переносили в среду BO-IVF («IVF Bioscience», Великобритания) для экстракорпорального оплодотворения (in vitro fertilization, IVF).
Ооциты оплодотворяли с использованием фракции активных сперматозоидов, полученных методом swim-up по ранее описанному протоколу с небольшими модификациями (16). Гранулы замороженной спермы барана породы катадин размораживали в среде Sperm-TALP (17), по 200 мкл переносили на дно пробирок, содержащих 1 мл среды того же состава, и инкубировали в течение 1 ч. После инкубации из пробирки отбирали верхний слой объемом 700 мкл, переносили его в другую пробирку со средой Sperm-TALP и центрифугировали. Полученный осадок, содержащий подвижные спермии, вносили в среду BO-IVF с предварительно помещенными туда созревшими ОКК (концентрация сперматозоидов составила 1½106/мл среды оплодотворения). Ооциты и сперматозоиды совместно инкубировали в течение 15-16 ч, после чего женские половые клетки осторожно освобождали в свежих каплях BO-IVF от КК, а также мертвых и налипших сперматозоидов и переносили в среду для эмбрионального развития.
Эмбрионы культивировали в каплях среды BO-IVC под слоем минерального масла в планшетном инкубаторе «Эмбриовизор» («Весттрэйд ЛТД», Россия) при температуре 38,5 ° С и газовой атмосфере, содержащей 5 % СО 2 , 5 % О 2 и 90 % N 2 . Через 2 сут культивирования проводили морфологическую оценку дробления оплодотворенных ооцитов на бластомеры и отбор 1090
части эмбрионов ранних стадий развития (имеющих два и более бластомеров) для трансплантации животным-реципиентам. Оставшуюся часть переносили в свежую среду BO-IVC и культивировали еще 5 сут в аналогичных условиях до стадии бластоцисты для оценки жизнеспособности в условиях in vitro. Морфологическую оценку развития эмбрионов проводили согласно общепринятым критериям (18).
Выделенные ОКК и развившиеся из них после экстракорпорального оплодотворения эмбрионы фотографировали с использованием инвертированного микроскопе Eclipse Ti-U («Nikon», Япония).
Трансплантация эмбрионов. Эмбрионы пересаживали половозрелым яркам романовской породы (возраст 17-18 мес, животные ранее приходили в естественную охоту) в условиях физиологического двора ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста в октябре 2022 года. Число эструсов у животных до момента их использования не учитывали. У овец-реципиентов предварительно стимулировали эструс посредством внутримышечной инъекции 125 мкг клорпрестенола («Bioveta», Чешская Республика) за 13 и 2 сут до предполагаемой охоты (19). Животных с признаками эструса отбирали с использованием барана-пробника. На 2-е сут после выявления охоты отобранным реципиентам ( n = 6) трансплантировали 2-суточные IVEP эмбрионы эндохирургическим методом с помощью двухпортовой лапароскопии под местной анестезией, как описано ранее (19).
Эмбрионы переносили в просвет матки (ипсилатерально по отношению к яичнику, содержащему по крайней мере одно функциональное желтое тело, ЖТ) с помощью капиллярной пипетки с внешним диаметром 10 мм, соединенной со шприцом объемом 1 мл. Капилляр заполняли следующим образом: среда для переноса эмбрионов — столбик длиной 25-30 мм, воздух — 2-3 мм, среда, содержащая эмбрионы, — 30-40 мм, воздух — 2-3 мм, среда — 25-30 мм. В качестве среды использовали ТС-199, содержащей HEPES (25 мМ), гентамицин (50 мкг/мл) и 10 % ФБС. Число желтых тел на одного реципиента в среднем составило 2,2 с варьированием от 1 до 4.
Через 35-42 сут после трансплантации эмбрионов исследовали овец-реципиентов на наличие суягности и затем вели наблюдение за развитием у них плодов вплоть до рождения живого потомства. Диагностику в обоих случаях проводили с помощью портативного УЗИ-сканера Draminski 4Vet Slim («DRAMINSKI S.A.», Польша), оснащенного конвексным датчиком с центральной частотой 2-8 МГц. Рожденных ягнят осматривали, определяя общее состояние здоровья, идентифицировали по полу и взвешивали.
Достоверность происхождения полученных суррогатных ягнят оценивали по микросателлитным маркерам (short tandem repeats, STR) (20). Проводили исследование матерей и потомства по 11 STR, составляющих 2 мультиплексные панели: INRA005, INRA23, MAF65, McM527, SPS113, INRA063 (панель 1), HSC, MAF214, OarAE129, OarCP49 и OarFCB11 (панель 2). Геномную ДНК ягнят и овец-реципиентов выделяли из ткани уха, используя набор ДНК-Экстран (ЗАО «Синтол», Россия) и перхлоратный метод. Амплификацию проводили в финальном объеме 15 мкл в ПЦР-бу-фере с 1,5 мМ MgCl 2 , 200 мкМ dNTP, 0,5 мМ смеси праймеров, 1 ед. Taq-полимеразы (ЗАО «Диалат Лтд», Россия) и 10-100 нг геномной ДНК при следующих температурно-временных режимах: начальная денатурация 95 ° С, 5 мин; 35 циклов последовательно: 95 ° С, 20 с; 63 ° С (панель 1) и 55 ° С (панель 2), 1 мин; 72 ° С, 1 мин; заключительная элонгация при 72 ° С, 10 мин. Фрагменты амплификации идентифицировали на генетическом анализаторе ABI Prism 3130xl («Applied Biosystems», США), обработку первичных STR данных выполняли в программе GeneMapper 4 («Applied Biosystems», США).
Вероятность исключения родства между животными оценивали с использованием программы GenAlEx 6.5 (20) по следующим критериям: PI — вероятность совпадения генотипом, PX1 — исключение одного родителя в родительской паре, PX2 — исключение родства, когда один из родителей известен, но другой генотип недоступен, PX3 — исключение родства предполагаемой родительской пары.
Результаты . Всего в лабораторию доставили 174 полученных post mortem яичника (рис. 1, А), из которых мы выделили 1028 ОКК (в среднем 5,9 на 1 яичник). По результатам морфологической оценки 620 ОКК (60,3 %) были отобраны как пригодные для созревания in vitro (в среднем 3,56 на 1 яичник, см. рис. 1, Б) и использованы для культивирования в среде IVM. Через 24 ч инкубации 96 ОКК отбирали для цитологической оценки уровня ядерного созревания в ооцитах. 524 ОКК подвергали процедуре экстракорпорального оплодотворения с последующей оценкой способности к развитию in vitro до стадии бластоцисты (7 сут культивирования). Кроме того, исследовали жизнеспособность части 2-суточных эмбрионов после трансплантации животным-реципиентам.
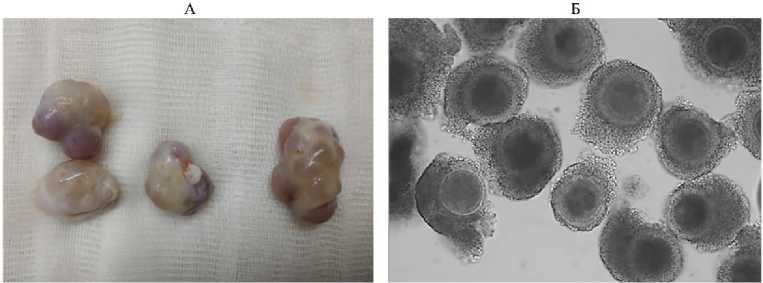
Рис. 1. Яичники овец, использованные для получения ооцитов (А), и микрофотография выделенных из них и отобранных для культивирования ооцит-кумулюсных комплексов (Б). Микрофотография выполнена на инвертированном микроскопе Eclipse Ti-U («Nikon, Япония), увеличение ½100 (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, Московская обл., 2022 год).
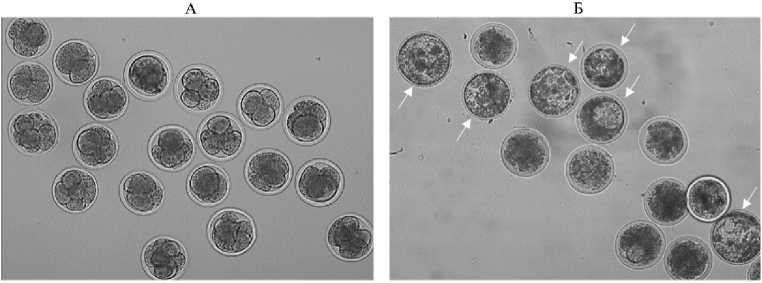
Рис. 2. Микрофотографии эмбрионов, развившихся из созревших и оплодотворенных in vitro ооцитов овец: А — 2-суточные раздробившиеся эмбрионы; Б — 7-суточные эмбрионы, в том числе достигшие стадии бластоцисты (указано стрелкой). Микрофотография выполнена на инвертированном микроскопе Eclipse Ti-U («Nikon, Япония), увеличение ½100 (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, Московская обл., 2022 год).
По данным цитологического анализа, доля созревания (число ооцитов на стадии метафазы II деления мейоза относительно исходного числа культивируемых ОКК) была приемлемой и составила в среднем 77,1 % (74 из 96). Из 524 созревших и оплодотворенных ооцитов первое деление дроб- ления преодолели 316 клеток (60,3 %, рис. 2, А), 92 раздробившихся эмбриона были пересажены животным-реципиентами. Из 224 оставшихся и продолживших развитие in vitro раздробившихся эмбрионов 78 достигли стадии бластоцисты (см. рис. 2, Б), что составило 34,8 %. В целом доля развития бластоцист от числа ОКК, поставленных на созревание, составила 21,0 %.
Результаты пересадки эмбрионов, полученных in vitro, представлены в таблице 1. По данным УЗИ-диагностики, после трансплантации эмбрионов у 3 из 6 реципиентов (50 %) наступила суягность (рис. 3, А). Доля пересадок, завершившихся рождением живого потомства (см. рис. 3, Б), составила 33,3 % (2 из 6). Одна овца (реципиент ¹ 195) принесла естественным образом трех ягнят (двух ярочек и одного баранчика), двое из которых (баранчик и ярочка) были живыми и здоровыми (см. рис. 3, Б), а один ягненок родился мертвым, но доношенным. Вторая овца (реципиент ¹ 26) аналогичным образом родила одного здорового ягненка (баранчика). В первом случае жизнеспособность пересаженных эмбрионов составила 21,4 % (3 из 14), во втором — 5,9 % (1 из 17). У реципиента ¹ 195 продолжительность периода суягности с даты пересадки эмбрионов составила 147 сут, средняя масса рожденных ягнят — 2,97 кг, у реципиента ¹ 26 — соответственно 145 сут и 3,0 кг.
1. Результативность пересадки IVEP-эмбрионов овцам-реципиентам романовской породы (физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, Московская обл., 2023 год)
|
Номер реципиента |
Число пересаженных эмбрионов, n |
Результаты УЗИ |
Рождено ягнят, n |
|
|
всего |
живых |
|||
|
062 |
14 |
Нет |
0 |
0 |
|
195 |
14 |
Да |
3 |
2 |
|
5750 |
19 |
Нет |
0 |
0 |
|
039 |
13 |
Нет |
0 |
0 |
|
005 |
15 |
Да |
0 |
0 |
|
26 |
17 |
Да |
1 |
1 |
Примечани е. Статус суягности (да/нет) оценивали по результатам ультразвукового исследования на 35-42-е сут после пересадки эмбрионов.
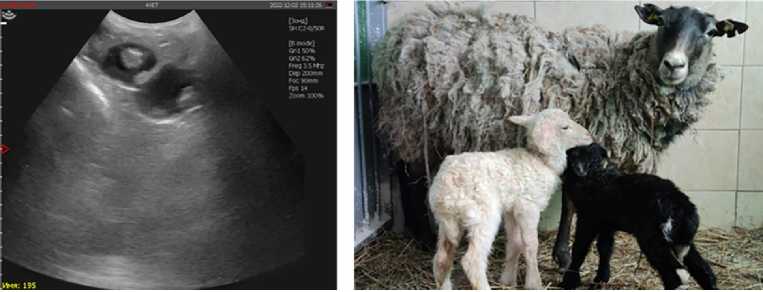
Рис. 3 . Развитие in vivo IVEP-эмбрионов овец после трансплантации: слева — результаты УЗИ-диагностики (УЗИ-сканер Draminski 4Vet Slim, «DRAMINSKI S.A.», Польша), 42-е сут после пересадки эмбрионов, реципиент ¹ 195; справа — овца ¹ 195 с двумя новорожденными ягнятами через 3 ч после окота (17 марта 2023 года, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, Московская обл.).
Для контроля происхождения мы определили микросателлитные профили животных (табл. 2). Этот метод считается общепринятым для под-тверждения/исключения родства в паре мать - потомок (20).
Выполненная оценка происхождения полученных суррогатных ягнят от реципиента ¹ 195 по 11 STR выявила вероятность совпадения гено- типов (PI) с нижним порогом 8,58½10-10. Точность подтверждения происхождения ягнят по двум (PX1) и одному (PX2) родителю была соответственно 99,92 и 98,31 %, точность исключения родителей (PX3) — 99,99 %. Сравнение аллельных профилей у потомков женского и мужского пола продемонстрировало их несовпадение с суррогатной матерью соответственно по 3 и 8 микросателлитным локусам, между собой — по 6 локусам, что исключает любую вероятность кровного родства. Отсутствие родства с суррогатной матерью (PX3) также подтвердилось у потомка, рожденного реципиентом ¹ 26 (по 7 микросателлитным локусам с точностью исключения 99,93 %). Совокупный анализ по двум суррогатным семьям показал точность исключения кровного родства по двум родителям (PX3) до 99,9999 %.
2. Микросателлитные профили овец-реципиетов романовской породы и суррогатных ягнят и информативные показатели STR панели (ФГБНУ ФИЦ ВИЖ им Л.К. Эрнста, Московская обл., 2023 год)
|
Семья 1 |
Семья 2 |
|
|
М195 П1 П2 |
М26 1 П |
|
|
INRA005 |
131/131 129/131 129/131 |
131/131 147/149а |
|
SPS113 |
140/152 140/148 148/148а |
140/148 140/152 |
|
McM527 |
169/169 169/171 173/175а |
169/183 169/177 |
|
INRA23 |
201/205 205/223 203/203а |
205/221 203/203а |
|
MAF65 |
125/125 131/137а 131/135а |
135/135 125/125а |
|
INRA063 |
181/181 181/187 189/205а |
173/183 177/181а |
|
HSC |
276/286 276/282 276/286 |
286/286 272/276а |
|
OarCP49 |
106/108 94/102а 96/100а |
100/106 98/106 |
|
OarAE129 |
147/149 147/149 139/139а |
149/149 147/147а |
|
MAF214 |
190/200 188/192а 190/192 |
192/192 190/190а |
|
OarFCB11 |
131/135 123/135 127/139а |
131/139 131/145 |
|
Показатель |
Семья 1 |
Семья 2 |
|
PI |
8,58½10 - 10 |
1,07½10 - 7 |
|
PX1 |
99,92 |
98,96 |
|
PX2 |
98,31 |
92,25 |
|
PX3 |
99,999 |
99,928 |
|
Примечание. Семья 1 |
— мать (М), реципиент ¹ 195, потомки (П) 1 и 2, семья 2 — мать (М), реци- |
|
|
пиент ¹ 26, потомок (П); буквой ( а) отмечены не совпадающие с материнскими микросателлитные аллели |
||
|
в профиле потомка. |
||
У овец в силу дороговизны и высокой инвазивности процедуры получения женских половых клеток от живых животных ооциты обычно извлекают из яичников post mortem (2), для этого проводят либо рассечение стенок фолликулов, либо аспирацию их содержимого (21). Последний подход считается более простым, но он не позволяет в полной мере использовать генеративный потенциал исходного биологического материала, а также, по мнению ряда авторов, негативно влияет на качество выделенных ОКК (22). Осторожное рассечение стенок фолликулов яичников режущим инструментом увеличивает число извлеченных ОКК и лучше сохраняет их структуру (5). С использованием такого подхода из одного яичника мы извлекли в среднем 5,9 ОКК, из которых 60 % были признаны нами пригодными для получения эмбрионов в системе in vitro. Об аналогичных показателях при выборе этого метода сообщали и другие авторы (5, 21, 22).
Выделенные из фолликулов ооциты, чтобы стать пригодными для оплодотворения, должны созреть in vitro, то есть достигнуть стадии метафазы II деления мейоза, и в них должны пройти необходимые цитоплазматические преобразования (4). Хорошо известно, что созревание in vitro рассматривается как ключевой этап получения ооцитов хорошего качества, определяющий их потенциальную способность к эмбриональному развитию. У овец, как показано в недавнем аналитическом обзоре, в условиях in vitro созревает 70-90 % ооцитов (2). При этом речь идет как о донорских (полученных от живых животных), так и post mortem ооцитах. Тем не менее 1094
есть работы, в которых сообщается и о меньших значениях этого показателя (23, 24) (табл. 3). В нашем исследовании доля созревания ооцитов, выделенных из фолликулов post mortem, сопоставима с более высокими значениями и составила 77 %.
3. Основные показатели эффективности технологии получения in vitro эмбрионов с использованием выделенных post mortem ооцитов овец (по данным литературы)
|
Страна |
Порода |
Сперма |
IVM, % |
Развитие эмбрионов, % |
Ссылка |
||
|
всего от числа созревших ооцитов |
до стадии Бл |
||||||
|
1 |
2 |
||||||
|
Австралия |
Merino |
Замороженная |
93,1 |
73,7 |
41,8 |
56.7 |
(15) |
|
Бразилия |
д/о |
Замороженная |
88,0 |
68,0 |
33,8 |
48,9 |
(25) |
|
Великобритания |
Texelб |
Замороженная |
63,2 |
89,7 |
40,4 |
45,1 |
(23) |
|
Иран |
д/о |
Замороженная |
92,0 |
63,3 |
20,0 |
31,7 |
(26) |
|
Иран |
Lori-Bakhtiari |
Свежая |
д/о |
81,6 |
31,7 |
38,7 |
(27) |
|
Иран |
Sajabiб |
Свежая |
д/о |
66,2 |
20,6 |
31,0 |
(28) |
|
Испания |
Rasa Aragonesaб |
Свежая |
д/о |
74,3 |
30,0 |
40,0 |
(29) |
|
Испания |
д/о |
Замороженная |
д/о |
60,4 |
4,0 |
6,7 |
(30) |
|
Италия |
Sarda sheep |
Свежая |
д/о |
80,0 |
30,0 |
38,0 |
(31) |
|
Италия |
Sarda sheepб |
Замороженная |
92,0 |
74,5 |
22,4 |
59,2 |
(32 |
|
Италия |
Sarda sheep |
Свежая |
73,2 |
58,6 |
11.6 |
19,8 |
(33) |
|
Китай |
д/о |
Свежая |
48,4 |
72,3 |
29,9 |
41.4 |
(24) |
|
Мексика |
Rideau Arcottа |
Свежая |
д/о |
76,5 |
21,3 |
27,7 |
(34) |
|
Польша |
д/о |
Замороженная |
д/о |
57,9 |
21,9 |
36,7 |
(35) |
|
Португалия |
Merino |
Свежая |
87 |
41,9 |
15,6 |
37,4 |
(36) |
|
Замороженная |
45,1 |
19,5 |
42,8 |
||||
|
Саудовская |
Naimi |
Свежая |
д/о |
29,9 |
7,1 |
23,5 |
(37) |
|
Аравия |
Замороженная |
18,8 |
1,3 |
7,0 |
|||
|
Саудовская |
Najdi |
Свежая |
д/о |
35,0 |
5,9 |
17,2 |
(37) |
|
Аравия |
Замороженная |
18,98 |
0,7 |
4,1 |
|||
|
Уругвай |
д/о |
Замороженная |
д/о |
69,8 |
35,2 |
50,5 |
(38) |
Примечани е. IVM — in vitro созревание, д/о — данные или информация отсутствуют; 1 — доля развившихся до стадии бластоцисты (Бл) от числа созревших ооцитов, 2 — доля развившихся до стадии бластоцисты от числа раздробившихся эмбрионов; а и б — информация о породе представлена соответственно для сперматозоидов или ооцитов.
Источником сперматозоидов для экстракорпорального оплодотворения созревших ооцитов может быть как свежее, так и замороженное семя (см. табл. 3). Мы в своей работе используем последнее. Это более практично, кроме того, лишь в некоторых публикациях сообщается о снижении фертильности криоконсерврованного семени по сравнению с нативным в условиях in vitro (30, 37). Активные спермии получают либо методом swim-up, либо центрифугированием в градиенте плотности, например, перколла. Вопрос о том, какой из этих приемов более эффективен для обработки семени баранов, остается открытым (5), поэтому мы отдали предпочтение методу swim-up, который применяем при IVEP у КРС (16).
Для успеха IVF важно, чтобы среда совместной инкубации половых клеток была способна обеспечить сперматозоидам идеальные условия для их проникновения в ооциты. Большинство лабораторий для этого используют синтетическую жидкость яйцевода, дополненную необходимыми ка-пацитирующими агентами (1). Мы поставили задачу упростить и сделать более воспроизводимым этот этап IVEP, поэтому для совместной инкубации яйцеклеток и сперматозоидов была использована коммерческая среда BO-IVF («IVF Bioscience», Великобритания). Доля ооцитов, перешедших к дроблению (что служит критерием оценки частоты их оплодотворения), в нашей работе составила 60,3 % и оказалась сопоставимой со значениями, установленными другими авторами (26, 30, 33, 35) (см. табл. 3), а в ряде случаев превышала эти значения (36, 37).
В нашем исследовании для определения способности оплодотворенных ооцитов к эмбриональному развитию их либо культивировали в тече- ние 7 сут до стадии бластоцисты, либо после 2 сут инкубации и дробления пересаживали в рог матки овец-реципиентов. Выход эмбрионов на стадии бластоцисты от числа ОКК, поставленных на созревание, составил 21,0 %, а от числа разробившихся ооцитов — 34,8 %. Если сравнивать эти значения с представленными в таблице 3, то можно увидеть, что в целом они согласуются с результатами других авторов (26, 32, 35, 26), но также есть как более успешные (15, 23, 25), так и менее успешные (30, 37) работы. Расхождения можно объяснить особенностями применяемых протоколов, различием в качестве ОКК, а также влиянием физиологического статуса и генетического фона животных — доноров половых клеток (2, 5, 13).
В нашем исследовании после трансплантации IVEP-эмбрионов суягные овцематки составили 50 % (3/6), и 33,3 % (2/6) пересадок завершились рождением ягнят. Появившееся потомство (три ягненка: два баранчика и одна ярочка) получено в отечественной практике впервые, в настоящее время животные здоровы и за их развитием ведется наблюдение.
Учитывая долю яйцеклеток, раздробившихся после оплодотворения до стадии Бл in vitro (34,8 %), описанный положительный эффект групповой трансплантации эмбрионов (5) и многоплодность романовской овцы, мы пересаживали одному реципиенту от 13 до 19 2-суточных эмбрионов, примерно о том же числе эмбрионов сообщали другие авторы (39, 40).
Таким образом, представленные результаты созревания ооцитов овец (77 %), образования после in vitro оплодотворения (60 %) и развития эмбрионов (34 %) свидетельствуют о соответствии примененной нами IVEP-технологии мировым аналогам. Получаемые с ее помощью эмбрионы полноценны и могут развиваться до жизнеспособного потомства. Есть все основания полагать, что предложенная технология получения in vitro эмбрионов и их трансплантации животным-реципиентам может быть применена на практике при воспроизводстве и геномном редактировании у овец.
Список литературы Результаты получения и трасплантации IVEP эмбрионов у овец (Ovis aries)
- Souza-Fabjan J.M.G., Batista R.I.T.P., Correia L.F.L., Paramio M.T., Fonseca J.F., Freitas V.J.F., Mermillod P. In vitro production of small ruminant embryos: latest improvements and further research. Reproduction, Fertility and Development, 2021, 33(2): 31-54 ⟨doi: 10.1071/RD20206⟩.
- Zhu J., Moawad A.R., Wang C.Y., Li H.F., Ren J.Y., Dai Y.F. Advances in in vitro production of sheep embryos. International Journal of Veterinary Science and Medicine, 2018, 27(Suppl. 6): S15-S26 (doi: 10.1016/j.ijvsm.2018.02.003).
- Viana J.H.M. 2021 Statistics of embryo production and transfer in domestic farm animals. In: Embryo Technology Newsletter, 2022, 40(4): 22-40.
- Ferré L.B., Kjelland M.E., Strøbech L.B., Hyttel P., Mermillod P., Ross P.J. Review: Recent advances in bovine in vitro embryo production: reproductive biotechnology history and methods. Animal, 2020, 14(5): 991-1004 (doi: 10.1017/S1751731119002775).
- Falchi L., Ledda S., Zedda M.T. Embryo biotechnologies in sheep: Achievements and new im-provements. Reproduction in Domestic Animal, 2022, 57 (Suppl. 5): 22-33 (doi: 10.1111/rda.14127).
- Gonźalez-Bulnes A., Baird D.T., Campbell B.K., Cocero M.J., García-García R.M., Inskeep E.K., López-Sebastián A., McNeilly A.S., Santiago-Moreno J., Souza C.J., Veiga-López A. Multiple fac-tors affecting the efficiency of multiple ovulation and embryo transfer in sheep and goats. Repro-duction Fertility Development, 2004, 16(4): 421-435 (doi: 10.10371/RD04033).
- Souza-Fabjan J.M.G., Rosa R.M., Balaro M.F.A., Pinto P.H.N., Santos G.B., Arashiro E.K.J., Fonseca J.F., Ungerfeld R., Brandão F.Z. Effect of different hormonal combinations on follicular wave emergence and superovulatory response in sheep. Theriogenology, 2017, 103: 24-29 (doi: 10.1016/j.theriogenology.2017.07.036).
- Gibbons A., Pereyra Bonnet F., Cueto M.I., Catala M., Salamone D.F., Gonzalez-Bulnes A. Procedure for maximizing oocyte harvest for in vitro embryo production in small ruminants. Reproduction in Domestic Animal, 2007, 42(4): 423-426 (doi: 10.1111/j.1439-0531.2006.00802.x).
- Perisse I.V., Fan Z., Singina G.N., White K.L., Polejaeva I.A. Improvements in gene editing technology boost its applications in livestock. Frontiers in Genetics, 2021, 11: 614688 (doi: 10.3389/fgene.2020.614688).
- Navarro-Serna S., Vilarino M., Park I., Gadea J., Ross P.J. Livestock gene editing by one-step embryo manipulation. Journal of Equine Veterinary Science, 2020, 89: 103025 (doi: 10.1016/j.jevs.2020.103025).
- Wang S., Qu Z., Huang Q., Zhang J., Lin S., Yang Y., Meng F., Li J., Zhang K. Application of gene editing technology in resistance breeding of livestock. Life (Basel), 2022, 12(7): 1070 (doi: 10.3390/life12071070).
- He Z., Zhang T., Jiang L., Zhou M., Wu D., Mei J., Cheng Y. Use of CRISPR/Cas9 technology efficiently targetted goat myostatin through zygotes microinjection resulting in double-muscled phe-notype in goats. Bioscience Reports, 2018, 38(6): BSR20180742 (doi: 10.1042/BSR20180742).
- Paramio M.T., Izquierdo D. Current status of in vitro embryo production in sheep and goats. Reproduction in Domestic Animal, 2014, 49(4, Suppl): 37-48 (doi: 10.1111/rda.12334).
- Cheng W.T.K. In vitro fertilization of pig and sheep oocytes matured in vivo and in vitro. Theri-ogenology, 1986, 25: 146.
- Morton K.M., Rowe A.M., Chis Maxwell W.M., Evans G. In vitro and in vivo survival of bisected sheep embryos derived from frozen-thawed unsorted, and frozen-thawed sex-sorted and refrozen-thawed ram spermatozoa. Theriogenology, 2006 65(7): 1333-1345 (doi: 10.1016/j.theriogenol-ogy.2005.08.009).
- Singina G.N. Change of culture medium positively influences the development and quality of in vitro cattle embryos. Sel'skokhozyaistvennaya Biologiya [Agricultural Biology], 2022, 57(6): 1197-1207 (doi: 10.15389/agrobiology.2022.6.1197eng).
- Singina G.N., Shedova E.N. Final maturation of bovine oocytes in a FERT-TALP medium in-creased their quality and competence to in vitro embryo development. Sel'skokhozyaistvennaya Biologiya [Agricultural Biology], 2019, 54(6): 1206-1213 (doi: 10.15389/agrobiology.2019.6.1206eng).
- Leoni G.G., Succu S., Berlinguer F., Rosati I., Bebbere D., Bogliolo L., Ledda S., Naitana S. Delay on the in vitro kinetic development of prepubertal ovine embryos. Animal Reproduction Science, 2006, 92(3-4): 373-383 (doi: 10.1016/j.anireprosci.2005.05.027).
- Луканина В.А., Чинаров Р.Ю., Позябин С.В., Шумаков Н.И., Черкасова О.В., Син-гина Г.Н. Сравнительное исследование результативности лапаротомического и лапароско-пического методов трансплантации клонированных эмбрионов у овец. Достижения науки техники АПК, 2023, 37(3): 39-43 (doi: 10.53859/02352451_2023_37_3_39).
- Deniskova T.E., Selionova M.I., Gladyr E.A., Dotsev A.V., Bobryshova G.T., Kostyunina O.V., Brem G., Zinovieva N.A. Variability of microsatellites in sheep breeds raced in Russia. Sel’skokho-zyaistvennaya Biologiya [Agricultural Biology], 2016, 51(6): 801-810 (doi: 10.15389/agrobiol-ogy.2016.6.801eng).
- Wang Z., Xu Z., Yu S. Effects of oocyte collection techniques and maturation media on in vitro maturation and subsequent embryo development in Boer goat. Czech Journal of Animal Science, 2007, 52(1): 21.
- Rodríguez C., Anel L., Alvarez M., Anel E., Boixo J. C., Chamorro C. A., de Paz P. Ovum pick-up in sheep: A comparison between different aspiration devices for optimal oocyte retrieval. Re-production in Domestic Animals, 2006, 41(2): 106-113 (doi: 10.1111/j.1439-0531.2006.00648.x).
- Moawad A.R., Zhu J., Choi I., Amarnath D., Chen W., Campbell K.H. Production of good-quality blastocyst embryos following IVF of ovine oocytes vitrified at the germinal vesicle stage using a cryoloop. Reproduction Fertility Development, 2013, 25(8): 1204-15 (doi: 10.1071/RD12215).
- Ni H., Sheng X., Cui X., Gu M., Liu Y., Qi X., Xing S., Guo Y. Epidermal growth factor-mediated mitogen-activated protein kinase3/1 pathway is conducive to in vitro maturation of sheep oocytes. PLoS ONE, 2015, 10(3): e0120418 (doi: 10.1371/journal.pone.0120418).
- Crocomo L.F., Ariu F., Bogliolo L., Bebbere D., Ledda S., Bicudo S.D. Reproduction in Domestic Animals, 2016, 51(2): 276-281 (doi: 10.1111/rda.12677).
- Amini E., Asadpour R., Roshangar L., Jafari-Joozani R. Effect of linoleic acid supplementation on in vitro maturation, embryo development and apoptotic related gene expression in ovine. International Journal of Reproductive Biomedicine, 2016, 14(4): 255-262.
- Shirazi A., Ardali M.A., Ahmadi E., Nazari H., Mamuee M., Heidari B. The effect of macro-molecule source and type of media during in vitro maturation of sheep oocytes on subsequent embryo development. Journal of Reproduction and Infertility, 2012, 13(1): 13-19.
- Aghaz F., Hajarian H., KaramiShabankareh H. In vitro culture medium (IVC) supplementation with sericin improves developmental competence of ovine zygotes. Reproductive Biology, 2016, 16(1): 87-90 (doi: 10.1016/j.repbio.2015.11.001).
- Cocero M.J., Alabart JL., Hammami S., Martí J.I., Lahoz B., Sánchez P., Echegoyen E., Beck-ers J.F., Folch J. The efficiency of in vitro ovine embryo production using an undefined or a defined maturation medium is determined by the source of the oocyte. Reproduction in Domestic Animals, 2011, 46(3): 463-470 (doi: 10.1111/j.1439-0531.2010.01690.x).
- Catalá M.G., Izquierdo D., Rodríguez-Prado M., Hammami S., Paramio M.T. Effect of oocyte quality on blastocyst development after in vitro fertilization (IVF) and intracytoplasmic sperm injection (ICSI) in a sheep model. Fertility and Sterility, 2012, 97(4): 1004-1008 (doi: 10.1016/j.fertnstert.2011.12.043).
- Mara L., Sanna D., Casu S., Dattena M., Muñoz I.M. Blastocyst rate of in vitro embryo production in sheep is affected by season. Zygote, 2014, 22(3): 366-371 (doi: 10.1017/S0967199412000706).
- Ledda S., Idda A., Kelly J., Ariu F., Bogliolo L., Bebbere D. A novel technique for in vitro maturation of sheep oocytes in a liquid marble microbioreactor. Journal of Assisted Reproduction and Genetics, 2016, 33(4): 513-518 (doi: 10.1007/s10815-016-0666-8).
- Serra E., Gadau S.D., Leoni G.G., Naitana S., Succu S. Seasonal Effect on developmental com-petence, oxidative status and tubulin assessment of prepubertal ovine oocyte. Animals (Basel), 2021, 11(7): 1886 (doi: 10.3390/ani11071886).
- Lorenzo-Torres A., Rangel-Santos R., Ruíz-Flores A., Ambríz-García D.A. In vitro embryo pro-duction from ewes at different physiological stages. Journal of Veterinary Science, 2023, 24(1): e10 (doi: 10.4142/jvs.22168).
- Zacchini F., Toschi P., Ptak G.E. Cobalamin supplementation during in vitro maturation im-proves developmental competence of sheep oocytes. Theriogenology, 2017, 93: 55-61 (doi: 10.1016/j.theriogenology.2017.01.035).
- Romao R., Marques C.C., Baptista M.C., Vasques M.I., Barbasb J.P., Horta A.E.M., Caro-lino N., Bettencourt E., Plancha C., Rodrigues P., Pereira R.M. Evaluation of two methods of in vitro production of ovine embryos using fresh or cryopreserved semen. Small Ruminant Re-search, 2013, 110(1): 36-41 (doi: 10.1016/j.smallrumres.2012.07.029).
- Al-Anazi Y., Al-Mutary M.G., Alfuraiji M.M., Al-Ghadi M., Al-himaidi A.R., Ammari A. Effect of ram breed on the efficiency of in vitro development of sheep embryos. Biosciences, Biotechnol-ogy Research Asia, 2017, 14(4): 1309-1313 (doi: 10.13005/bbra/2574).
- Crispo M., Dos Santos-Neto P.C., Vilariño M., Mulet A.P., de León A., Barbeito L., Menchaca A. Rapid communication: Nerve growth factor influences cleavage rate and embryo development in sheep. Journal of Animal Science, 2016, 94(10): 4447-4451 (doi: 10.2527/jas.2016-0736).
- Hu S., Ni W., Sai W., Zi H., Qiao J., Wang P., Sheng J., Chen C. Knockdown of myostatin expression by RNAi enhances muscle growth in transgenic sheep. PLoS ONE, 2013, 8(3): e58521 (doi: 10.1371/journal.pone.0058521).
- Zhu H., Hu L., Liu J., Chen H., Cui C., Song Y., Jin Y., Zhang Y. Generation of β-lactoglobulin-modified transgenic goats by homologous recombination. FEBS J., 2016, 283(24): 4600-4613 (doi: 10.1111/febs.13950).


