Риски развития возрастной макулярной дегенерации и светодиодное освещение
Автор: Капцов В.А., Дейнего В.Н.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Аналитические обзоры
Статья в выпуске: 4 (20), 2017 года.
Бесплатный доступ
Спектральный состав света окружающей среды может существенным образом влиять на риски раннего проявления различных болезней глаз. Представлены механизмы развития возрастной макулярной дегенерации и роли глазного липофусцина. Рассмотрены модели прогнозирования накопления липофусцина и методология их формирования. С учетом особенностей светодиодного освещения и его возрастного восприятия сформулирована математическая модель прогнозирования накопленного количества липофусцина А2Е, которая учитывает генерацию активных форм кислорода при снижении эффективности антиоксидантной защиты клеток в световой среде с повышенной дозой синего света. Показано, что в условиях синего света эффективность супероксиддисмутазы, каталазы и глутатионпероксидазы 1 (GPХ 1) в диапазоне 445 нм (± 10 нм) существенно падает, что увеличивает риски снижения сопротивляемости клеток к воздействию некомпенсированных активных форм кислорода. Эти процессы, происходящие в течение длительного времени, могут привести к появлению ранней возрастной макулярной дегенерации. По математическим расчетам в ближайшее время резко возрастет доля пациентов с возрастной макулярной дегенерацией в возрасте 30-40 лет, что соответственно увеличит долю инвалидов по зрению к 50-60-летнему возрасту. Показано, что если механизмы снижения рисков раннего развития возрастной макулярной дегенерации не будут найдены в обозримом будущем, расходы на решение проблем нарушения зрения будут продолжать резко расти. Если в 2012 г. в мире было потрачено около $ 140 млрд, то на решение проблем, связанных со зрением, в 2050 г. потребуется около $ 377 млрд.
Возрастная макулярная дегенерация, липофусцин, антиоксидантная защита клеток, профилактика глазной патологии, световая среда, светодиодное освещение, синий свет
Короткий адрес: https://sciup.org/142212840
IDR: 142212840 | УДК: 614/5: | DOI: 10.21668/health.risk/2017.4.14
Текст обзорной статьи Риски развития возрастной макулярной дегенерации и светодиодное освещение
Экономические последствия развития не-оваскулярной ВМД значительны для пациентов, их семей и системы здравоохранения (снижение качества жизни, потеря независимости, инвалидизация). Оценка экономических потерь от инвалидизации населения изложена в приказах Минэкономразвития России, Минздравсоцразвития России, Минфина России, а также в приказе Росстата № 113 от 10.04.2012 г. «Об утверждении Методологии расчета экономических потерь от смертности, заболеваемости и инвалидизации населения»1.
Известно, что патогенез ВМД основан на нарушении окислительно-восстановительного баланса в сетчатке глаза. Главную роль в этом процессе играют свободные радикалы, которые образуются в структурах сетчатки при постоянном воздействии активных форм кислорода и света. Активные формы кислорода образуются в результате воздействия внешних факторов и зрительного цикла – А2Е (бис-ретинилиден-этаноламин), который при определенной накопленной концентрации в культуре ткани пигментного эпителия и воздействии синего света генерирует активные формы кислорода [20]. В конечном итоге этот процесс приводит к гибели клеток и развитию возрастной деградации сетчатки глаза, болезни Штаргардта, различных ретинопатий и других опасных заболеваний зрения [9].
В ретинальном пигменте эпителия (РПЭ) липофусцин находится в виде сферических частиц микронной величины и характеризуется собственной желтой флуоресценцией при возбуждении синим светом , которое приводит к образованию активных промежуточных форм кислорода.
На рис. 1 приведены результаты распределения флуоресценции липофусцина в сетчатке людей разных возрастных групп.
Группой исследователей были оценены риски, рассчитанные с помощью множественного логистического регрессионного анализа, рассмотрены генетические и экологические факторы риска (курение, гипертония, индекс массы тела, диабет) для разных возрастных групп [14]. Учеными были проанализированы различные возрастные группы (<70, 70–79 и 80–89 лет, а также неагенетики) для вариантов риска с генами CFH (фактор комплемента человека с генетической восприимчивостью к ВМД и ARMS2 с возрастной восприимчивостью). Считается, что вероятность ВМД в основном повышают три основных фактора: полиморфизм гена CFH (генетический маркер Т1204С) – 43 %, полиморфизм гена ARMS2 (генетический маркер G205T) – 36 %, курение – 20 %. У гомозигот по измененным (минорным) аллелям генов CFH и ARMS2 риск заболеть ВМД в 50 раз больше, чем у носителей основных аллелей [14].
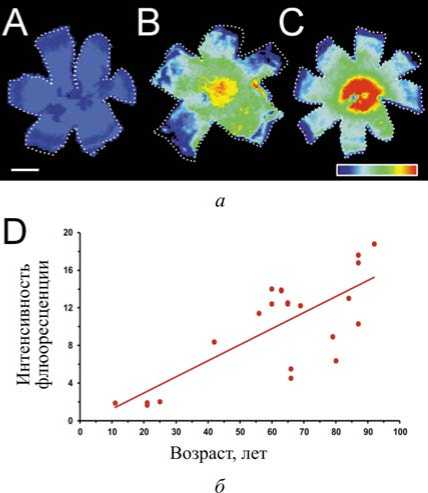
Рис. 1. Пространственное распределение флуоресценции липофусцина в глазу человека: а – флуоресцентные изображения всего пигментного эпителия сетчатки у пациентов разных возрастных групп:
A – 21-летние, B – 41-летние и С – 65-летние; изображения записывались с помощью биолюми-несцентной системы формирования изображений с фильтром излучения от 575 до 650 нм (DC красный фильтр); б – измеренная общая интенсивность флюоресценции липофусцина (DC красный фильтр) увеличивается с возрастом [19]
На основе ступенчатой логистической регрессии для генетических и экологических факторов оценки риска были рассчитаны риски для ВМД с использованием взаимоувязанных трех уравнений логистической регрессии:
logit (p1) = log (p1/[1 – р1]) = = b0 + b1·ARMS2 + b2·CFH, logit (р2) = log (р2/[1 – p1]) = b0 + b1·smoking + + b2·bepertension + b3·BMI + b4·diabetes + b5·sex, logit (р3) = log (р3/[1 – р2]) = b0 + b1·ARMS2 + + b2·CFH + b1·smoking + b2·bepertension + + b3·BMI + b4·diabetes + b5·sex, где p1 – риск для ВМД с учетом генетического влияния;
-
р 2 – риск для ВМД с учетом воздействия окружающей среды;
-
р 3 – риск для ВМД с учетом генетического и экологического воздействия.
Оценка вероятности ВМД для каждого показателя риска учеными рассчитывалась с помощью уравнения P = exp (logit[ P ]) / (1 + exp [logit { P }]) с учетом степени влияния внешних факторов. Авторами подробно изложена методика оценки рисков, а оценка значимости факторов определена на следующем массиве данных о пациентах: 2737 человек (1204 – контроль, 1433 – опыт), в том числе 166 неагенетиков (52 – контроль, 114 – опыт). Определены однонуклеотидные полиморфизмы (SNP) в генах ARMS2 и CFH. Авторы статьи считают, что генетические и возрастные факторы риска оказывают значительно меньшее влияние на развитие ВМД у неагенети-ков, в то время как факторы окружающей среды сохраняют аналогичный эффект у лиц старших возрастных групп [20].
В своей статье F.C. Delori et al. [12] предложили математические модели для оценки возрастного накопления липофусцина, скорости его накопления и пространственного распределения в сетчатке с учетом меланина. Исследователями установлено, что концентрация меланина в клетках пигментного эпителия меняется с возрастом. На рис. 2 показаны обобщенные результаты проведенной оценки.
На основании регрессионного анализа предложены следующие функциональные зависимости для каждого возраста [12]:
-
♦ F15 - флуоресценция у молодых пациентов (от 15 лет), со всем меланином, расположенным апикально к липофусцину;
-
♦ F65 - флуоресценция у старых субъектов (после 65 лет), у которых меланин равномерно смешивается с липофусцином во всей клетке.
Эти флуоресценции рассчитываются по формулам:
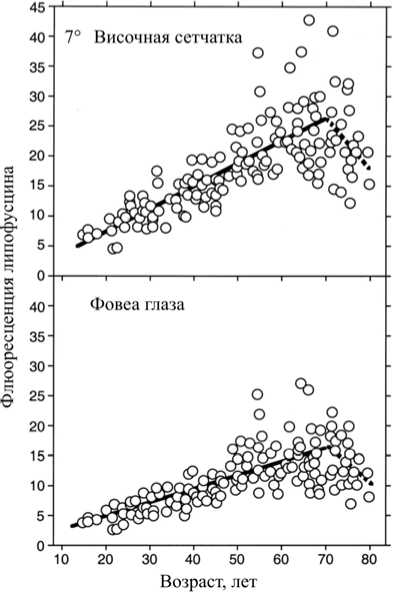
Рис. 2. Флуоресценция липофусцина в зависимости от возраста. Сплошными линиями показаны уравнения линейной регрессии для возраста от 20 до 70 лет ( p < 0,0001); прерванными линиями – уравнения линейной регрессии для возраста от 70 до 80 лет ( p < 0,12)
F 15 = Z d 10 - [ K л+ K 1 ] D 500
или
Z d { 1 - 10 - [ K л+ K 1 ] D 500 }
F 65 = ln(10) [ K л + K i ] D 500 '
Липофусциновая флуоресценция увеличивалась линейно до 70-летнего возраста, затем уменьшалась. Скорость накопления была значительно медленнее в ямке, чем на височном участке; скорости накопления in vivo были выше, чем ранее наблюдалось в микроскопических исследованиях. Флуоресценция была на 40 % ниже в ямке, чем при эксцентриситете 7°, и была асимметрично распределена вокруг ямки. Флюоресценция была максимальной при «11° на виске», «7° на носу», «13° выше» и «9° ниже». При том же эксцентриситете флуоресценция всегда была меньше по нижнему меридиану, чем по любому другому. Поглощение света меланином в пигментном эпителии можно объяснить различием между оценками скорости липофусцина in vivo и ex vivo. Снижаю- щаяся флуоресценция в пожилом возрасте может быть связана с удалением атрофических клеток ретинального пигментного эпителия (РПЭ). Пространственное распределение липофусцина в целом совпадает с пространственным распределением палочек и отражает, но не предсказывает, картину возрастной потери [12]. Из этого положения вытекает важное следствие – площадь пятна засветки сетчатки, которая зависит от диаметра зрачка в данной световой среде, должна быть меньше площади макулы с колбочками, надежно защищенными желтым пятном [5].
В работе J.P. Greenberg [25] измерен количественный показатель автофлюоресценции qAF дна сетчатки у здорового пациента с использованием стандартизованного подхода. Цель работы состояла в том, чтобы установить нормативные данные и определить факторы, влияющие на накопление липофусцина в клетках пигментного эпителия и/или моделировать наблюдаемый сигнал AF в изображениях дна. Изображения AF были получены у 277 здоровых субъектов (возрастной диапазон от 5 до 60 лет) с использованием конфокального сканирующего офтальмоскопа Spectralis (cSLO, 488 нм возбуждение, 30°), оснащенного внутренним флуоресцентным эталоном. Для каждого изображения средний уровень серого был рассчитан как среднее из восьми предустановленных областей и был откалиброван к эталонному, нулевому свету, увеличению и плотности оптических носителей по нормативным данным о спектрах пропускания линз. Были оценены отношения между qAF и возрастом, полом, расой/этничес-кой принадлежностью, цветом глаз, преломле-нием/осевой длиной и статусом курения, а также изучена повторяемость измерения и пространственное распределение qAF. Для этого исследования были использованы уравнения линейной регрессии смешанных эффектов, которые учитывали внутрипредметные корреляции между глазами (Stata, College Station, TX). После опробования различных моделей лучшая линейная диаграмма была получена с экспоненциальной моделью вида:
log (qAFs) = B0 + B1 factor1 + …. + + Bn factorn + Bage log (age), где factor1 и factorn были комбинацией двоичных и непрерывных факторов. Бинарные факторы в модели включали пол, расовую и этническую принадлежность.
Расчеты показали, что уровни qAF значительно увеличивались с возрастом, возрастали с увеличением эксцентриситета со 108 до 158, были выше у женщин, а также различались в зависимости от расовой принадлежности. Никаких ассоциаций с осевой длиной глаза и курением не наблюдалось. Авторы пришли к выводу, что нормальные уровни qAF являются справочным инструментом, необходимым для интерпретации измерений qAF при болезни глаз.
Приведенные выше модели справедливы для прогнозирования А2Е – компонента глазного липофусцина, который начинает накапливаться в клетках пигментного эпителия с первого зрительного цикла и первого взгляда. Для последующего прогнозирования развития ВМД очень важно знать первоначальное накопление липофусцина за первые пять лет жизни, пока формируется защитное желтое пятно и ресничная мышца.
На рис. 3 представлены возрастные группы пациентов, обследованных в 1978 г. Пациенты были разбиты на две группы по критерию цветовой температуры световой среды, в которой они родились и провели первые пять лет жизни. Первая группа – родились и прожили первые пять лет в световой среде с цветовой температурой 2700 К (источник света лампы накаливания с малой дозой синего света). Вторая группа – родились в световой среде с цветовой температурой 4000–6000 К (люминесцентные лампы с большей дозой синего света) и прожили первые пять лет в условиях люминесцентных ламп и ламп накаливания.
Рождались при свете ЯЛ
Рождались при свете ЛН *
Измерения проводились 1 в 1978 г.
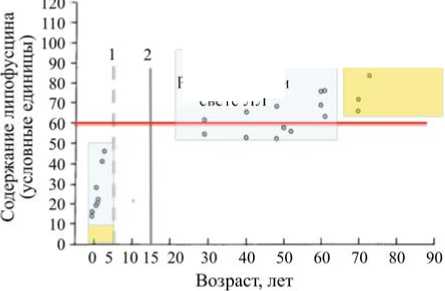
Рис. 3. Содержание липофусцина в общем количестве RPE в зависимости от возраста [32] ( 1 – желтое пятно формируется до пятилетнего возраста, 2 – момент завершения формирования ресничной мышцы)
В настоящее время дети рождаются в световой среде с цветовой температурой более 4000 К, а проживают первые пять лет «в обнимку» со светодиодными игрушками и экранами устройств отображения информации. Все они получают повышенную дозу синего света на ранних этапах жизненного пути, а следовательно, и высокий уровень накопленного липофусцина с риском раннего развития ВМД.
E. Kitchel и M. Ed [18] приводят обзор эволюционных этапов причин повышенных рисков возникновения ВМД, среди которых повышенная доза синего света в спектре солнечного света рассматривается как идентифицированный фактор риска для катаракты и ВМД. Так, у 838 лодочников Чесапикского залива, которые большую часть времени проводили при ярком солнечном свете на воде, была выявлена значительная корреляция ( p = 0,05) между их работой в течение предыдущих 20 лет и тяжелой формой катаракты и деградацией желтого пятна. По сравнению с контролем, пациенты с ВМД были значительно более подвержены воздействию синего света, но в равной степени подвержены воздействию УФ-излучения [13, 18].
При исследовании глазного дна у 5000 человек в возрасте от 43 до 84 лет выявлена зависимость количества времени, проведенного на открытом воздухе (между 13 и 19 годами и 30 и 39 годами), с развитием как раннего, так и «позднего» ВМД [31].
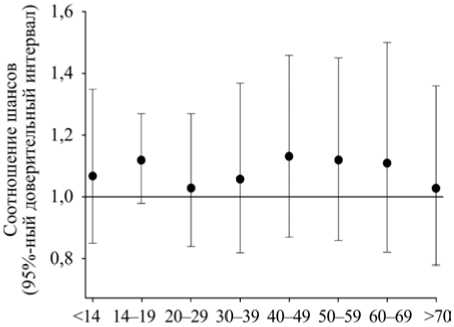
Для определения корреляции между синим воздействием и влажной ВМД у пациентов с более низким уровнем антиоксидантов было обследовано 4753 участника в возрасте 65 лет и старше (рис. 4). У всех обследованных фотографировали сетчатку глаз. Участники были опрошены о времени пребывания под воздействием солнечного света и сдали кровь для антиоксидантного анализа. Измерение синего света оценивалось путем объединения метеорологических данных и анкетирования [26].
В следующем исследовании принимали участие 4753 человека в возрасте 65 лет и старше, среди которых данные о воздействии солнечных лучей и антиоксидантов были доступны у 101 человека с неоваскулярной ВМД, у 218 – с ранней ВМД. Контрольную группу составили 2117 человек. В ходе исследования связи между синим светом и неоваскулярной или ранней ВМД обнаружено не было. Однако установлена значительная зависимость между воздействием синего света и более высоким риском развития влажной ВМД при низких уровнях витамина С, зеаксантина и витамина Е, которые также были связаны с ранними стадиями ВМД с коэффициентом шансов (OR) около 1,4, или 40 % [29]. Хотя невозможно было установить причинность между воздействием солнечного света и неоваскулярной ВМД. Результаты исследования показали, что люди в общей популяции должны использовать защиту глаз и следовать рекомендациям для получения основных антиоксидантных питательных веществ.
Эпидемиологи постоянно спорят о солнечном свете как факторе риска возрастной дегенерации желтого пятна (ВМД). Мета-анализ 14 объединенных исследований показал, что в 12 исследованиях был сделан вывод о повышенном риске ВМД при воздействии солнечного света ( OD 1,379). Шесть исследований сообщили о значительных рисках, но некоторые ученые считают их недостаточно доказанными и недостоверными [17]. Некоторые авторы связывают потерю естественной синей фильтрации после хирургии катаракты с более высокой распространенностью ВМД [31].
Все вышесказанное доказывает, что на каждом этапе жизненного цикла человека исследователи формируют свои модели для прогнозирования развития ВМД, а также отмечают роль в риске ее возникновения (таблица). Анализ различных моделей и механизмов развития ВМД позволил выявить общие методологические подходы к их построению. Исходя из интересов гигиенической науки (какие гигиенические меры необходимо предпринять с целью исключения негативного протекания того или иного процесса?), можно предложить модель, иллюстрирующую процесс омоложения рисков ВМД (той или иной тяжести).
Возраст, лет
Рис. 4. Соотношение шансов и доверительные интервалы воздействия blue light [29]
Характеристика этапов развития возрастной макулярной дегенерации [12, 14, 18, 25, 32]
|
Параметр |
Характеристика |
|
Временная этапность процесса |
Весь жизненный цикл человека делится на временные этапы по критериям, которые определяют исследователи процессов ВМД |
|
Индивидуальность и последовательность этапов |
Каждый этап характеризуется своим уровнем накопленного количества А2Е. Скорость накопления описывается математическими моделями исходя из специфических особенностей текущего временного этапа |
|
Непрерывность процесса |
Результаты предыдущего этапа являются начальными условиями для последующего этапа. Количество накопления А2Е на текущем этапе суммируется с количеством накопленного А2Е на предшествующем временном этапе |
Исходя из сформулированной целевой функции гигиенического подхода, математическую модель поэтапного накопления А2Е для прогнозирования ВМД можно представить как
KΣА2Е = Σ (Аi + Bi Δti), где i – текущий номер этапа из ряда 1, 2, 3…. n; n – количество этапов, на которые разбит жизненный цикл человека по определенным критериям (длительность нахождения в световой среде родильного дома, домашняя световая среда, дошкольные учреждения, школа, учреждения образования, производство). С гигиенической точки зрения этими критериями являются: а) моменты завершения формирования защитных элементов структур зрительного анализатора, связанные с возрастными особенностями (завершение формирования желтого пятна, мышечной системы аккомодационного аппарата); б) момент начала деградационных процессов, связанных с возрастом;
А i – количество А2Е, накопленного на момент начала i -го этапа, вычисляется по формуле
А i = Σ ( A i –1 + B i –1 Δ t i –1 );
Δ t i –1 – продолжительность i- го этапа;
В i – скорость образования А2Е на i -м этапе.
Под воздействием синего света процесс образования А2Е генерирует активные формы кислорода. В это время важна эффективность работы антиоксидантной защиты (формирование желтого пятна для защиты макулы сетчатки и эффективного синтеза супероксиддисмутазы при увеличенной экспозиции активных форм кислорода). Так, J.M. McCord et al. [30] в своей работе показывает, что клетки с недостаточным содержанием супероксиддисмутазы необычайно чувствительны к кислородному отравлению.
Учитывая вышесказанное, нами предлагается модель прогнозирования скорости омоложения ВМД в условиях повышенной дозы синего излучения в спектре света. Эта доза в современных условиях увеличивается по мере массового внедрения светодиодного освещения, а эффективность его негативного воздействия нарастает по мере внедрения этого освещения в роддомах, дошкольных учреждениях, школах, на производстве и в быту. Обобщенная модель представлена на рис. 5.
Прогнозируемый уровень «омоложения» ВМД в условиях повышенной дозы синего излучения в спектре света
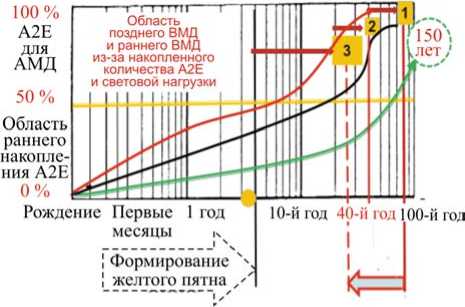
Рис. 5. Скорость развития ВМД
Потенциальный ресурс работы человеческих органов превышает привычные 60–80 лет раза в два. Но человеческое тело при нарушении гигиенических правил и нахождении в условиях современной окружающей среды деградирует значительно быстрее. Мозг человека может функционировать в течение 200 лет, глаза, легкие и сердце могут служить до 140 лет, печень – до 120 лет, почки – до 130 лет, мышцы – до 150 лет [8].
Человеческий организм стареет, потому что почти каждый акт его взаимодействия с окружающей средой заканчивается стрессом на том или ином уровне. Результатом какого-либо стресса являются активные формы кислорода, которые должны быть компенсированы антиоксидантной системой.
В нашей модели накопления А2Е и прогнозирования момента раннего наступления
ВМД рассмотрено состояние антиоксидантной защиты через эффективность ее работы в конкретной световой среде. В математических моделях учитывались многие воздействующие факторы, но не рассчитывалось состояние антиоксидантной защиты (супероксиддисмутазы, каталазы) и эффективность ее работы в световой среде с искусственными источниками освещения, спектр которых отличается от солнечного света [12, 14, 18, 25, 32]. Раскроем более подробно это важное положение для понимания образования ВМД в условиях светодиодной световой среды.
Современная искусственная световая среда формируется приборами освещения и устройствами отображения информации. Для выявления закономерностей и критических длин волн (дозы синего света), воздействующих на зрительный анализатор (образований А2Е), следует рассмотреть общий вид спектров источников искусственного света современной световой среды (рис. 6).
Из графиков видно, что все современные искусственные источники характеризуются повышенной дозой излучения в области синего света (460 нм), провалом в области синебирюзового (480–500 нм), а также отсутствием света (380 нм), участвующего в зрительном цикле и получении родопсина из витамина А.
Если в настоящее время светодиодное освещение директивно, без одобрения офтальмологов, только внедряется, то аналогичная по спектру подсветка экранов устройств отображения информации уже «синюшным» светом освещает лица и глаза почти всех детей России. При полном молчании главных офтальмологов страны производители светодиодного освещения, основываясь на заключениях экспертов SCHEER, говорят, что уровни низкоинтенсивного излучения находятся ниже порога поражения сетчатки, который определяется по Icnirp Guidelines: Оn limits of exposure to laser radiation of wavelengths between 180 nm and 1,000 μm2 и Icnirp Statement: On Light-Emitting Diodes (Leds) And Laser Diodes: Implications For Hazard As-sessment3.
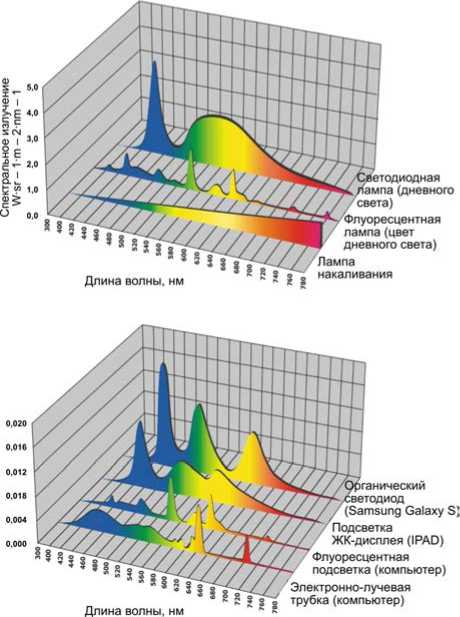
Рис. 6. Общий вид спектров света световых приборов
В настоящее время Научный комитет по рискам для здоровья и окружающей среды (SCHEER) опубликовал предварительное заключение «Потенциальные риски для здоровья человека светоизлучающих диодов (светодиоды)», от 6 июля 2017 г.4. В разделе 6.5 «Основы глазной оптики» эксперты сделали следующий вывод: «Несмотря на то, что нет надежных данных для оценки риска безопасности жизни при использовании светодиодных источников света, может возникнуть некоторая обеспокоенность в отношении потенциальных негативных последствий выбросов светодиодов, особенно у восприимчивой популяции, которая уже представляет ранние признаки патологического старения макулы. Однако следует подчеркнуть, что эти проблемы проистекают из результатов, полученных в экспериментальных моделях животных или моделях культуры клеток, с использованием уровней воздействия, превышающих те, которые, вероятно, будут достигнуты при использовании светодиодных осветительных систем на практике. Воздействие оптического излучения белых светодиодов может привести к серьезному повреждению внешней сетчатки при высоких уровнях воздействия. Спектральное распределение мощности (SPD) и облучение являются факторами риска, которые способствуют фотохимическому повреждению сетчатки. Чтобы предотвратить или уменьшить этот потенциал следует использовать более низкие синие компоненты для внутреннего освещения». В отчет SCHEER в разделе 6.5.2.3 «Задний сегмент глаза» эксперты отмечают, что «Спектр, излучаемый белыми светодиодами, содержит фотоны с энергиями, превышающими порог ферментов, служащих механизмом защиты от стресса»5.
Профессор Джон Маршалл, в своей новой книге «The Blue Light Paradox: Problem or Pana-cea» отмечает, что:
– низкоуровневое светодиодное освещение в течение очень длительных периодов (часы, дни, месяцы) приводило к повреждению сетчатки;
– сине-фиолетовый свет более опасен, чем другие длины волн;
– светодиоды имеют высокие спектральные выбросы в синем диапазоне на уровнях, которые могут оказывать кумулятивное воздействие в течение жизни человека;
– фототоксичность сетчатки была продемонстрирована несколькими исследованиями для длин волн с высокой энергией, синефиолетового света, вплоть до 455 нм [22].
Пагубность воздействия на зрительный анализатор искусственных источников света наглядно показывают новые исследования офтальмологов по оценке скорости развития миопии в странах, в которых массово внедрены энергосберегающие источники света и компьютерные технологии. Исследования, проведенные в Южной Корее, в которой массово применяются компактные люминесцентные и светодиодные лампы, показали ужасающий результат – 96,5 % всех 19-летних мужчин призывного возраста имеют миопию [24]. От миопии до раннего проявления болезни ВМД один шаг, так как то и другое зарождается при малоинтенсивном свете. Если интенсивность света не поражает клетки сетчатки, то спектр «синюшного света» может понизить эффективность антиоксидантной защиты зрительного анализатора.
Некоторыми исследователями было показано, что низкотемпературный светодиодный свет 4000 К по дозе синего равен солнечному свету с цветовой температурой 6500 К [7]. Устройства отображения информации со светодиодной подсветкой 7000 К по дозе синего эквивалентны солнечному свету при цветовой температуре более 10 000 К. Академик РАН М.А. Островский (Институт биохимической физики РАН им. Н.М. Эммануэля) описывает эти процессы как фотобиологический парадокс зрения, который состоит в том, что свет, являясь носителем зрительной информации, одновременно выступает как фактор риска [6]. Сочетание света и кислорода – необходимое условие для осуществления нормального фоторецепторного процесса. Но в то же время это классические условия, необходимые и достаточные для возникновения и развития в структурах глаза деструктивных фотохимических реакций по механизму свободнорадикального окисления.
По мнению академика М.А. Островского, правомерно выделить две функциональные системы глаза: собственно фоторецепции и защиты от опасности фотоповреждения. Рассматривая проблему фотобиологического парадокса зрения, следует подчеркнуть, что в обоих механизмах – и фоторецепции, и в механизме повреждающего действия света – ключевым звеном является ретиналь. В основе зрительного процесса лежит зрительный цикл (рис. 7).
СВЕТ
Родопсин ------
11 -цис-ретиналь
11-цис- Зрительный Все транс- фосфатиднл.
ретинол цикл ретинолы 1 и z - этаноламин
Норма
Биосинтез А2Е
Все трансретинолы
Фототоксичность
Рис. 7. Зрительный цикл и опасность фотоповреждения
Зрительный цикл обеспечивает эффективное удаление полностью транс-ретиналя из фоторецепторной мембраны с тем, чтобы затем снова вернуть его в эту мембрану, но уже в 11-цисизомерной форме (рис. 7). Только этот изомер обладает способностью «войти», как ключ в замок, в хромофорный центр («хромофорный карман») белковой части молекулы (опсина) и вновь образовать ковалентную химическую связь с 296-м лизиновым аминокислотным остатком в его седьмой α-спирали. Таков, схематично, путь регенерации родопсина, то есть возвращения его в исходное темновое состояние с максимумом оптического поглощения фотонов при 500 нм и других длин волн в сине-бирюзовой части спектра. В этом диапазоне длин волн в спектре светодиодного освещения фотонный поток имеет провал (минимальное значение при 500 нм) по сравнению с солнечным светом. Цикл регенерации родопсина – одно из ключевых событий в процессе темновой адаптации сетчатки [6].
П.П. Зак совместно с М.А. Островским отмечают, что «в результате зрительного цикла в мембране образуется так называемый бис-ретиналиден-фосфатидилэтаноламин (А2ЕРЕ). Судя по всему, он и сам по себе фототоксичен, но главное – он служит предшественником следующего крайне фототоксичного соединения – бис-ретинилиден-этаноламина (в англоязычной литературе pyridinium bisretinoid или сокращенно А2Е)» [4]. При облучении синим светом (<455 нм) фототоксичного соединения – бис-ретинилиден-этаноламин А2Е генерирует активные формы кислорода. Подробно механизмы фототоксичности и важная роль синего света изложены в работах М.А. Островского.
Сетчатка представляет собой среду с высокой кислородной напряженностью, близкой к 70 мм рт. ст. [11], что идеально подходит для развития оксидативного стресса ROS (процесс повреждения клетки в результате окисления). Спектр (с наличием баланса сине-бирюзового света) запускает зрительный цикл, в котором с определенной эффективностью разрушается и восстанавливается родопсин с образованием фототоксичного соединения А2Е – флуорофора липофусциновых гранул, которые накапливаются в культуре ткани пигментного эпителия. При воздействии синего света и определенной концентрации А2Е способен проявлять как детергентные свойства, повреждая, например, наружную митохондриальную мембрану и запуская апоптоз клетки, так и выступать в качестве фотосенсибилизатора свободнорадикального повреждения клетки, что в итоге также способно вызвать ее апоптоз. Парадокс ситуации, когда свет выступает и носителем информации, и потенциально опасным повреждающим фактором, был решен в ходе эволюции созданием достаточно надежной многоуровневой системы защиты от опасности фотоповреждения. Эта система включает:
-
♦ обновление фоторецепторных мембран;
-
♦ комплекс эндогенных антиоксидантов;
-
♦ механизм максимально быстрого удаления свободного ретиналя из зрительной клетки;
-
♦ систему оптических фильтров глаза, в которой ключевую роль играет хрусталик, желтеющий у приматов и человека с возрастом.
Следующая линия защиты – антиоксидантная. Она включает витамины Е (α-токоферол) и С (аскорбиновую кислоту), таурин, набор антиоксидантных ферментов (супероксиддисмута-зу, каталазу, пероксидазу). Эффект усиливают экранирующие пигменты глаза – меланосомы. Меланосома – это органелла, имеющая в составе меланин и другие светопоглощающие пигменты.
Супероксиддисмутаза переводит активные формы кислорода в перекись водорода, затем каталаза превращает перекись в воду. Нет сомнения, что нарушения в этой системе (спектр света – родопсин – антиоксидантная система) приводят к возрастанию риска светового повреждения сетчатки и пигментного эпителия. В отчете SCHEER в разделе 6.5.2.3 «Задний сегмент глаза» эксперты отмечали, что «Спектр, излучаемый белыми светодиодами, содержит фотоны с энергиями, превышающими порог ферментов, служащих механизмом защиты от стресса»6. Приводится всесторонний анализ потенциальных рисков белых светодиодов, с учетом доклинических знаний, а также эпидемиологических исследований и отчетов Французского агентства по предотвращению потенциальной опасности сетчатки тремя системами [21]:
-
1) неферментативные молекулы, такие как тиолы, витамины (E и C), каротиноиды (витамин А);
-
2) поглотители ионов металлов;
-
3) специфические ферменты, такие как су-пероксиддисмутаза (СОД), каталаза.
Молекулы СOД встречаются во всех клетках живого мира, подвергшихся воздействию кислородсодержащей среды, включая эпителиальные (ретинальный пигментный эпителий – РПЭ) клетки сетчатки. Пигментный эпителий сетчатки человека содержит два различных вида супероксиддисмутазы [24]. Показана роль как CuZn-, так и Mn-содержащих форм СОД, которые могут быть важны при очистке супероксидных радикалов, образующихся в митохондриях в качестве побочного продукта кислородного обмена [23].
-
1. Цитоплазматическая (или цитозольная) супероксиддисмутаза (или СОД-1). Функционирует внутри клеток. Ген, ответственный за синтез цитоплазматической супероксиддисму-тазы, локализуется в 21-й хромосоме, в локусе 21q22.1.
-
2. Митохондриальная (СОД-2). Локализуется в митохондриальном матриксе. Ген, ответственный за синтез и функцонирование митохондриальной супероксиддисмутазы, располагается в 6-й хромосоме. Локус 6q25.3.
-
3. Экстраклеточная (СОД-3). Располагается в межклеточном веществе. Ген, ответственный за ее синтез и функцию, локализован в 4-й хромосоме. Его локус – 4p15.3-p15.1.
Супероксиддисмутазы поддерживают стационарную концентрацию супероксидных радикалов на определенном уровне, защищая тем самым клеточные структуры от их повреждающего действия. При этом СОД-1 находится в цитоплазме, СОД-2 – в митохондрии, а СОД-3 – это внеклеточная (экстраклеточная) форма. Первая форма – димерная, тогда как вторая и третья формы – тетрамерные (состоящие из четырех равных субъединиц). СОД-1 и СОД-3 содержат медь в активном центре и цинк как структурный компонент, а СОД-2 – марганец в активном центре. Гены этих форм локализуются соответственно в хромосомах 21, 6 и 4 (21q22.1, 6q25.3 и 4p15.3-p15.1). Цитоплазменная СОД-1 является небольшим белком с молекулярной массой 32,5 кДа, молекулярная масса митохондриальной СОД-2 – около 86–88 кДа. Экстраклеточная СОД-3 представляет собой самую крупную супер-оксиддисмутазу, молекулярная масса – 135 кДа.
Как установили Hassan, Fridovich в 1977 г., усиленный синтез супероксиддисмутазы происходил при увеличенной экспозиции кислорода на факультативные организмы, при повышен- ном образовании внутри клетки переокислен-ных радикалов. Внутриклеточная концентрация супероксиддисмутазы коррелирует с резистентностью клетки к кислородной интоксикации [15]. Реакция, катализируемая СОД, состоит из двух стадий и заключается в переносе электрона с одного супероксидного радикала на другой. Промежуточным акцептором этого электрона служит атом меди, входящий в активный центр СОД:
COД-Cu2+ + HO* => COД-Cu+ + O 2 COД-Cu+ + HO2* => COД-Cu2+ + H 2 O 2 .
Перекись водорода (Н 2 О 2 ) – основной источник самых токсичных радикалов в живых системах – НО-радикалов. Следовательно, снижение уровня Н 2 О 2 приведет к снижению концентрации НО-радикалов. Удаление Н 2 О 2 осуществляют два класса ферментов: каталаза и пероксидаза.
Стадии ферментативного цикла каталазы:
Cat-Fe3+ + H 2 O 2 => Cat-Fe5+ + 2H 2 O
Cat-Fe5+ + H 2 O 2 => Cat-Fe3+ + O 2 .
Специалисты Института биофизики и клеточной инженерии НАН Беларуси провели исследования по оценке влияния синего света на активность супероксиддисмутазы (СОД) и показали, что эта активность по компенсации активных форм кислорода в клетках значительно подавляется [3].
На рис. 8 приведены ранжированные результаты этих исследований.
||||8|||||1||^|||!1|||||1|||1|1||||
Цветовая температура
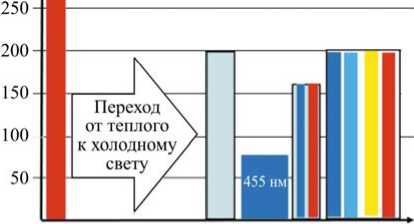
Рис. 8. Изменения общей активности (СОД) в органическом объекте при освещении: красный светодиод 630–650 нм; белый свет – люминесцентная лампа Philips TL-D36W/765 (6200 K); синий светодиод 450–465 нм; синий + красный светодиоды; синий + голубой (465–485 нм) + желтый (590–595 нм) + красный светодиод
Из рассмотрения представленных данных следует, что фотонный поток в диапазоне синего света (450–465 нм) существенно влияет на активность (СОД) по нейтрализации активных форм кислорода. Активность супероксиддис-мутазы (СОД) значительно возрастает при облучении светом от спектрально управляемого светодиодного светильника, построенного с применением синего+голубого (465–485 нм) + жел-того+красного светодиодов. По мере повышения цветовой температуры уменьшается активность супероксиддисмутазы (СОД).
Представляют интерес опыты на лабораторных животных. Так, было установлено, что у мышей с дефицитом СОД-2 повышен уровень A2E и липофусцина, накопленный в РПЭ [28]. Некоторые ученые считают вероятной позитивную роль СОД-2 в профилактике ранней ВМД, которая защищает пигментный эпителий мыши от апоптоза, вызванного окислением [27].
На Ежегодном собрании ARVO, проведенном в Сиэтле 1–5 мая 2016 г., штат Вашингтон, был представлен реферат «Синий свет снижает оксидативный стресс модели ВМД in vitro » [10]. Используя специально разработанную систему освещения, обеспечивающую диапазоны освещения шириной 10 нм в синезеленом диапазоне, было показано, что узкий диапазон 415–455 нм является наиболее токсичным для EE-нагруженных ячеек РПЭ и отображает высокие уровни оксидативного стресса (процесс повреждения клетки в результате окисления). Для дальнейшего понимания механизмов, связанных с этой фототоксичностью, была исследована фотомодуляция основных окислительных стрессовых защит в сине-зеленом диапазоне видимого спектра. Световое облучение было нормализовано по отношению к естественному солнечному свету (6500 К), достигающему сетчатки после того, как он был отфильтрован окулярными структурами ( E max < 1,5 мВт / см²).
При использовании этой модели ВМД in vitro установлено снижение антиоксидантной защиты после воздействия синего света, что может способствовать сопутствующему увеличению активных форм кислорода. Эти результаты доказывают, что синий свет может выступать как индуктор ROS и ингибитор процесса элиминации ROS, что приводит к увеличению окислительного стресса и, следовательно, к гибели клеток. Эти результаты дают более точные знания для предотвращения окислительного стресса, создаваемого синим светом при фотонастройке сетчатки и ВМД.
На рис. 9 приведены обобщенные результаты влияния синего света на:
-
– уровень перекиси водорода от концентрации А2Е;
-
– потенциал митоходрии;
-
– супероксиддисмутазы (СОД-2);
-
– каталазы;
-
– глутатионпероксидазы 1, также известной как GPХ1.
Глутатионпероксидаза функционирует при детоксикации перекиси водорода и является одним из наиболее важных антиоксидантных ферментов у людей, повсеместно экспрессируется во многих тканях, где защищает клетки от окислительного стресса. Внутри клеток она локализуется в цитоплазме и митохондриях, катализирует восстановление других органических гидропероксидов, таких как перекиси липидов, к соответствующим спиртам. GPx1 обычно использует глутатион (GSH) в качестве восстановителя, но и глутатионсинтетаза (GSS), как и в митохондриях головного мозга, может служить восстановителем вместо γ-глутамилцисте-ина. Белок, кодируемый этим геном, защищает от CD95-индуцированного апоптоза в культивируемых клетках рака молочной железы и ингибирует 5-липоксигеназу в клетках крови, а ее избыточная экспрессия задерживает гибель эндотелиальных клеток и повышает устойчивость к токсическим проблемам, особенно окислительному стрессу.
Снижение уровней экспрессии мРНК СОД-2, каталазы и GPX1 наблюдалось после воздействия синего света в течение 15 часов в клетках, нагруженных A2E, по сравнению с необработанными контрольными элементами или A2E-нагруженными клетками, подвергшимися воздействию красного света (среднее ± s.e.m, n = 3).
В митохондриях клеток, облученных синефиолетовым светом (430–440 нм), наблюдалась периядерная кластеризация и глобулярные формы, а их мембранный потенциал значительно уменьшился в клетках РПЭ, вплоть до митохондриальной дисфункции. Низкие уровни экспрессии основных антиоксидантных ферментов были обнаружены после воздействия синего света в присутствии A2E, а высокие уровни перекиси водорода – в клетках, подвергнутых синему свету между 415 и 455 нм, что позволяет считать синий свет идентифицированным фактором риска для ВМД.
В статье О.В. Башариной [1] установлено, что воздействие ультрафиолетового света (240–390 им)
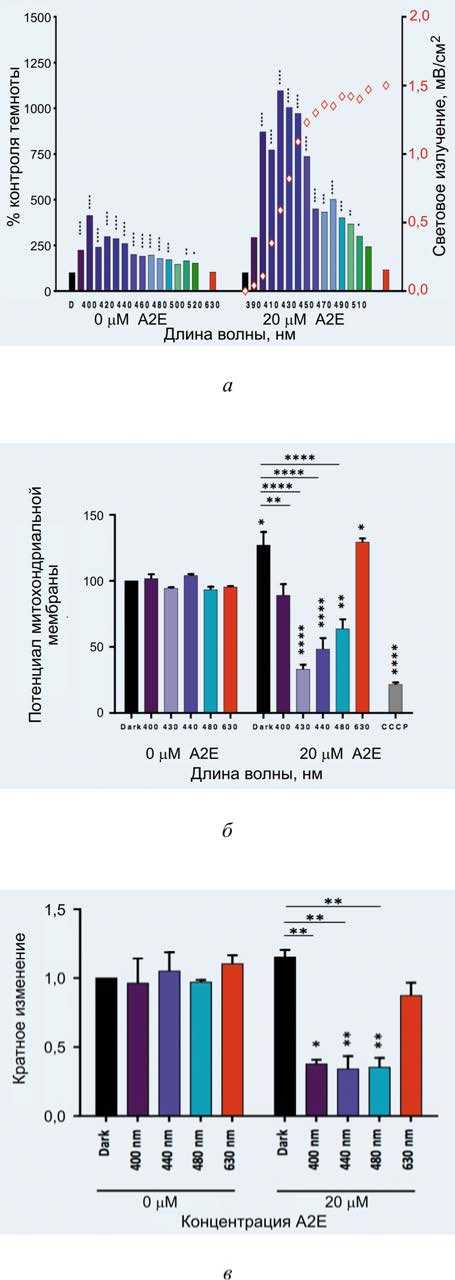
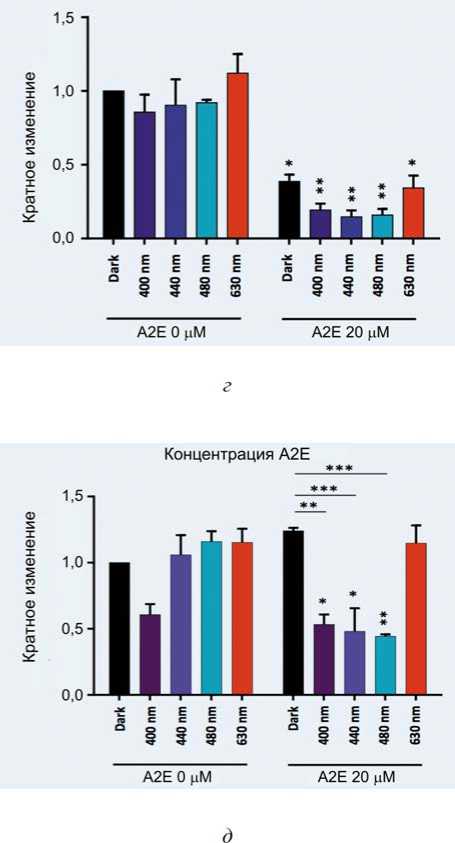
Рис. 9. Влияние синего света на: уровень перекиси водорода от концентрации А2Е; потенциал мито-ходрии; супероксиддисмутазы (СОД-2); каталазы; глутатионпероксидазы-1: а – высокие уровни перекиси водорода были обнаружены в сине-фиолетовом спектре после 15-часового облучения в присутствии A2E по сравнению с темновым контролем и красным светом, особенно между 415–455 нм (среднее ± s.e.m, n = 4); б – потенциал митохондриальной мембраны значительно уменьшился после сине-фиолетового светового воздействия при 440 нм в загруженных A2E клетках (среднее ± s.e.m, n = 3);
в – низкие уровни экспрессии антиоксидантной защиты СОД-2; г – уровни каталазы; д – уровни глутатионпероксидазы-1
в определенных дозах ((4,5–15,1) · 102 Дж/м2 при рН 6,3, (1,5–45,3) · 102 Дж/м2 при рН 9,0 и (1,5–22,6) · 102 Дж/м2 при рН 11,5) приводит к повышению активности супероксиддисмута-зы. При более высоких дозах ультрафиолетового света индуцируется инактивация фермента.
Из анализа приведенных выше материалов следует, что антиоксидантная защита (супероксиддисмутаза) обладает максимумом эффективности при определенных дозах света, а при превышении этого уровня индуцируется инактивация металлосодержащих защитных ферментов.
Итак, спектральный состав света окружающей среды человека может существенным образом влиять на риски раннего проявления ВМД и других болезней глаз. Избыточная доза синего – это разница между дозами при светодиодном освещении относительно гигиенически безопасного солнечного света при заданном уровне освещенности. Учитывая выявленные недостатки белых светодиодов (синий кристалл, покрытый желтым люминофором) и их негативное влияние на зрительный анализатор человека [7], отечественными специалистами уже разработана концепция полупроводниковых источников белого света с биологически адекватным спектром излучения.
Биологически адекватный спектр света – это совокупность фотонных потоков, которые формируют матрицу управляющих сигналов, обеспечивающую гармоничную работу функциональных элементов (клеток) зрительного анализатора, гормональной системы человека и функционирования его мозга.
Биологически адекватная световая среда – это среда, создаваемая полупроводниковыми источниками белого света с биологически адекватным спектром излучения, для минимизации рисков здоровью человека на всех этапах его жизненного цикла. Это определение сформулировано, исходя из вышесказанного и опыта работы по созданию научных основ создания полупроводниковых источников белого света с биологически адекватным спектром излучения.
В ходе реализации работы «Разработка промышленной технологии производства энергоэффективных светодиодных источников белого света с биологически адекватным спектром излучения» специалисты ЗАО «ЭЛТАН» синтезировали спектр белого света без выбросов в области 460 нм и провалов в области 480 нм. На рис. 10 приведен измеренный спектр разработанной лампы.
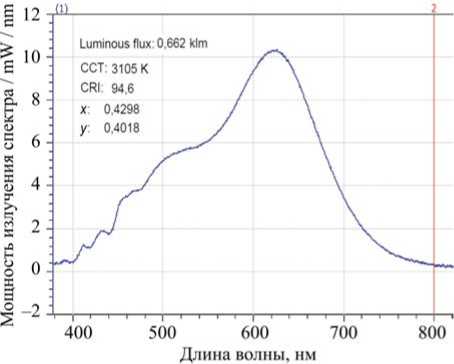
Рис. 10. Спектр света полупроводникового источника с биологически адекватным спектром белого света 3105 К, разработанного в ЗАО «ЭЛТАН»
Данный спектр не имеет вышеуказанных недостатков, присущих спектру стандартного белого светодиода. Разработанная технология защищена патентами России, Европы, Кореи, США и Китая и побудила зарубежных производителей светодиодов провести работы по повышению качества света. И страны, в которых близорукость подростков имеет самые высокие показатели, добились успеха в синтезе полупроводниковых излучателей белого света со спектром, равным спектру гигиенически безопасного солнечного света. Разработанные в Японии и Южной Корее светодиоды второго поколения (провалы и выбросы синего света в спектре не превышают показателей гигиенически безопасного солнечного света) поступают на Европейский светотехнический рынок. Компания ЕuroLighting GmbH (Германия) расширяет свою деятельность по продажам светодиодов корейского производства ALLIX. Белые светодиоды со спектром солнечного света защищены патентами в Европе, Корее, США и Китае. Новый светодиод доступен в двух сериях: Xenoled I и Xenoled II. Разница между обеими сериями заключается в том, что Xenoled I использует синий чип в качестве основы, а в светодиодах серии Xenoled II применяется кристалл, излучающий фиолетовый свет и люминофоры разных цветов. Эти SMD-светодиоды имеют высокий CRI – до 98, и в их спектре отсутствуют синие пики (выбросы) 450–460 нм и провалы в области 480 нм (рис. 11).
Наличие выброса в спектре светодиодов серии Xenoled II требует применения в светодиодной лампочке дополнительной конструк-
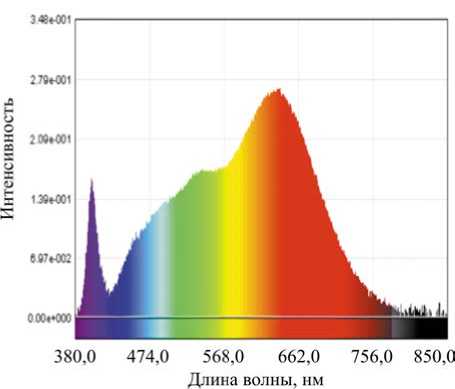
Рис. 11. Спектр белого света при 3000 К, излучаемого светодиодом, серия Xenoled II тивной защиты. Но в целом светодиоды этой серии излучают почти солнечный свет при уменьшенной опасности синих всплесков.
Полупроводниковые источники света, излучающие белый свет с биологически адекватным спектром, после соответствующей гигиенической сертификации с участием офтальмологов могут найти применение в качестве источников света для формирования здоровой световой среды для детей и взрослых.
Выводы:
-
1. Для опережающего прогнозирования риска развития ранней ВМД целесообразна разработка математических моделей с целью оценки безопасности новых искусственных источников света, предлагаемых к внедрению в образовательные и медицинские учреждения.
-
2. Существующие математические модели прогнозирования уровня А2Е глазного липофусцина не учитывают влияния синего света на эффективность антиоксидантной защиты и цветовую температуру световой среды с момента рождения и первых пяти лет жизни.
-
3. Следует учитывать особенности и время нахождения в световой среде с различными искусственными источниками, различающимися по спектру и цветовой температуре, при разработке профилактических мероприятий для лиц разного возраста.
-
4. Массовое внедрение светодиодного освещения и устройств отображения информации с подсветкой с повышенной долей синего света 450–460 нм и провалом в области 480 нм увеличит риски возникновения АМД уже к возрасту 30–40 лет, что в обозримом будущем может привести к росту расходной части бюджета государства вследствие инвалидизации населения по зрению.
Список литературы Риски развития возрастной макулярной дегенерации и светодиодное освещение
- Башарина О.В., Артюхов В.Г. Анализ фотоиндуцированных структурно-функциональных изменений супероксиддисмутазы//I Всероссийская конференция фотобиологов: тезисы докладов на конференции. -Пущино: ОНТИ, 1996. -C. 62-63 с.
- Болбас З.В., Василевская Н.А., Чикун Е.А. Возрастная макулярная дегенерация: фактор роста эндотелия сосудов VEGF, шаперон RPE65 и рецепторы семейства ppar как перспективные мишени лекарственной терапии [Электронный ресурс] // Интернет-сессия: всероссийская образовательная интернет-программа для врачей. - 2011. - URL: https://internist.ru/publications/detail/vozrastnaya-makulyarnaya-degeneraciya:-faktor-rosta-endoteliya-sosudov-vegf,-shaperon-rpe65-i-receptory-semeystva-ppar-kak-perspektivnye-misheni-lekarstvennoy-terapii/ (дата обращения: 18.04.2017).
- Вязов Е.В., Шалыго Н.В. Влияние спектрального состава светодиодного излучения на активность антиоксидантных ферментов и накопления защитных белков в растениях огурца//Доклады национальной академии наук Белоруси. -2015. -Т. 59, № 2. -С. 87-92.
- Зак П.П., Островский М.А. Потенциальная опасность освещения светодиодами для глаз детей и подростков//Светотехника. -2012. -№ 3. -С. 4-6.
- Капцов В.А., Дейнего В.Н. Синий свет светодиодов -новая гигиеническая проблема//Анализ риска здоровью. -2016. -№ 1. -С. 15-25.
- Островский М.А. Фотобиологический парадокс зрения . -URL: http://www. library.biophys.msu.ru/PDF/3353.pdf (дата обращения: 17.08.2017).
- Профилактика глазных заболеваний у детей и подростков в учебных помещениях со светодиодными источниками света первого поколения/В.Н. Дейнего, В.А. Капцов, Л.И. Балашевич, О.В. Светлова, Ф.Н. Макаров, М.Г. Гусева, И.Н. Кошиц//Российская детская офтальмология. -2016. -№ 2. -С. 57-72.
- Смагин В.А. Геронтология и теория надежности о долговечности человека //Компания открытых систем. -URL: http://sir35.narod.ru/Cmagin/K015/Ger.htm (дата обращения: 12.05.2017).
- Соколов А.В. Изучение воздействия продуктов зрительного цикла на бислойные липидные мембраны: дис. … канд. биол. наук: 03.00.02. -М., 2009. -143 с.
- Blue light decreases oxidative stress defenses in an in vitro model of AMD / M. Marie, C. Barrau, P. Gondouin, Th. Villette, D. Cohen-Tannoudji, J. Sahel, S. Picaud [Электронный ресурс]. - URL: https://www.google.ru/url? sa=t&rct=j&q=&esrc=s&source=web&cd=4&ved=0ahUKEwjToMmaqd7XAhWIHpoKHRMMAskQFghDMAM&url=http%3A%2F%2Fwww.pointsdevue.com%2Fsites%2Fdefault%2Ffiles%2Fposter-arvo-2016.pdf&usg=AOvVaw 0zmMf5q4uBHkebESmEebMH (дата обращения: 18.06.2017).
- Boulton M., Rozanowska M., Rozanowski B. Retinal photodamage//Journal of Photochemistry and Photobiology. -2001. -Vol. 64, № 2-3. -P. 144-161.
- Delori F.C., Goger D.G., Dorey C.K. Age-Related Accumulation and Spatial Distribution of Lipofuscin in RPE of Normal Subjects//Investigative Ophthalmology & Visual Science. -2001. -Vol. 42, № 8. -P. 1855-1866.
- Effect of Ultraviolet Radiation on Cataract Formation/H.R. Taylor, S.K. West, F.S. Rosenthal, B. Munoz, H.S. Newland, H. Abbey, E.A. Emmett//The New England Journal of Medicine. -1988. -Vol. 319. -P. 1429-1433 DOI: 10.1056/NEJM198812013192201
- Genetic and Environmental Risk Factors for Age-Related Macular Degeneration in Persons 90 Years and Older/L. Ersoy, T. Ristau, M. Hahn, M. Karlstetter, T. Langmann, K. Droge, A. Caramoy, A.I. den Hollander, S. Faus//Investigative Ophthalmology & Visual Science. -2014. -Vol. 55, № 3. -P. 1842-1847 DOI: 10.1167/iovs.13-13420
- Hassan H.M., Fridovich I. Regulation of the synthesis of superoxide dismutase in Escherichia coli. Induction by methyl viologen//J. Biol. Chem. -1977. -Vol. 252, № 21. -P. 7667-7672.
- Human retinal pigment epithelium contains two distinct species of superoxide dismutase/D.A. Newsome, E.P. Dobard, M.R. Liles, P.D. Oliver//Investigative Ophthalmology & Visual Science. -1990. -Vol. 31. -P. 2508-2513.
- Is sunlight exposure a risk factor for age-related macular degeneration? A systematic review and meta-analysis /Guo-Yuan Sui, Guang-Cong Liu, Guang-Ying Liu, Yan-Yan Gao, Yan Deng, Wen-Ying Wang, Shu-Hui Tong, Lie Wang//British Journal of Ophthalmology. -2013. -Vol. 97, № 4. -URL: http://bjo.bmj.com/content/97/4/389 (дата обращения: 07.07.2017).
- Kitchel E., Ed M. The Effects of Blue Light on Ocular Health //Texas School for the Blind and Visually Impaired. -URL: http://www.tsbvi.edu/instructional-resources/62-family-engagement/3654-effects-of-blue-light (дата обращения: 26.06.2017).
- Lack of Correlation Between the Spatial Distribution of A2E and Lipofuscin Fluorescence in the Human Retinal Pigment Epithelium/Z. Ablonczy, D. Higbee, D.M. Anderson, M. Dahrouj, A.C. Grey, D. Gutierrez, Y. Koutalos, K.L. Schey, A. Hanneken, R.K. Crouch//Investigative Ophthalmology & Visual Science. -2013. -Vol. 54, № 8. -P. 5535-5542.
- Lamb L.E., Simon J.D. A2E: A Component of Ocular Lipofuscin//Photochemistry and Photobiology. -2004. -Vol. 79, № 2. -P. 127-136.
- Light-emitting diodes (LED) for domestic lighting: Any risks for the eye?/F. Behar-Cohen, C. Martinsons, F. Viénot, G. Zissis, A. Barlier-Salsi, J.P. Cesarini, O. Enouf, M. Garcia, S. Picaud, D. Attia//Prog. Retin. Eye. Res. -2011. -Vol. 30, № 4. -P. 239-257 DOI: 10.1016/j.preteyeres.2011.04.002
- Marshall J. The Blue Light Paradox: Problem or Panacea //Mivision: Bringing Optics into Focus. -2017. -URL: https://www.mivision.com.au/the-blue-light-paradox-problem-or-panacea (дата обращения: 12.08.2017).
- Oliver P.D., Newsom D.A. Mitochondrial Superoxide Dismutase in Mature and Developing Human Retinal Pigment Epithelium//Investigative Ophthalmology & Visual Science. -1992. -Vol. 33, № 6. -P. 1909-1918.
- Prevalence of Myopia and its Association with Body Stature and Educational Level in 19-Year-Old Male Conscripts in Seoul, South Korea/S.-K. Jung, J.H. Lee, H. Kakizaki, D. Jee//Invest. Ophthalmol. Vis. Sci. -2012. -Vol. 53, № 9. -P. 5579-5583 DOI: 10.1167/iovs.12-10106
- Quantitative Fundus Autofluorescence in Healthy Eyes/J.P. Greenberg, T. Duncker, R.L. Woods, R.T. Smith, J.R. Sparrow, F.C. Delori//Investigative Ophthalmology & Visual Science. -2013. -Vol. 54, № 8. -P. 5684-5693 DOI: 10.1167/iovs.13-12445
- Retina is Vulnerable to Effects of Blue Light //ScienceBased Health. -URL: http://www.sciencebasedhealth.com/EUREYE-Study-Blue-Light-Exposure-Low-Antioxidants-Increase-AMD-Risk-W27.aspx (дата обращения: 07.07.2017).
- SOD2 knockdown mouse model of early AMD/V. Justilien, J.J. Pang, K. Renganathan, X. Zhan, J.W. Crabb, S.R. Kim //Investigative Ophthalmology & Visual Science. -2007. -Vol. 48. -P. 4407-4420.
- SOD2 protects against oxidation-induced apoptosis in mouse retinal pigment epithelium: implications for age-related macular degeneration/E. Kasahara, L.R. Lin, Y.S. Ho, V.N. Reddy//Investigative Ophthalmology & Visual Science. -2005. -Vol. 46. -P. 3426-3434.
- Sunlight exposure, antioxidants, and age-related macular degeneration/A.E. Fletcher //Archives Ophthalmology. -2008. -Vol. 126. -P. 1396-1403.
- Superoxide and superoxide dismutase/J.M. McCord, C.O. Beauchamp, S. Goscin, H.P. Misra, I. Fridovich//Oxidases and Related Redox Systems; In: T.E. King, H.S. Mason, M. Morrison, eds. -Baltimore: University Park Press, 1973. -Vol. 1. -P. 51-76.
- Villette Th., Lawrenson J. BLUE LIGHT: A review of the evidence on the potential benefits and harms of blue-filtering lenses [Электронный ресурс]. - London, 2016. - URL: https://www.google.ru/url? sa=t&rct=j&q= &esrc=s&source=web&cd=1&ved=0ahUKEwjXuu2y_93XAhWpNpoKHZcrD8AQFggnMAA&url=https%3A%2F%2Fwww.college-optometrists.org%2Fasset%2F08136AA5-480B-46DE-98375A2DD001B8C7%2F&usg= AOvVaw3UH48IykcSdwSfWosX0V7R (дата обращения: 10.07.2017).
- Wing G.L., Blanchard G.C., Weiter J.J. The topography and age relationship of lipofuscin concentration in the retinal pigment epithelium//Invest. Ophthalmol. Vis. Sci. -1978. -Vol. 17, № 7. -P. 601-607.


