Роль ассистирующих методов при внутрисосудистой окклюзии аневризм головного мозга
Автор: Кандыба Дмитрий Вячеславович, Бабичев Константин Николаевич, Савелло Александр Викторович, Ландик Сергей Александрович, Свистов Д.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ангионеврология и нейрохирургия
Статья в выпуске: 3 т.16, 2012 года.
Бесплатный доступ
Проанализированы 270 эмболизированных аневризм у 260 пациентов. В зависимости от метода окклюзии аневризм головного мозга были выделены три группы пациентов. Пациентам I группы была выполнена эмболизация аневризм без использования ассистирующих методов. Во II группе пациентов использовалась баллон-ассистенция. У пациентов III группы аневризмы выключены из кровотока в условиях стент-ассистенции. Использование стента уменьшало влияние геометрии аневризм головного мозга на качество окклюзии: радикальность операции не зависела от объема и размеров шейки аневризмы, а также слабо зависела от плотности паковки. Применение ассистирующих методов позволяет радикально выключить из кровотока аневризмы с неблагоприятной геометрией, представляющих проблему для техники традиционной эмболизации.
Аневризма головного мозга, баллон-ассистенция, стент-ассистенция, плотность паковки
Короткий адрес: https://sciup.org/142140486
IDR: 142140486 | УДК: 616.1
Текст научной статьи Роль ассистирующих методов при внутрисосудистой окклюзии аневризм головного мозга
Военно-медицинская академия им. С.М. Кирова, 194044, Санкт-Петербург, Пироговская наб., 3, dv-kandyba@mail. ru
ВАК 14. 01.18
Поступила в редакцию 20 июля 2012 г.
К.Н. Бабичев,
А.В. Савелло,
С.А. Ландик,
Д.В. Свистов, 2012
Проанализированы 270 эмболизированных аневризм у 260 пациентов. В зависимости от метода окклюзии аневризм головного мозга были выделены три группы пациентов. Пациентам I группы была выполнена эмболизация аневризм без использования ассистирующих методов. Во II группе пациентов использовалась баллон-ассистенция. У пациентов III группы аневризмы выключены из кровотока в условиях стент-ассистенции. Использование стента уменьшало влияние геометрии аневризм головного мозга на качество окклюзии: радикальность операции не зависела от объема и размеров шейки аневризмы, а также слабо зависела от плотности паковки. Применение ассистирующих методов позволяет радикально выключить из кровотока аневризмы с неблагоприятной геометрией, представляющих проблему для техники традиционной эмболизации. Ключевые слова: аневризма головного мозга; баллон-ассистенция; стент-ассистенция; плотность паковки.
Современную тенденцию развития сосудистой нейрохирургии ярко характеризует рост абсолютного числа и доли внутрисосудистых вмешательств по поводу аневризм головного мозга (АА) как после кровоизлияния, так и в догеморрагический период [3, 12]. В настоящее время рекомендательные протоколы отдают предпочтение применению внутрисосудистых методов в случаях неразорвавшихся аневризм (НА), в холодном периоде кровоизлияния, а также в остром периоде в тех случаях, если существует возможность выполнения как клипирования, так и эмболизации аневризмы [12]. Эта тенденция обусловлена меньшей операционной травмой внутрисосудистых вмешательств при достаточной эффективности окклюзии, превышающей 90%, что приводит к снижению госпитальной летальности и улучшению отдаленных показателей лечения пациентов с АА [3].
Расширяются показания к эмболизации анатомически сложных АА, но при этом остается высокий риск реканализации или роста аневризм после внутрисосудистой окклюзии [2, 6, 11]. Частота неудовлетворительных результатов в отдаленном периоде преимущественно определяется морфологией аневризмы. К морфологическим факторам, влияющим на стабильность окклюзии, относятся размеры купола и шейки
АА, плотность паковки, локализация АА в бассейне внутренней сонной артерии (ВСА) [8]. Существенна роль эффективной коррекции артериальной гипертензии [8].
Наиболее значимым прогностическим фактором стабильности окклюзии АА является размер шейки аневризмы, увеличение которого отрицательно влияет как на эффективность первичной окклюзии, так и на отдаленные исходы [2]. Так, при размере шейки АА более 4 мм частота реканализации возрастает в 4 раза, по сравнению с аневризмами с узкой шейкой. Большой размер аневризмы снижает вероятность достижения радикальной первичной окклюзии, а также часто приводит к реканализации, которая отмечается в 35–87% при крупных и гигантских аневризмах (ГА) [11]. Независимо от размера/объема купола АА, плотная паковка микроспиралей, превышающая 24% от объема АА, позволяет минимизировать риск реканализации/рецидивирования [15].
Радикальная эмболизация возможна при плотном заполнении значимого объема купола аневризмы, но при увеличении размеров аневризмы добиться качественной окклюзии значительно сложнее. Так, например, стандартной эмболизации не позволяет достичь необходимую плотность паковки (ПП) при размерах купола более 10 мм (объем более 600 мм3). В свою очередь, на ПП влияет структура микроспиралей (диаметр проволоки и витков первого порядка) и их форма. При спиралях большего диаметра отмечается увеличение ПП на 6,8%. В случае использования «трехмерной» (3D) микроспирали (МСП) в качестве первой процентный объем окклюзии не зависит от размера АА, а в случае использования трех и более 3D МСП – от соотношения размеров купола и шейки [16, 17]. С целью повышения качества окклюзии и предотвращения реканализации проблемных аневризм были последовательно предложены два метода поддержки традиционной эмболизации при помощи баллон-катетера и внутрисосудистого сетчатого протеза – стента.
Баллон-ассистенция была разработана J. Moret и его сотрудниками в 1997 г. и получила широкое распространение, позволила существенно повысить радикальность и стабильность окклюзии аневризм без значительного повышения частоты ишемических и геморрагических осложнений [9, 13]. Потребность в баллон-ассистенции, по мнению разных авторов, варьирует от 20 до 80% [4].
Риск протрузии спиралей в просвет несущей артерии при эмболизации АА с широкой шейкой, а также неудовлетворительные результаты окклюзии при крупных и гигантских АА привели к разработке метода стент-ассистенции. Имплантация стента в сосуд, несущий аневризму, на уровне шейки способствует удержанию витков микроспиралей в куполе, препятствует их выпадению в просвет несущей артерии, обеспечивая проходимость сосуда. Кроме выполнения опорной функции, стент влияет на локальную гемодинамику, снижая напряжение сдвига в проекции устья аневризмы, а также создает условия для заживления дефекта стенки артерии в области АА неоинтимой, разрастающейся на ребрах и перемычках стента [5].
Возможность применения стента меняет сложившиеся представления о необходимой ПП аневризмы. Так, ретроспективный анализ 5-летнего опыта эмболизации аневризм в условиях стент-ассистенции показал, что даже при достижении волюметрической окклюзии менее 20%, тотальная окклюзия составила 85,3–71,1% [1]. Стент-ассистенция способствует достоверному снижению частоты реканализации аневризм с неблагоприятной геометрией [10], создает условия для отсроченной положительной трансформации в области вмешательства в отдаленном периоде после эмболизации [10, 14]. Частота симптомных стенозов и окклюзий просвета имплантированного стента невысока (3,5 и 0,6%, соответственно) [14].
В настоящее время предложены другие методы эрадика-ции АА, такие как имплантация на уровне шейки стентов, отклоняющих поток, или изолирующих графт-стентов. Что касается изолирующих стентов, то их использование ограничено относительно прямолинейными каменистыми, кавернозными, параклиноидными сегментами внутренней сонной и позвоночной артерий, не имеющих изолированных функционально значимых ветвей. Устройства, отклоняющие поток, показывают впечатляющие результаты, но необходимы дальнейшие исследования безопасности и эффективности для детализации показаний к применению с учетом морфологии, локализации аневризм, периода заболевания. В данной статье представлен опыт клиники нейрохирургии в использовании ассистирующих методов во внутрисосудистой хирургии аневризм.
МАТЕРИАЛ И МЕТОДЫ
Материалом исследования послужили 270 эмболизиро-ванных аневризм у 260 пациентов, находившихся на лечении в клинике нейрохирургии Военно-медицинской академии в период с 2004 по 2012 г. Соотношение женщин и мужчин было 1,0:0,9. Средний возраст пациентов составил 43±2 года. Большинство аневризм (83,3%) локализовалось в передних отделах артериального круга. В зависимости от метода окклюзии аневризм были выделены три группы пациентов: первая – эмболизация АА без ассистенции (168 наблюдений); вторая – баллон-ассистенция (50 операций); третья – стент-ассистенция (55 операций).
В группе ассистирующих методов преобладали аневризмы ВСА, частота которых составила 52 и 61,8%.
В группе стент-ассистенции отсутствовали аневризмы средней мозговой артерии (СМА). В первой группе преобладали аневризмы комплекса «передняя мозговая – передняя соединительная артерия» (ПМА – ПСоА) (42,2%). В первой группе большинство операций выполняли в остром периоде кровоизлияния (57,5%). Во второй и третьей группах операции в остром периоде выполняли гораздо реже – в 11,4 и 1,8%. Необходимо отметить, что в виду отсутствия противопоказаний в последнее время аневризмы с неблагоприятной анатомией оперируются в условиях баллон-ассистенции и в остром периоде.
Большинство пациентов, оперированных в остром периоде кровоизлияния, находились в удовлетворительном состоянии, I-II по Hunt – Hess (42,4 и 43,3%). Пациенты в декомпенсированном состоянии (HH IV) составили 2,2% и были оперированы без использования ассистирующих методов.
В остром периоде всем пациентам выполняли компьютерную томографию (КТ) головного мозга с целью определения вида внутричерепного кровоизлияния и СКТА для выявления источника кровоизлияния. В холодном периоде или в случаях неразорвав-шихся аневризм ведущим методом диагностики было магнитно-резонансное исследование.
Операции осуществляли доступом через правую бедренную артерию, техника соответствовала рекомендательным протоколам. В тех случаях, когда планировалось применение ассистирующих методов, использовался направляющий катетер большего диаметра (7-8F). Направляющий катетер проводили до каменистого сегмента ВСА или V3 сегмента ПА в зависимости от локализации АА.
Отношение купол/
Группа Объем купола, мм3 Размеры шейки, мм шейка менее 1,5, %
Таблица 1
Морфологические характеристики аневризм различных групп
|
Первая (стандартная эмболизация) |
132,5 |
≤4 |
10,7 |
|
Вторая (баллон-ассистенция) |
375 |
4,6 |
52 |
|
Третья (стент-ассистенция) |
486 |
5,76 |
81,8 |
В остром периоде кровоизлияния гепаринизацию начинали только после имплантации первой спирали в купол аневризмы. В холодном периоде кровоизлияния или при НА гепарин вводили перед установкой направляющего катетера. При использовании стент-ассистенции добивались двукратного повышения АСТ до 250–300 с. В случаях планирования применения ассистирующих методик за несколько дней до операции назначали дезагреганты: монотерапию (аспирин) при баллон-ассистенции, стандартную двойную дезагрегантную терапию (клопидогрель и аспирин) при стент-ассистенции. Эмболизацию выполняли по принципу трех F: Framing (армирование), Filling (заполнение), Finishing (завершение). Во всех случаях первая спираль была «трехмерной». В большинстве случаев заполняющие спирали также были «трехмерными».
В до- и послеоперационном периодах оценивали неврологический статус. В остром периоде кровоизлияния, после выключения аневризмы из кровотока, пациенты получали стандартную рекомендованную терапию субарахноидального кровоизлияния. Повторные контрольные исследования выполняли через 6, 12 мес. и 2 года. Контрольные исследования выполнены в 68% случаев у пациентов I группы и у 72/71% пациентов II/III групп. Катамнез составил 14,3; 19,5 и 19,8 мес. в I–III группах.
Выбор метода эмболизации основывался на оценке морфологических параметров аневризмы, таких как размеры шейки, купола, соотношение шейки и купола, а также зависел от локализации и возможности внутрисосудистого доступа. В группе стандартной эмболизации большинство аневризм (89,3%) имело благоприятную геометрию, размеры купола не превышали 200 мм3. Несмотря на то что размеры аневризмы в I и II группах достоверно не различались, в 52% наблюдений II группы анатомия АА была неблагоприятной. В трех наблюдениях II группы выполнялись повторные вмешательства после неудачных попыток эмболизации или рецидива аневризм. У пациентов III группы аневризмы были достоверно крупнее (р<0,01), чем в I и II группах, а неблагоприятная геометрия
АА отмечена в 81,8% случаев. Средние размеры купола и шейки АА у пациентов III группы составили 486 мм3 и 5,76 мм. Таким образом, большинство АА в III группе имели абсолютно широкую шейку. В третью группу также вошли 16 пациентов (29,1%), оперированных повторно после эмболизации в условиях баллон-ассистенции (табл. 1).
РЕЗУЛЬТАТЫ
В связи со строгим отбором у пациентов первой группы большинство аневризм (89,3%) имело благоприятную для эмболизации геометрию, однако частота первичной радикальной окклюзии составила только 66,7% наблюдений. В то же время эффективная окклюзия (тип А+В) достигнута в 88,5% случаев. Несмотря на то что во II группе более половины пациентов имели неблагоприятную анатомию АА, радикальная окклюзия была достигнута в 82% наблюдений, субтотальная – в 18%.
В III группе радикальная окклюзия достигнута в 69,1% случаев, но при этом в трех наблюдениях (5,5%) отмечен неудовлетворительный результат с достижением частичной окклюзии. При контрольных исследованиях в период первичной госпитализации у троих пациентов III группы отмечена положительная трансформация – изменение степени окклюзии из типа В в А. Тотальная окклюзия была достигнута в 74,5%. В ходе дальнейшего наблюдения при контрольных ангиографических исследованиях отмечено снижение градации радикальности окклюзии аневризм на 23, 10 и 9,1% в I–III группах.
Наибольшая ПП достигнута во II группе (36,6%). Плотность паковки при стент-ассистенции была достоверно ниже в сравнении с другими методами внутрисосудистой окклюзии (р<0,01) и в среднем составила 28,6%, что обусловлено значительными размерами купола аневризм, но радикальность первичной окклюзии при этом не уступала результатам стандартной эмболизации у пациентов I группы. При оценке влияния различных вариантов стент-ассистенции на эффективность эмболизации отмечено, что плотность паковки несколько выше при использовании баллон-ассистенции с последующей имплантацией стента (баллон + стент) и при эмболизации в условиях прижатия стентом микрокатетера (прижатый катетер). При использовании техники прижатия катетера стентом осложнений не было. Наименьшая ПП и наибольшее число осложнений отмечены при эмболизации АА через ячейку стента, что обусловлено трудностями кате- теризации камеры аневризмы через ячейку и неустойчивым положением микрокатетера. С целью преодоления ограничений метода эмболизации через ячейку стента мы применили инфляцию баллона в просвете стента (стент + баллон), которая была выполнена у трех пациентов при реканализации аневризм, ранее эмболизиро-ванных в условиях стент-ассистенции (табл. 2, рис. 1).
Ретроспективный анализ результатов контрольных исследований показал, что факторами риска реканализации эмболизированных аневризм у больных I группы стали недостаточная плотность паковки (менее 20%) при размерах аневризм <200 мм3; субтотальная и частичная эмболизация ввиду технических трудностей или невозможности достижения более плотной паковки в связи с выпадением спиралей в просвет несущей артерии.
У пациентов II группы реканализация (n = 5) отмечена при аневризмах с неблагоприятной геометрией. При этом только в двух наблюдениях (40%) объем купола был менее 200 мм3. В четырех наблюдениях объем купола превышал 500 мм3, и ни в одном из них необходимая ПП (>24%) не была достигнута. В одном наблюдении при небольших размерах аневризмы (V = 118 мм3) при достаточной окклюзии купола использовались только биологически активные МСП с покрытием из PGLA, что без должной механической поддержки платиновыми МСП привело к реканализации из-за резорбции полимерного покрытия. В одном наблюдении при аневризме объемом 125 мм3и достаточной ПП (20,5%) развилась реканализация, причины которой не ясны. Повторные вмешательства выполнены в четырех наблюдениях (80%): в одном – стандартная эмболизация, в трех – в условиях стент-ассистенции (рис. 2).
В III группе реканализация отмечена у 5 пациентов (9,1%), при этом в трех наблюдениях при ГА. В двух других случаях реканализация отмечена при аневризмах офтальмического сегмента ВСА с размерами купола более 500 мм3 и ПП менее 20%. При повторных вмешательствах достигнута тотальная окклюзия с длительным без-рецидивным периодом наблюдения (более двух лет).
В общей сложности выполнено 13 повторных операций со средней ПП 17,8%, имплантировано 8 стентов.
В одном наблюдении достигнута тотальная и в трех случаях субтотальная окклюзия, в одном случае в связи с рецидивирующим характером АА выполнена деструктивная баллон-окклюзия ВСА. Контрольные исследования проведены троим пациентам с подтверждением стабильной окклюзии на протяжении 17,3 мес.
Осложнения внутрисосудистых вмешательств были у 63 оперированных пациентов (23,3%), при этом геморрагические осложнения наблюдали только у 10 пациентов (2,7%) I (n = 9) и III (n = 1) групп. Геморрагическое осложнение у пациентов III группы отмечено в единственном наблюдении реперфузионного кровоизлияния на фоне комбинированного (внутриартериаль- ного и механического тромболизиса) острого in stent тромбоза, развившегося на 7-е сутки послеоперационного периода за пределами клиники. Несмотря на достигнутую реканализацию основной артерии и интенсивную терапию, пациент погиб (рис. 3).
В остальных случаях (n = 9) летальных исходов не было, пациенты выписаны с хорошим или удовлетворительным исходом лечения (1–3 балла, по mRs). Частота тромбоэмболических осложнений была выше во II и III группах и составила 9,5% (n = 16), 24% (n = 12) и 14,5% (n = 8) у пациентов I–III групп. У пациентов II группы доминировали клинически незначимые эпизоды тромбоэмболии. Бόльшая частота малых ишемических осложнений при использовании баллон-ассистенции в сравнении с III группой, по всей видимости, обусловлена меньшей нагрузкой дезаг-регантами. У пациентов III группы в четырех случаях (7,2%) отмечен острый тромбоз стента, в трех случаях достигнута полная или частичная реканализация на фоне введения ингибиторов IIb/IIIa гликопротеиновых рецепторов. Сим-птомное острое нарушение мозгового кровообращения со стойким неврологическим дефицитом после имплантации стента отмечено только в двух наблюдениях (3,6%).
Наибольшее число технических сложностей отмечено в ходе имплантации стента (20%). В одном наблюдении произошла дислокация стента в купол аневризмы, в связи с чем пришлось выполнить деструктивную окклюзию ВСА (рис. 4). Технические сложности в других группах чаще были представлены выпадением спиралей в просвет артерии, заклиниванием спиралей в микрокатетере, сложностями катетеризации купола аневризмы, которые наблюдались в 3,7 и 6% случаев в I и II группах.
ОБСУЖДЕНИЕ
Необходимость использования ассистирующих методов во внутрисосудистой хирургии обусловлена большой частотой аневризм с неблагоприятной геометрией (АА с широкой шейкой составляют 20–44%), высокой вероятностью реканализации после стандартной эмболизации аневризм, достигающей 37%. Применение ассистирующих технологий способствует улучшению непосредственных и отдаленных результатов внутрисосудистой окклюзии аневризм. По нашим данным, ни в одном из случаев АА с объемом купола более 200 мм3 при стандартной эмболизации не была достигнута рекомендуемая ПП (>24%), в отличие от групп, в которых применялись ассистирующие методы. В то же время следует отметить, что при объеме купола более 600 мм3 ни в одной группе ПП более 20% не была достигнута, что отражает объективные ограничения современных внутрисосудистых технологий. Эти наблюдения в большинстве случаев были в III группе. Несмотря на недостаточно плотную эмболизацию, имплантация стента позитивно отразилась как на непосредственном результате операции, так и на качестве окклюзии аневризм в отдаленном периоде.
Таблица 2
Результат эмболизации аневризм в зависимости от модификации метода стент-ассистенции у больных III группы
|
Вид ассистенции |
Кол-во, n (%) |
Окклюзия типа А, n (%) |
Плотность паковки, % |
Технические трудности, % |
|
Баллон+стент |
16 (29,1) |
11(69) |
30 |
27 |
|
Прижатый катетер |
16 (29,1) |
12 (72) |
31,7 |
0 |
|
Эмболизация+стент |
5 (9,1) |
4 (80) |
19 |
9 |
|
Эмболизация через ячейку стента |
15 (27,3) |
8 (53,3) |
25,8 |
64 |
|
Стент+баллон |
3 (5,5) |
3 (100) |
36 |
0 |
|
Итого |
55 (100) |
38 (69,1) |
Рис. 1.
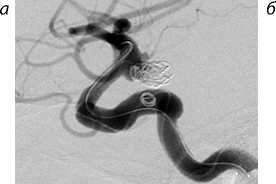
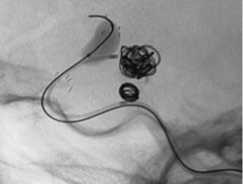
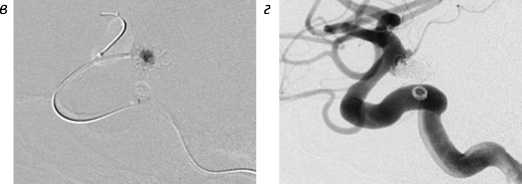
Применение баллон-ассистенции внутри стента: а – реканализация АА супраклиноидного отдела левой ВСА; б – метки ранее имплантированного стента и клубок МСП; в – эмболизация через ячейку стента в условиях раздутого баллона; г – контрольная ангиография.
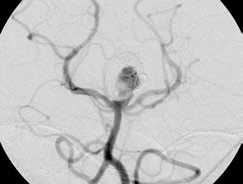
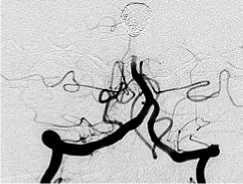
Рис. 2.
Этапное лечение пациента с рецидивирующей аневризмой основной артерии: а – рецидив аневризмы после двух внутрисосудистых операций (стандартной эмболизации);
б – эмболизация в условиях баллон-ассистенции; в – поперечная имплантация стента в бифуркацию основной артерии; г – контрольная ангиография – тотальная окклюзия. Стабильная окклюзия на протяжении трех лет динамического наблюдения.
а
б
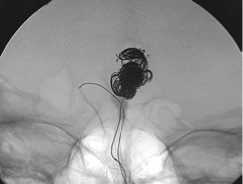
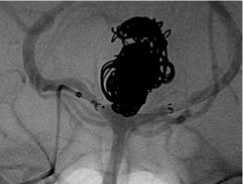
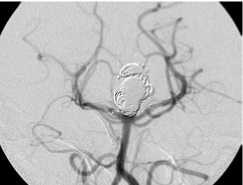
Рис. 3.
Острый тромбоз стента, имплантированного в терминальный сегмент основной артерии, P1 сегмент ЗМА: а – тромбоз проксимального отрезка стента на 7-е сутки после операции; б – реперфузионное кровоизлияние в средний мозг после комбинированного тромболизиса; в – вид мозга на секции.
б
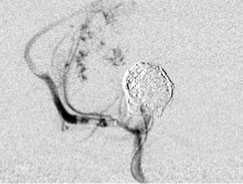
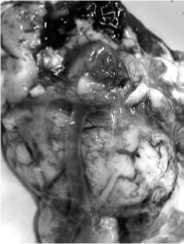
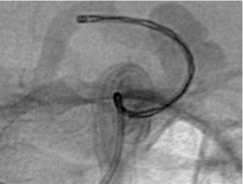
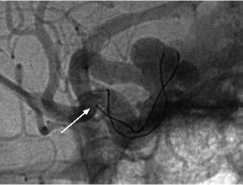
Рис. 4.
Миграция стента, имплантированного в С1-3 сегменты ВСА, в купол АА офтальмического сегмента: а – позиционирование стента перед имплантацией;
б – дислокация стента в купол АА; в – деструктивная баллон-окклюзия ВСА, контрастирование части купола АА;
г – прогрессирующий тромбоз купола АА при контрольной ангиографии на 7-е сутки после операции.
б
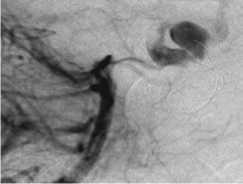
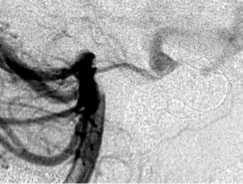
Несмотря на отсутствие достоверной разницы размеров АА в I и II группах, имела место тенденция к увеличению объема аневризм у пациентов, в ходе хирургического лечения которых использовалась баллон-ассистенция. Кроме того, более 50% аневризм у пациентов II группы имели неблагоприятную анатомию, но именно во II группе достигнуты лучшие показатели радикальности вмешательств. В III группу попали аневризмы с наибольшим размером купола и неблагоприятной геометрией более чем в 80% случаев, что при прочих равных условиях привело бы к некачественной окклюзии или реканализации в отдаленном периоде.
Несмотря на то что ПП при эмболизации в условиях стент-ассистенции была достоверно ниже, чем в других группах, имплантация стента на уровне шейки существенно нивелировала этот «дефект». Только у пациентов III группы отмечены случаи положительной трансформации благодаря изменению потока в аневризме и заживлению устья АА неоинтимой.
Проведен анализ факторов геометрии АА, влияющих на качество окклюзии. В связи со строгим отбором пациентов в I группу и использованием «трехмерных» спиралей качество окклюзии зависело только от размеров аневризм и достигнутой ПП (р<0,01), а не от ширины шейки и соотношения размеров купола и шейки аневризм. Во II группе объем аневризм, размеры шейки, ПП влияли на радикальность окклюзии (p<0,01). Использование стента уменьшало влияние геометрии АА на качество окклюзии: радикальность операции не зависела от объема и размеров шейки АА, а также слабо зависела от ПП, хотя имеется тенденция к повышению качества эмболизации при увеличении плотности паковки.
Использование ассистирующих методов расширяет возможности внутрисосудистой окклюзии аневризм. Наряду с преимуществами эти методы не лишены недостатков. К преимуществам баллон-ассистенции, помимо повышения плотности паковки и обеспечения стабильности микрокатетера, относятся возможность использования более жестких спиралей, облегчение навигации при катетеризации несущей артерии и купола аневризмы. За счет обеспечения стабильности системы доставки появляется возможность эмболизации дистальных и малых аневризм СМА или ПМА, предупреждается выпадение спиралей в просвет артерии, защищаются артерии, отходящие от шейки АА.
Неоспоримое преимущество применения баллон-ассис-тенции – возможность немедленной остановки кровотечения при перфорации камеры аневризмы, а также выполнения ангиопластики в остром периоде кровоизлияния до или после эмболизации аневризм. Недостатков баллон-ассистенции значительно меньше. К ним относят риск разрыва сосуда при избыточной инфляции баллона, ишемию вследствие временной окклюзии артерии, возможность смещения витков МСП после дефляции баллона. Но данные осложнения можно предупредить тщательным отбором пациентов и освоением техники манипулирования новым инструментом. К преимуществам стент-ассистенции относят возможность эмболизации аневризм с абсолютно широкой шейкой, профилактику выпадения спиралей в просвет артерии, создание условий для заживления устья АА. Основным недостатком стент-ассистенции мы считаем необходимость длительной антиагрегантной терапии, что является фактором риска раннего или отсроченного внутричерепного кровоизлияния (в нашей серии таковых не отмечено).
Для решения вопроса внутрисосудистой окклюзии «проблемных» аневризм необходимо обеспечить максимально возможную плотность паковки купола АА, что возможно за счет использования «трехмерных» микроспиралей и ассистирующих методов. В случае реканализации ранее окклюзированной АА необходимо стентирование пораженного сегмента, возможно использование биологически активных микроспиралей. При рецидиве АА после эмболизации в условиях стент-ассистенции показано использование устройств, отклоняющих поток.
ВЫВОДЫ
-
1. Применение ассистирующих методов позволяет радикально выключить из кровотока АА с неблагоприятной геометрией (широкая шейка, соотношение размеров купола и шейки менее 1,5), представляющих проблему для техники традиционной эмболизации.
-
2. Использование временной баллон-окклюзии несущей артерии на уровне шейки позволяет существенно увеличить плотность паковки купола аневризмы и сохранить проходимость артерий, отходящих от шейки аневризмы.
-
3. Имплантация стента создает условия для прогрессирующей окклюзии даже при недостаточной (<20%) плотности паковки купола аневризмы.
-
4. Применение стент-ассистенции обязательно при крупных, гигантских и рецидивирующих аневризмах.
Список литературы Роль ассистирующих методов при внутрисосудистой окклюзии аневризм головного мозга
- Chalouhi N., Dumont A. et al.//J. Neurosurgery. 2012. V. 7.
- Debrun G. et al.//Neurosurgery. 1998. V. 43. P. 1281-1297.
- Lin N., Cahill K. et al.//J. Neur. Surg. 2012. V. 4. P. 182-189.
- Moret J. et al.//Intervent. Neuroradiol. 1997. V. 3. P. 21-35.
- Minsuok K., Hui M., Nelson L. et al.//Neurosurgery. 2007. V. 61. P. 1305-1313.
- Murayama Y. et al.//J. Neurosurg. 2003. V. 98, № 5. P. 959-966.
- Pierot L., Leclercb X., Bonafеc A., Bracard S.//AJNR. 2008. V. 29. P. 57-61.
- Pierot L., Cognard C., Anxionnat R., Ricolfi F.//AJNR. 2012.
- Pierot L., Spelle L., Leclerc X. et al.//AJNR. 2012. V. 33. P. 12-15.
- Piotin M., Blanc R., Spelle L. et al.//Stroke. 2010. V. 41 P. 110-115.
- Raymond J. et al.//Stroke. 2003. V. 34, № 6. P. 1398-1403.
- Sander E., Rabinstein A., Derdeyn P. et al.//Stroke. 2012. V. 43. P. 1711-1737.
- Shapiroa M., Babba J., Becskea T., Nelsona P.//AJNR. 2008. V. 29. P. 1777-1781.
- Shapiroa M., Becskea T., Sahleina D. et al.//AJNR. 2012. V. 33. P. 159-163.
- Slob M., Rooij van W.J., Sluzewski M.//Neurol. Res. 2005. V. 27. P. 116-119.
- Sluzewski M., Rooij van W. J., Marian J., Slob M.//Radiology. 2004. V. 231. P. 653-658.
- Vallee J.-N., Pierot L., Bonafеc A. et al.//AJNR. 2004. V. 25. P. 298-306.


