Роль лучевых методов исследования в диагностике болезни Мойа-Мойа у молодого пациента, осложненная острым нарушением мозгового кровообращения
Автор: Лагкуева И.Д., Джигкаева М.М., Рагимов В.А., Котляров П.М., Черниченко Н.В., Сергеев Н.И., Солодкий В.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клинические наблюдения
Статья в выпуске: 4 т.22, 2022 года.
Бесплатный доступ
В клиническом наблюдении представлен случай болезни Мойа-Мойа у молодого пациента, диагностированный посредством компьютерно-томографической и магнитно-резонансной ангиографии после развития грозных осложнений в виде геморрагического инфаркта в области базальных ядер слева и ишемического инфаркта в лобной доле справа.
Болезнь мойамойа, компьютерно-томографическая ангиография, магнитно-резонансная ангиография
Короткий адрес: https://sciup.org/149142063
IDR: 149142063
Текст научной статьи Роль лучевых методов исследования в диагностике болезни Мойа-Мойа у молодого пациента, осложненная острым нарушением мозгового кровообращения
Author ID: 759369, ORCID: , e-mail:
Сергеев Николай Иванович – д.м.н., ведущий научный сотрудник лаборатории лучевой диагностики заболеваний (включая молочную железу) научно-исследовательского отдела комплексной диагностики заболеваний и радиотерапии ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, SPIN-код: 2408-6502, Author ID: 720796, ORCID: , e-mail:
Солодкий Владимир Алексеевич – академик Российской академии наук, профессор, доктор медицинских наук, директор ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, ORCID: , e-mail: Контактное лицо
Болезнь Мойа-Мойа – ангиопатия терминальных отделов внутренних сонных артерий (ВСА) и их проксимальных ветвей, характеризующаяся прогрессирующим стенозированием просветов вплоть до полной окклюзии, с последующим развитием сети патологических сосудов Мойа-Мойа («клубки дыма, туман») [1]. Заболевание встречается как у детей, так и у взрослых, может приводить к тяжелым клиническим последствиям, таким как ишемический инсульт и внутричерепное кровоизлияние, последнее состояние чаще встречается у взрослых, чем у детей [2]. Предрасполагающими факторами являются генетические нарушения и условия внешней среды, заболевание наиболее распространено среди жителей стран Восточной Азии, реже встречается в странах Европы и США [3]. Первый случай болезни был описан Takeuchi и Shimizu в 1957 г. [4]. Позднее, в 1974 году в Японии создан исследовательский комитет, который на протяжении 45 лет занимается диагностикой и лечением данной патологии, а в 1978 году организацией впервые установлены диагностические критерии заболевания. С тех пор критерии неоднократно пересматривались в соответствии с изменениями в концепции заболевания и достижениями в области диагностической визуализации [5].
Хирургическое лечение болезни Мойа-Мойа является наиболее эффективным у данной категории больных, состоит в удалении гематомы и в создании анастомозов между внутри- и внечерепными артериями: прямых экстраинтракраниальных анастомозов (ЭИКМА) и непрямых анастомозов - синангиозов. При прямом шунтировании соединяют поверхностную височную артерию со средней мозговой артерией. При создании синангиоза богато кровоснабженные мягкие ткани скальпа фиксируют к поверхности мозга, тем самым создавая условия для формирования новых сосудов - неоангиогенеза. Возможно сочетание прямого и непрямого анастомозов. Как правило, для полноценной реваскуляризации головного мозга требуется несколько операций [6]. Медикаментозная терапия имеет лишь вспомогательное значение и не предотвращает прогрессию заболевания.
Клиническое наблюдение
Пациент Н., 1971 г.р. с направительным диагнозом: последствия острого нарушения мозгового кровообращения, обратился в отделение лучевой диагностики РНЦРР для выполнения компьютерной томографии головного мозга с внутривенным контрастным усилением (КТ в/в к.у.) по назначению невролога. Поводом для обращения к врачу послужил эпизод интенсивной головной боли, возникший резко около трех месяцев назад на фоне подъема артериального давления до 180/120 мм. рт. ст., потеря равновесия и афазия. В анамнезе у пациента геморрагический инсульт базальных ядер слева, перенесенный около полугода назад. По данным КТ с в/в к.у. в лобной доле справа определялся кистозной плотности участок, не накапливающий контрастный препарат, размерами до 4,3 х 4,3 см (Рис. 1). Отмечалось компенсаторное расширение переднего рога правого бокового желудочка. Кроме того, в базальных ядрах слева определялась аналогичная по структуре зона, размерами до 1,4 х 0,7 см (Рис. 2). При анализе сосудов, выявлено неравномерное контрастирование просветов проксимальных отделов средних мозговых артерий (СМА) и передних мозговых артерий (ПМА) с обеих сторон, нечеткость наружных контуров, повышение плотности периваскулярного пространства (Рис. 3), что и вызвало подозрение в отношении болезни Мойа-Мойа и было в последующем подтверждено при магнитнорезонансной томографии (МРТ) с безконтрастной ангиографией. По данным МРТ в сосудистом режиме выявлен резкий стеноз и окклюзия проксимальных отделов СМА и ПМА с обеих сторон, сеть капилляров в виде «клубков дыма» в базальных отделах головного мозга-патогномоничная картина для болезни Мойа-Мойа (Рис. 4). В лобной доле справа определялся участок кистозно-глиозных изменений, соответствующий инфаркту в хронической стадии (Рис. 5–7). В базальных ядрах слева определялся участок измененного сигнала, соответствующий гематоме в хронической стадии (Рис. 8). Изменений в бассейне артерий вертебрально-базалярной системы выявлено не было, задние коммуникантные артерии определялись с обеих сторон.
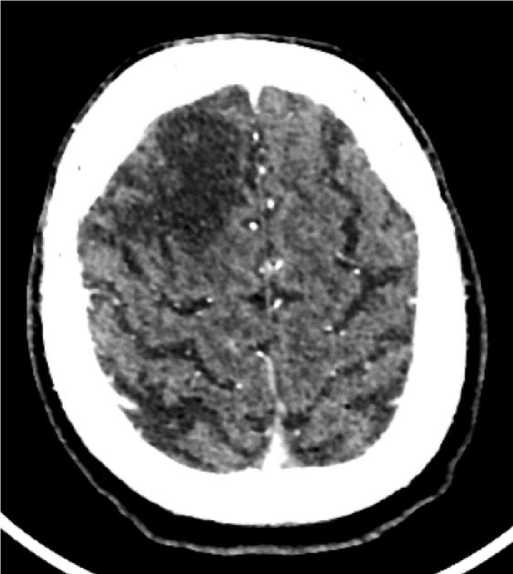
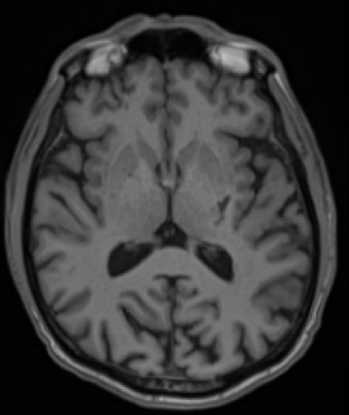
Рис. 1. КТ. Мягкотканный режим. Аксиальная плоскость. В лобной доле справа отмечается участок кистозных изменений.
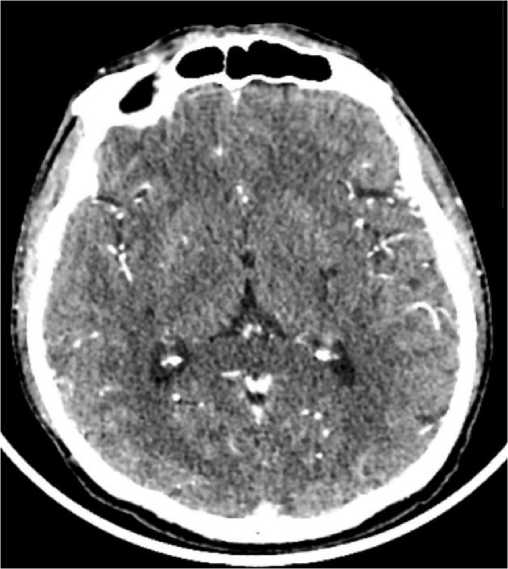
Рис. 2. КТ. Мягкотканный режим. Аксиальная плоскость. В области базальных ядер слева участок кистозных изменений.
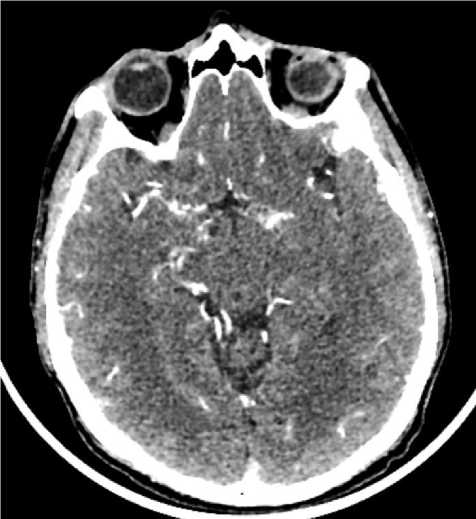
Рис. 3. КТ. Мягкотканный режим. Аксиальная плоскость. Определяется неравномерное контрастирование просветов СМА и ПМА с обеих сторон, нечеткость наружных контуров, повышение плотности периваскулярного пространства.
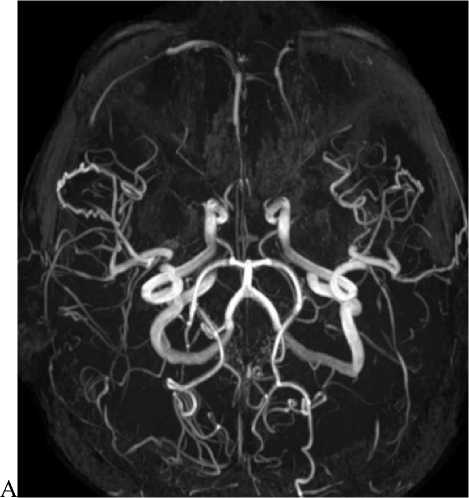
Рис. 4. МРТ. 3D TOF. Аксиальная (А) и корональная (Б) плоскости. Окклюзия СМА и ПМА с обеих сторон. В базальных отделах отмечается патологическая сосудистая сеть в виде «клубков дыма».
Б
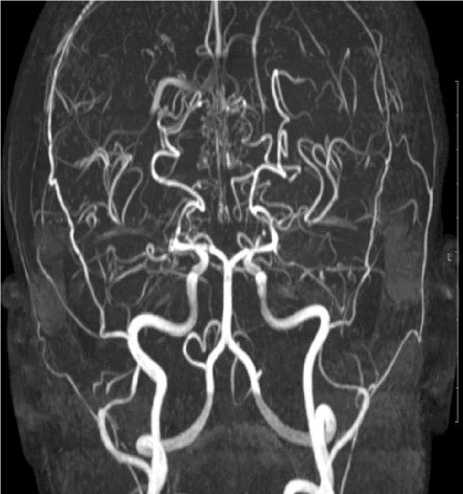
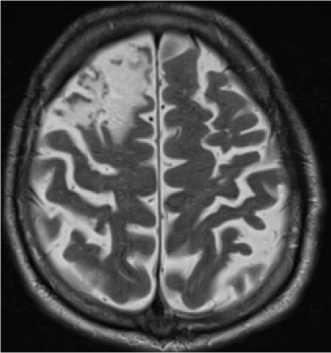
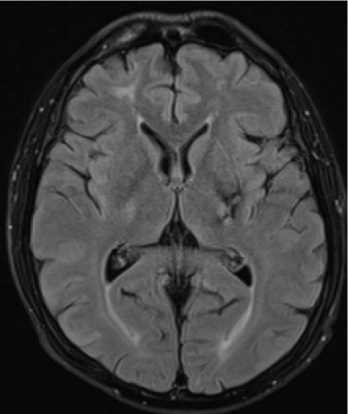
Рис. 5. МРТ. Т2ВИ. Аксиальная плоскость. В лобной доле справа определяется участок кистозно-глиозных изменений.
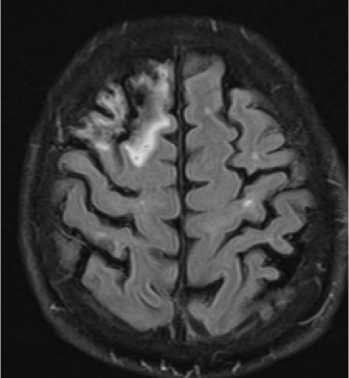
Рис. 6. МРТ. Т2 dark-fluid. Аксиальная плоскость. В лобной доле справа определяется участок кистозно-глиозных изменений.
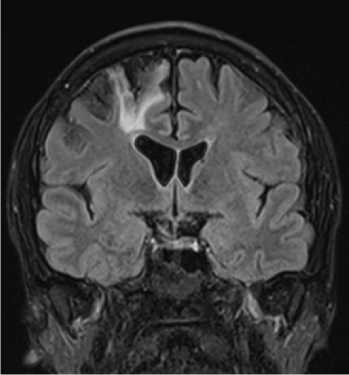
Рис. 7. МРТ. Т2 dark-fluid. Корональная плоскость. В лобной доле справа определяется участок кистозно-глиозных изменений, компенсаторное расширение переднего рога правого бокового желудочка.
А
Б
В
Г
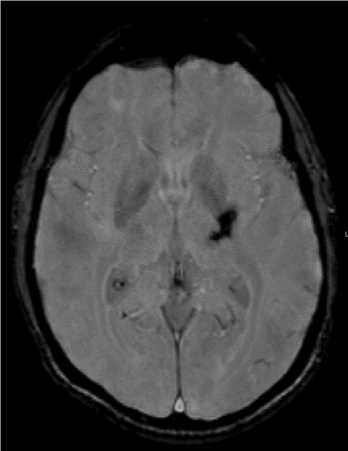
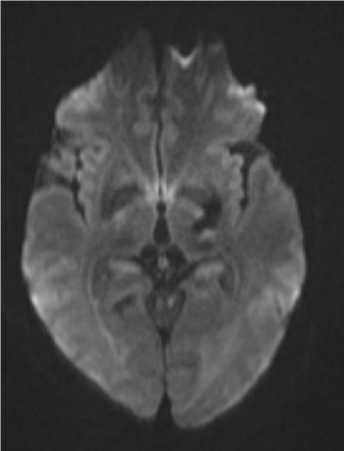
Рис. 8. МРТ. (А) Т2 darc-fluid. (Б) Т1ВИ. (В) Т2*. (Г) DWI. Аксиальная плоскость. В области базальных ядер слева определяется участок постгеморрагических изменений, соответствующий гематоме в хронической стадии.
Обсуждение
Несмотря на то, что болезнь Мойа-Мойа не является крайне редко встречающейся патологией в популяции, диагностика данного состояния в случае с нашим пациентом оказалась несколько несвоевременной. Относительно молодой возраст пациента и отсутствие в анамнезе гипертонической болезни должны являться поводом заподозрить врожденную патологию сосудов Виллизиева круга. Дифференциальную диагностику следует проводить с артерио-венозными мальформациями, которые, как правило, бывают односторонними и редко вызывают стеноз магистрального русла. Последний пересмотр 299
диагностических критериев болезни Мойа-Мойа был осуществлен в 2021 г. Согласно пересмотренным критериям, рентгенологический диагноз по данным МРТ и МРА TOF напряженностью магнитного поля 1,5 Тесла (Т) и выше устанавливается в случае одно- или двусторонних изменений: стеноза или окклюзии терминального отдела интракраниальной внутренней сонной артерии; уменьшения наружного диаметра конечной части внутренней сонной артерии и горизонтальной части средней мозговой артерии с обеих сторон на Т2-взвешенной МРТ; при наличии аномальной сосудистой сети в базальных ганглиях и/или перивентрикулярном белом веществе. Выполнение церебральной ангиографии является обязательным при подозрении на данное состояние, в особенности при одностороннем характере изменений. Диагноз устанавливается после исключения аутоиммунных заболеваний, менингита, опухоли головного мозга, нейрофиброматоза 1 типа [5].
На примере данного клинического наблюдения еще раз подчеркиваем насколько важно врачам-рентгенологам развивать клиническое мышление и уметь по данным лучевых методов исследования не только констатировать свершившиеся изменения (ОНМК), но и постараться разобраться в причинах их возникновения.
В данном случае, корректно поставленный диагноз при первом обращении пациента за полгода до последнего события, вероятно, помог бы своевременно оказать специализированную медицинскую помощь и предотвратить второй эпизод нарушения мозгового кровообращения. В приведенном нами наблюдении у мужчины выявлены диагностические критерии болезни Мойа-Мойа по данным МРА TOF, пациент направлен на консультацию к специалистам в профильное учреждение для определения дальнейшей лечебной тактики.
Заключение
Магнитно-резонансная томография является методом выбора для оценки структур головного мозга; возможности метода существенно увеличиваются с применением парамагнитных веществ, позволяющих на основании характера накопления контрастного препарата проводить дифференциальную диагностику выявленных изменений. Наш клинический случай в очередной раз демонстрирует роль МР-ангиографии в диагностике патологии церебральных сосудов, влияющей на прогноз и качество жизни пациентов с
Мойа-Мойа.
Список литературы Роль лучевых методов исследования в диагностике болезни Мойа-Мойа у молодого пациента, осложненная острым нарушением мозгового кровообращения
- Fujimura M., Bang O.Y., Kim J.S. Moyamoya Disease. Front Neurol Neurosci. 2016. V. 40. P.204-220.
- Ancelet C., Boulouis G., Blauwblomme T., et al. Imaging Moya-Moya disease. Rev Neurol (Paris). 2015. V. 171. No. 1. P. 45-57.
- Ihara M., Yamamoto Y., Hattori Y., et al. Moyamoya disease: diagnosis and interventions. Lancet Neurol. 2022. V. 21. No. 8. P. 747-758.
- Takeuchi K, Shimizu K. Hypoplasia of the bilateral internal carotid arteries. Brain Nerve. 1957. V. 9. P. 37-43.
- Kuroda S., Fujimura M., Takahashi J., et al. Diagnostic Criteria for Moyamoya Disease - 2021 Revised Version. Neurol Med Chir (Tokyo). 2022. V. 62. No. 7. P. 307-312.
- Fujimura M., Bang O.Y., Kim J.S. Moyamoya Disease. Front Neurol Neurosci. 2016. V. 40. P.204-220.


