Роль магнитно-резонансной томографии с гепатоспецифичным контрастным препаратом в дифференциальной диагностике солидных опухолей печени
Автор: Ломовцева К.Х., Кармазановский Г.Г.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая диагностика
Статья в выпуске: 4 т.18, 2018 года.
Бесплатный доступ
Резюме Цель: оценить диагностические возможности магнитно-резонансной томографии (МРТ) с гепатоспецифичным контрастным препаратом (гадоксетовой кислотой) в дифференциальной диагностике солидных опухолей печени. Материалы и методы. В исследование включено133 пациента с солидными опухолями печени, которым была выполнена МРТ с гадоксетовой кислотой. Всего проанализировано 260 солидных опухолей печени (85 доброкачественных, 175 злокачественных образований). Оценивали характер контрастирования опухоли в динамические и гепатобилиарные фазы (ГБФ) (на 10 и 20 минутах). Сравнивали диагностические 167 возможности качественных признаков при дифференциальной диагностике солидных опухолей печени. Результаты. Были выделены пять типов контрастирования солидных опухолей печени в динамические фазы контрастирования, семь типов характера сигнала солидных опухолей вгепатобилиарную фазу. Наиболее высокие диагностические показатели при дифференциальной диагностике доброкачественных и злокачественных солидных опухолей печени определялись для характера сигнала опухоли в ГБФ (чувствительность 98,9%, специфичность 94,1%, точность 97,3%, положительная прогностическая значимость 97,2%, отрицательная прогностическая значимость 97,6%). Выводы. МРТ с гадоксетовой кислотой является высокоинформативным методом в дифференциальной диагностике солидных опухолей печени. Исследование в гепатобилиарной фазе дает дополнительную информацию о структурных особенностях опухоли, тем самым повышая диагностическую ценность метода.
Магнитно-резонансная томография, солидные опухоли печени, контрастное вещество, гадоксетовая кислота, гепатобилиарная фаза
Короткий адрес: https://sciup.org/149132081
IDR: 149132081
Текст научной статьи Роль магнитно-резонансной томографии с гепатоспецифичным контрастным препаратом в дифференциальной диагностике солидных опухолей печени
Магнитно-резонансная томография (МРТ) является одним из ведущих методов в выявлении и уточнении характера очагового поражения печени. Применение контрастных препаратов способствует улучшению диагностики патологических изменений. Наряду с традиционными внеклеточными парамагнитными контрастными веществами существуют гепатоспецифичные контрастные препараты [14].
Гадоксетовая кислота (торговое название Примовист®) – гепатотропное контрастное средство, имеющее двойной путь выведения из организма: около половины контрастного вещества выводится почками, другая половина – с желчью. С помощью гадоксетовой кислоты получают динамические фазы сканирования (артериальная, портальная, транзиторная) и гепатобилиарную фазу (ГБФ). Таким образом, гадоксетовая кислота позволяет получить информацию как о характере кровоснабжения опухоли печени, так и о функциональном состоянии гепатоцитов [13, 14].
Дифференциальная диагностика опухолевого поражения печени нередко представляет собой сложную задачу. В ряде работ подчеркивается важность и эффективность применения МРТ с гадоксетовой кислотой при диагностике очаговой патологии печени. Однако в отечественной литературе имеется ограниченное количество исследований, изучающих возможности гадоксетовой кислоты [1, 2, 3].
Цель исследования: оценить диагностические возможности МРТ с гадоксетовой кислотой в дифференциальной диагностике солидных опухолей печени.
Материалы и методы
В исследование включено 133 пациентов, среди которых было 88 (66,2%) женщин и 45 (33,8%) мужчин в возрасте от 18 до 83 лет (средний возраст 53,2 года). Всем пациентам была проведена МРТ брюшной полости с гадоксетовой кислотой в НМИЦ хирургии им. А.В. Вишневского в период с января 2011 по май 2017 г. Критериями включения являлись наличие солидной опухоли печени; возможность ее верификации посредством патоморфологического исследования, типичных лучевых признаков, данных анамнеза, динамического наблюдения (не менее 6 месяцев). Критериями исключения являлись наличие жидкостного образования печени (простые кисты, кистозные опухоли, гемангиомы), паразитарное поражение печени, неудовлетворительное качество изображений и невозможность верификации опухоли.
Все исследования проводились на высокопольном магнитно-резонансном томографе Philips Achieva 3T с применением 16-канальной катушки SENSE XL Torso. Стандартный протокол сканирования включал Т1 и Т2 взвешенные изображения в стандартных плоскостях, в том числе с подавлением сигнала от жировой ткани, а также диффузионновзвешенные изображения (у 102 пациентов). Гадоксетовую кислоту вводили болюсно в кубитальную вену дозой 0,1 мл/кг массы тела, со скоростью 1 – 2 мл/с. Болюс контрастного препарата сопровождался болюсом физиологического раствора в объёме 20 – 25 мл с аналогичной скоростью. Для получения контрастных изображений применяли Т1 сверхбыстрые градиентные эхо последовательности (THRIVE) с подавлением сигнала от жировой ткани. С их помощью получали томограммы в нативную, в артериальную (через 20 – 25 с после введения контрастного препарата), в портальную (через 40 – 60 с), в транзиторную (через 140 –180 с) фазы. ГБФ получали через 10 и 20 минут после введения гадоксетовой кислоты.
При множественном очаговом поражении печени анализировали три произвольных очага. Оценивали паттерн контрастирования очагов в динамические фазы сканирования и их характер сигнала в ГБФ (на 10 и 20 минутах).
Взаимосвязь между качественными признаками (характером контрастирования опухоли в динамические фазы и ГБФ) с принадлежностью очага к доброкачественной или злокачественной группе определяли с помощью критерия V Крамера (V). Коэффициент "лямбда" применяли для определения вероятности верного предсказания по качественным признакам нозологической принадлежности очага, его принадлежности к доброкачественной или злокачественной группе.
С помощью ROC-анализа определяли диагностические возможности изучаемых признаков в дифференциальной диагностике солидных очагов печени. Принимали общепринятые критерии качества модели в зависимости от AUC (площадь под кривой): 0,91,0 – отличное; 0,8-0,9 – очень хорошее; 0,7-0,8 – хорошее; 0,6-0,7 – удовлетворительное; менее чем 0,6 –неудовлетворительное.
Результаты
Всего было проанализировано 260 солидных очаговых образований печени (Рис. 1). Размер опухолей составил от 5 мм до 160 мм (средний размер 35,8 мм ± 29,3 мм). Злокачественных солидных опухолей было 175 (67,3%): метастазы (97), гепатоцеллюлярный рак (ГЦР) (49), холангиоцеллюлярный рак (ХЦР) (17), гепатохолангиоцеллюлярный рак (ГХЦР) (1), ангиосаркома (2), гемангиоэндотелиома (9). Доброкачественные солидные образования (85, 24,5%) были представлены гепатоцеллюлярной аденомой (ГЦА) (6), фокальной нодулярной гиперплазией (ФНГ) (79).
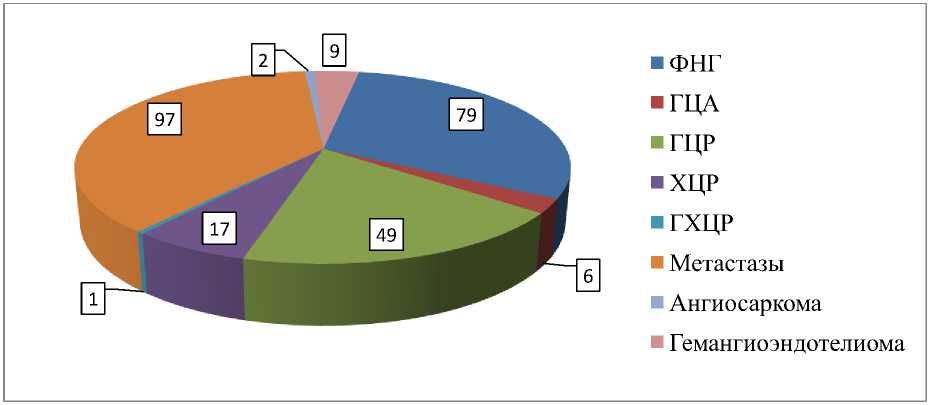
Рисунок 1. Диаграмма распределения солидных опухолей печени по нозологическим группам.
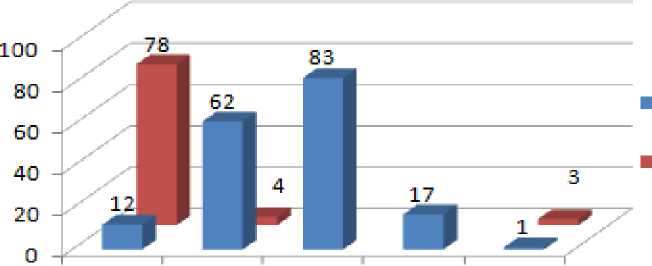
При анализе характера сигнала солидных опухолей печени в динамические фазы были выделены пять паттернов контрастирования (Рис. 2).
-
1. Гиперваскулярный персистирующий тип характеризовался интенсивным накоплением контрастного вещества в артериальную фазу без признаков вымывания в последующие фазы. Данный тип контрастирования был более характерен для доброкачественных солидных опухолей, чем для злокачественных. Он встретился в 78 случаях ФНГ. Среди злокачественных солидных опухолей данным типом контрастирования обладали: 1 ГЦР, 1 ХЦР, 8 метастазов (нейроэндокринной опухоли (НЭО) и гастроинтестинальной стромальной опухоли (ГИСО)), 2 очага ангиосаркомы.
-
2. Гиперваскулярный тип с вымыванием контрастного препарата в портальную, или транзиторную фазы, был более характерен для злокачественных солидных образований печени, чем для доброкачественных. Среди злокачественных солидных опухолей данный тип был характерен для ГЦР (47 очагов), ХЦР (1 очаг), метастазов НЭО и меланомы (14 очагов). Также данным типом контрастирования характеризовались 3 ГЦА и 1 ФНГ. При этом сигнал ФНГ был слабо гипоинтенсивный в транзиторную фазу.
-
3. Слабое постепенное накопление контрастного вещества с гиперваскулярным ободком в артериальную, или портальную фазы, было характерно только для злокачественных солидных опухолей (10 ХЦР, 1 ГХЦР, 63 метастазов, 9 гемангиоэндотелиом). Среди метастазов были метастазы колоректального рака (МКР), рака молочной железы (РМЖ) и
- рака легкого.
-
4. Слабое постепенное накопление контрастного вещества без гиперваскулярного ободка также было характерно только для злокачественных солидных опухолей (5 ХЦР, 12 метастазов колоректального рака и рака поджелудочной железы).
-
5. Отсутствие накопление контрастного вещества наблюдалось в 3 случаях ГЦА и 1 случае ГЦР.
Злокачественные солидные опухоли
Доброкачественные солидные опухоли

Рисунок 2. Диаграмма распределения солидных опухолей печени по типам контрастирования в динамические фазы.
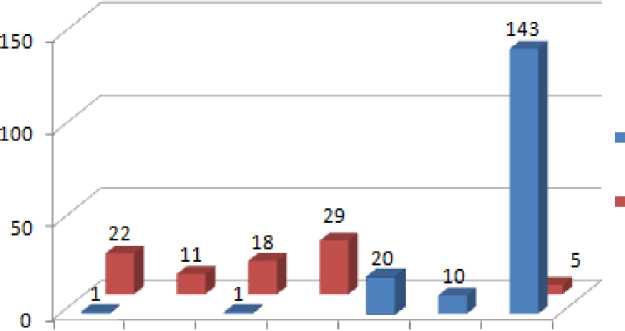
При анализе характера сигнала солидных опухолей в ГБФ были выделены семь типов (Рис. 3). При сравнении паттернов контрастирования солидных опухолей в ГБФ10 и
ГБФ20 не было выявлено статистически значимых различий (p=0,102).
Злокачественные солидные опухоли
Доброкачественные солидные опухоли
Рисунок 3. Диаграмма распределения солидных опухолей печени по характеру сигнала в ГБФ.
I тип , характеризующийся однородно изоинтенсивным сигналом , наиболее часто наблюдался при доброкачественной природе опухоли (22 ФНГ); в 1 случае встретился при ГЦР.
II тип , при котором опухоль имела однородный гиперинтенсивный сигнал , встретился только при доброкачественных солидных опухолях (11 ФНГ).
III тип характеризовался неоднородно изо-, либо гиперинтенсивным сигналом, с гипоинтенсивными зонами . Наиболее часто он встречался при доброкачественных солидных опухолях (17 ФНГ, 1 ГЦА). В 1 случае наблюдался при ГЦР.
IV тип определялся только при доброкачественных солидных опухолях (29 ФНГ) и характеризовался кольцевидным накоплением контрастного вещества в ГБФ .
V тип , при котором опухоль имела мишеневидную структуру и в центральном отделе определялся слабо гиперинтенсивный сигнал , наблюдался только при злокачественных солидных опухолях (5 ХЦР, 1 ГХЦР, 14 метастазов колоректального рака, НЭО, РМЖ).
VI тип характеризовался слабо гипоинтенсивным сигналом; либо неоднородно гипоинтенсивным сигналом с локальными зонами накопления контрастного вещества , и встретился только при ГЦР (10 случаев).
VII тип , при котором отсутствовали признаки накопления контрастного вещества , более часто встречался при злокачественных солидных опухолях (37 ГЦР, 12 ХЦР, 83 метастазов, 9 гемангиоэндотелиом, 2 ангиосаркомы), чем при доброкачественных солидных опухолях (5 ГЦА).
С целью статистической обработки данных выделенные типы характера сигнала солидных опухолей в динамические фазы и в ГБФ были закодированы соответствующими цифрами. Со статистической достоверностью (р<0,001) было установлено, что знание паттерна контрастирования солидного очага в динамические фазы улучшает прогнозирование его принадлежности к доброкачественной или злокачественной группе на 80%, к отдельным нозологическим единицам на 65%; знание сигнала опухоли в ГБФ на 91,8% и 54,6%, соответственно. Наиболее сильная связь между характером сигнала опухоли и ее природой (доброкачественная или злокачественная) была характерна для ГБФ (V для ГБФ = 0,939; V для динамических фаз = 0,860).
На основании данных ROC-анализа были рассчитаны показатели диагностической эффективности для изучаемых признаков. При условии, что гиперваскулярный персистирующий тип контрастирования в динамические фазы характерен только для доброкачественных солидных опухолей, а все остальные типы - для злокачественных солидных опухолей, было установлено, что чувствительность методики составляет 93,1%, специфичность 91,8%, точность 92,7%, положительная прогностическая значимость 95,9%, отрицательная прогностическая значимость 86,7%. При условии, что для доброкачественных солидных опухолей характерны I - IV типы характера сигнала очага в ГБФ, а для злокачественных - только V - VII типы, аналогичные показатели для сигнала опухоли в ГБФ составили: 98,9%, 94,1%, 97,3%, 97,2%, 97,6%, соответственно.
Также мы определили диагностическую ценность характера сигнала опухоли в ГБФ при дифференциальной диагностике гиперваскулярных солидных образований печени: с персистирующим типом контрастирования и с признаками вымывания контрастного вещества. В первом случае по данным ROC-анализа площадь под кривой составила 0,915, во втором случае AUC = 0,706. Из таблицы 1 видно, что диагностическая ценность характера сигнала очага в ГБФ снижается при дифференциальной диагностике доброкачественных и злокачественных солидных опухолей с признаками вымывания КВ: специфичность снижается до 50%, отрицательная прогностическая значимость до 66,7%.
Таким образом, характер сигнала опухоли в ГБФ имеет высокие диагностические показатели при дифференциальной диагностике гиперваскулярных образований печени с персистирующим типом контрастирования.
Таблица 1. Диагностические показатели для характера сигнала очага в ГБФ при дифференциальной диагностике гиперваскулярных солидных опухолей
|
Показатели Тип |
AUC |
Se |
Sp |
Ac |
PPV |
NPV |
|
Гиперваскулярный персистирующий тип |
0,915 |
91,7% |
100% |
98,9% |
100% |
98,7% |
|
Гиперваскулярный тип с вымыванием КВ |
0,706 |
98,4% |
50% |
95,4% |
96,8% |
66,7% |
На Рис. 4 приведен пример, когда при дифференциальной диагностике метастаза ГИСО от ФНГ решающую роль имеет ГБФ. МРТ с гадоксетовой кислотой было выполнено с целью точной предоперационной оценки локализации и количества метастазов.
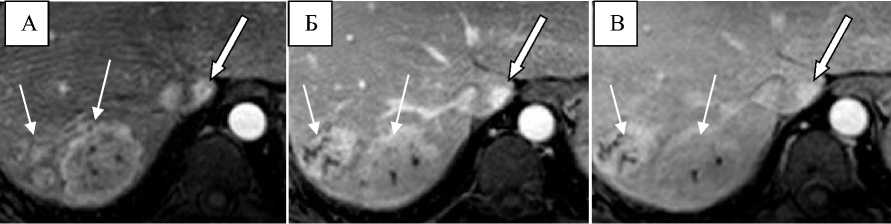
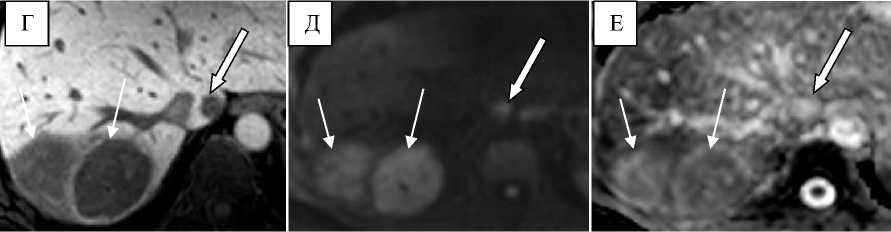
Рисунок 4. Метастазы ГИСО тощей кишки. А - артериальная фаза, в I сегменте визуализируется достаточно однородное гиперваскулярное образование (стрелка), которое сохраняет гиперинтенсивный сигнал в портальную (Б) и транзиторную (В) фазы (стрелка). Без данных о характере сигнала в ГБФ невозможно однозначно провести дифференциальный диагноз с доброкачественной опухолью (ФНГ). На этом же уровне (А - В), в VII сегменте дифференцируются две гиперваскулярные опухоли неоднородной структуры (тонкие стрелки), злокачественную природу которых можно предположить уже по динамическим фазам контрастирования. Г - ГБФ20, во всех выявленных опухолях отсутствует накопление ГСКВ, что свидетельствует в пользу их единой природы (метастазы ГИСО). Д - ДВИ (b=600 с/мм2), все опухоли гиперинтенсивны относительно паренхимы печени и на ИКД-карте (Е) имеют гиперинтенсивный сигнал .
Обсуждение
В нашем исследовании доброкачественные солидные опухоли в подавляющем большинстве случаев были представлены ФНГ. ФНГ содержат функционирующие гепатоциты и желчные канальцы, следовательно, накапливают гадоксетовую кислоту в
ГБФ [1, 6]. По нашим данным они характеризуются в ГБФ однородным изо- или гиперинтенсивным сигналом, неравномерным изо- или гиперинтенсивным сигналом с гипоинтенсивными зонами, кольцевидным накоплением контрастного вещества. В результате такой особенности визуализации ГБФ имеет высокие диагностические показатели при дифференциальной диагностике ФНГ от гиперваскулярных злокачественных солидных опухолей с персистирующим типом контрастирования.
Интересно отметить, что в исследовании C.S. van Kessel и соавт. ФНГ в единичном наблюдении имела слабо гипоинтенсивный сигнал в ГБФ [15]. По данным других авторов [17] в 10 - 12% случаев ФНГ не накапливали контрастный препарат в ГБФ. В нашем исследовании ни одна ФНГ не имела гипоинтенсивный сигнал в ГБФ. Возможно, из-за изоинтенсивного кольцевидного ободка в ГБФ сигнал от ФНГ был расценен авторами [17] как гипоинтенсивный.
Другими представителями доброкачественных солидных опухолей печени в нашем исследовании являлись ГЦА. Они характеризовались, преимущественно, гипоинтенсивным сигналом в ГБФ. Это объясняется особенностями строения опухоли (отсутствием желчных канальцев) и сниженной экспрессией мембранных транспортёров контрастного вещества [16]. Однако некоторые ГЦА, в частности воспалительного и β-катенин активированного типа, могут быть изо- или гиперинтенсивными в ГБФ из-за сохранённой или повышенной экспрессии мембранных переносчиков [4, 5]. Мы наблюдали две ГЦА, которые накапливали контрастный препарат в ГБФ. Одна из них была воспалительного типа, другая - β-катенин активированная, с признаками трансформации в пределах опухоли в очаг высокодифференцированного ГЦР, в связи с чем при статистической обработке данных она была отнесена к ГЦР.
Стоит отметить, что другие доброкачественные солидные опухоли (например, ангиомиолипома), которые не были представлены в нашей работе, не будут накапливать контрастный препарат в ГБФ, потому что в их структуре отсутствуют гепатоциты и желчные канальцы. Гемангиомы не являются истинными жидкостными образованиями:
они содержат эндотелий сосудов, фиброзные перегородки, однако их дифференциальная диагностика, как правило, не вызывает сложностей, поэтому они не были включены в исследование.
Среди злокачественных солидных опухолей в нашем исследовании преобладали метастазы, которые чаще всего характеризуются отсутствием накопления гадоксетовой кислоты в ГБФ, что связано с отсутствием в них гепатоцитов и желчных протоков. В то же время для метастазов колоректального рака, РМЖ и НЭО было отмечено повышение интенсивности сигнала в центральном отделе в ГБФ, за счёт чего они имели мишеневидную структуру. Данное явление связывают с накоплением контрастного вещества во внеклеточном пространстве опухоли за счёт некроза или выраженной десмопластической реакции [7, 9].
ГЦР чаще всего не накапливает гадоксетовую кислоту в ГБФ [10, 11], однако в высоко и умеренно дифференцированной опухоли может отмечаться накопление контрастного вещества [10]. Из-за схожей картины ГЦР и ГЦА в ГБФ, применение гадоксетовой кислоты для дифференциации двух нозологий не представляется целесообразным. Об этом же говорят рассчитанная нами низкая специфичность (50%) и отрицательная прогностическая значимость (66,7%) при дифференциальной диагностике гиперваскулярных солидных опухолей с вымыванием контрастного вещества.
ХЦР, как и метастазы, в нашем исследовании наиболее часто характеризовались гипоинтенсивным сигналом в ГБФ, что объясняется отсутствием в структуре опухоли гепатоцитов [12]. Также для ХЦР был характерен мишеневидный паттерн, что связывают с накоплением контрастного препарата во внеклеточном пространстве на фоне выраженного фиброзного компонента [8].
Гемангиоэндотелиома и ангиосаркома являются редкими сосудистыми опухолями, но освещение их паттернов контрастирования при МРТ с гадоксетовой кислотой, на наш взгляд, необходимо. Отсутствие гепатоцитов в структуре гемангиоэндотелиомы и ангиосаркомы приводит к гипоинтенсивному сигналу опухоли в ГБФ.
Заключение
Характер сигнала солидной опухоли в ГБФ обладает высокими диагностическими показателями при дифференциации ее доброкачественной или злокачественной природы, в особенности, при дифференциальной диагностике ФНГ от злокачественных гиперваскулярных опухолей с персистирующим характером накопления КВ (метастазы НЭО, ангиосаркома и др.).
Список литературы Роль магнитно-резонансной томографии с гепатоспецифичным контрастным препаратом в дифференциальной диагностике солидных опухолей печени
- Багненко С.С. Комплексное магнитно-резонансное исследование в выявлении и дифференциальной диагностике очаговых поражений печени: дис.. докт. мед. наук: 14.01.13 / СПб. 2014. 267 с.
- Котляров П.М., Сергеев Н.И., Солодкий В.А., Шимановский Н.Л. Магнитнорезонансная томография печени с гепатотропными парамагнетиками в выявлении очаговой патологии печени и определении ее природы. Медицинская визуализация. 2011. № 2. С. 26-33.
- Ратников В.А., Бакушкин И.А., Скульский С.К. и др. Магнитно-резонансная томография с применением гадоксетовой кислоты: новые возможности диагностики заболеваний гепатобилиарной системы. Анналы хирургической гепатологии. 2008. № 4. С. 85-95.
- Agarwal S., Fuentes-Orrego J.M., Arnason T., et al. Inflammatory hepatocellular adenomas can mimic focal nodular hyperplasia on gadoxetic acid-enhanced MRI. AJR Am J Roentgenol. 2014. V. 203. No. 4. P. W408-414.
- Fukusato T. Soejima Y., Kondo F. Preserved or enhanced OATP1B3 expression in hepatocellular adenoma subtypes with nuclear accumulation of β-catenin. Hepatol Res. 2015. V. 45. No. 10. P. 32-42.
- Goodwin M.D., Dobson J.E., Sirlin C.B., et al. Diagnostic challenges and pitfalls in MR imaging with hepatocyte-specific contrast agents. Radiographics. 2011. V. 31. No. 6. P. 1547-1568.
- Ha S., Lee C.H., Kim B.H., et al. Paradoxical uptake of Gd-EOB-DTPA on the hepatobiliary phase in the evaluation of hepatic metastasis from breast cancer: is the "target sign" a common finding? Magn Reson Imaging. 2012. V. 30. No. 8. P. 1083- 1090.
- Jeong H.T., Kim M.J., Chung Y.E., et al. Gadoxetate disodium-enhanced MRI of mass- forming intrahepatic cholangiocarcinomas: imaging-histologic correlation. AJR Am J Roentgenol. 2013. V. 201. No. 4. P. W 603-611.
- Kim A., Lee C.H., Kim B.H., et al. Gadoxetic acid-enhanced 3.0T MRI for the evaluation of hepatic metastasis from colorectal cancer: metastasis is not always seen as a "defect" on the hepatobiliary phase. Eur J Radiol. 2012. V. 81. No. 12. P. 3998-4004.
- Lee S.A., Lee C.H., Jung W.Y., et al. Paradoxical high signal intensity of hepatocellular carcinoma in the hepatobiliary phase of Gd-EOB-DTPA enhanced MRI: initial experience. Magn Reson Imaging. 2011. V. 29. No. 1. P. 83-90.
- Motosugi U., Bannas P., Sano K., Reeder S.B. Hepatobiliary MR contrast agents in hypovascular hepatocellular carcinoma. J Magn Reson Imaging. 2015. V. 41. No. 2. P. 251-265.
- Péporté A.R., Sommer W.H., Nikolaou K., et al. Imaging features of intrahepatic cholangiocarcinoma in Gd-EOB-DTPA-enhanced MRI. Eur J Radiol. 2013. V. 82. No. 3. P. e101-106.
- Schwope R.B., May L.A., Reiter M.J., et al. Gadoxetic acid: pearls and pitfalls. Abdom Imaging. 2015. V. 40. No. 6. P. 2012-2029.
- Van Beers B.E., Pastor C.M., Hussain H.K. Primovist, Eovist: what to expect? J Hepatol. 2012. V. 57. No. 2. P. 421-429.
- van Kessel C.S., de Boer E., ten Kate F.J., et al. Focal nodular hyperplasia: hepatobiliary enhancement patterns on gadoxetic-acid contrast-enhanced MRI. Abdom Imaging. 2013. V. 38. No. 3. P. 490-501.
- Yoneda N., Matsui O., Kitao A., et al. Benign Hepatocellular Nodules: Hepatobiliary Phase of Gadoxetic Acid-enhanced MR Imaging Based on Molecular Background. Radiographics. 2016. V. 36. No. 7. P. 2010-2027.
- Zech C.J., Grazioli L., Breuer J., et al. Diagnostic performance and description of morphological features of focal nodular hyperplasia in Gd-EOB-DTPA-enhanced liver magnetic resonance imaging: results of a multicenter trial. Invest. Radiol. 2008. V. 43. No. 7. P. 504-511.


