Роль маркеров воспаления и пролиферации в диагностике резистентного гиперактивного мочевого пузыря у женщин
Автор: Тетерина Т.А., Аполихина И.А., Глыбочко П.В., Безнощенко О.С., Кречетова Л.В., Миркин Я.Б.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Инфекционно-воспалительные заболевания
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
Актуальность проблемы. В последнее время в отечественной и зарубежной литературе большое внимание уделяется изучению цитокинов, некоторые из которых, в частности, интерлейкин 8 (ИЛ-8), имеют доказанную провоспалительную активность. Ряд авторов высказали мнение о том, что мочевой фактор роста нервов (м - ФРН) может также являться медиатором в модуляции уротелиального ответа на воспаление и порога восприятия ургентности. Цель исследования. Изучить роль маркеров воспаления и пролиферации (ИЛ-8 и м -ФРН) в диагностике резистентного гиперактивного мочевого пузыря (ГМП). Материалы и методы. Отобрано 313 образцов мочи, из них 80 образцов мочи в контрольной группе женщин и 79 - в исследуемых группах с резистентным ГМП и хроническим циститом (ХЦ) до начала терапии. Все пациентки получали антибактериальную терапию в течение 10 дней. Впоследствии в исследуемых группах было отобрано 79 проб мочи через 2 недели и повторно через 6 месяцев после лечения. Результаты. Установлено, что в группе женщин с ХЦ уровень ИЛ-8 в моче был в 2,4 раза выше, чем в контрольной группе, а в группе с резистентным ГМП - в 1,7 раза (р
Резистентный гиперактивный мочевой пузырь, хронический цистит, интерлейкин-8, мочевой фактор роста нервов
Короткий адрес: https://sciup.org/142187929
IDR: 142187929
Текст научной статьи Роль маркеров воспаления и пролиферации в диагностике резистентного гиперактивного мочевого пузыря у женщин
-
1 ФГБУ «Научный центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова» Минздрава России
-
2 ГОУ ВПО Первый Московский государственный медицинский университет имени И.М. Сеченова
-
3 Международный Медицинский Центр "УРО-ПРО", Краснодарский край, г. Армавир
роническое воспаление мочевого пузыря сопровождается инфильтрацией стенки мочевого пузыря мононуклеарами (макрофагами, лимфоцитами, тучными и плазматическими клетками), приводящей к необратимым изменениям в его тканях – фиброзу, гиперактивности детрузора и ги-пералгезии [1].
Слизистая оболочка мочевого пузыря, постоянно подвергающаяся растяжению и сокращениям, покрыта уротелием, который содержит многочисленные рецепторы и уроплакины, и выполняет защитную функцию [2, 3].
В структуре уротелия имеется слой гликозаминогликан–хондроитин сульфатов, гиалуроната натрия, гликопротеинов и муцинов для защиты от повреждающих факторов и предотвращения адгезии уропатогенов к уротелию. Его повреждение сопровождается кровоизлиянием и продукцией цитокинов, запускающих пролиферацию и активацию тучных клеток [4, 5, 6, 7].
В последнее время как в отечественной, так и в зарубежной литературе большое внимание уделяется изучению цитокинов – биологически активных веществ белковой природы, выполняющих медиаторные функции в развитии ряда патологических процессов, в том числе воспаления. Некоторые цитокины, в частности интерлейкин 1β (ИЛ-1β), интерлейкин 8 (ИЛ-8), фактор некроза опухоли α (ФНО-α), имеют доказанную провоспали-тельную активность, повышение их концентрации в крови и биологических жидкостях является маркером воспалительного процесса. ИЛ – 8, секретируемый клетками мочевого пузыря и почек, играет важную роль в активации миграции нейтрофилов при внедрении уропатогенов [8, 9]. Пик экспрессии большинства цитокинов и хемокинов достигается примерно через 24 ч после внедрения уропатогена, и возвращается к исходным показателям через 2 недели [9]. ИЛ-8 относится к СХС-хемокинам и является мощным хемотаксическим и активирующим фактором для нейтрофилов. Это самый ранний провос-палительный цитокин, продуцируемый многими клетками, включая моноциты, макрофаги, Т-клетки, нейтрофилы, фибробласты, эндотелиальные клетки, керати-ноциты, гепатоциты, астроциты и хондроциты. Наряду с другими цитокинами, ИЛ-8 участвует в процессах стимуляции и дегрануляции лейкоцитов, ангиогенезе, способствует миграции фагоцитов в очаг воспаления и, по мнению ряда авторов [4, 6, 7, 9], может иметь диагностическое значение при инфекциях урогенитального тракта.
Повышение концентрации ИЛ – 8 в моче может являться маркером воспаления не только при хроническом цистите, но и латентного воспаления у пациентов с симптомами гиперактивного мочевого пузыря (ГМП). По мнению некоторых исследователей, определение уровня данного интерлейкина целесообразно включать в алгоритм обследования пациенток с ГМП для выбора оптимальной и эффективной патогенетически обоснованной терапии [10].
В последние годы появляется все больше данных, подтверждающих инфекционную этиологию ГМП. Впервые в исследовании Khasriya RK. et al. [11], а затем другими исследователями, было выявлено, что внутриклеточная бактериальная колонизация может быть причиной ГМП.
В настоящее время многими исследователями [15, 16, 17, 18, 19] также предлагается рассматривать мочевой фактор роста нервов (м – ФРН) в качестве биомаркера ГМП. М – ФРН – это нейротрофический фактор, продуцируемый уротелием и гладкомышечными клетками.
Хроническое воспаление сопровождается повышением секреции м-ФРН у пациентов с ГМП и детрузорной гиперактивностью, приводящим к морфологическим изменениям в системе чувствительных и двигательных нейронов мочевого пузыря и, следовательно, к детрузорной гиперактивности [12, 13, 14]. Считается, что м-ФРН играет ключевую роль в корреляции между воспалением и болевой импульсацией, так как он продуцируется клетками уротелия, гладкомышечными и тучными клетками, при этом активируя их дегрануляцию и пролиферацию [15].
В многочисленных исследованиях повышенный уровень м-ФРН обнаружен при таких заболеваниях, как ГМП, интерстициальный цистит и простатит [8, 16, 17, 18, 19].
Некоторыми авторами [8, 16, 17] высказано мнение о том, что уровень м-ФРН может играть важную роль во взаимосвязи между субуротелиальными чувствительными волокнами и гиперчувствительностью детрузора. Также м-ФРН является медиатором в модуляции уротелиального ответа на воспаление и порога восприятия ургентности.
В последнее время в медицинской литературе все чаще появляется термин «резистентный гиперактивный мочевой пузырь», характеризующийся сохранением симптоматики после проведения пациенткой лечения более, чем двумя М – холиноблокаторами с тренировкой мочевого пузыря в течение более 1 года [20].
Liu HT. et al. [19] исследовали уровень м-ФРН в сыворотке крови и моче 34 женщин, страдающих резистентным ГМП. Было выявлено значительное повышение уровня м-ФРН в сыворотке и моче по сравнению с контрольной группой (31 здоровая женщина). Значимых отличий в уровне м-ФРН среди женщин с «сухим» и «мокрым» типами ГМП не выявлено. Также после трехмесячного курса лечения солифенацином уровень м-ФРН оставался стабильно высоким, вследствие чего авторы сделали предпо- ложение, что резистентный ГМП может быть вызван хронической инфекций.
Исходя из изложенного, целью нашего исследования было изучить роль маркеров воспаления и пролиферации (ИЛ-8 и м-ФРН) в диагностике резистентного ГМП.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное рандомизированное сравнительное открытое исследование были включены 79 женщин, из которых у 32 подтвержден диагноз резистентного ГМП, а у 47 – был хронический неспецифический бактериальный цистит. С использованием таблицы случайных чисел была проведена блочная рандомизация, вследствие чего пациентки были разделены на 4 группы:
I группа – 19 женщин с хроническим циститом, которым был проведен 10-дневный курс антибактериальной терапии с учетом чувствительности микроорганизма, после которого произведены 4 внутрипузырные инстилляции гиалуроната натрия по 1 процедуре в неделю. При этом 7 (36,8%) пациенток получали левофлоксацин по 500 мг 1 раз в день внутрь, 11 (57,9%) – цефиксим по 400 мг 1 раз в день внутрь и 1 (5,3%) – монурал 3,0 г внутрь однократно в сочетании с нитрофурантоином по 100 мг 2 раза в день в течение 7 дней (в связи с наличием микст-инфекции и разной чувствительности микроорганизмов).
II группа – 28 женщин с хроническим циститом, которым был проведен только 10-дневный курс антибактериальной терапии с учетом чувствительности микроорганизма: 11 (39,3%) пациенток принимали левофлоксацин по 500 мг 1 раз в день внутрь и 16 (57,1%) – цефик-сим по 400 мг 1 раз в день внутрь.
III группа – 17 женщин с резистентным ГМП, которым была проведена комплексная терапия антибактериальными препаратами и курс из 4-х внутри-пузырных инстилляций гиалуроната натрия. 7 (41,2%) пациенткам был назначен 10-дневный курс левофлоксацина по 500 мг 1 раз в день внутрь и 10 (58,8%) – 10-дневный курс цефиксима по 400 мг 1 раз в день внутрь.
IV группа – 15 женщин с резистентным ГМП получили только 10дневный курс антибактериальной терапии с учетом чувствительности микроорганизма. При этом 6 (40%) принимали левофлоксацин по 500 мг 1 раз в день внутрь и 9 (60%) – цефиксим по 400 мг
1 раз в день внутрь.
Всем 36 пациенткам I и III групп назначали курс из 4-5 внутрипузырных введений раствора гиалуроната натрия по 50 мл 1 раз в неделю. После самостоятельного опорожнения мочевого пузыря и обработки наружных половых органов 0,2% раствором октенисепта проводили катетеризацию мочевого пузыря стерильным уретральным катетером. После введения раствора гиалуроната натрия пациенткам рекомендовали не опорожнять мочевой пузырь в течение 1 – 2-х часов для увеличения времени экспозиции препарата.
Во всех группах проводилось динамическое наблюдение через 2 недели, 6 и 12 мес после проведенного лечения.
Для количественного определения м-ФРН и ИЛ-8 было отобрано 313 образцов мочи, из них 80 образцов мочи женщин контрольной группы (средний возраст 36,5±13,3 лет), не имеющих в анамнезе и в момент обследования заболеваний урогенитального тракта и признаков инфекции мочевыводящих путей по данным экспресс-теста; 79 образцов мочи женщин исследуемых групп до начала терапии и затем через 2 недели и 6 мес после лечения (4 пациентки не явились на 3-й визит), (всего 233 пробы). Забор мочи осуществлялся в стерильную пробирку объемом 10 мл, после чего полученные биообразцы на льду в течение 15-20 мин доставлялись в лабораторию. Образцы центрифугировались в течение 10 мин при 3000 об/мин и температуре 4оС. Для хранения супернатанты разливали в пробирки типа «Эппендорф» по 1мл, хранили до анализа при температуре минус 80 оС.
Для количественного определения м-ФРН в моче использовали набор Human beta-NGF (beta nerve growth factor) ELISA, RayBio (США).
Для определения ИЛ-8 в моче использовали набор реагентов для имму-ноферментного определения концентрации интерлейкина-8 в сыворотке крови и моче, ВекторБест (Россия).
Измерение оптической плотности (ОП) в обоих случаях проводилось с помощью планшетного спектрофотометра Expert plus (Австрия).
При описании полученных результатов определяли среднее арифметическое (М), ошибку среднего (m), среднее квадратичное отклонение (σ), частоты встречаемости качественных признаков (%, доли единицы), ассиметрию и эксцесс с их ошибками, моду, медиану, квантили □ и 10-й с 90-м персентилем. Показатели асимметрии и эксцесса позволили оценить характер распределения, в первую очередь, его принадлежность к нормальному.
Достоверность различий между группами по количественным признакам оценивали с помощью непараметрических критериев Краскала-Уоллиса и Манна-Уитни. Для определения различий между номинальными показателями (%) использовали критерий Пирсона Хи-квадрат и точный критерий Фишера для малых выборок. В случае последовательных измерений одного и того же пациента использовались критерии Фридмана и Вилкоксона для парных случаев, а так же критерий Мак-Немара. Различия между сравниваемыми величинами признавалось значимыми при р<0,05. Учитывался эффект множественных сравнений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты исследования концентрации ИЛ-8 в моче
Измерение концентрации ИЛ-8 в моче имеет диагностическое значение при инфекциях урогенитального тракта [4, 6, 7, 9]. Мониторинг содержания этого показателя в моче позволяет оценить степень выраженности воспалительного процесса, поэтому мы исследовали уровень ИЛ-8 у пациенток с резистентным ГМП и хроническим циститом в сравнении со здоровыми женщинами и в динамике для оценки эффективности проводимого лечения.
Нами было установлено, что в группе женщин с хроническим циститом уро-
Таблица 1. Значения ИЛ-8 в моче пациенток исследуемых групп до лечения
|
Исследуемый параметр |
Группа I (ХЦ+ГК) (n = 19) |
Группа II (ХЦ) (n = 28) |
Группа III (рГМП+ГК) (n = 17) |
Группа IV (рГМП) (n = 15) |
Контроль (n = 80) |
|
Концентрация ИЛ-8, пг/мл |
59,5±20,5 |
53,3±16 |
45,4±12,5 |
32,5±9,9 |
23,7±2,9 |
Примечание. Данные представлены как среднее ± стандартное отклонение; ХЦ – хронический цистит; рГМП – резистентный ГМП; ГК – инстилляции гиалуроновой кислоты; n – количество пациенток
Таблица 2. Концентрация ИЛ-8 в моче пациенток исследуемых групп после лечения
|
Группа пациенток |
Визит 2 (через 2 недели после лечения), пг/мл |
Визит 3 (через 6 месяцев после лечения), пг/мл |
|
I (ХЦ+ГК) (n = 19) |
23,1±8,5 |
9,4±2,8 |
|
II (ХЦ) (n = 28) |
24,5±8 |
11,3±3,8 |
|
III (рГМП+ГК) (n = 17) |
29,9±10,8 |
11,7±3,2 |
|
IV (рГМП) (n = 15) |
26,9±10,1 |
20,5±6,9 |
Примечание. Данные представлены как среднее ± стандартное отклонение; ХЦ – хронический цистит; рГМП – резистентный ГМП; ГК – инстилляции гиалуроновой кислоты; n – количество пациенток
вень ИЛ-8 в моче был в 2,4 раза выше, чем в контрольной группе, а в группе с резистентным ГМП – в 1,7 раза (р < 0,05). Таким образом, мы сделали вывод о наличии и ведущей роли воспалительного компонента не только при хроническом цистите, но и при резистентном ГМП (табл. 1).
При делении на 4 группы с учетом проведения внутрипузырных инстилляций гиалуроната натрия статистически значимых различий между группами не выявлено. Отсутствие статистически значимых результатов в данном случае связано, по-видимому, с небольшим количеством пациенток в группах.
Всем пациенткам был проведен вышеописанный курс лечения, включающий антибактериальную терапию с учетом чувствительности микроорганизма, и 4 внутрипузырные инстилляции гиалуроната натрия у пациенток групп 1 и 3.
Через 2 нед и через 6 мес после проведенной терапии у всех пациенток была повторно исследована концентрация ИЛ-8 в моче (табл. 2).
Выявлено статистически значимое снижение концентрации ИЛ-8 в моче пациенток исследуемых групп на 2 и 3 визите было по сравнению с исходной концентрацией.
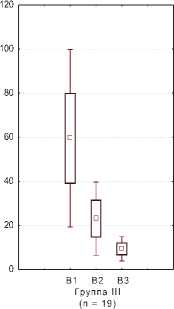
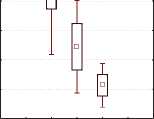
Отмечалось статистически значимая положительная динамика изменения концентрации ИЛ-8 в динамике в I и II группах женщин с хроническим циститом (рис. 1), в то время как в III и IV группах с резистентным ГМП статистически значимой разницы не обнаружено, однако отмечается тенденция к уменьшению уровня ИЛ-8 (рис. 2). Данный факт может быть
SO
р < 0,01
o Mean
□ Mean=SE
T Mean-1,96*SE
B1 B2 83
Группа II (n = 28)
Рис. 1. Динамика концентрации ИЛ-8 в моче у женщин с хроническим циститом (n = 47)
ВI B2 B3
Группа III (n- 17)
p > 0,05
o Mean
□ Mean=SE
I Mean=1.96*SE
ВI B2 B3 Группа IV (n- 15)
Рис. 2. Динамика концентрации ИЛ-8 в моче у женщин с резистентным ГМП (n = 32)
обусловлен недостаточностью проведения антибактериальной и терапии гиалуронатом натрия, снижением эффективности последнего в динамике с течением времени.
В I группе женщин наблюдалось снижение концентрации ИЛ-8 в моче в 6 раз (с 59,5±5 до 9,4±2,8 пг/мл), во II группе – в 4,7 раза (с 53,3±16 до 11,3±3,8 пг/мл), в 3 группе – в 3,9 раза (с 45,4±12,5 до 11,7±3,2 пг/мл) и в 4-й – в 1,6 раза (с 32,5±9,9 до 20,5±6,9 пг/мл) (р < 0,01). Таким образом, в I и III группах пациенток эффективность проведенной терапии оказалась статистически значимо выше, чем во II и IV, что, вероятно, связано с проведением курса терапии гиалуронатом натрия, приводящего к восстановлению поврежденного слоя уротелия.
При проведении корреляционного анализа также была обнаружена слабая прямая зависимость между концентрацией ИЛ-8 в моче и количеством лейкоцитов в моче (r = 0,25; p < 0,05). Таким образом, нами было отмечено, что при повышении лейкоцитов в моче увеличивается концентрация ИЛ-8, что еще раз подтверждает инфекционно-воспалительный генез заболеваний.
Результаты исследования концентрации м-ФРН в моче
Увеличение уровня м-ФРН отмечается в ткани мочевого пузыря и в образцах мочи у пациентов с ГМП. Уровень м-ФРН может рассматриваться в качестве значимого биомаркера для диагностики и мониторирования прогрессии ГМП. Также в многочисленных исследованиях обсуждается роль м-ФРН в качестве маркера воспаления.
В нашем исследовании средние значения м-ФРН были нормированы на концентрацию креатинина в моче по формуле: м-ФРНн= м-ФРН/ креатинин.
При оценке полученных данных установлено, что концентрация м-ФРН до лечения в группах пациенток статистически значимо не различалась (табл. 3), что может подтверждать наше предположение о роли воспалительной реакции при резистентном ГМП как и при хроническом цистите. Отсутствие различий концентрации данного биомаркера, возможно, свидетельствует об одинаковой степени выраженности процесса в тканях при данных состояниях.
Сравнительный анализ уровня м-ФРН после лечения в исследуемых группах также не выявил статистически значимых различий.
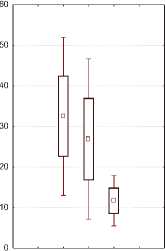
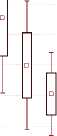
Тем не менее, в I и III группах женщин, в комплекс терапии которых входили по 4 внутрипузырные инстилляции гиалуроната натрия, нами была обнаружена тенденция к некоторому увеличению экспрессии м-ФРН, а в группах без назначения инстилляций гиалуроновой кислоты – наоборот, к уменьшению. В некоторых исследованиях показано, что экспрессия м-ФРН увеличивается при воспалительных заболеваниях, при которых он может играть роль ингибитора воспалительного процесса [21]. Однако при сравнительной суммарной оценке динамики изменения концентрации м-ФРН статистически значимых различий между группами нами не выявлено (рис. 3).
Таблица 3. Концентрация м-ФРНн в исследуемых группах
|
Группа пациенток |
Концентрация м-ФРНн до лечения, пг/мл |
Концентрация м-ФРНн после лечения, пг/мл |
|
I (ХЦ+ГК) (n = 19) |
0,8±0,3 |
1,1±0,5 |
|
II (ХЦ) (n = 28) |
0,9±0,2 |
0,8±0,2 |
|
III (рГМП+ГК) (n = 17) |
1±0,2 |
1,3±0,5 |
|
IV (рГМП) (n = 15) |
0,9±0,2 |
0,5±0,2 |
Примечание. Данные представлены как среднее ± стандартное отклонение; n – число пациенток в групп; ХЦ – хронический цистит, ГК – гиалуроновая кислота, рГМП – резистентный ГМП
2,6
2,4
2,2
2,0
1,8
1,6
1,4
1,2
1,0
0,8
0,6
0,4
0,2
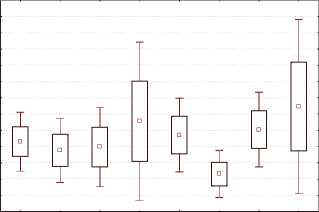
Bl B2 Bl B2 Bl B2 Bl B2
Группа II Группа I Группа IV Группа III (п = 28) (п=19) (п=15) (п=17)
-
□ .Mean
-
□ Mean+SE Р > 0’05
I Mean+1.96*SE
Рис.3. Концентрация м-ФРН у женщин исследуемых групп до и после лечения
При проведении корреляционного анализа Спирмена была обнаружена слабая прямая зависимость между концентрацией м-ФРН в моче и длительностью заболевания (r = 0,27; p < 0,05), а также умеренная прямая зависимость между концентрацией м-ФРН в моче и количеством рецидивов в год после лечения (r = 0,34; p < 0,05). Таким образом, нами было отмечено, что чем длительнее период заболевания, тем выше концентрация м-ФРН в моче, и тем больше количество рецидивов.
ОБСУЖДЕНИЕ
В своей работе мы сочли целесообразным включить определение концентрации ИЛ-8 в моче в перечень обследования пациенток и обнаружили, что в обеих исследуемых группах уровень ИЛ-8 в моче был в 2 раза выше, чем в контрольной группе. Таким образом, мы сделали вывод о наличии и ведущей роли воспалительного компонента не только при хроническом цистите, но и при рГМП. Немаловажным является и тот факт, что при повышении лейкоцитов в моче увеличивается концентрация ИЛ-8, что еще раз подтверждает инфекционно-воспалительный генез заболеваний.
В многочисленных исследованиях обсуждается роль м-ФРН в качестве маркера воспаления [16, 17, 18, 19]. При анализе собственных результатов относительно кон- центрации м-ФРН до лечения в группах пациенток значимых различий не отмечалось, что может подтверждать наше предположение о роли воспалительной реакции при рГМП как и при хроническом цистите. Также нами было отмечено, что чем длительнее период заболевания, тем выше концентрация м-ФРН в моче, и тем больше количество рецидивов наблюдается после проведенного лечения. Таким образом, определение мочевого уровня м-ФРН может рассматриваться как значимый биомаркер для диагностики и мониторирования прогрессии ГМП, а также прогнозирования эффективности лечения хронического цистита.
При сравнительной оценке концентрации ИЛ-8 в динамике до и после лечения в группах женщин с хроническим циститом мы отметили статистически значимую положительную динамику. Несмотря на то, что у пациенток с рГМП также отмечается тенденция к уменьшению уровня ИЛ-8, однако статистически значимой разницы не обнаружено. Данный факт может быть обусловлен недостаточностью проведения курсов антибактериальной и терапии гиалуронатом натрия, снижением эффективности последнего в динамике с течением времени. Кроме того, в группах пациенток, которым проводилась комбинированная терапия, эффективность оказалась статистически значимо выше, что, вероятно, связано с проведением курса терапии гиалуронатом натрия, который восстанавливает поврежденный слой уротелия.
Однако при анализе изменения концентрации м-ФРН в группах женщин, в комплекс терапии которых входили 4 внут-рипузырные инстилляции гиалуроната натрия, нами была обнаружена тенденция к некоторому увеличению экспрессии м-ФРН, а в группах без назначения инстилляций гиалуроновой кислоты – наоборот, к уменьшению. В некоторых исследованиях показано, экспрессия м-ФРН увеличивается при воспалительных заболеваниях, при которых он играет роль ингибитора воспаления [21].
Таким образом, применение внут-рипузырных инстилляций гиалуроната натрия в комплексной терапии хронического цистита и резистентного ГМП значительно повышает эффективность лечения. Комбинированная терапия должна проводиться поэтапно: I этап – 10-дневный курс антибактериальной терапии, выбор антибиотика осуществляется согласно чувствительности выделенного микроорганизма по данным □ культурального исследования мочи и наличия урогенитальной инфекции при исследовании отделяемого уретры методом ПЦР, затем II этап – курс из 4 – 5 внутри-пузырных введений раствора гиалуроната натрия по 50 мл 1 раз в неделю. В связи с тем, что данная терапия недостаточно купирует некоторые симптомы резистентного ГМП (ургентность, количество мочеиспусканий), вероятно, необходимо проведение дополнительных методов лечения на последующих этапах (длительный прием М-холиноблока-торов, нейростимуляция, тренировка мочевого пузыря и мышц тазового дна и др.). При этом на начальном этапе ведения пациенток с резистентным ГМП, как и с хроническим циститом, необходимо проведение именно патогенетически обоснованной комбинированной терапии, состоящей из 10-дневного курса антибактериальной терапии и 4-5 внутрипузырных инстилляций гиалуроната натрия.
ЗАКЛЮЧЕНИЕ
Определение маркеров воспаления и пролиферации (ИЛ-8 и м-ФРН) в моче может быть рекомендовано для использования в качестве диагностических критериев и мониторирования резистентного ГМП, а также прогнозирования эффективности терапии как хронического цистита, так и резистентного ГМП. □
Резюме:
Список литературы Роль маркеров воспаления и пролиферации в диагностике резистентного гиперактивного мочевого пузыря у женщин
- Grover S., Srivastava A., Lee R., Tewari A.K., Te A.E. Role of inflammation in bladder function and interstitial cystitis.//Ther Adv Urol. 2011. Vol. 3, N 1. P. 19 -33.
- Apodaka G. The uroepithelium: not just a passive barrier.//Traffic. 2004. Vol. 5, N 3. P. 117 -128.
- Parsons C.L. The role of the urinary epithelium in the pathogenesis of interstitial cystitis/prostatitis/urethritis.//Urol. 2007. Vol. 69, Suppl. 4. P. 9 -16.
- Graham E., Chai T.C. Dysfunction of bladder urothelium and bladder urothelial cells in inrestitial cystitis.//Curr Urol Rep. 2006. Vol. 7, N 6. P. 440 -446.
- Sivick K.E., Mobley H.L. Waging war against uropathogenic Escherichia coli: winning back the urinary tract (minireview).//Infect Immun. 2010. Vol. 78, N 2. P. 568 -585.
- Hurst R.E. Structure, function and pathology of proteoglycans and glycosamino-glycans in the urinary tract.//World J Urol. 1994. Vol. 12, N 1. P. 3 -10.
- Lilly J.D., Parsons C.L. Bladder surface glycosaminoglycans is a human epithelial permeability barrier.//Surg Gynec Obstet. 1990. Vol. 171. P. 2543 -2551.
- Janeway C. Immunobiology: the immune system in health and disease, 6th edition. Garland Science, New York, NY; 2005. 566 p.
- Ingersoll M.A., Kline K.A., Nielsen H.V., Hultgren S.J. G -CSF induction early in uropathogenic E. coli infection of the urinary tract modulates host immunity.//Cell Microbiol. 2008. Vol. 10, N 12. P. 2568 -2578.
- Лесовой В.Н., Гарагатый И.А., Колупаев С.М., Колупаева Л.С. Диагностическое значение определения уровня провоспалительных цитокинов в моче больных гиперактивным мочевым пузырем.//Экспериментальная и клиническая медицина. 2011. N 2. C. 159 -161.
- Khasriya R.K., Ismail S., Wilson M., Malonee-Lee. A new aethiology for OAB: intracellular bacterial colonization of urothelial cells.//Intern J Urogynecol. 2011. Vol. 22, Suppl 1. P. 141 -142.
- Yin X., Hou T., Liu Y., Chen J., Yao Z., Ma C., Yang L., Wei L. Association of Toll like receptor 4 gene polymorphism and expression with urinary tract infection types in adults. PLoS oNe. 2010. Vol. 5, N 12. P. 14223
- Bishop B.L., Duncan M.J., Song J., Li G., Zaas D., Abraham S.N. Cyclic AMP -regulated exocytosis of Escherichia coli from infected bladder epithelial cells.//Nat Med. 2007. Vol. 13, N5. P. 625 -630.
- Song J., Bishop B.L., Li G., Duncan M.J., Abraham S.N. TLR4 initiated and cAMP mediated abrogation of bacterial invasion of the bladder.//Cell Host Microbe. 2007. Vol. 1, N 4. P. 287 -298.
- Steers W.D., Kolbeck S., Creedon D., Tuttle J.B. Nerve growth factor in the urinary bladder of the adult regulates neuronal form and functions.//J Clin Invest. 1991. Vol. 88. P. 1709 -1715.
- Liu H.T., Kuo H.C. Intravesical botiulinum toxin A injections plus hydrodistention can reduse nerve growth factor production and control bladder pain in interstitial cystitis.//Urol. 2007. Vol. 70. P. 463 -468.
- Kim J.C., Park E.Y. Nerve growth factor and prostaglandins in the urine of female patient with overactive bladder.//J Urol. 2006. Vol. 175. P. 1773 -1776.
- Liu H.T., Kuo H.C. Urinary nerve growth factor level could be a potential biomarker for diagnosis of overactive bladder.//J Urol. 2008. Vol. 179. P. 2270 -2274.
- Liu H.T., Chancellor M.B., Kuo H.C. Urinary nerve growth factor levels are elevated in patients with detrusor overactivity and decreased in responders to detrusor botulinum toxin A injection.//Eur Urol. 2009. Vol. 56. P. 700-706.
- Walsh C.A., Cheng Y., Siddins A., Mansfield K. et al. Low -count bacteriuria and its relationship to ATP release in refractory detrusor overactivity.//Intern J Urogynecol. 2011. Vol. 25. P. 11-15.
- Ochodnický P., Cruz C.D., Yoshimura N., Michel M.C. Nerve growth factor in bladder dysfunction: Contributing factor, biomarker, and therapeutic target.//Neurourol Urodynamics. 2011. Vol. 30, N 7. P. 1227-1241.


