Роль мультиспиральной компьютерной томографии в оценке площади титанового импланта при протезирующей герниопластике
Автор: Никитин П.А., Солодкий В.А., Нуднов Н.В., Знаменский И.А., Кондаков А.К., Кудрявцев А.Д.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая диагностика
Статья в выпуске: 3 т.21, 2021 года.
Бесплатный доступ
Встатье описан опыт применения мультиспиральной компьютерной томографии для оценки степени охвата грыжевого дефекта сетчатым титановым имплантом после выполнения протезирующей герниопластики.
Компьютерная томография, мскт, паховая грыжа, сетчатый титановый имплант, герниопластика, повг, «титановый шелк»
Короткий адрес: https://sciup.org/149139024
IDR: 149139024
Текст научной статьи Роль мультиспиральной компьютерной томографии в оценке площади титанового импланта при протезирующей герниопластике
Знаменский Игорь Альбертович – доктор медицинских наук, врач-радиолог, заведующий отделением радионуклидных методов диагностики ФГБНУ Центральной клинической больницы РАН, профессор кафедры лучевой диагностики и терапии ФГАОУ ВО “Российский национальный исследовательский медицинский университет имени Н.И. Пирогова” Минздрава России,
Кондаков Антон Кириллович – кандидат медицинских наук, доцент кафедры лучевой диагностики и терапии ФГАОУ ВО "Российский национальный исследовательский медицинский университет им. Н.И. Пирогова" Минздрава России,
Кудрявцев Антон Денисович – младший научный сотрудник ФГБНУ Центральной клинической больницы РАН, ассистент кафедры рентгенорадиологии ФГАОУ ВО "Российский национальный исследовательский медицинский университет им. Н.И. Пирогова" Минздрава России,
К грыжам передней брюшной стенки относятся паховые, пупочные, бедренные, грыжи белой линии живота и спигелиевой линии. Распространенность грыж передней брюшной стенки в Российской Федерации находится на уровне 20,9%, при этом у мужчин встречаемость грыж выше, чем у женщин, 31,2% и 14,6% соответственно [14]. Наиболее часто встречаются паховые грыжи, которые составляют порядка 80% от всех выявленных грыж передней брюшной стенки. Во всем мире ежегодно проводится более 20 млн герниопластик [15].
Принятым стандартом лечения грыж передней брюшной стенки является протезирующая пластика с использованием сетчатого импланта [8]. Важное преимущество применения имплантов – это снижение частоты послеоперационных рецидивов, которая составляет 0,5–2%, тогда как при герниопластике с использованием собственных тканей пациента частота рецидива доходит до 15% [3, 5, 6].
Несмотря на сравнительно низкий процент рецидивов после герниопластики с использованием сетчатого импланта, уменьшение частоты их возникновения является одной из важных задач герниологии. В настоящий момент для снижения риска развития рецидивов грыж рекомендовано использование сетчатого импланта, размер которого позволяет охватить не менее 50 мм мягких тканей по периферии грыжевого дефекта [7].
Размер сетчатых имплантов может уменьшиться после их установки за счет сжатия, что может привести к развитию рецидива грыжи [9]. Для раннего выявления этого состояния могут быть использованы методы лучевой диагностики, в частности мультиспиральная компьютерная томография (МСКТ), которая доказала свою эффективность в выявлении различных осложнений после герниопластики, таких как: образование сером либо гематом, формирование спаек, инфицирование области оперативного вмешательства и т. д. [11, 12].
До недавнего времени применение МСКТ для оценки эффективности проведенной герниопластики и прогнозирования риска развития рецидива было ограничено по причине рентгенонегативности применяемых имплантов [1, 4, 13]. Однако, в настоящее время для проведения герниопластики стали применяться титансодержащие сетчатые импланты, использование которых сопровождается меньшей степенью выраженности болевого синдрома в послеоперационном периоде и, как следствие, повышением качества жизни пациентов [2, 10].
Важным свойством титановых имплантов является рентгеноконтрастность. Это свойство может быть использовано для оценки положения сетки в области проведенного хирургического вмешательства с помощью такого высокоинформативного метода диагностики как МСКТ.
Цель исследования: оценка возможности применения МСКТ для определения достаточности степени охвата грыжевого дефекта эндопротезом «титановый шелк» с учетом степени уменьшения его размеров при хирургическом лечении для прогнозирования вероятности рецидива.
Материал и методы
В настоящем исследовании, проведенном в Центральной клинической больнице РАН, участвовало 104 пациента, которым была выполнена герниопластика титановым имплантом. Включенные в исследование пациенты были поделены на 3 группы в зависимости от локализации грыжи и типа выполняемой пластики.
К первой группе были отнесены 14 пациентов (13% от общего числа пациентов), которым была выполнена пластика послеоперационной вентральной грыжи (ПОВГ). Вторую группу составили 36 пациентов (35%), которым была выполнена открытая пластика пахового канала по Лихтенштейну. В третью группу вошли пациенты, которым была выполнена лапароскопическая паховая герниопластика – 54 пациента (52%). Исследуемые группы пациентов были сопоставимы по полу и возрасту.
Всем пациентам интраоперационно было проведено измерение размеров грыжевого дефекта прямым методом. Исходя из полученных данных, для каждого пациента был определен требуемый размер сетчатого импланта, при этом для всех пациентов соблюдалась рекомендация по использованию сетки, размер которой позволяет охватить не менее 50 мм тканей по периферии грыжевого дефекта.
Всем пациентам была проведена МСКТ органов брюшной полости на компьютерном томографе Philips Ingenuity Core 64 по заранее заданным стандартным параметрам: толщина среза 1,5 мм, область сканирования от 12 грудного позвонка до проксимальной трети бедренных костей, сканирование проводилось при глубокой задержке дыхания пациентом. Исследование выполнялось на 3 сутки после оперативного вмешательства. Интерпретация изображений производилась на рабочей станции для обработки диагностических изображений IntelliSpace Portal.
Измерение площади импланта по данным МСКТ выполнялось по разработанной нами схеме:
-
1) Замер продольного размера импланта в сантиметрах: один размер в центральных отделах сетки и два размера в латеральных отделах. Из полученных измерений выводилось среднее арифметическое значение по формуле:
К = (а + b + с)/3, где а – продольный размер в центральных отделах (см), b и с – продольные размеры в латеральных отделах (см), K – среднее арифметическое значение продольного размера (см) (Рис. 1).
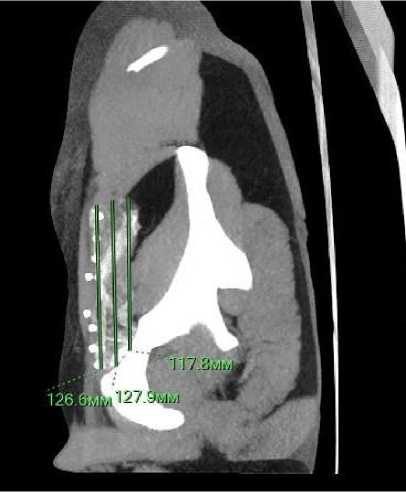
Рисунок 1. МСКТ органов брюшной полости. Измерение продольного размера титанового сетчатого импланта после пластики паховой грыжи.
-
2) Замер поперечного размера проводился по аналогичной формуле:
С = (х + у + z)/3, где x – поперечный размер в центральных отделах (см), y и z – поперечные размеры краниально и каудально (см), C – среднее арифметическое значение поперечного размера (см) (Рис. 2).
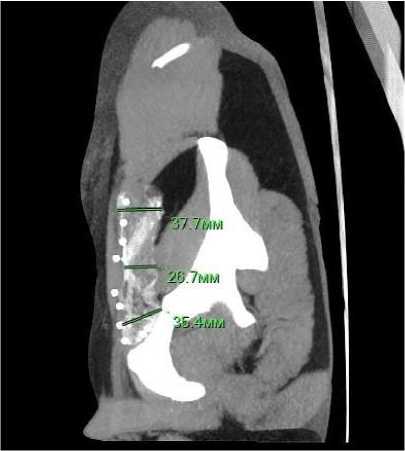
Рисунок 2. МСКТ органов брюшной полости. Измерение поперечного размера титанового сетчатого импланта после пластики паховой грыжи.
Для оценки покрытия сетчатым титановым имплантомушитого грыжевого дефекта дополнительно производилась оценка площади сетчатого эндопротеза по формуле:
S = K*C,
где C – среднее арифметическое значение поперечного размера (см), K – среднее арифметическое значение продольного размера (см), S – площадь импланта (см2).
Анализ степени уменьшения размеров протеза проводился на основании сравнения площади импланта по данным МСКТ и интраоперационных размеров сетчатого эндопротеза и грыжевого дефекта.
Для статистической обработки полученных данных использовалась специализированная статистическая программа Jamovi (JamoviStats, Австралия), в которой получали описательную статистику для всех исследуемых переменных, включая среднее арифметическое (M), стандартное отклонение (m), медиану распределения (Me), межквартильный (25%-75%) размах и разброс. Проверка статистической значимости полученных результатов проводилась с использованием непараметрического метода -критерия Краскела-Уоллиса с определением достигнутого уровня статистической значимости (р).
Результаты исследования . Площадь грыжевого дефекта, определенная интраоперационно, составила: при пластике послеоперационной вентральной грыжи -11,6 см2 (10,5; 5,0-14,3); при лапароскопической паховой герниопластике - 14,0 см2 (16,0; 12,016,0); при открытой паховой герниопластике - 14,3 см2 (13,5; 10,0-18,0). При анализе полученных данных с использованием теста Краскела-Уоллиса выявлено, что площадь грыжевого дефекта в группах статистически значимо не отличалась между собой (p=0,101) (Таблица 1).
Таблица 1. Площадь грыжевого дефекта
|
Тип хирургического вмешательства |
Площадь грыжевого дефекта, „ 2 см |
|
|
M ± m |
Me [25-75%] |
|
|
Пластика послеоперационной вентральной грыжи |
11,6 ± 8,6 |
10,5 [5,0-14,3] |
|
Лапароскопическая паховая герниопластика |
14,0 ± 5,8 |
16,0 [12,0-16,0] |
|
Открытая паховая герниопластика |
14,3 ± 6,3 |
13,5 [10,0-18,0] |
Размер применяемого эндопротеза составил: при пластике послеоперационной вентральной грыжи - 108,0 см2 (83,0; 66,0-100,0); при лапароскопической паховой герниопластике - 168,0 см2 (150,0; 150,0-180,0); при открытой паховой герниопластике -94,8 см2 (66,0; 66,0-150,0). При статистическом анализе выявлено, что площадь используемого импланта при различных типах операций значимо отличается между собой
(p<0,001) (Таблица 2).
Таблица 2. Площадь протеза «титановый шелк»
|
Тип хирургического вмешательства |
Площадь протеза, см2 |
|
|
M ± m |
Me [25-75%] |
|
|
Пластика послеоперационной вентральной грыжи |
108,0 ± 83,6 |
83,0 [66,0-100,0] |
|
Лапароскопическая паховая герниопластика |
168,0 ± 29,2 |
150,0 [150,0-180,0] |
|
Открытая паховая герниопластика |
94,8 ± 38,7 |
66,0 [66,0-150,0] |
Произведен анализ площади импланта на основании МСКТ исследований. При пластике послеоперационной вентральной грыжи - 58,7 см2 (39,9; 14,9-89,1); при лапароскопической паховой герниопластике - 63,9 см2 (57,8; 47,9-74,3); при открытой паховой герниопластике - 42,0 см2 (40,7; 34,1-49,7). При сравнении полученных результатов между собой с использованием теста Краскела-Уоллиса установлено, что площадь импланта по данным МСКТ статистически значимо отличается между собой у пациентов с различными типами хирургического вмешательства (p<0,001). (Таблица 3).
Таблица 3. Площадь импланта по данным МСКТ
|
Тип хирургического вмешательства |
2 Площадь протеза по данным МСКТ, см |
|
|
M ± m |
Me [25-75%] |
|
|
Пластика послеоперационной вентральной грыжи |
58,7 ± 52,6 |
39,9 [14,9-89,1] |
|
Лапароскопическая паховая герниопластика |
63,9 ± 21,7 |
57,8 [47,9-74,3] |
|
Открытая паховая герниопластика |
42,0 ± 11,5 |
40,7 [34,1-49,7] |
На основании полученных значений проведен расчет значений уменьшения площади имплантов (сморщивания) в процентах, который измерялся по формуле: z = 100-^* 100, где z - процент сморщивания импланта на 3 сутки после операции относительно дооперационного периода (%), a - площадь импланта по данным МСКТ (см2), b - площадь импланта в дооперационном периоде (см2).
При пластике послеоперационной вентральной грыжи процент сморщивания составил 48,4% (46,9; 37,1-63,1); при лапароскопической паховой герниопластике - 60,8% (63,1; 51,473,7); при открытой паховой герниопластике - 47,4% (41,4; 27,8-73,4). При сравнении полученных результатов между собой с использованием теста Краскела-Уоллиса выявлено, что процент сморщивания импланта на 3 сутки статистически значимо отличается между собой у пациентов с различными типами оперативного вмешательства (p=0,023) (Таблица 4).
Таблица 4. Уменьшение площади импланта в процессе выполнения хирургического вмешательства
|
Тип хирургического вмешательства |
Уменьшение площади импланта в процессе выполнения хирургического вмешательства, % |
|
|
M ± m |
Me [25-75%] |
|
|
Пластика послеоперационной вентральной грыжи |
48,4 ± 21,6 |
46,9 [37,1-63,1] |
|
Лапароскопическая паховая герниопластика |
60,8 ± 14,9 |
63,1 [51,4-73,7] |
|
Открытая паховая герниопластика |
47,4 ± 24,5 |
41,4 [27,8-73,4] |
Дополнительно в ходе исследования по данным МСКТ у 8 пациентов был выявлен ряд осложнений: образование послеоперационной гематомы (4 пациента, 3,8% от общего числа пациентов); формирование серомы (4 пациента, 3,8% от общего числа пациентов).
Выявленные осложнения не привели к увеличению продолжительности госпитализации и снижению качества жизни пациентов.
Обсуждение
В ходе проведенного исследования интраоперационно было выполнено измерение размеров и площади грыжевого дефекта у пациентов с грыжами передней брюшной стенки различной локализации. На основании интраоперационных данных для каждого пациента был определен необходимый размер сетчатого импланта. На 3 сутки после герниопластики была проведена МСКТ брюшной полости и определение размеров установленного сетчатого импланта «титановый шелк», с последующим сопоставлением полученных результатов и интраоперационных данных.
В ходе работы выявлено существенное уменьшение размеров импланта в послеоперационном периоде. Так, при выполнении пластики послеоперационной вентральной грыжи он достигает 48,4%; при лапароскопической паховой герниопластике – 60,8%; при открытой паховой герниопластике – 47,4%. Наиболее существенное уменьшение размеров импланта наблюдалось у пациентов после проведения лапароскопической паховой герниопластики.
При сопоставлении результатов с интраоперационными размерами грыжевого дефекта выявлено, что, несмотря на уменьшение размеров импланта, грыжевой дефект у всех пациентов был полностью закрыт сеткой с соблюдением рекомендаций по охвату тканей по периферии грыжевого дефекта не менее чем на 50 мм. Это позволяет сделать вывод о том, что подбор импланта врачом-хирургом во время оперативного вмешательства осуществлялся корректно.
Степень охвата дефекта, даже при условии выраженного уменьшения размеров протеза при хирургическом лечении, остается достаточной и не должна приводить к увеличению риска развития рецидивов вне зависимости от типа проведенной протезирующей герниопластики при покрытии сетчатым имплантом не менее чем 50 мм свободных тканей по периферии от дефекта передней брюшной стенки.
МСКТ является эффективным методом для контроля качества проведенного лечения у пациентов с пластикой грыжи передней брюшной стенки с использованием титанового сетчатого импланта и может быть использована для прогнозирования риска развития рецидива заболевания.
Список литературы Роль мультиспиральной компьютерной томографии в оценке площади титанового импланта при протезирующей герниопластике
- Имангазинов С.Б., Каирханов Е.К., Казангапов Р.С. Послеоперационные вентральные грыжи. Хирургическое лечение и профилактика раневых осложнений. Обзор литературы. Наука и Здравоохранение. 2019. T. 2019. № 1. C. 29-41.
- Akalin C., Karagulle O.O. The effects of onlay titanium-coated mesh on recurrence, foreign body sensation and chronic pain after ventral hernia repair. Asian J Surg. 2021. V. 44. No. 9. P. 1158-1165. DOI: 10.1016/j.asjsur.2021.02.022.
- Bay-Nielsen M., Kehlet H., Strand L., et al. Quality assessment of 26,304 herniorrhaphies in Denmark: a prospective nationwide study. Lancet. 2001. V. 358. No. 9288. P. 1124-1128. DOI: 10.1016/S0140-6736(01)06251-1.
- Gavlin A., Kierans A.S., Chen J., et al. Imaging and treatment of complications of abdominal and pelvic mesh repair. Radiographics. 2020. V. 40. No. 2. P. 432-453. DOI: 10.1148/rg.2020190106.
- EU Hernia Trialists Collaboration. Repair of groin hernia with synthetic mesh: meta-analysis of randomized controlled trials. Ann Surg. 2002. V. 235. No. 3. P. 322-332. DOI: 10.1097/00000658-200203000-00003.
- EU Hernia Trialists Collaboration. Mesh compared with non-mesh methods of open groin hernia repair: systematic review of randomized controlled trials. Br J Surg. 2000. V. 87. No. 7. P. 854-859. DOI: 10.1046/j.1365-2168.2000.01539.x.
- Henriksen N.A., Montgomery A., Kaufmann R., et al. Guidelines for treatment of umbilical and epigastric hernias from the European Hernia Society and Americas Hernia Society. Br J Surg. 2020. V. 107. No. 3. P. 171-190. DOI: 10.1002/bjs.11489.
- Hori T., Yasukawa D. Fascinating history of groin hernias: Comprehensive recognition of anatomy, classic considerations for herniorrhaphy, and current controversies in hernioplasty. World J Methodol. 2021. V. 11. No. 4. P. 160-186. DOI: 10.5662/wjm.v11.i4.160.
- Jonas J. The problem of mesh shrinkage in laparoscopic incisional hernia repair. Zentralbl Chir. 2009. V. 134. No. 3. P. 209-213. DOI: 10.1055/s-0028-1098779.
- Köckerling F., Schug-Pass C. What do we know about titanized polypropylene meshes? An evidence-based review of the literature. Hernia. 2014. V. 18. № 4. P. 445-457. DOI: 10.1007/s10029-013-1187-3.
- Lacour M., Ridereau Z. C., Casa C., et al. CT findings of complications after abdominal wall repair with prosthetic mesh. Diagn Interv Imag. 2017. V. 98. No. 7-8. P. 517-528. DOI: 10.1016/j.diii.2017.01.002.
- Patil A.R., Nandikoor S., Mohanty H.S., et al. Mind the gap: imaging spectrum of abdominal ventral hernia repair complications. Insights Imaging. 2019. V. 10. No. 1. Article ID 40. DOI: 10.1186/s13244-019-0730-x.
- Rakic S., Leblanc K.A. The radiologic appearance of prosthetic materials used in hernia repair and a recommended classification. AJR Am J Roentgenol. 2013. V. 201. No. 6. P. 1180-1183. DOI: 10.2214/AJR.13.10703.
- Sazhin A., Zolotukhin I., Seliverstov E., et al. Prevalence and risk factors for abdominal wall hernia in the general Russian population. Hernia. 2019. V. 23. № 6. P. 1237-1242. DOI: 10.1007/s10029-019-01971-3.
- HerniaSurge Group. International guidelines for groin hernia management. Hernia. 2018. V. 22. No. 1. P. 1-165. DOI: 10.1007/s10029-017-1668-x.


