Роль полиморфизма гена кальсеквестрина в развитии фибрилляции предсердий и синдрома слабости синусового узла
Автор: Арчаков Евгений Александрович, Баталов Роман Ефимович, Попов Сергей Валентинович, Муслимова Эльвира Фаритовна, Сморгон Андрей Владимирович, Афанасьев Сергей Александрович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.32, 2017 года.
Бесплатный доступ
В настоящее время особое внимание уделяется исследованию роли генетических факторов в развитии сердечно-сосудистой патологии. Широкое внедрение генетических и клеточных технологий в будущем, возможно, решит проблемы профилактики и лечения различных нарушений ритма сердца. Транспортирующие ионные системы кардиомиоцитов играют большую роль в регуляции гомеостаза клеток миокарда. В литературе описаны полиморфные варианты гена кальсеквестрина, связанные с аритмией, внезапной сердечной смертью и развитием сердечной недостаточности у больных ишемической болезнью сердца (ИБС). Цель: проанализировать роль полиморфизма гена кальсеквестрина в развитии фибрилляции предсердий (ФП) и синдрома слабости синусового узла (СССУ). В исследование включено 47 пациентов, средний возраст - 67,0±15,4 лет; из них 38 (80,8%) мужчин с ФП - 15 (31,9%), СССУ - 11 (23,4%) и их сочетанием - 21 (44,6%). В исследуемую группу вошли пациенты с ИБС - 27 (57,4%), гипертонической болезнью - 10 (21,2%), миокардитом - 3 (6,4%), идиопатическим нарушением ритма сердца - 7 (14,9%). Всего 35 пациентов имели генотип С/С и 12 - генотип С/Т. Частота встречаемости аллеля С в выборке пациентов с сочетанием ФП и СССУ - 88%, аллеля Т - 12%; в группе с ФП аллель С - 93%, аллель Т - 7%; в группе с СССУ аллель С - 77%, аллель Т - 23%. Заключение. Полученные данные не показали достоверной связи развития ФП и СССУ с генетическим полиморфизмом белка кальсеквестрина.
Фибрилляция предсердий, синдром слабости синусового узла, кальсеквестрин
Короткий адрес: https://sciup.org/14920175
IDR: 14920175 | УДК: 616.12-07
Текст научной статьи Роль полиморфизма гена кальсеквестрина в развитии фибрилляции предсердий и синдрома слабости синусового узла
ФП – наиболее распространенная аритмия сердца. Известно, что ФП ассоциируется с пятикратным увеличением риска развития инсульта, трехкратным увеличением сердечной недостаточности, двукратным увеличением деменции и смертности [1–3]. ФП – сложное нарушение ритма сердца, которое требует междисциплинарного подхода. В течение длительного времени фармакотерапия была единственным способом лечения ФП. Не так давно были предложены и стали активно развиваться хирургические и интервенционные способы лечения. Несмотря на значительные успехи данных методов, далеко не всегда можно добиться желаемого эффекта.
Достаточно часто в клинической практике наблюдается сочетание ФП и СССУ [4], в основе которого лежит снижение способности синусового узла (СУ) выполнять задачи доминантного пейсмейкера или различные варианты нарушения проведения импульса [5, 6].
Распространенность дисфункции СУ в общей популяции неизвестна. Согласно имеющейся информации, у кардиологических больных она составляет приблизительно 3:5000. Признаки заболевания СУ отмечаются у 6,3–24% больных, в связи с чем они нуждаются в имплантации водителя ритма. Считается, что нарушения функции СУ одинаково часто встречаются у мужчин и жен- щин. С возрастом частота возникновения СССУ увеличивается.
Органическое происхождение заболевания проводящей системы сердца требует как можно более раннего выявления больных и своевременной хирургической коррекции с целью предотвращения внезапной смерти.
В подавляющем большинстве случаев СССУ является приобретенным и лишь в редких случаях – врожденным заболеванием. В его основе лежат дегенеративные изменения в синусно-предсердной области, обусловленные многими причинами (ИБС, артериальная гипертония, кардиомиопатии, гемохроматоз, метастазы опухолей, коллагенозы, инфекционные и инфекционно-аллергические заболевания, амилоидоз сердца, токсические поражения, операции на сердце).
В некоторых случаях не удается выявить причину возникновения как СССУ, так и ФП, в связи с чем необходимо более глубокое изучение молекулярно-клеточных механизмов, регуляции гомеостаза ионов.
Ключевым фактором в понимании природы ФП и СССУ может стать полиморфизм генов, кодирующих белки ионных каналов. Мутации в этих генах могут приводить к нарушению гомеостаза ионов в миокарде. Одним из наиболее важных ионов в клетках сердца является ион кальция – Са2+. Подавляющее большинство клеток, в том числе и кардиомиоциты, имеют специальные системы, которые в покое поддерживают внутриклеточную концентрацию Са2+ на низком уровне и обеспечивают его быстрое удаление после прекращения действия внешнего сигнала, системы, которые в ответ на этот сигнал обеспечивают вход Са2+ в клетку из окружающей среды или его освобождение из внутриклеточных источников, а также те, которые отвечают на изменение внутриклеточной концентрации Са2+ изменением своей функциональной активности. Первые два типа систем представлены мембранными белками – Са2+-каналами и Са2+-насосами. Последняя подразумевает существование в цитоплазме специальных белков, которые при связывании Са2+ изменяют свою активность, регулируют различные внутриклеточные процессы. В настоящее время такие системы хорошо известны, причем, несмотря на огромное разнообразие клеток и выполняемых ими функций, они достаточно универсальны и имеют много общих свойств. Основным депо и регулятором внутриклеточного транспорта Са2+ в кардиомиоцитах является саркоплазматический ретикулум (СР) [7]. Транспортирующие системы СР осуществляют связывание и перенос этого иона. Так, Са2+-АТФ-аза СР участвует в процессах обратного захвата ионов Са2+. Белок – кальсеквестрин обеспечивает связывание Са2+ внутри СР, а рианодиновые рецепторы осуществляют их освобождение. Осцилляции Са2+ внутри клетки играют определяющую роль в процессах электромеханического сопряжения кардиомиоцитов и, соответственно, сократительной активности сердца [8].
Выявлен ряд мутаций гена кальсеквестрина CASQ2, также определяющих развитие желудочковой тахикардии; хотя они описаны в небольшом количестве семей и их доля в общей структуре заболевания неизвестна [9]. Существуют варианты, связанные с семейной аритмоген-ной дисплазией правого желудочка. В литературе представлено мало информации о роли однонуклеотидных полиморфизмов гена CASQ2 в развитии сердечно-сосудистой патологии. Тем не менее, описаны полиморфные варианты, связанные с аритмией, внезапной сердечной смертью и развитием сердечной недостаточности (СН) у больных ИБС [10].
В последнее время в литературе довольно часто стали появляться результаты исследований, проведенных на лабораторных животных, которые показывают связь полиморфизма генов кальцийтранспортирующих белков, в том числе кальсеквестрина, рианодиновых рецепторов, с развитием нарушений ритма сердца. По данным авторов этих исследований, с дисфункцией систем могут быть связаны задержка потенциала действия в синоатриальном узле с развитием брадикардии, возникновение эктопической и re-entry активности с развитием ФП [11].
Материал и методы
В исследование включено 47 пациентов, средний возраст – 67,0±12,4 лет; из них 38 мужчин 38 (80,8%), с ФП – 15 (31,9%), СССУ – 11 (23,4%) и их сочетанием – 21 (44,6%). В исследуемую группу вошли пациенты с ИБС – 27 (57,4%), гипертонической болезнью – 10 (21,2%), миокардитом – 3 (6,4%), идиопатическим нарушением ритма сердца – 7 (14,9%). Пациенты разделены на 3 группы: первая – пациенты с наличием ФП и СССУ, вторая – только с ФП и третья – с СССУ. Пациентам с верифицированным диагнозом СССУ имплантирован электрокардиостимулятор (ЭКС). Всем исследуемым взята кровь из кубитальной вены в пробирку с этилендиаминтетрауксус-ной кислотой (ЭДТА) для последующего проведения генетического анализа. Получены образцы ДНК у 47 пациентов с ФП и СССУ. Выделение ДНК из цельной крови осуществляли с помощью набора реагентов “Wizard Genomic DNA Purification Kit” (“Promega”, USA) по предлагаемому фирмой протоколу. Выполнена полимеразная цепная реакция (ПЦР) с использованием набора реактивов (ООО “ТестГен”, Россия) и амплификатора T-100 (Bio– Rad).
Используемые праймеры:
– Прямой праймер: CCAGAACTATAAGCTGAATACACCA.
– Обратный праймер:
AATAATAATAAATCATAAAACCCATTTGATTTTTCTTGCACA.
Условия амплификации. Первая денатурация: 95 °C – 2 мин 35 циклов; 94 °C – 10 с; 62 °C – 20 с; 72 °C – 20 с. Последний синтез цепи: 72 °C – 2 мин.
Для определения генотипа производилось последующее расщепление продуктов ПЦР с использованием рес-триктазы CASQ2-rs6684209 (BssT1I, НПО “СибЭнзим”, Россия). Регистрация результатов осуществлялась электрофоретическим методом в 4%-м агарозном геле на основе однократного трис-боратного буфера с добавлением бромистого этидия. В своей работе мы использовали электрофоретические камеры и гель-документирующую систему Bio-Rad Gel Doc 2000TM производства фирмы “Bio–Rad” (USA).
После обработки рестриктазой получаются следующие продукты:
– Фрагмент длиной 207 п.н. (пар нуклеотидов) – генотип C/C.
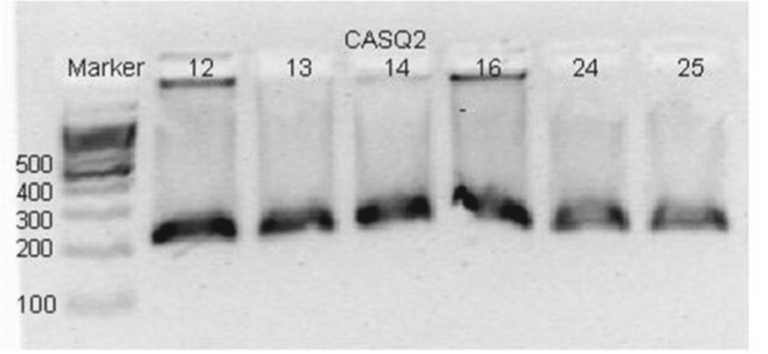
Рис. 1. Электрофореграмма продуктов рестрикции гена кальсеквестрина (CASQ2), указывающая на длину полученных фрагментов, что демонстрирует генотип C/C. Сверху цифрами указаны номера проб, сбоку – количество пар нуклеотидов
– Фрагменты длиной 182 и 25 п.н. – генотип T/T.
– Фрагменты длиной 207, 182 и 25 п.н. – генотип C/T.
Результаты и обсуждение
Выполнен анализ полиморфизма rs6684209 гена кальсеквестрина CASQ2 у 47 пациентов методом анализа полиморфизма длин рестрикционных фрагментов (ПДРФ-анализ), рисунок 1.
Всего 35 пациентов имели генотип С/С и 12 – генотип С/Т. У первой группы пациентов выявлен генотип C/C полиморфизма rs6684209 гена CASQ2 у 16, генотип С/Т – у 5. У второй группы пациентов обнаружен генотип С/С гена CASQ2 в 13 случаях, генотип С/Т – в 2. В третьей группе 6 пациентов имели гомозиготный генотип и 5 – гетерозиготный (рис. 2).
Частота встречаемости аллеля С в выборке пациентов с сочетанием ФП и СССУ – 88%, аллеля Т – 12%, в группе с ФП аллель С – 93%, аллель Т – 7%, в группе с СССУ аллель С – 77%, аллель Т – 23%.
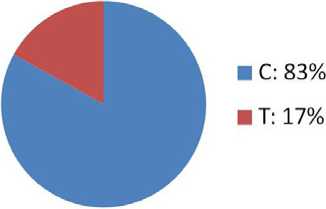
Результаты статистической обработки полученных данных представлены в таблице. В нашем исследовании распределение генотипов гена CASQ2 в обследованных группах соответствовало равновесию Харди–Вейнберга. Частота встречаемости генотипов и аллелей в исследовании оказалась сопоставима с данными, полученными в европейской популяции (рис. 3).
Анализ распределения частот генотипов полиморфизма С/Т гена CASQ2 и аллелей не показал наличия статистически значимых различий между исследуемыми группами ( χ 2=0,91, р=0,63; χ 2=1,7, р=0,42).
Для оценки взаимосвязи носительства того или иного аллеля гена CASQ2 с развитием ФП и СССУ рассчитана величина показателя OR (Odds Ratio – отношение шансов). С учетом полученных данных положительной ассоциации между изучаемым фактором и развитием патологического состояния не выявлено.
Полученные результаты у небольшой группы пациентов не выявили связи полиморфизма гена CASQ2 с та-
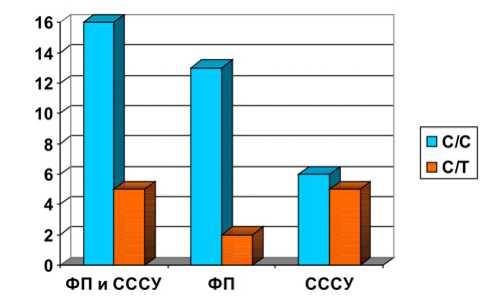
Рис. 2. Распространенность генотипов С/С и С/Т у пациентов разных групп, где слева по оси представлено количество пациентов: С/С и С/Т – генотипы CASQ2.
Таблица
Распределение частот генотипов CASQ2 и аллелей в группах исследования
|
Группы |
Генотипы |
Аллель |
||
|
С/С (%) |
С/Т (%) |
С (%) |
Т (%) |
|
|
ФП и СССУ (n=21) |
76,2 |
23,8 |
88,0 |
12,0 |
|
ФП (n=15) |
86,7 |
13,3 |
93,0 |
7,0 |
|
СССУ (n=11) |
55,0 |
45,0 |
77,0 |
23,0 |
|
p |
р1=0,63 |
р2=0,42 |
||
Примечание: С и Т – аллели гена CASQ2, – значимость различий в распределении генотипов и аллелей между исследуемыми группами (р1 и p2 соответственно).
кими заболеваниями, как ФП и СССУ. По данным литературных источников, мутация CASQ2 встречается в 1–2% случаев у пациентов с полиморфной желудочковой тахикардией. Распространенность мутации у пациентов с другими нарушениями ритма сердца неизвестна.
EUR
C|C: 0.694(349)C|T: 0.280(141)
Рис. 3. Частота встречаемости генотипов и аллелей в европейской популяции, где С и Т – аллели гена CASQ2
Выводы
Связи развития ФП и СССУ с генетическим полиморфизмом белка кальсеквестрина в исследуемой выборке не выявлено.
Список литературы Роль полиморфизма гена кальсеквестрина в развитии фибрилляции предсердий и синдрома слабости синусового узла
- January C.T., Wann L.S., Alpert J.S. et al. Guideline for the management of patients with atrial fibrillation//J. Am. Coll. Cardiol. -2014. -Vol. 64, No. 21. -P. 2246-2280.
- Turakhia M., Solomon M.D., Jhaveri M. et al. Burden, timing, and relationship of cardiovascular hospitalization to mortality among Medicare beneficiaries with newly diagnosed atrial fibrillation//Am. Heart J. -2013. -Vol. 166, No. 3. -P. 573-580.
- Kirchhof P., Auricchio A., Bax J. et al. Outcome parameters for trials in atrial fibrillation: executive summary//Eur. Heart J. -2007. -Vol. 28. -P. 2803-2817.
- Lehnart S.E., Maier L.S., Hasenfuss G. Abnormalities of calcium metabolism and myocardial contractility depression in the failing heart//Heart Fail. Rev. -2009. -Vol. 14. -P. 213-224.
- Priori S.G., Allot E., Blomstrom-Lundqvist C. et al. Update of the guidelines on sudden cardiac death of the European Society of Cardiology//Eur. Heart J. -2003. -Vol. 24. -P. 13-15.
- Емельянчик Е.Ю., Анциферова Е.В., Чернова А.А. и др. Диагностика синдрома слабости синусового узла у детей//Вестн. аритмол. -2010. -Т. 32, № 61. -С. 6-14.
- Franzini-Armstrong C., Protasi F., Ramesh V. Shape, size, and distribution of Ca(2+) release units and couplons in skeletal and cardiac muscles//Biophys. J. -1999. -No. 77. -P. 1528-1539.
- Heinzel F.R., MacQuaide N., Biesmans L., Sipido K. Dyssynchrony of Ca2+ release from the sarcoplasmic reticulum as subcellular mechanism of cardiac contractile dysfunction//J. Mol. Cell Cardiol. -2011. -Vol. 50, No. 3. -P. 390-400.
- Бокерия О.Л., Ахобеков А.А. Ионные каналы и их роль в развитии нарушений ритма сердца//Анн. аритмол. -2014. -T. 11, № 3. -С. 277-284.
- Refaat M.M., Aouizerat B.E., Pullinger C.R. Association of CASQ2 polymorphisms with sudden cardiac arrest and heart failure in patients with coronary artery disease//Heart Rhythm. -2014. -Vol. 11. -P. 646-652.
- Glukhov A.V., Kalyanasundaram A., Lou Q. et al. Calsequestrin 2 deletion causes sinoatrial node dysfunction and atrial arrhythmias associated with altered sarcoplasmic reticulum calcium cycling and degenerative fibrosis within the mouse atrial pacemaker complex//Eur. Heart J. -2015 -Vol. 14, No. 36(11). -P. 686-697.
- Gussak I., Antzelevitch C. Electrical diseases of the heart. Genetics, mechanisms, treatment, prevention. -London: Springer-Verlag, 2008. -P. 461-654, 705-719.


