Роль реваскуляризации миокарда в снижении риска внезапной сердечной смерти
Автор: Яшин Сергей Михайлович, Громыко Григорий Алексеевич
Журнал: Клиническая практика @clinpractice
Рубрика: Обзоры
Статья в выпуске: 4 (20), 2014 года.
Бесплатный доступ
В статье отражены современные взгляды на стратификацию риска и влияние реваскуляризации на прогноз у больных с ишемической болезнью сердца. Обсуждаются особенности применения имплантируемых кардиовертеров-дефибрилляторов в данной группе пациентов.
Внезапная сердечная смерть, имплантируемый кардиовертер " дефибриллятор, ишемическая болезнь сердца, реваскуляризация миокарда
Короткий адрес: https://sciup.org/14338506
IDR: 14338506
Текст научной статьи Роль реваскуляризации миокарда в снижении риска внезапной сердечной смерти
Внезапная сердечная смерть (ВСС) остается одной из самых главных проблем здравоохранения, несмотря на прогресс в изучении ее патофизиологических механизмов и совершенствование методов ее лечения.
Наиболее часто основным заболеванием у внезапно умерших пациентов является ишемическая болезнь сердца. Так, по данным Myeberg и соавт. с ИБС связано около 80% внезапных сердечных смертей в США и Западной Европе. Примерно 50% всех смертей от ИБС являются внезапными [1].
С успехами в хирургическом и медикаментозном лечении ИБС в последние годы связано и уменьшение числа случаев внезапной смерти. Однако, доля ВСС в смертности больных от ИБС не уменьшилась, снижение общего числа случаев ВСС связано со снижением общей смертности от ИБС [2, 3].
Реваскуляризация миокарда является ключевым методом лечения ИБС. Основной терапией для профилактики ВСС в группе пациентов после реваскуляризации миокарда является имплантируемый кардиовертер-дефибриллятор (ИКД). Однако, критерии стратификации риска ВСС и сроки использования ИКД в этой группе больных остаются предметом дискуссии.
Патофизиология ВСС у больных с ИБС
Патофизиология ВСС у больных с ИБС определяется тремя связанными между собой факторами: повреждением коронарных сосудов, повреждением миокарда и хроническими изменениями физиологии миокарда левого желудочка. Патофизиологические механизмы возникновения ВСС при транзиторной ишемии миокарда, в остром и подостром периодах инфаркта миокарда, и у пациентов с хроническими постинфарктными изменениями показаны на схеме 1.
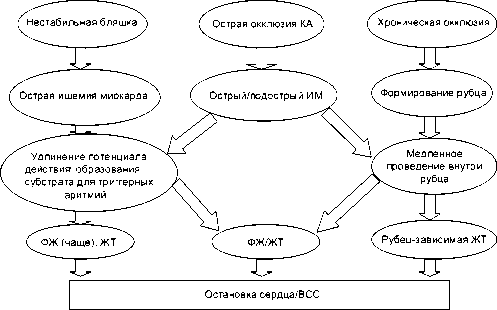
Схема. Патофизиология ВСС у больных с ИБС
-
1. Повреждение коронарных сосудов может вести к транзиторной ишемии миокарда. Жиз-не-угрожающие аритмии могут возникнуть как во время самой ишемии миокарда, когда изменяется трансмембранный потенциал сердечных клеток, так и при реперфузии миокарда, которая, в особенности в первые 5-30 минут, может быть самостоятельной причиной аритмий [4]. При реперфузии миокарда происходит локальное удлинение потенциала действия, своего рода локальный «длинный QT» [5]. Это может вести к возникновению триггерных желудочковых аритмий, которые, кроме того, что представляют самостоятельную опасность, могут привести к возникновению желудочковых ре-ентри аритмий у больных с измененным субстратом левого желудочка. Вероятно, тран-зиторная ишемия миокарда и его реперфузия являются механизмом ВСС в тех случаях, когда ИБС дебютирует внезапной смертью. Реваскуляризация миокарда при выявлении гемодинамически значимых стенозов коронарных артерий снижает риск возникновения повторных ишемических состояний и ассоциированных с ними эпизодов желудочковых тахиаритмий.
-
2. В острой фазе инфаркта миокарда (до 48 часов) в пораженных участках сердечной мышцы проходят различные патофизиологические процессы. Кроме изменений, характерных для ишемии и реперфузии миокарда, в пораженном участке сердечной мышцы происходят изменения локальной скорости проведения сердечного импульса и изменения реполяризации. Ранние вмешательства для восстановления кровотока в зоне инфаркта могут стабилизировать миокард и привести к снижению риска ВСС в острой фазе инфаркта миокарда [6].
-
3. При длительном наблюдении больных, перенесших инфаркт миокарда, вероятность внезапной смерти увеличивается. Это связано не только с наличием рубца левого желудочка как субстрата для желудочковых тахикардий, но и с ремоделированием миокарда, формированием ишемической кардиомиопатии [7]. Также повторные ишемические состояния в данной группе пациентов могут являться триггерами возникновения желудочковых аритмий и ухудшать течение сердечной недостаточности.
В подостром периоде в пораженной области происходят процессы формирования рубца. Основным механизмом ВСС в этом периоде является ри-ентри тахикардия.
Влияние реваскуляризации миокарда на риск ВСС
Так как ишемия миокарда является значимым триггером ВСС, потенциальное снижение риска после реваскуляризации миокарда находится в фокусе современных исследований. Большинство обсервационных исследований показали положительное влияние реваскуляризации гибернирующего миокарда на выживаемость и сократительную функцию левого желудочка.
Первые обсервационные исследования, такие как Coronary artery surgery study (CASS) [8] и Veterans administration (VA) [9] показали статистически значимое снижение смертности в группе пациентов после реваскуляризации миокарда в сравнении с медикаментозной терапией.
Несмотря на то, что реваскуляризация миокарда связана со снижением риска ишемических событий, которые могут быть триггером жизнеугрожающих желудочковых тахиаритмий, ее влияние на снижение риска ВСС, не связанной с острой ишемией миокарда, остается недостаточно исследованным. В исследовании Brugada и соавт. [10] оценивалась индуци-руемость желудочковых аритмий при ЭФИ и рецидивы спонтанных ЖА за время наблюдения после реваскуляризации миокарда. Несмотря на реваскуляризацию, риск индукции и риск рецидива ЖА оставались высокими у пациентов с уже имевшимися аритмиями. Это наблюдение является свидетельством того, что реваскуляризация миокарда не приводит к модификации уже сформировавшегося субстрата желудочковой тахикардии.
Однако, не во всех клинических ситуациях у пациентов, перенесших инфаркт миокарда,
Таблица 1
Чувствительность и специфичность данных МРТ сердца для определения пациентов, у которых ЖТ/ФЖ может быть индуцирована при ЭФИ. (По данным Bello et al)
|
Показатель |
Значение |
Чувствительность |
Специфичность |
|
Фракция выброса ЛЖ |
< 30% < 40% |
56 89 |
62 38 |
|
Площадь рубцовой ткани |
> 100 см2 |
89 |
57 |
|
Масса рубцовой ткани |
> 25 г |
94 |
43 |
|
Процент массы |
> 15 % |
89 |
48 |
имплантация ИКД существенно влияет на улучшение показателей выживаемости. В рандомизированное исследование Coronary Artery Bypass Graft (CABG) Patch Trial [11] были включены пациенты, направляемые на аортокоронарное шунтирование, с фракцией выброса менее 36%, аномальной сигнал-усредненной ЭКГ. Первой ключевой особенностью исследования было включение в исследование пациентов, направляемых на аорто-коронарное шунтирование с оценкой фракции выброса до реваскуляризации. Фракция выброса при наблюдении после реваскуляризации у этих пациентов становилась выше, чем на момент имплантации устройства. Второй особенностью данного исследования стала эпикардиальная имплантация дефибрилляционных электродов, не получившая в дальнейшем широкого распространения. На данный момент эпикардиальные шоковые пластины используются только в случаях невозможности имплантации трансвенозного электрода. Результатом исследования стала примерно одинаковая общая смертность в группах с ИКД и с медикаментозной терапией. В группе ИКД несколько снизилось количество аритмических смертей (4,0% в группе ИКД и 6,9% в контрольной группе), однако большое количество неаритмических смертей (71%) [12] уравняло итоговую смертность.
Также, в исследовании MADIT II не было выявлено преимуществ в выживаемости пациентов, которым ИКД был имплантирован непосредственно после реваскуляризации миокарда в сравнении с пациентами, которым ИКД был имплантирован через 6 и более месяцев после реваскуляризации. В группе пациентов, не получавших ИКД терапию, общая сердечная смертность возрастала через 6 и более месяцев после реваскуляризации, в основном за счет шестикратного увеличения риска ВСС [13].
В исследовании Veenhuyzen et al. [14] показано влияние операции АКШ на выживаемость в большой группе из 5410 пациентов с фракцией выброса левого желудочка менее 36%. Реваскуляризация миокарда была ассоциирована со снижением риска общей смертности на 25% и снижением риска ВСС на 46%, вне зависимости от степени снижения фракции выброса левого желудочка и выраженности симптомов сердечной недостаточности.
Таким образом, реваскуляризация миокарда в группе пациентов с низкой фракцией выброса и наличием жизнеспособного миокарда связана со значительным снижением общей и внезапной смертности. Фракция выброса левого желудочка и другие вышеописанные факторы риска ВСС должны быть переоценены на отдаленных сроках после реваскуляризации. По совокупности имеющихся данных в существующих рекомендациях [15] реваскуляризация миокарда у пациентов с фракцией выброса левого желудочка менее 36% относится к I классу показаний, уровень доказанности B, при наличии стеноза главного ствола левой коронарной артерии, его эквивалента, проксимального стеноза передней межжелудочковой ветви левой коронарной артерии при наличии двух-или трехсосудистого поражения. Также в тексте показаний оговорено, что фракция выброса левого желудочка должна быть переоценена через 3 месяца после реваскуляризации для повторной стратификации риска и решения вопроса о необходимости имплантации ИКД у пациентов без анамнеза устойчивых желудоч- ковых аритмий. У пациентов с большой площадью рубцовой ткани восстановление фракции выброса левого желудочка менее вероятно, и показания предусматривают возможность имплантации ИКД на более ранних сроках. У пациентов, имевших эпизоды остановки сердца или зарегистрированные устойчивые желудочковые аритмии, риск рецидива аритмии может сохраняться вне зависимости от реваскуляризации миокарда. Этим пациентам может быть рекомендована имплантация ИКД до процедуры реваскуляризации.
Имплантация ИКД как профилактика ВСС после реваскуляризации миокарда
Одной из главных проблем в лечении пациентов после реваскуляризации миокарда является определение необходимых сроков имплантации ИКД. Исследования выживаемости после АКШ и стентирования КА показали значительный риск смерти на ранних сроках после реваскуляризации у пациентов со сниженной фракцией выброса левого желудочка. Имплантация ИКД ранее 6 месяцев после реваскуляризации не показала эффективного снижения смертности в данной группе пациентов.
Однако высокая смертность в первый месяц после реваскуляризации миокарда была зарегистрирована в крупных национальных регистрах. По данным регистра Society of Thoracic
Surgeons Adult Cardiac Surgery Database [16], включившего в себя 348 341 пациентов старше 64 лет, перенесших АКШ, смертность через 30 дней после операции составляла 7,6%, а через год – 18,6% у пациентов с фракцией выброса ЛЖ менее 30% и 4,4% и 11,6%, соответственно, у пациентов с фракцией выброса ЛЖ от 30 до 45%. Таким образом, смертность в первые 30 дней после реваскуляризации составила более трети от смертности за первый год после операции. По данным National Cardiovascular Data Registry [17], включившего в себя 343 466 пациентов, перенесших стентирование КА, общая смертность после операции составила 3% через 30 дней и 6% – через 6 месяцев. Таким образом, смертность за первые 30 дней после реваскуляризации составила половину от общей смертности в данной группе пациентов.
Снижение общей смертности при оценке отдаленных результатов реваскуляризации миокарда обусловлено процессами ремоделирования миокарда, ведущими к улучшению систолической функции левого желудочка. Многие пациенты через 3 месяца после реваскуляризации за счет повышения фракции выброса левого желудочка перестают выполнять критерии первичной профилактики ВСС и не нуждаются в ИКД терапии.
Современной мерой для защиты пациентов с низкой фракцией выброса левого желудочка
Таблица 2
|
Признак |
Вероятность рисков (OR) |
Баллы |
|
Генерализованный атеросклероз |
2 |
1 |
|
Дилатация ЛЖ при отсутствии его гипертрофии |
2,93 |
1 |
|
Полная блокада правой ножки пучка Гиса |
6,5 |
1 |
|
Гемодинамически значимое поражение ПМЖВ ЛКА |
12,47 |
2 |
|
Расчетный ПРТ от 9 до 21% |
8,56 |
2 |
|
Расчетный ПРТ > 21% |
17,95 |
4 |
|
Общий максимум |
9 |
Балльная система определения риска мотивированных срабатываний ИКД
в первые месяцы после реваскуляризации миокарда являются носимые кардиовертеры-дефибрилляторы. Эта терапия получила широкое распространение в США и Европе, но на данный момент не используется в РФ. Результаты использования носимого кардиовертера-дефибриллятора по данным канадского национального регистра, включившего 4958 пациентов с фракцией выброса ЛЖ менее 36% , были оценены Zishiri et al. [18]. Терапия носимым кардиовертером-дефибриллятором была ассоциирована со снижением общей смертности на 39%, (p < 0,0001) в сравнении с контрольной группой при 90-дневном сроке наблюдения. При анализе подгруппы пациентов, перенесших АКШ, среди пациентов с носимым кардиовертером-дефибриллятором общая смертность составила 3%, в контрольной группе –7% (p = 0,03), в подгруппе пациентов, перенесших стентирование КА, общая смертность у пациентов с носимым кардиовертером-дефибриллятором составила 2%, в контрольной группе – 10%, (p < 0,0001).
По истечению 90-дневного периода наблюдения после реваскуляризации миокарда пациентам, у которых сохраняется фракция выброса ЛЖ менее 36%, должен быть имплантирован ИКД для первичной профилактики ВСС; па- циентам, у которых наблюдается увеличение фракции выброса левого желудочка более 35% и не регистрируются эпизоды устойчивых желудочковых аритмий, имплантация ИКД не показана. Использование носимых кардиовертеров-дефибрилляторов является перспективным направлением улучшения выживаемости пациентов с низкой фракцией выброса после реваскуляризации миокарда и может быть использовано в клинической практике.
Заключение
Принимая клиническое решение, мы всегда должны понимать, что реваскуляризация миокарда имеет большее влияние на триггеры желудочковых аримий, чем на их субстрат. Риск возникновения жизнеугрожающих желудочковых аритмий у пациентов, перенесших инфаркт миокарда, остается наиболее высоким в группе пациентов с низкой фракцией выброса левого желудочка. Улучшение стратификации риска на отдаленных сроках после реваскуляризации миокарда является перспективным направлением будущих исследований. Имплантация кардиовертера-дефибриллятора и реваскуляризация миокарда в соответствии с существующими показаниями должны быть использованы у пациентов с ИБС для снижения риска внезапной сердечной смерти.
Список литературы Роль реваскуляризации миокарда в снижении риска внезапной сердечной смерти
- Myerburg R.J. Sudden cardiac death: exploring the limits of our knowledge. J Cardiovasc Electrophysiol 2001;12:369-81.
- Fox C.S., Evans J.C., M.G.,Larson M.G. et al. Temporal trends in coronary heart disease mortality and sudden cardiac death from 1950-1999: the Framingham Heart Study. Circulation 2004;110: 522-27.
- Huikuri, H., Castellanos A., Myerburg R.J. Sudden death due to cardiac arrhythmias. New England J Med 2001;345:1473-82.
- Myerburg R.J., Kessler K.M., Mallon S.M. et al. Life-threatening ventricular arrhythmias in patients with silent myocardial ischemia due to coronary artery spasm. New England J Med 1992;326: 1451-55.
- Furukawa T., Bassett A.L., Furukawa N. et al. The ionic mechanism of reperfusion-induced early after depolarizations in the feline left ventricular hypertrophy. J Clin Invest. 1993;91:1521-31.
- Goldberg R.J., Yarzebski J., Spencer F.A. et al. Thirty-year trends (1975-2005) in the magnitude, patient characteristics, and hospital outcomes of patients with acute myocardial infarction com"plicated by ventricular fibrillation. Am J Cardiol. 2008;102:1595-1601.
- Myerburg R.J., Juhani Junttila M. Sudden Cardiac Death Caused by Coronary Heart Disease. Circulation 2012;125:1043-52.
- Alderman E.L., Bourassa M.G., Cohen L.S. et al. Ten year follow-up of survival and myocardial infarction in the randomized Coronary Artery Surgery Study. Circulation 1990;82:1629-46.
- The VA Cooperative Study Group. Eighteen-year follow-up in the Veterans Affairs Cooperative Study of coronary artery by-pass surgery for stable angina. Circulation 1992;86:121-30.
- Brugada J. Aguinaga L., Mont L,. et al./Coronary artery revascularization in patients with sustained ventricular arrhythmias in the chronic phase of a myocardial infarction: effects on the electrophysiologic substrate and outcome. J Am Coll Cardiol. 2001;37:529-33.
- Bigger J.T. Jr. Prophylactic use of implanted cardiac defibrillators in patients at high risk for ventricular arrhythmias after coronary-artery bypass graft surgery. Coronary Artery Bypass Graft (CABG) Patch Trial Investigators. New England J Med 1997;337:1569-75.
- Bigger J.T. Jr., Whang W., Rottman J.N. et al. Mechanisms of Death in the CABG Patch Trial: A Randomized Trial of Implantable Cardiac Defibrillator Prophylaxis in Patients at High Risk of Death After Coronary Artery Bypass Graft Surgery. Circulation 1999;99:1416-21.
- Goldenberg I., Moss A, McNitt S., et al. Time dependence of defibrillator benefit after coronary revascularization in the Multicenter Automatic Defibrillator Implantation Trial (MADIT)-II. J Am Coll Cardiol 2006;47:1811-181.
- Veenhuyzen, G.D., Singh S.N., D. McAreavey D. et al. Prior Coronary Artery Bypass Surgery and Risk of Death Among Patients With Ischemic Left Ventricular Dysfunction. Circulation 2001;104:1489-93.
- Wijns W., Kolh P., Danchin N. et al. Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Euro Heart Journal 2010;31:2501-55.
- Shahian D.M., O'Brien S.M., S. Sheng S., et al. Predictors of long-term survival after coronary artery bypass grafting surgery: results from the Society of Thoracic Surgeons Adult Cardiac Surgery Database (the ASCERT study). Circulation 2012;125:1491-1500.
- Weintraub W.S., Grau-Sepulveda M.V., Weiss J.M. et al. Prediction of long-term mortality after percutaneous coronary intervention in older adults: results from the National Cardiovascular Data Registry. Circulation 2012;125:1501-10.
- Zishiri E. T., Williams S., Cronin E.M., et al. Early Risk of Mortality After Coronary Artery Revascularization in Patients With Left Ventricular Dysfunction and Potential Role of the Wearable Cardioverter Defibrillator. Circ Arrhythm Electrophysiol. 2013;6(1):117-28.


