Роль визуализационных методов исследования в диагностике первичных мышечных дистоний (обзор)
Автор: Бушуева О.О., Антипенко Е.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Нервные болезни
Статья в выпуске: 3 т.18, 2022 года.
Бесплатный доступ
Цель: анализ данных литературы о возможностях методов нейровизуализации в диагностике мышечных дистоний. В статье рассматриваются результаты исследований диффузионно-тензорной магнитно-резонансной томографии (МРТ) с трактографией, воксельной МР-морфометрии, функциональной МРТ (фМРТ), МР-спектроскопии, позитронно-эмиссионной томографии (ПЭТ) и однофотонной эмиссионной компьютерной томографии (КТ) головного мозга при первичных мышечных дистониях. Материалом исследования послужили публикации из баз данных PubMed и eLibrary. Период электронного поиска составил 1976-2021 гг., использовались комбинации ключевых слов «dystonia» и «neuroimaging». Для написания обзора использованы 34 источника. Несмотря на то, что постановка диагноза мышечной дистоний основывается на клинической картине, достижения современных методов нейровизуализации могут помочь в дифференциальной диагностике ее первичных и вторичных форм, а также определения тактики хирургического лечения. Для установления функциональных нейроанатомических субстратов наиболее предпочтительным методом нейровизуализации является фМРТ с измерением функциональной активности коры головного мозга, что особенно важно при действие-специфических формах дистоний и выборе тактики лечения в функциональной нейрохирургии.
Двигательные расстройства, дистония, магнитно-резонансная томография, нейровизуализация
Короткий адрес: https://sciup.org/149141767
IDR: 149141767 | УДК: 616.74-009.51
Текст научной статьи Роль визуализационных методов исследования в диагностике первичных мышечных дистоний (обзор)
1 Введение. Мышечная дистония — это синдром, характеризующийся устойчивыми или прерывистыми мышечными сокращениями, вызывающими ненормальные, часто повторяющиеся движения, позы или и то и другое. Дистонические движения обычно однотипны и имеют вращательный характер, а также могут сопровождаться дрожанием. Дистония часто инициируется или усугубляется произвольными движениями и связана с избыточной активацией мышц [1]. В последние годы, благодаря развитию нейрови-зуализационных инструментов, значительно расширены знания об этиологии и патогенезе мышечных дистоний, раскрыты новые пути патогенеза.
В классическом понимании в основе патогенеза дистонии лежит дисфункция базальных ганглиев.
Фундаментальная схема функционирования базальных ганглиев включает два основных пути: активирующий прямой путь (кора — полосатое тело — внутренний сегмент бледного шара — таламус — кора) и непрямой путь, оказывающий тормозящее действие (кора — полосатое тело — наружный сегмент бледного шара — субталамическое ядро — внутренний сегмент бледного шара — таламус — кора).
В настоящее время данная концепция претерпевает изменения и взамен предлагается патогенетическая модель обширной подкорковой сети (рис. 1). В этой модели базальные ганглии рассматриваются как «круги», организованные для выбора желаемых действий и подавления потенциально конкурирующих нежелательных действий, имеющие многочисленные афферентные и эфферентные связи с разными отделами головного мозга, в результате чего формируются сложные кольцевые пути, которые
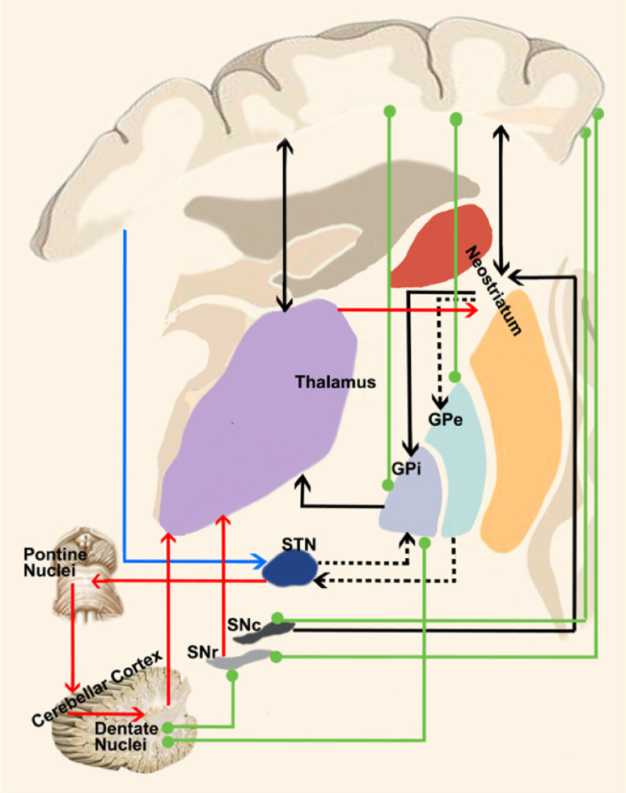
Рис. 1. Модель патогенеза дистонии по A. Quartarone и соавт. [2].
Предлагаемая модель объединяет «классические» и «новые» кортикобазально-мозжечковые пути. Сплошные черные линии демонстрируют «прямой» путь. Пунктирные черные линии изображают «непрямой» путь. Синие линии — «гиперпрямой» путь. Красные линии указывают на связи мозжечка с базальными ганглиями. Зеленые линии демонстрируют недавно выявленные связи между корой головного мозга, внутренним сегментом бледного шара (GPi), наружным сегментом бледного шара (GPe) и черной субстанцией (STN), а также дополнительные цепи между зубчатым ядром. SNr — ретикулярная часть черной субстанции. SNc — компактная часть черной субстанции способны как возбуждать, так и тормозить корковые отделы [2].
Новый взгляд на патофизиологию дистоний стал активно развиваться после внедрения новых инструментальных методов диагностики, в первую очередь методов нейровизуализации, таких как диффузионно-тензорная МРТ (ДТ-МРТ) с трактографией, вок-сельная МР-морфометрия, фМРТ, МР-спектроскопия, ПЭТ и однофотонная эмиссионная КТ.
Цель — анализ данных литературы о возможностях методов нейровизуализации в диагностике мышечных дистоний.
В данной статье проанализированы основные исследования в области нейровизуализации и объяснены новые идеи в патофизиологии дистоний, а также отражено участие разных структур головного мозга в патогенезе заболевания. Благодаря внедрению современных методов нейровизуализации облегчится дифференциальная диагностика первичных и вторичных форм мышечной дистонии, а также расширятся возможности ее хирургического лечения.
Материалом исследования послужили публикации из баз данных PubMed и eLibrary. Период электронного поиска составил с 1976 по 2021 г., использовались комбинации ключевых слов «dystonia» и «neuroimaging». Для написания обзора использованы 34 источника.
Диффузионно-тензорная магнитно-резонансная томография с трактографией. ДТ-МРТ способна оценивать региональную организацию белого вещества путем измерения диффузии воды, а также in vivo реконструировать тракты белого вещества с использованием детерминированной и вероятностной трактографии. В патофизиологии дистоний доминирующей концепцией является формирование функционального коннектома, при котором происходит дезорганизация путей, связывающих базальные ганглии, таламус, мозжечок и корковое представительство. В дополнение к глубоко измененной функциональной сети структурный коннектом характеризуется реорганизацией нормальной структуры белого вещества. Так, при действие-специфичных дистониях выявлена реорганизация островка и верхней лобной извилины [3].
Благодаря трактографии в 2002 г. описан гиперпрямой путь, связывающий кору конечного мозга с наружным и внутренним сегментами бледного шара через субталамическое ядро (кортикопаллидный путь) [4]. Продемонстрировано также взаимодействие между мозжечком и базальными ганглиями. In vivo описан афферентный путь, идущий от субталамического ядра к коре мозжечка с переключением в ядрах моста [5, 6], у приматов описаны пути, соединяющие зубчатое ядро со скорлупой и наружным сегментом бледного шара, проходящий через таламус [7], также приведены доказательства вероятного существования прямых связей зубчатого ядра мозжечка с внутренним сегментом бледного шара и черной субстанцией [8].
При цервикальной дистонии в нескольких исследованиях продемонстрированы высокие показатели фракционной анизотропии в скорлупе с двух сторон и снижение данного показателя в мозолистом теле и префронтальной коре [9, 10], что объясняется возможной повышенной клеточностью базальных ганглиев и, наоборот, потерей нейронов в областях с пониженной фракционной анизотропией [11].
Таким образом, на основании данных, полученных с помощью нейровизуализационных методов, в частности ДТ-МРТ с трактографией, предлагается пересмотреть патофизиологическую модель фокальной дистонии как расстройства не только функциональных, но и структурных коннектомов [12].
Воксельная МР-морфометрия и измерение толщины коры. Метод МР-морфометрии заключается в повоксельном сравнении серого и белого веществ между пациентами и группой контроля, сопоставимых по полу и возрасту [13]. С помощью воксельной МР-морфометрии можно обнаружить и количественно оценить различия в объеме серого и белого веществ головного мозга. Этот метод дополняет возможность измерения толщины коры на основании определения внутренних и внешних границ.
Согласно данным многочисленных исследований у пациентов с первичными фокальными формами дистоний обычно наблюдается двустороннее увеличение объема базальных ганглиев, преимущественно скорлупы, а также области сенсомоторной коры [14–16].
Однако опубликованы работы с противоположными результатами. Так, в исследовании M. Obermann с соавт. обнаружено значительное двустороннее уменьшение серого вещества в скорлупе вместе с двусторонним увеличением серого вещества в хвостатом ядре у пациентов с цервикальной дистонией и блефароспазмом в сравнении с контролем [17]. В исследовании D. Martino с соавт. 2011 г., посвящен- ном анализу объема серого вещества у пациентов с блефароспазмом, выявлено различие в объеме серого вещества исключительно в областях коры головного мозга (в левой постцентральной извилине и левой верхней височной извилине), что объясняет наличие сенсомоторной дезинтеграции как важнейшего звена патогенеза в модуляции моторных феноменов дистонии [18].
Для действие-специфичных дистоний продемонстрировано увеличение объема серого вещества в области первичной моторной коры на контрлатеральной стороне по отношению к пораженной руке, двустороннее увеличение объемов серого вещества сенсомоторной коры [19, 20]. Это связано с тем, что выполнение сложных двигательных актов требует значительного участия корковых отделов, в первую очередь таких, как лобные и теменные доли. Эти находки подтверждают, что аномальная функциональная организация корковых отделов — один из основных компонентов патофизиологии мышечных дистоний [21].
Не обнаружено корреляции между выявленными структурными аномалиями и продолжительностью и тяжестью цервикальной дистонии, за исключением миоклонической дистонии, для которой продемонстрирована положительная корреляция между тяжестью дистонии и двусторонним увеличением скорлупы [22, 23].
В клинической картине дистонии в настоящее время большое внимание уделяется немоторным симптомам, таким как тревога и депрессия. Интересные результаты опубликованы в 2020 г., где вок-сельная МР-морфометрия проводилась пациентам с синдромом Мейжа с сопутствующей депрессией и без таковой. Участие базальных ганглиев как обязательной анатомической основы развития дистонии также не было подтверждено, но продемонстрировано четкое вовлечение гиппокампа и клина затылочной доли у пациентов с сопутствующими психоэмоциональными нарушениями [24].
Функциональная магнитно-резонансная томография. фМРТ — методика, измеряющая гемодинамический ответ, вызванный нейронной активацией на основании соотношения оксигемоглобина и дезоксигемоглобина. Существует два основных способа проведения функциональной МРТ с измерением функциональной активности коры головного мозга: при выполнении определенного задания в сравнении с его активностью в покое/с контрольным заданием (task fMRI); в покое (resting state fMRI (RS-fMRI) [13].
Сегодня фМРТ является наиболее часто используемым методом визуализации в исследованиях у пациентов с фокальной дистонией. Это связано с тем, что данная методика позволяет изучать дистонию как динамический кинезиогенный феномен, так как во время проведения фМРТ-сканирования можно выполнять различные действия, например письмо, рисование или любые другие движения руками, моргание, тесты на визуальную и тактильную стимуляцию.
Большое количество исследований фМРТ подтвердило участие базальных ганглиев, таламуса, мозжечка, сенсомоторной коры в патофизиологии дистоний. При выполнении движений, вызывающих дистонический феномен, характерно увеличение активности данных областей. Так, при писчем спазме после письма отмечается повышенная активность контралатерального таламуса, базальных ганглиев, первичной сенсомоторной коры и мозжечка с ипси- латеральной стороны, одно- или двусторонняя активация скорлупы при зажмуривании и активация зрительной коры при спонтанном моргании у пациентов с блефароспазмом. И наоборот, задачи, которые не вызывают дистонию, приводят к снижению активации вышеперечисленных областей.
Благодаря фМРТ во время сенсорной стимуляции обнаружено уменьшение расстояния между корковым представительством 2–5-го пальцев в первичной сенсорной коре при писчем спазме [12]. В исследовании K. Uehara и соавт. продемонстрирована аномальная соматотопия при амбушюрных дистониях и аномальная мозговая активность в первичных моторных и сенсорных областях справа, левой скорлупе и мозжечке при сохраненной соматотопии при действие-специфичных дистониях. Вероятно, аномальная мозговая активность и измененная со-матотопическая проекция связаны с различными аспектами дистонических симптомов [25].
Продемонстрированы эффекты ботулинического токсина на центральную нервную систему. При цервикальной форме дистонии увеличение активации сенсомоторной коры по данным фМРТ выявлено даже после первой инъекции ботулинического токсина [26].
Магнитно-резонансная спектроскопия. МР-спектроскопия — активно развивающийся метод диагностики, позволяющий неинвазивно оценить концентрацию различных метаболитов в заданных областях головного мозга. Данный метод применен в исследовании количественной оценки уровня гамма-аминомасляной кислоты (ГАМК) в структурах головного мозга у пациентов с дистониями.
Первые исследования продемонстрировали сниженный уровень ГАМК в сенсомоторной коре и чечевицеобразном ядре, противоположных пораженной руке, у пациентов с фокальной дистонией кисти по сравнению со здоровыми испытуемыми [27]. Согласно исследованию K. Simonyan, ГАМК-ергический дефицит может быть результатом потери или снижения плотности ГАМК-рецепторов, аномальных связывающих свойств этих рецепторов или снижения синтеза ГАМК из-за потери ингибирующих интернейронов при дистонии [28]. Снижение доступности ГАМК-рецепторов в нижней теменной коре связано с увеличением объема серого вещества и повышенной активностью мозга [29]. По всей вероятности, дисфункция в работе ГАМК-ергической системы может играть определенную роль в патофизиологии дистонии.
В качестве иллюстрации приводим собственное наблюдение пациента.
Пациентка Б., 57 лет, обратилась с жалобами на насильственное зажмуривание глаз, непроизвольные движения в области нижней трети лица, поворот и подергивания головы влево, подъем левого плеча.
Считает себя больной с 20-летнего возраста, когда впервые появились частые моргания, зажмуривания глаз, затем постепенно в течение нескольких лет присоединились дистонические симптомы в нижней трети лица в виде оромандибулярной дистонии, в области шеи в виде тортилатероколлиса влево с дистоническим тремором и подъемом левого плеча. В неврологическом статусе: черепно-мозговые нервы — зрачки d=s, движения глазных яблок в полном объеме, двусторонний блефароспазм, лицо симметрично, бульбарных нарушений нет, насильственные движения в нижней трети лица в виде оромандибу-лярной дистонии. Сухожильные рефлексы d=s. Мышечная сила 5 баллов, чувствительность сохранена.
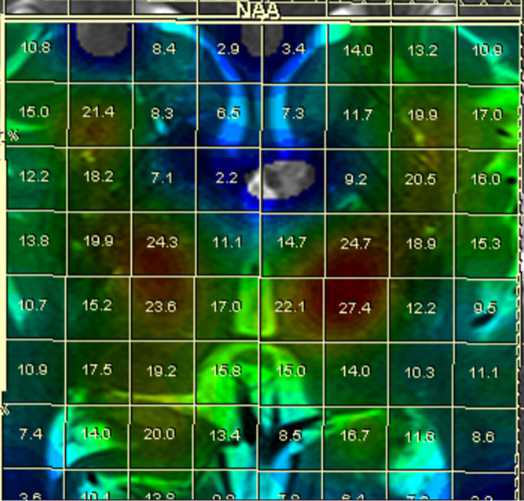
Рис. 2. Результат спектроскопии.
На цветной карте отражается повышение NAA в области базальных ганглиев (красный цвет)
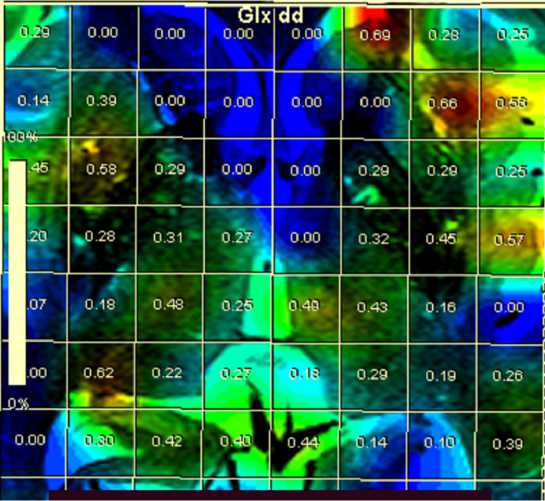
Рис. 3. Результат спектроскопии.
На цветной карте отражено распределение Glx, являющегося предшественником ГАМК. Отмечено снижение индекса Glx/NAA в области базальных ганглиев
Дистоническая установка головы и шеи в виде торти-латероколлиса влево, а также дистонический тремор головы по типу «нет — нет» и подъем левого плеча. В позе Ромберга устойчива, координаторные пробы выполняет удовлетворительно. Патологических знаков не определяется. Пациентке установлен диагноз сегментарной формы мышечной дистонии и рекомендованы регулярные инъекции ботулинического токсина типа А с кратностью 1 раз в 4 мес. С учетом постепенной генерализации процесса было проведено МРТ головного мозга с режимом спектроскопии.
По данным исследования (рис. 2) обнаружены пики NAA (N-ацетиласпартата) в области базальных ганглиев, что характерно для неповрежденных нейронов и, вероятно, связано с их высокой функциональной активностью, а также снижение индекса Glx (глутамата и глутамина)/NAA (рис. 3), что косвенно указывает на низкий уровень ГАМК в базальных ганглиях, тем самым подтверждает значимость нейромедиаторных нарушений в патогенезе дистоний на примере конкретного клинического случая.
Позитронно-эмиссионная томография. ПЭТ — это сцинтиграфический метод, основанный на регистрации гамма-квантов после аннигиляции позитронов с электронами. Двумя радиофармпрепаратами, обычно используемыми в исследованиях ПЭТ при фокальной дистонии, являются [18F]-фтордезоксиглюкоза и [15О]-Н 2 О. Поглощение [18F]-фтордезоксиглюкозы отражает региональный метаболизм глюкозы, а [15O]-H2O количественно определяет региональный мозговой кровоток (rCBF). Кроме того, существуют радиофармпрепараты для ПЭТ которые связываются с рецепторами дофамина D2/3 — [11C]-N-метил-спиперон ([11C]-NmSp) и [18F]-спиперон ([18F]-SP). Метаболизм глюкозы чаще был повышен в базальных ганглиях, таламусе, мозжечке и варолиевом мосту. В большинстве исследований было обнаружено снижение регионального мозгового кровотокав первичной сенсомоторной коре и увеличение регионального мозгового кровотока в лобных и теменных ассоциативных областях [11].
В работе V. Belenky с соавт. сравнивалась ПЭТ с [18F]-фтордезоксиглюкозой у пациентов с эссенциальным тремором и дистонией. Исследование де- монстрирует сниженный метаболизм глюкозы в области таламуса и лентикулярного ядра у пациентов с дистонией и сниженный метаболизм глюкозы в области моста и поясной извилины в группе эссенциального тремора [30]. При цервикальной дистонии при проведении ПЭТ описана двусторонняя активация зрительной коры у пациентов, которые использовали сенсорный трюк. Зрительная кора участвует в тактильной ориентации, что, по-видимому, помогает определить положение головы относительно туловища и, соответственно, скорректировать это положение [31].
Однофотонная эмиссионная компьютерная томография. Однофотонная эмиссионная КТ также является сцинтиграфическим методом, при котором радиофармпрепараты метятся изотопами, способными связываться со специфическими рецепторами или транспортерами в головном мозге.
По данным J. Hierholzer и соавт., у пациентов с цервикальной дистонией наблюдалось более высокое связывание рецепторов D2/3R в полосатом теле, с противоположной стороны по отношению к вращению головы, что может указывать на снижение плотности постсинаптических рецепторов D2/3 в чечевицеобразном ядре [32]. При фокальной дистонии кисти результаты также указывают на дисфункцию дофаминергической системы [33].
Компьютерная томография и магнитно-резонансная томография шейного отдела и мягких тканей шеи. Для более точного выбора мышц-мишеней для ботулинотерапии при цервикальной дистонии было проведено исследование, где пациентам выполнялись послойные КТ-снимки мягких тканей шеи и МРТ шейного отдела позвоночника и мягких тканей. В подавляющем большинстве наблюдалось вовлечение мышц, осуществляющих движения в области соединения черепа и шейного отдела позвоночника и мышц, которые приводят в движение только шейный отдел позвоночника. КТ-снимки на уровнях С1, С2 и С7 наиболее полезны для дифференцирования тор-тикапута и тортиколлиса. Для остальных форм цервикальной дистонии может быть полезна МРТ мягких тканей шеи, где возможно увидеть асимметрию мышц, а для дифференциальной диагностики латерокапута и латероколлиса достаточно простого рентгеновского снимка в переднезадней проекции [34].
Заключение. Развитие методов и инструментов нейровизуализации привело к расширению знаний о нейронных изменениях при дистониях. Мышечные дистонии — это синдром, патогенез которого не ограничивается дисфункцией базальных ганглиев, в его основе лежит нарушение функционирования целой нейрональной сети, включающей подкорковые и корковые области. С помощью ДТ-МРТ описаны новые пути взаимодействия базальных ганглиев с мозжечком и корковыми отделами, что позволяет рассматривать патофизиологию мышечных дистонией как кор-тикобазально-мозжечковый коннектом, с наличием не только функциональных, но и структурных изменений. Продемонстрировано активное участие коры головного мозга, базальных ганглиев в патогенезе заболевания с помощью воксельной МР-морфометрии, изменение содержания нейрометаболитов в базальных ганглиях по данным МР-спектроскопии. Результаты сцинтиграфических методов исследования головного мозга (ПЭТ, однофотонная эмиссионная КТ) подтверждают вовлечение разных областей мозга, а также дисфункцию дофаминергической системы при мышечных дистониях.
Безусловно, современные методы нейровизуализации будут активно внедряться в клиническую практику, в первую очередь для дифференциальной диагностики первичных и вторичных форм мышечных дистоний.
Для определения функциональных нейроанато-мических субстратов наиболее предпочтительным методом нейровизуализации является фМРТ с измерением функциональной активности коры головного мозга, что особенно важно при действие-специфи-ческих формах дистоний и выборе тактики лечения в функциональной нейрохирургии.
Список литературы Роль визуализационных методов исследования в диагностике первичных мышечных дистоний (обзор)
- Albanese A, Bhatia K, Bressman SB, et al. Phenomenology and classification of dystonia: a consensus update. Mov Disord 2013; 28 (7): 863–73. DOI: 10.1002 / mds.25475.
- Quartarone A, Cacciola A, Milardi D, et al. New insights into cortico-basal-cerebellar connectome: clinical and physiological considerations. Brain 2020; 143 (2): 396–406. DOI: 10.1093 / brain / awz310.
- Bianchi S, Fuertinger S, Huddleston H, et al. Functional and structural neural bases of task specificity in isolated focal dystonia. Mov Disord 2019; 34 (4): 555–63. DOI: 10.1002 / mds.27649.
- Nambu A, Tokuno H, Takada M. Functional significance of the cortico-subthalamo-pallidal ‘hyperdirect’ pathway. Neurosci Res 2002; 43 (2): 111–7. DOI: 10.1016 / s0168-0102(02)00027–5.
- Bostan AC, Dum RP, Strick PL. The basal ganglia communicate with the cerebellum. Proc Natl Acad Sci USA. 2010; 107 (18): 8452–6. DOI: 10.1073 / pnas.1000496107.
- Milardi D, Arrigo A, Anastasi G, et al. Extensive direct subcortical cerebellum-basal ganglia connections in human brain as revealed by constrained spherical deconvolution tractography. Front Neuroanat 2016; 10: 29. DOI: 10.3389 / fnana.2016.00029.
- Hoshi E, Tremblay L, Féger J, et al. The cerebellum communicates with the basal ganglia. Nat Neurosci 2005; 8 (11): 1491–3. DOI: 10.1038 / nn1544.
- Snider RS, Maiti A, Snider SR. Cerebellar pathways to ventral midbrain and nigra. Exp Neurol 1976; 53 (3): 714–28. DOI: 10.1016 / 0014-4886(76)90150-3.
- Fabbrini G, Pantano P, Totaro P, et al. Diffusion tensor imaging in patients with primary cervical dystonia and in patients with blepharospasm. Eur J Neurol. 2008; 15 (2): 185–9. DOI: 10.1111 / j.1468–1331.2007.02034.x.
- Zoons E, Booij J, Nederveen AJ, et al. Structural, functional and molecular imaging of the brain in primary focal dystonia — a review. Neuroimage 2011; 56 (3): 1011–20. DOI: 10.1016 / j.neuroimage.2011.02.045.
- Hanekamp S, Simonyan K. The large-scale structural connectome of task-specific focal dystonia. Hum Brain Mapp 2020; 41 (12): 3253–65. DOI: 10.1002 / hbm.25012.
- Colosimo C, Pantano P, Calistri V, et al. Diffusion tensor imaging in primary cervical dystonia. J Neurol Neurosurg Psychiatry 2005; 76 (11): 1591–3. DOI: 10.1136 / jnnp. 2004.056614.
- Krotenkova MV, Brjuhov VV, Morozova SN et al. Modern neuroimaging technologies. Radiology — Practice 2017; 2 (62): 47–63. Russian (Кротенкова М. В., Брюхов В. В., Морозова С. Н. и др. Современные технологии нейровизуализации (лекция). Радиология — практика. 2017; 2 (62): 47–63).
- Etgen T, Mühlau M, Gaser C, et al. Bilateral grey-matter increase in the putamen in primary blepharospasm. J Neurol Neurosurg Psychiatry 2006; 77 (9): 1017–20. DOI: 10.1136 / jnnp.2005.087148.
- Bradley D, Whelan R, Walsh R, et al. Temporal discrimination threshold: VBM evidence for an endophenotype in adult onset primary torsion dystonia. Brain 2009; 132 (Pt 9): 2327–35. DOI: 10.1093 / brain / awp156.
- Black KJ, Ongür D, Perlmutter JS. Putamen volume in idiopathic focal dystonia. Neurology 1998; 51 (3): 819–24. DOI: 10.1212 / wnl.51.3.819.
- Obermann M, Yaldizli O, De Greiff A, et al. Morphometric changes of sensorimotor structures in focal dystonia. Mov Disord 2007; 22 (8): 1117–23. DOI: 10.1002 / mds.21495.
- Martino D, Di Giorgio A, D’Ambrosio E, et al. Cortical gray matter changes in primary blepharospasm: a voxel-based morphometry study. Mov Disord 2011; 26 (10): 1907–12. DOI: 10.1002 / mds.23724.
- Delmaire C, Vidailhet M, Elbaz A, et al. Structural abnormalities in the cerebellum and sensorimotor circuit in writer’s cramp. Neurology 2007; 69 (4): 376–80. DOI: 10.1212 / 01.wnl.0000266591.49624.1a.
- Garraux G, Bauer A, Hanakawa T, et al. Changes in brain anatomy in focal hand dystonia. Ann Neurol 2004; 55 (5): 736–9. DOI: 10.1002 / ana.20113.
- Tomić A, Agosta F, Sarasso E, et al. Brain structural changes in focal dystonia-what about task specificity? A multimodal MRI study. Mov Disord 2021; 36 (1): 196–205. DOI: 10.1002 / mds.28304.
- Nevrlý M, Hluštík P, Hok P, et al. Changes in sensorimotor network activation after botulinum toxin type A injections in patients with cervical dystonia: a functional MRI study. Exp Brain Res 2018; 236 (10): 2627–37. DOI: 10.1007 / s00221‑018‑5322‑3.
- Beukers RJ, van der Meer JN, van der Salm SM, et al. Severity of dystonia is correlated with putaminal gray matter changes in myoclonus-dystonia. Eur J Neurol 2011; 18 (6): 906–12. DOI: 10.1111 / j. 1468-1331.2010.03321.x.
- Liu J, Li L, Chen L, et al. Grey matter changes in Meige syndrome: A voxel-based morphology analysis. Sci Rep 2020; 10 (1): 14533. Published 2020 Sep 3. DOI:10.1038 / s41598‑020‑71479‑9.
- Uehara K, Furuya S, Numazawa H, et al. Distinct roles of brain activity and somatotopic representation in pathophysiology of focal dystonia. Hum Brain Mapp 2019; 40 (6): 1738–49. DOI: 10.1002 / hbm.24486.
- Opavský R, Hluštík P, Otruba P, Kaňovský P. Somatosensory cortical activation in cervical dystonia and its modulation with botulinum toxin: an fMRI study. Int J Neurosci 2012; 122 (1): 45–52. DOI: 10.3109 / 00207454.2011.623807.
- Levy LM, Hallett M. Impaired brain GABA in focal dystonia. Ann Neurol 2002; 51 (1): 93–101.
- Simonyan K. Neuroimaging applications in dystonia. Int Rev Neurobiol 2018; (143): 1–30. DOI: 10.1016 / bs.irn.2018.09.007.
- Gallea C, Herath P, Voon V, et al. Loss of inhibition in sensorimotor networks in focal hand dystonia. Neuroimage Clin 2017; (17): 90–7. Published 2017 Oct 13. DOI: 10.1016 / j.nicl.2017.10.011.
- Belenky V, Stanzhevsky A, Klicenko O, et al. Brain positron emission tomography with 2-18F-2‑deoxi-D-glucose of patients with dystonia and essential tremor detects differences between these disorders. Neuroradiol J 2018; 31 (1): 60–8. DOI: 10.1177 / 1971400917719912.
- Naumann M, Magyar-Lehmann S, Reiners K, et al. Sensory tricks in cervical dystonia: perceptual dysbalance of parietal cortex modulates frontal motor programming. Ann Neurol 2000; 47 (3): 322–8.
- Hierholzer J, Cordes M, Schelosky L, et al. Dopamine D2 receptor imaging with iodine-123‑iodobenzamide SPECT in idiopathic rotational torticollis [published correction appears in J Nucl Med 1995; 36 (4): 568]. J Nucl Med 1994; 35 (12): 1921–7.
- Horstink CA, Praamstra P, Horstink MW, et al. Low striatal D2 receptor binding as assessed by [123I] IBZM SPECT in patients with writer’s cramp. J Neurol Neurosurg Psychiatry 1997; 62 (6): 672–3.
- Reichel G, Stenner A, Jahn A. Cervical dystonia: clinical-radiological correlations and recommendations for the correction of botulinum therapy. S. S. Korsakov Journal of Neurology and Psychiatry 2012; 112 (1): 73–9. Russian (Reichel G, Stenner A, Jahn A. Цервикальные дистонии: клинико-радиологические корреляции рекомендации по коррекции ботулинотерапии. Журнал неврологии и психиатрии им. С. С. Корсакова 2012; 112 (1): 73–9).


