SCAR-маркер гена Rfl подсолнечника у линий восстановителей фертильности пыльцы растений с различными типами ЦМС
Автор: Маркин Н.В., Тихонова М.А., Анисимова И.Н., Рожкова В.Т., Гаврилова В.А., Усатов А.В.
Статья в выпуске: 2 (141), 2009 года.
Бесплатный доступ
Исследовано наличия ДНК-маркера гена Rfl у линий-восстановителей фертильности пыльцы растений с цитоплазматической мужской стерильностью, источником которой явилась цитоплазма H. petiolaris и H. rigidus. Молекулярно генетический и гибридологический анализ показали, что SCAR-маркер гена Rfl позволяет определить восстановители фертильности пыльцы мужско-стерильных линий, полученных на цитоплазматической основе H. petiolaris. Однако наличие этого маркера в генотипе восстановителя не всегда приводит к восстановлению фертильности пыльцы ЦМС на основе H. rigidus.
Подсолнечник (helianthus), цитоплазматическая мужская стерильность (цмс), car- (sequence characterized amplified region) маркер, гены rf, гибридологический анализ
Короткий адрес: https://sciup.org/142150903
IDR: 142150903
Текст научной статьи SCAR-маркер гена Rfl подсолнечника у линий восстановителей фертильности пыльцы растений с различными типами ЦМС
Введение. В настоящее время главным направлением селекции подсолнечника ( Helianthus annuus L. ) является получение гетерозисных гибридов. Для производства таких гибридов используют материнские линии ЦМС на основе цитоплазмы однолетнего дикорастущего вида подсолнечника Н. petiolaris и отцовские растения, несущие гены-восстановители фертильности пыльцы ( Rf ) [1]. Поиск растений, восстанавливающих фертильность пыльцы линий ЦМС, является отдельным предметом исследований в гетерозисном производстве подсолнечника.
Одним из перспективных подходов в этом направлении является поиск надежных ДНК-маркеров, ассоциированных с генами Rf [2, 3, 4, 5, 6]. Установлено, что у большинства культурных линий подсолнечника восстановление фертильности пыльцы определяют два ядерных доминантных гена – Rf1 и Rf2 . При этом ген Rf2 присутствует практически у всех инбредных линий, в том числе и закрепителей ЦМС, и только ген Rf1 интродуцируется линиями восстановителями, приводя к получению фертильных гибридов подсолнечника [7, 1, 8]. С целью ухода от унификации использования одной системы ЦМС в селекции подсолнечника во Всероссийском институте растениеводства им. Н.И. Вавилова исследуется возможность в качестве материнской формы использовать линии с другим типом ЦМС. Наиболее перспективным в этом направлении является ЦМС на основе цитоплазмы многолетнего дикорастущего вида подсолнечника Н. rigidus .
В связи с этим целью настоящей работы является выявление доноров восстановителей фертильности пыльцы линий ЦМС, полученных на основе H. petiolaris и H. rigidus , представленных в коллекции Всероссийского института растениеводства им. Н.И. Вавилова, с помощью SCAR-маркера гена Rf1 подсолнечника.
Материалы и методы. Материалом для молекулярно-генетического исследования служили проростки семян подсолнечника линий-восстановителей фертильности пыльцы: ВИР 792,
ВИР 793, ВИР 160, RIL 38, RIL 228, RIL 130 из коллекции Всероссийского института растениеводства.
Геномную ДНК выделяли из этиолированных проростков по методике Шагай-Маруфа с нашими модификациями. Растертые проростки (стебли и семядоли) инкубировали в 600 мкл (на один образец) экстракционного буфера (в 100 мл буфера 10 мл 1 М трис/HCl pH 0,8; 8,19 г NaCl; 0,744 г ЭДТА; 2 г СТАВ; 1 г ПВП; 0,5 % Na 2 S 2 O 3 ) при температуре 65 °С в течение 1,5 часа. После хлороформ-изопропаноловой экстракции жидкую фазу отделяли центрифугированием в течение 10 минут при 5000 об/мин. Затем в пробы вносили 1 %-ную РНК-азу и инкубировали при температуре 37 °С в течение 1 часа. После повторной экстракции и центрифугирования в надосадочную жидкость добавляли равный объем изопропанола, охлажденного до -20 °С, пробы оставляли в холодильнике на ночь при +4 °С. ДНК осаждали центрифугированием в течение 15 минут при 14000 об/мин, три раза промывали 75 % этанолом, охлажденным до +4 °С, с последующим центрифугированием в течение 10 минут при 13000 об/мин. ДНК высушивали при комнатной температуре и растворяли в 100-200 мкл ТЕ-буфера (в 100 мл – 1 мл 1 М трис/HCl pH 0,8; 0,2 мл 0,5 М ЭДТА). Концентрацию ДНК определяли на спектрофотометре SmartSpec (Bio-Rad, США).
Амплификацию специфического участка ДНК, связанного с геном Rf1 подсолнечника, проводили, используя SCAR-маркер – HRG02/OPY10, разработанный Р. Хорн с сотрудниками [4].
Для каждой ПЦР-реакции использовали 25 мкл реакционной смеси, содержащей 1,5 мкл ДНК, 1,2 мкл 1,2 мМ dNTP, 2,5 мкл 10× реакционного буфера (Silex, Москва), по 0,5 мкл прямого и обратного праймера HRG02/OPY10 в концентрации 20 пМ, 0,8 мкл Taq полимеразы (Синтол, Москва) и 14,3 мкл Н2О. Амплификацию проводили в термоциклере Technе TC-312 по следующей программе: один цикл: 1 мин 94 °С; 35 циклов: 45 сек 94 °С , 45 сек 65 °С и один цикл: 7 мин 72 °С.
Продукты реакции амплификации разделяли электрофоретически в 1,8 %-ном агарозном геле с бромистым этидием (1 мкг/мл), используя трис-боратный буфер. Размер амплифицирован-ных фрагментов определяли путем сравнения их подвижности с подвижностью маркера в агарозном геле.
Для гибридологического анализа использовали материнские растения четырех линий: ВИР 471, ВИР 116, ВИР 109 и ВИР 151, представленных в двух вариантах: 1) с ЦМС на основе Н. peti-olaris (PET1) и 2) с ЦМС на основе H. rigidus (RIG0) (таблица). Аналоги линий ЦМС RIG получены путем 8-кратного бекроссирования.
Результаты и обсуждение. Результаты амплификации SCAR-маркера у шести из семи исследованных линий-восстановителей фертильности пыльцы показали, что маркер гена Rf1 присутствует у линий ВИР 792, ВИР 793, RIL 38, RIL 228, RIL 130. При этом выявлен специфический фрагмент размером около 738 п.н., который не обнаружен у растений линии ВИР 160 (рисунок).
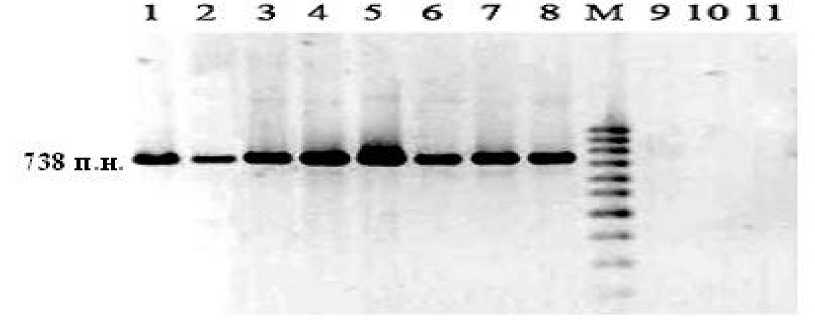
Рисунок – Электрофореграмма продуктов амплификации геномной ДНК линий восстановителей фертильности пыльцы с праймером OPY10: 1 – ВИР 792; 2 – ВИР 793; 3 – RIL 38;
-
4, 5 – RIL 228; 6, 7, 8 – RIL 130; 9, 10, 11 – ВИР 160. М – маркер.
Восстанавливающая способность пыльцы линий-восстановителей ЦМС на основе H. petiolaris (РЕТ1) и H. rigidus (RIG0) была исследована с помощью гибридологического анализа.
Как видно из таблицы, линии ВИР 792, ВИР 793, RIL 38, RIL 228 восстанавливают фертильность пыльцы как ЦМС РЕТ, так и ЦМС RIG, линия RIL 130 восстанавливает фертильность пыльцы только ЦМС РЕТ, а линия ВИР 160 закрепляет стерильность пыльцы обоих источников ЦМС. Эти данные не противоречат результатам амплификации специфического маркера гена Rf1 .
Таблица – Линии ЦМС, восстановители фертильности пыльцы и восстановление фертильности пыльцы гибридов F1
|
Линии ЦМС |
Линии-восстановители фертильности пыльцы |
Гибриды, восстановление фертильности пыльцы в F1 |
|
|
ВИР 471 РЕТ |
ВИР 792 |
ВИР 471 РЕТ × И 792 |
+ |
|
ВИР 471 RIG |
ВИР 471 RIG × ВИР 792 |
+ |
|
|
ВИР 471 РЕТ |
ВИР 793 |
ВИР 471 РЕТ ×ВИР 793 |
+ |
|
ВИР 471 RIG |
ВИР 471 RIG × ВИР 793 |
+ |
|
|
ВИР 116 РЕТ |
RIL 38 |
ВИР 116 РЕТ × RIL 38 |
+ |
|
ВИР 116 RIG |
ВИР 116 RIG × RIL 38 |
+ |
|
|
ВИР 116 РЕТ |
RIL 228 |
ВИР 116 РЕТ × RIL 228 |
+ |
|
ВИР 116 RIG |
ВИР 116 RIG × RIL 228 |
+ |
|
|
ВИР 109 PET |
RIL 130 |
ВИР 109 PET × RIL 130 |
+ |
|
ВИР 109 RIG |
ВИР 109 RIG × RIL 130 |
- |
|
|
ВИР 151 PET |
ВИР 160 |
ВИР 151 PET×ВИР 160 |
- |
|
ВИР 151 RIG |
ВИР 151 RIG × ВИР 160 |
- |
|
Известно, что наличие гена Rf1 недостаточно для восстановления фертильности пыльцы линий ЦМС RIG. Было высказано предположение, что восстановление фертильности пыльцы ЦМС RIG находится под контролем трех генов – Rfr1, Rfr2 и Rfr3 . Более того, рецессивная аллель гена Rfr3 в гомозиготном состоянии оказывает эпистатирующее действие на гены Rfrl и Rfr2 , и восстановления фертильности пыльцы не происходит [9].
Необходимо также учитывать, что в настоящее время нуклеотидная последовательность гена Rf1 не известна и SCAR -маркер комплементарен не самому гену Rf1 , а сцепленной с ним последовательности, и находится на расстоянии 2 сМ от гена, т.е. это сцепление не является полным, что в свою очередь не исключает рекомбинационную изменчивость этого локуса. Линия ВИР 160 может и не являться носителем гена Rf1, так как закрепляет стерильность пыльцы ЦМС на основе H. petiolaris и H. rigidus .
Заключение. Полученные результаты указывают на то, что используемый SCAR-маркер выявляет наличие гена Rf1 в генотипе линий-восстановителей фертильности пыльцы и его можно использовать для прогнозирования восстановительной способности в отношении мужскостерильных линий, полученных на цитоплазматической основе H. petiolaris . Однако результаты, полученные на линии RIL 130, подтверждают, что восстановление фертильности пыльцы ЦМС RIG предполагает участие большего количества генов Rf по сравнению с ЦМС РЕТ, следовательно, наличие этого маркера в генотипе восстановителя не всегда указывает на восстановительный потенциал в отношении ЦМС на основе H. rigidus .
В результате настоящего исследования проведена идентификация новых линий, необходимых для селекции подсолнечника на гетерозис. Линии ВИР 792, ВИР 793 и L 38 и L 228 введены в состав генетической коллекции подсолнечника как носители генов восстановления фертильности пыльцы к двум типам ЦМС на основе H. petiolaris (РЕТ1) и H. rigidus (RIG0).
Исследование выполнено при финансовой поддержке Министерства науки и образования РФ (грант «Развитие научного потенциала высшей школы (2009-2010)» № 2.1.1/4947) и гранта РФФИ (проект 08-04-90112-Мол_а).
МАСЛИЧНЫЕ КУЛЬТУРЫ. Научно-технический бюллетень Всероссийского научно-исследовательского института масличных культур. Вып. 2 (141), 2009


